Le plaisir devrait être recherché avec modération.
Le plaisir doit être mérité.
Le plaisir doit être atteint de manière naturelle.
Le plaisir est passager.
Le refus du plaisir peut mener à l’élévation spirituelle.
Comme le dit si bien David Linden dans son livre Tous addicts !, nos lois, nos religions, nos systèmes éducatifs ont tous à cœur, d’une manière ou d’une autre, de contrôler le plaisir. Nous avons créé des coutumes et des cadres stricts jugulant le sexe, la drogue, la nourriture, l’alcool, voire le jeu. Nos prisons regorgent d’individus ayant violé ces lois.
Mais d’où vient ce plaisir ? Certains disent que c’est dans la nature humaine, d’autres disent que c’est inhérent à notre biologie (ce qui est plus ou moins la même chose mais dite différement). Et il y a du vrai, après tout, quel comportement humain n’a pas son point de départ dans la biologie ? Lorsque l’on parle de plaisir, nous entendons de plus en plus parler de dopamine, parfois de sérotonine ou d’endorphines.
Nous pouvons voir sur internet, quand on écrit “dopamine”, toutes sortes d’articles de vulgarisation qui sont là pour nous faciliter la vie. On peut alors y lire des propos du type : “A quoi sert cette hormone du bonheur ?” ; “Comment fonctionne cette hormone du bonheur ?” ; “Aussi appelée molécule du plaisir immédiat ou du bonheur, la dopamine est un moteur à l’action.” ; “La dopamine, une des quatre hormones du bonheur !
Pourquoi le besoin de simplifier à l’extrême est-il aussi fort chez les médias classiques que l’on retrouve en deux clics sur Google ? Il n’est pas rare de trouver ce vocabulaire simpliste (et en grande partie faux, nous l’allons voir tout à l’heure), qui voudrait laisser croire qu’une hormone comme la dopamine aurait une action claire et simple : provoquer le bonheur, ou bien le plaisir. La propagande simplificatrice ne s’arrête pas là, puisqu’il y a aussi toute une flopée de livres cherchant à appuyer toujours plus ces visions binaires et erronées de la réalité, comme Ocytocine mon amour écrit par un professeur de faculté de pharmacie (ce qui rend ce livre d’autant plus désolant), ou encore Vos hormones du bonheur en lumière. Les articles sur l’ocytocine et sur la testostérone sont déjà deux exemples de sujets complexes qu’il serait dangereux de simplifier à l’extrême.
Pourquoi dangereux ? Parce que, rappelons nous l’article sur la complexité décomplexée, les personnes qui cherchent à vous éloigner d’une bonne compréhension de ce qui vous entoure n’ont pas votre intérêt en tête, mais le leur. C’est souvent d’un agenda idéologique que provient cette volonté de simplifier ou de complexifier, et les hormones ne font pas exception, surtout dans un monde où la biologie peut rapidement servir de prétexte afin de catégoriser des gens dans un but à la morale douteuse (si tant est que l’on donne de l’importance à la morale, ou pire, à l’éthique). Ainsi, faire croire qu’il existe l’hormone qui fera de vous un bisounours ou, au contraire, qu’il existe une hormone qui fera de vous un méchant malveillant, ce n’est pas permettre de régler les problèmes et d’améliorer les relations entre les gens, la correction de leur comportement et donc la vision d’une société plus saine.
De plus, la dopamine présentée comme étant l’hormone du bonheur laisse un goût amer quand on s’intéresse un peu à l’addiction. Comment pourrions-nous scander que la dopamine est l’hormone du bonheur tout en présentant la dopamine comme étant un des facteurs principaux de l’addiction ? Plongeons-nous dans ce que la recherche en neurobiologie nous apporte afin de mieux entrevoir ce qu’est la dopamine, ou, pour être plus rigoureux, ce que semble être la dopamine. Vous ne serez pas surpris à l’issue de cette lecture que nous n’obtiendrons pas de réponse claire et tranchée telle que “dopamine = hormone de l’addiction.”
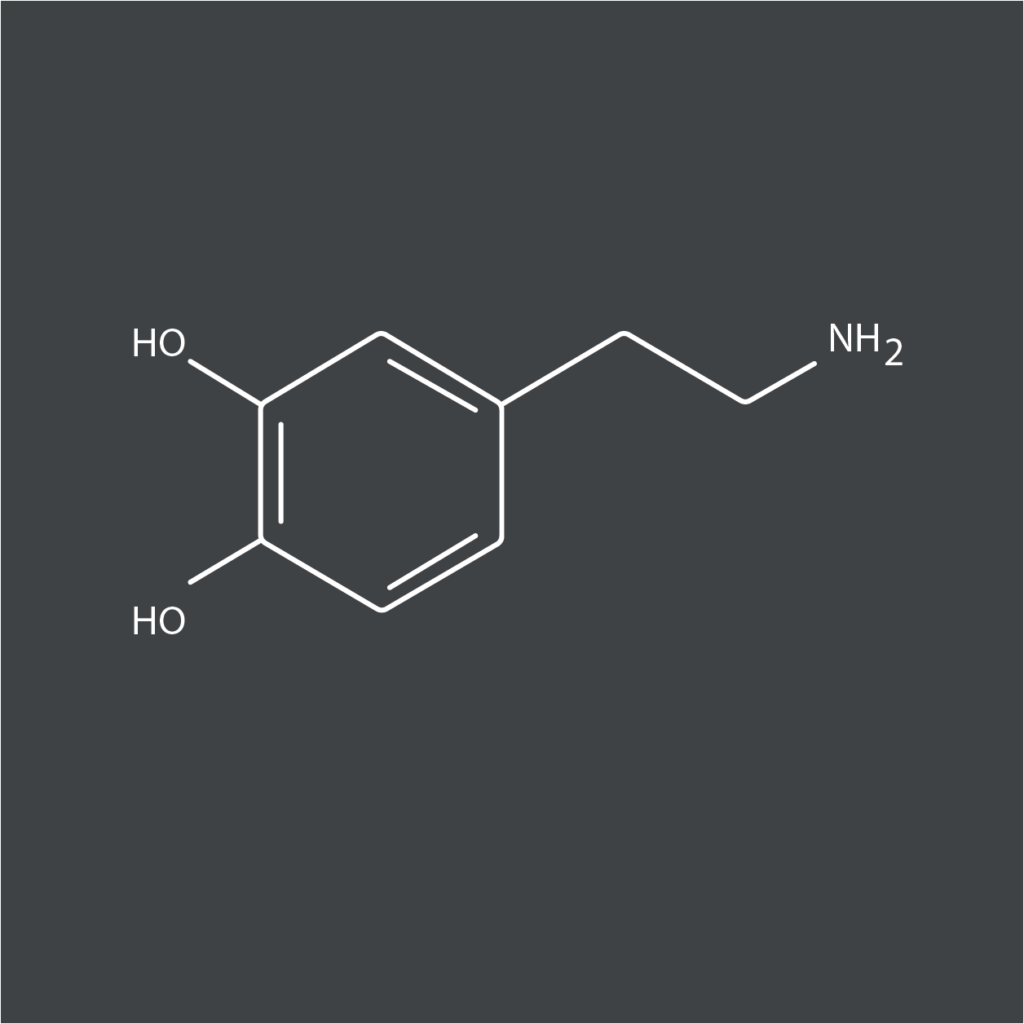
La dopamine (DA) est un neurotransmetteur, une molécule biochimique qui permet la communication au sein du système nerveux, et l’une de celles qui influent directement sur le comportement.
C’est aussi une neurohormone produite par l’hypothalamus. Sa principale fonction hormonale est d’inhiber la libération de prolactine par le lobe antérieur de l’hypophyse.
Cette molécule appartient au groupe des catécholamines, et est issue de deux acides aminés tyrosine ou phénylalanine. Dans le système nerveux central, elle active les récepteurs dopaminergiques postsynaptiques et présynaptiques (autorécepteur D2). Elle est principalement produite dans la substance noire et dans l’aire tegmentale ventrale, situées dans le mésencéphale (partie supérieure du tronc cérébral).
Le portrait robot de cette molécule paraît simple quand on le compare à la testostérone ou à l’ocytocine, mais nous allons voir qu’une molécule aussi “simple” a tout de même un effet considérable sur le comportement de tout un chacun. La récompense, le plaisir et le bonheur sont des notions complexes, et leur recherche motivée est présente, au moins sous une forme rudimentaire, chez de nombreuses espèces. La dopamine, neurotransmetteur et neurohormone1, est essentielle pour comprendre ce phénomène, bien qu’elle n’agisse évidemment pas seule lorsque l’on se comporte d’une manière ou d’une autre. De la même manière qu’on ne peut dire “agressivité = testostérone” ou “amour = ocytocine”, on ne peut se contenter de résumer le bonheur à l’action de la dopamine dans nos cerveaux. Nous allons nous appuyer principalement sur les livres Behave de Robert Sapolsky, Tous addicts ! de David Linden, Never Enough de Judith Grisel, ainsi que sur un certain nombre d’articles qui n’apparaissent pas nécessairement dans ces synthèses.
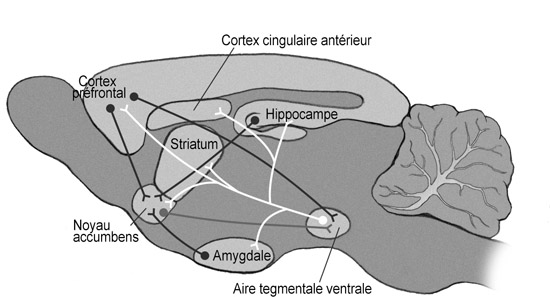
La dopamine est synthétisée dans plusieurs régions du cerveau. L’une de ces régions contribue à l’initiation du mouvement ; une atteinte de cette région entraîne la maladie de Parkinson. Une autre régule la libération d’une hormone hypophysaire. Mais le système dopaminergique qui nous intéresse provient d’une région ancienne, conservée au cours de l’évolution, située près du tronc cérébral et appelée aire tegmentale ventrale que l’on nommera après “tegmentum”.
L’une des principales cibles de ces neurones dopaminergiques est la dernière région cérébrale multisyllabique, le noyau accumbens que l’on nommera après “accumbens”. La question de savoir si le noyau accumbens doit être considéré comme faisant partie du système limbique fait l’objet d’un débat, mais il est en tout cas très proche du système limbique.
Voici notre premier aperçu de l’organisation de ce circuit2:
1. Le tegmentum envoie des projections vers l’accumbens et les (autres) zones limbiques telles que l’amygdale et l’hippocampe. C’est ce qu’on appelle collectivement la “voie mésolimbique de la dopamine”.
2. Le tegmentum projette également vers le cortex préfrontal (mais, de manière significative, pas vers d’autres zones corticales). C’est ce qu’on appelle la “voie mésocorticale de la dopamine”. Je regrouperai les voies mésolimbiques et mésocorticales sous le nom de “système dopaminergique”, sans tenir compte du fait qu’elles ne sont pas toujours activées simultanément*.
3. L’accumbens projette vers les régions associées au mouvement.
4. Naturellement, la plupart des zones qui reçoivent des projections du tegmentum et/ou de l’accumbens s’y ramènent. Les projections en provenance de l’amygdale et du PFC seront les plus intéressantes.
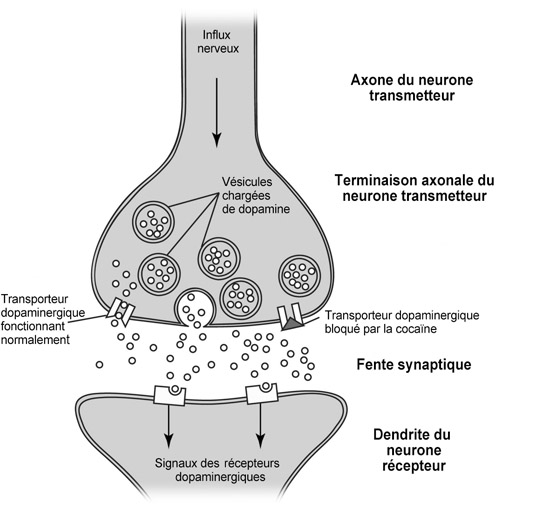
Récompense !
Dans un premier temps, le système dopaminergique concerne la récompense – divers stimuli plaisants activent les neurones tegmentaux, déclenchant leur libération de dopamine3. Quelques preuves à l’appui :
(a) les drogues comme la cocaïne, l’héroïne et l’alcool libèrent de la dopamine dans l’accumbens ;
(b) si la libération de dopamine dans le tegmentum est bloquée, des stimuli auparavant gratifiants deviennent aversifs ;
(c) le stress ou la douleur chroniques épuisent la dopamine et diminuent la sensibilité des neurones dopaminergiques à la stimulation, produisant le symptôme caractéristique de la dépression – “l’anhédonie”, l’incapacité à ressentir du plaisir.
Certaines récompenses, comme le sexe, libèrent de la dopamine chez toutes les espèces étudiées4. Pour les humains, le simple fait de penser au sexe suffit5. La nourriture provoque une libération de dopamine chez les individus affamés de toutes les espèces, avec une particularité chez les humains. Montrez la photo d’un milk-shake à quelqu’un après qu’il en ait consommé un, et il y a rarement une activation dopaminergique – c’est la satiété. Mais chez les sujets qui ont suivi un régime, l’activation est plus forte. Si vous vous efforcez de limiter votre consommation de nourriture, un milk-shake vous donne envie d’en reprendre un.
Le système dopaminergique mésolimbique réagit également à l’esthétique agréable6. Dans une étude, des personnes ont écouté de la musique nouvelle ; plus l’activation du système accumbens était importante, plus les sujets étaient susceptibles d’acheter la musique par la suite. Et puis il y a l’activation dopaminergique pour les inventions culturelles artificielles – par exemple, lorsque des hommes typiques regardent des photos de voitures de sport.
Les schémas de libération de dopamine sont plus intéressants lorsqu’ils concernent les interactions sociales7. Dans une étude, un sujet jouait à un jeu économique avec quelqu’un, où un joueur est récompensé dans deux circonstances : (a) si les deux joueurs coopèrent, chacun reçoit une récompense modérée, et (b) si l’autre personne est poignardée dans le dos, le sujet reçoit une grosse récompense, tandis que l’autre personne ne reçoit rien. Si les deux résultats ont augmenté l’activité dopaminergique, l’augmentation la plus importante a eu lieu après la coopération.
D’autres recherches ont examiné le comportement économique des personnes qui punissent les cons8. Dans une étude, les sujets ont joué à un jeu dans lequel le joueur B pouvait escroquer le joueur A pour en tirer un bénéfice. En fonction du tour, le joueur A pouvait (a) ne rien faire, (b) punir le joueur B en lui retirant une partie de son argent (sans frais pour le joueur B), ou (c) payer une unité d’argent pour que deux unités soient retirées au joueur B. La punition a activé le système de dopamine, en particulier lorsque les sujets devaient payer pour punir ; plus l’augmentation de la dopamine était importante pendant la punition sans frais, plus la personne était prête à payer pour punir. Punir les violations de normes est satisfaisant.
Une autre grande étude, menée par Elizabeth Phelps de l’Université de New York, concerne la “surenchère” dans les enchères, lorsque les gens font des offres plus élevées que prévu9. Ceci est interprété comme reflétant la récompense supplémentaire de battre quelqu’un dans l’aspect compétitif des enchères. Ainsi, “gagner” une enchère est intrinsèquement compétitif socialement, contrairement à “gagner” à la loterie. Gagner une loterie et gagner une enchère ont tous deux activé la signalisation dopaminergique chez les sujets ; perdre une loterie n’a eu aucun effet, tandis que perdre une guerre d’enchères a inhibé la libération de dopamine. Ne pas gagner à la loterie relève de la malchance ; ne pas gagner une enchère relève de la subordination sociale.
Cela soulève le spectre de l’envie. Dans une étude de neuro-imagerie, des sujets ont lu des articles sur les résultats scolaires, la popularité, l’attrait et la richesse d’une personne hypothétique10. Les descriptions qui évoquaient l’envie autodéclarée activaient les régions corticales impliquées dans la perception de la douleur. Ensuite, la personne hypothétique était décrite comme subissant un malheur (par exemple, elle était rétrogradée). Une plus grande activation des voies de la douleur à l’annonce de la bonne fortune de la personne prédisait une plus grande activation dopaminergique après avoir appris son malheur. Il y a donc une activation dopaminergique lors du schadenfreude – se réjouir de la déchéance d’une personne enviée11.
Le système dopaminergique donne un aperçu de la jalousie, du ressentiment et de l’ingratitude, ce qui conduit à une autre constatation déprimante12. Un singe a appris que lorsqu’il appuie dix fois sur un levier, il obtient un raisin sec comme récompense. Cela vient de se produire, et en conséquence, dix unités de dopamine sont libérées dans l’accumbens. Maintenant, surprise, le singe appuie dix fois sur le levier et obtient deux raisins secs. Ouah : vingt unités de dopamine sont libérées. Et comme le singe continue à recevoir deux raisins secs, la réponse de la dopamine revient à dix unités. Maintenant, récompensez le singe avec un seul raisin sec, et les niveaux de dopamine diminuent.
Pourquoi ? C’est notre monde d’accoutumance, où rien n’est jamais aussi bon que la première fois. Et les exemples sont nombreux : sexe, prise de drogue, discussion profonde avec autrui, etc.
Malheureusement, les choses doivent fonctionner de cette manière en raison de notre gamme de récompenses13. Après tout, le codage de la récompense doit tenir compte des propriétés gratifiantes de la résolution d’un problème de mathématiques et de l’orgasme. Les réponses dopaminergiques à la récompense, plutôt que d’être absolues, sont relatives à la valeur de récompense des résultats alternatifs. Afin de prendre en compte les plaisirs des mathématiques et de l’orgasme, le système doit constamment changer d’échelle pour s’adapter à la gamme d’intensité offerte par des stimuli particuliers. La réponse à toute récompense doit s’habituer avec la répétition, de sorte que le système puisse répondre sur toute sa gamme à la prochaine nouveauté.
C’est ce qu’a montré une magnifique étude réalisée par Wolfram Schultz de l’université de Cambridge14. Selon les circonstances, les singes ont été entraînés à s’attendre à une récompense de deux ou vingt unités. S’ils recevaient inopinément quatre ou quarante unités, respectivement, il y avait une poussée identique de libération de dopamine ; donner une ou dix unités produisait une diminution identique. C’est la taille relative, et non absolue, de la surprise qui importait dans une fourchette de récompense décuplée. Cela permet une réflexion importante en ces temps de crise, quant à l’effort demandé aux plus riches et aux plus pauvres, prendre quelques euros à l’un peut avoir le même effet psychologique subjectif que prendre quelques miliers d’euros à l’autre.
Ces études montrent que le système de dopamine est bidirectionnel15. Il réagit par des augmentations sans échelle pour les bonnes nouvelles inattendues et des diminutions pour les mauvaises. Schultz a démontré qu’à la suite d’une récompense, le système de dopamine code pour l’écart par rapport aux attentes : si vous obtenez ce que vous attendiez, il y a un filet de dopamine à l’état stable. Si vous recevez une récompense plus importante et/ou plus tôt que prévu, il y a une forte poussée de dopamine ; si vous en recevez moins et/ou plus tard, il y a une diminution. Certains neurones tegmentaux répondent à un écart positif par rapport à l’attente, d’autres à un écart négatif ; ces derniers sont, comme il se doit, des neurones locaux qui libèrent le neurotransmetteur inhibiteur GABA (acide γ-aminobutyrique). Ces mêmes neurones participent à l’accoutumance, c’est-à-dire que la récompense qui suscitait autrefois une forte réponse dopaminergique devient moins excitante.
Logiquement, ces différents types de neurones de codage dans le tegmentum (ainsi que dans l’accumbens) reçoivent des projections du cortex frontal – c’est là que s’effectuent tous les calculs d’espérance/d’écart – “Bon, je pensais que j’allais avoir 5,0 mais j’ai eu 4,9. C’est une grosse déception, non ?”
D’autres régions corticales interviennent. Dans une étude, on a montré à des sujets un article à acheter, le degré d’activation de l’accumbens permettant de prédire le prix qu’ils seraient prêts à payer16. Ensuite, on leur a indiqué le prix ; s’il était inférieur à ce qu’ils étaient prêts à dépenser, il y avait une activation du cortex préfrontal ventro-médian (vmPFC) émotionnel ; s’il était plus cher, il y avait une activation du cortex insulaire lié au dégoût. En combinant toutes les données de neuro-imagerie, on pouvait prédire si la personne allait acheter l’article.
Ainsi, chez les mammifères typiques, le système de dopamine code sans échelle sur un large éventail d’expériences pour les bonnes et les mauvaises surprises et s’habitue constamment aux nouvelles d’hier. Mais les humains ont quelque chose en plus, à savoir que nous inventons des plaisirs bien plus intenses que tout ce qu’offre le monde naturel.
Autrefois, les chasseurs-cueilleurs pouvaient tomber par hasard sur du miel provenant d’une ruche et satisfaire ainsi brièvement une envie de nourriture profondément ancrée. Aujourd’hui, nous disposons de centaines d’aliments commerciaux soigneusement conçus qui procurent une explosion de sensations inégalée par un aliment naturel de qualité médiocre. Autrefois, nous avions des vies qui, au milieu de privations considérables, offraient également de nombreux plaisirs subtils et durement gagnés. Et maintenant, nous avons des drogues qui provoquent des spasmes de plaisir et une libération de dopamine mille fois supérieure à tout ce qui était stimulé dans notre ancien monde sans drogue. Je vais évoquer plus tard la série de vidéos d’Arte sur les réseaux sociaux et la dopamine pour aller plus en détail sur pourquoi ce qui correspond parfaitement à nos attentes et désirs n’est pas nécessairement un bienfait pour l’humanité.
Un vide résulte de la combinaison de sources de récompense non naturelles excessives et de l’inévitabilité de l’accoutumance, car les explosions anormalement fortes d’expériences, de sensations et de plaisirs synthétiques évoquent des degrés d’accoutumance anormalement forts17. Cela a deux conséquences. Tout d’abord, nous remarquons bientôt à peine les murmures fugaces de plaisir provoqués par les feuilles en automne, ou par le regard persistant de la bonne personne, ou par la promesse de récompense à la suite d’une tâche difficile et méritante. Et l’autre conséquence est que nous finissons par nous habituer même à ces déluges artificiels d’intensité. Si nous étions conçus par des ingénieurs, à mesure que nous consommons plus, nous désirerions moins. Mais la tragédie humaine fréquente est que plus nous consommons, plus nous avons faim. Plus, plus vite et plus fort. Ce qui était un plaisir inattendu hier est ce à quoi nous avons droit aujourd’hui, et ce qui ne sera pas suffisant demain.
L’anticipation de la récompense.
Ainsi, la dopamine est une récompense injuste, qui entraîne une accoutumance rapide. Mais la dopamine est plus intéressante que cela. Revenons à notre singe bien entraîné travaillant pour une récompense. Une lumière s’allume dans sa chambre, signalant le début d’un essai de récompense. Il se dirige vers le levier, appuie dix fois et obtient la récompense sous forme de raisin sec ; cela s’est produit suffisamment souvent pour que la dopamine n’augmente que légèrement avec chaque raisin sec.
Cependant, il est important de noter qu’une grande quantité de dopamine est libérée lorsque la lumière s’allume pour la première fois, signalant le début de l’essai de récompense, avant que le singe ne commence à presser le levier.
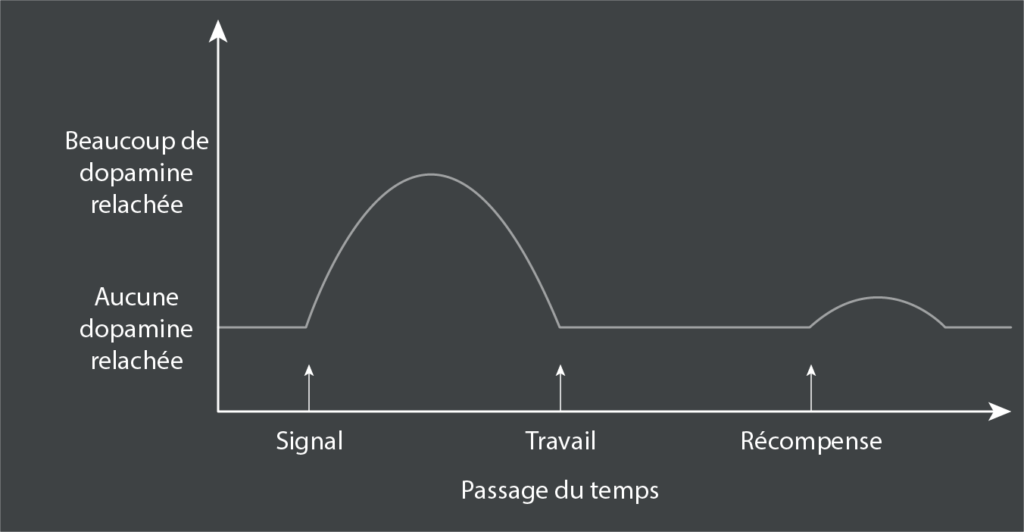
En d’autres termes, une fois les contingences de récompense apprises, la dopamine est moins liée à la récompense qu’à son anticipation. De même, les travaux de Brian Knutson, ont montré l’activation des voies de la dopamine chez les personnes qui anticipent une récompense monétaire18. La dopamine est liée à la maîtrise, à l’attente et à la confiance, mais ne s’y résume évidemment pas. C’est “Je sais comment les choses fonctionnent ; ça va être génial”. En d’autres termes, le plaisir est dans l’anticipation de la récompense, et la récompense elle-même est presque une pensée après coup (à moins, bien sûr, que la récompense n’arrive pas, auquel cas elle est la chose la plus importante au monde). Si vous savez que votre appétit sera assouvi, le plaisir est davantage lié à l’appétit qu’à l’assouvissement (je suis une de ces personnes à qui on dit qu’il mange trop vite, et bien entendu j’ai plus de plaisir à me jeter sur l’assiette qu’à la voir vide). C’est extrêmement important.
L’anticipation nécessite un apprentissage19. Apprenez le deuxième prénom de Warren G. Harding, et les synapses de l’hippocampe deviennent plus excitables. Apprenez que lorsque la lumière s’allume, c’est l’heure de la récompense, et ce sont les neurones de l’amygdale hippocampique et du cortex frontal qui se projettent sur les neurones dopaminergiques qui deviennent plus excitables.
C’est ce qui explique le besoin dépendant du contexte dans la dépendance20. Supposons qu’un alcoolique soit clean et sobre depuis des années. Ramenez-le à l’endroit où il avait l’habitude de consommer de l’alcool (par exemple, ce coin de rue délabré, ce club d’hommes huppés), et ces synapses potentialisées, ces indices que l’on a appris à associer à l’alcool, reviennent en force, la dopamine monte en flèche par anticipation, et l’état de besoin s’intensifie.
Un indice fiable d’une récompense imminente peut-il devenir lui-même une récompense ? C’est ce qu’a démontré Huda Akil de l’Université du Michigan. Une lumière placée sur le côté gauche de la cage d’un rat signale qu’en appuyant sur un levier, il recevra une récompense provenant d’un toboggan à nourriture situé sur le côté droit. Il est remarquable que les rats finissent par travailler pour avoir la chance de rester du côté gauche de la cage, simplement parce que c’est agréable d’être là. Le signal a gagné le pouvoir dopaminergique de ce qui est signalé. De même, les rats travailleront pour être exposés à un indice qui signale qu’une sorte de récompense est probable, sans savoir laquelle ni quand. C’est ce que sont les fétiches, au sens anthropologique et sexuel du terme21. Le cerveau est une machine à associer, et si la lumière est associée à un stimulus plaisant, alors la lumière elle-même devient plaisante. Du conditionnement tout ce qu’il y a de plus basique et intuitif.
Le groupe de Schultz a montré que l’ampleur de l’augmentation anticipée de la dopamine reflète deux variables. La première est la taille de la récompense anticipée. Un singe a appris qu’une lumière signifie que dix pressions sur le levier donnent une unité de récompense, tandis qu’une tonalité signifie que dix pressions donnent dix unités. Et très vite, une tonalité provoque plus de dopamine anticipative qu’une lumière. C’est “Ça va être génial” contre “Ça va être génial“.
La deuxième variable est extraordinaire. La règle est que la lumière s’allume, vous appuyez sur le levier, vous obtenez la récompense. Maintenant les choses changent. La lumière s’allume, on appuie sur le levier, on obtient la récompense… seulement 50 % du temps. Remarquablement, une fois que ce nouveau scénario est appris, beaucoup plus de dopamine est libérée. Pourquoi ? Parce que rien n’alimente la libération de dopamine comme le “peut-être” du renforcement intermittent22. Vous me voyez arriver avec les lootbox dans les jeux vidéos ? Les récompenses sociales où une de nos photos ayant connu un succès phénoménal laisse un arrière goût déplaisant lorsque toutes celles qui suivent sont simplement ignorées ?
Cette dopamine supplémentaire est libérée à un moment différent. La lumière s’allume dans le scénario 50 %, produisant l’habituelle montée de dopamine anticipée avant que la pression sur le levier ne commence. À l’époque prévisible où l’actionnement d’un levier donnait toujours lieu à une récompense, une fois l’actionnement terminé, les niveaux de dopamine restaient bas jusqu’à l’arrivée de la récompense, suivie d’un petit pic de dopamine. Mais dans ce scénario à 50 %, une fois la pression terminée, les niveaux de dopamine commencent à augmenter, poussés par l’incertitude du “peut-être oui, peut-être non”.
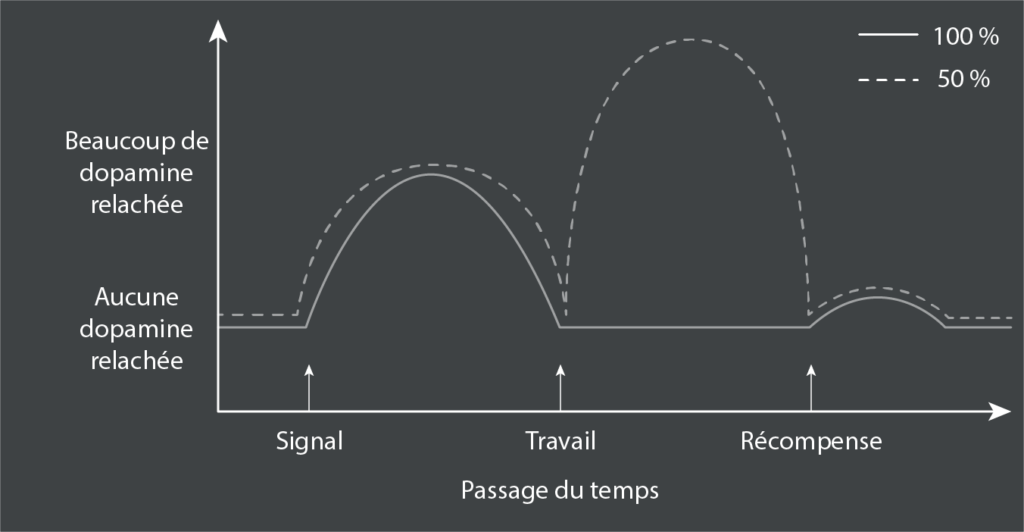
Modifiez encore les choses : la récompense survient maintenant dans 25 ou 75 % des cas. Un passage de 50 à 25 pour cent et un passage de 50 à 75 pour cent sont exactement opposés, en termes de probabilité de récompense, et les travaux du groupe de Knutson montrent que plus la probabilité de récompense est grande, plus l’activation du PFC médian est importante23. Mais les passages de 50 à 25 pour cent et de 50 à 75 pour cent réduisent tous deux l’ampleur de l’incertitude. Et l’augmentation secondaire de la dopamine pour une probabilité de récompense de 25 ou 75 % est plus faible que pour une probabilité de 50 %. Il est intéressant de noter qu’en cas d’incertitude, l’augmentation de la libération anticipée de dopamine se situe principalement dans la voie mésocorticale plutôt que mésolimbique, ce qui implique que l’incertitude est un état cognitif plus complexe que l’anticipation d’une récompense prévisible. Plus on est sûr du résultat, plus les niveaux de dopamine liés à l’incertitude diminuent, qu’on approche du 0% ou du 100%
Rien de tout cela n’est nouveau pour les psychologues honoraires qui dirigent Las Vegas. Logiquement, les jeux d’argent ne devraient pas susciter beaucoup de dopamine d’anticipation, étant donné les chances astronomiques de gagner. Mais l’ingénierie comportementale – l’activité 24 heures sur 24 et 7 jours sur 7 et l’absence de repères temporels, l’alcool bon marché qui affaiblit le jugement frontocortical, les manipulations visant à vous faire croire que c’est votre jour de chance – déforme et déplace la perception des chances dans une fourchette où la dopamine se déverse et, “oh, pourquoi pas, essayons à nouveau.”
L’interaction entre le “peut-être” et la propension à la dépendance au jeu est illustrée par une étude sur les “presque ratés”, c’est-à-dire les cas où deux bobines sur trois s’alignent dans une machine à sous. Chez les sujets témoins, l’activation dopaminergique est minime après un échec, quel qu’il soit ; chez les joueurs pathologiques, un échec de justesse active le système dopaminergique comme jamais. Une autre étude a porté sur deux situations de pari avec des probabilités de récompense identiques mais des niveaux d’information différents sur les éventualités de récompense. La situation comportant moins d’informations (c’est-à-dire qui portait davantage sur l’ambiguïté que sur le risque) a activé l’amygdale et réduit au silence la signalisation dopaminergique ; ce qui est perçu comme un risque bien calibré crée une dépendance, tandis que l’ambiguïté est simplement agitée24.
Poursuite de la récompense ?
La dopamine est donc plus liée à l’anticipation de la récompense qu’à la récompense elle-même. Il est temps d’ajouter un autre élément au tableau. Considérez ce singe entraîné à répondre à l’indice lumineux en appuyant sur le levier, et la récompense arrive ; comme nous le savons maintenant, une fois que cette relation est établie, la libération de dopamine est en grande partie anticipée, se produisant juste après l’indice.
Que se passe-t-il si la libération de dopamine après le signal lumineux ne se produit pas25 ? Le singe n’appuie pas sur le levier. De même, si vous détruisez son accumbens, un rat fait des choix impulsifs, au lieu d’attendre une récompense plus importante et différée. À l’inverse, revenons au singe : si, au lieu de faire clignoter le signal lumineux, vous stimulez électriquement le tegmentum pour libérer de la dopamine, le singe appuie sur le levier. La dopamine ne concerne pas seulement l’anticipation de la récompense ; elle alimente le comportement orienté vers un but, nécessaire pour obtenir cette récompense ; la dopamine “lie” la valeur d’une récompense au travail qui en résulte. La dopamine “lie” la valeur d’une récompense au travail qui en résulte. Il s’agit de la motivation découlant de ces projections dopaminergiques vers le cortex préfrontal qui est nécessaire pour faire la chose la plus difficile (c’est-à-dire travailler).
En d’autres termes, la dopamine ne concerne pas le bonheur de la récompense. Il s’agit du bonheur de la poursuite de la récompense qui a une chance décente de se produire26.
Cela est essentiel pour comprendre la nature de la motivation, ainsi que ses échecs (par exemple, pendant la dépression, où il y a une inhibition de la signalisation de la dopamine grâce au stress, ou dans l’anxiété, où une telle inhibition est causée par des projections de l’amygdale)27. Cela nous renseigne également sur la source de la puissance frontocorticale derrière la volonté. Dans une tâche où l’on choisit entre une récompense immédiate et une récompense différée (plus importante), la contemplation de la récompense immédiate active les cibles limbiques de la dopamine (c’est-à-dire la voie mésolimbique), tandis que la contemplation de la récompense différée active les cibles frontocorticales (c’est-à-dire la voie mésocorticale). Plus l’activation de cette dernière est importante, plus le report de la gratification est probable.
Ces études portaient sur des scénarios de travail bref et rapide suivi d’une récompense28. Qu’en est-il lorsque le travail requis est prolongé et que la récompense est considérablement retardée ? Dans ce scénario, il y a une augmentation secondaire de la dopamine, une augmentation graduelle qui alimente le travail soutenu ; l’ampleur de la montée en puissance de la dopamine est fonction de la durée du délai et de la taille anticipée de la récompense :
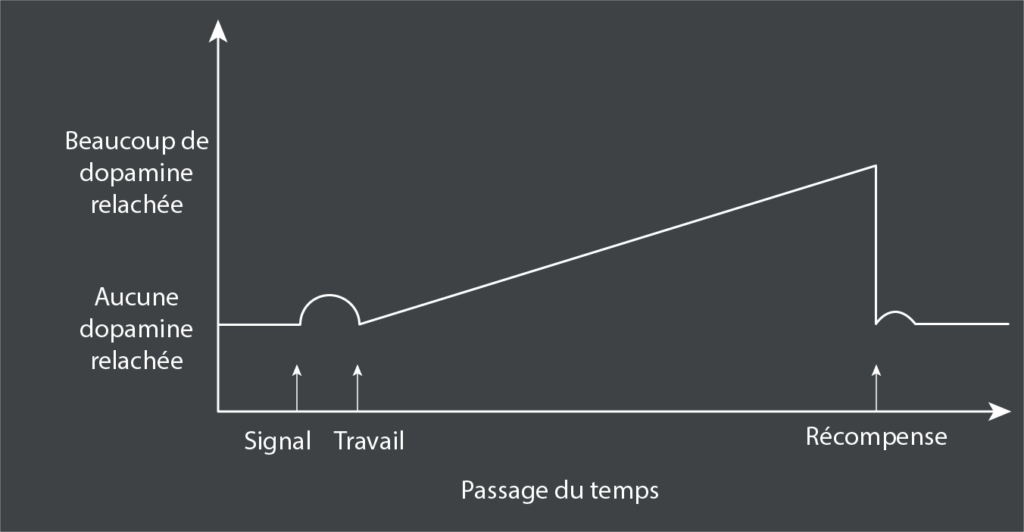
Cela révèle comment la dopamine alimente la gratification différée. Si attendre un temps X pour une récompense a une valeur Z ; attendre 2X devrait logiquement avoir une valeur ½Z ; au lieu de cela, nous “escomptons temporellement” – la valeur est plus petite, par exemple, ¼Z. Nous n’aimons pas attendre.
La dopamine et le cortex frontal sont au cœur de ce phénomène. Les courbes d’actualisation – une valeur de ¼Z au lieu de ½Z – sont codées dans l’accumbens, tandis que les neurones du cortex préfrontal dorso-latéral (dlPFC) et du cortex préfrontal ventro-médian (vmPFC) codent pour le délai29.
Cela génère des interactions complexes. Par exemple, si vous activez le vmPFC ou inactivez le dlPFC, la récompense à court terme devient plus attrayante. Une étude de Knutson en neuro-imagerie permet de mieux comprendre les personnes impatientes qui présentent des courbes d’actualisation temporelles abruptes ; leur accumbens sous-estime en effet l’ampleur de la récompense différée et leur dlPFC surestime la durée du délai30.
Collectivement, ces études montrent que le système dopaminergique, le cortex frontal, l’amygdale, l’insula et d’autres membres du chorus codent pour différents aspects de l’ampleur, du délai et de la probabilité de la récompense avec des degrés de précision variables, influençant tous le fait que nous parvenions à faire la chose la plus difficile et la plus correcte31.
Les différences individuelles dans la capacité de report de la gratification découlent de la variation du volume de ces voix neuronales individuelles32. Par exemple, il existe des anomalies dans les profils de réponse de la dopamine pendant les tâches d’actualisation temporelle chez les personnes présentant l’impulsivité inadaptée du trouble de déficit de l’attention/hyperactivité (TDAH). De même, les drogues addictives biaisent le système dopaminergique vers l’impulsivité.
Encore une complication : Ces études sur l’actualisation temporelle impliquent généralement des délais de l’ordre de quelques secondes. Bien que le système dopaminergique soit similaire chez de nombreuses espèces, les humains font quelque chose de tout à fait nouveau : nous retardons la gratification pendant des périodes incroyablement longues. Aucun phacochère ne restreint ses calories pour être beau en maillot de bain l’été prochain. Aucune gerbille ne travaille dur à l’école pour obtenir de bons résultats au BAC afin d’entrer dans une bonne université, puis dans une bonne école supérieure, puis dans un bon emploi, puis dans une bonne maison de retraite. Nous faisons quelque chose qui va même au-delà de ce délai de gratification sans précédent : nous utilisons le pouvoir dopaminergique du bonheur de la poursuite pour nous motiver à travailler pour des récompenses qui viennent après notre mort – selon votre culture, cela peut être de savoir que votre nation est plus proche de gagner une guerre parce que vous vous êtes sacrifié au combat, que vos enfants hériteront de l’argent grâce à vos sacrifices financiers, ou que vous passerez l’éternité au paradis. Ce sont des circuits neuronaux extraordinaires qui permettent d’éviter l’actualisation temporelle et qui permettent à certains d’entre nous de se soucier de la température de la planète dont hériteront nos arrière-petits-enfants. En fait, on ne sait pas comment les humains font cela. Nous sommes peut-être simplement un type d’animal, de mammifère, de primate et de singe, mais nous sommes profondément uniques.
Un plaisir charitable ?
William Harbaugh et des collègues à lui de l’université d’Oregon ont étudié le plaisir d’une manière intéressante33. L’objectif de leur étude était de mesurer l’activité du noyau accumbens soumis à des modèles économiques liés à la taxation et au don caritatif.
Une première théorie soutient que certains individus font œuvre charitable par pur altruisme ; ceux-ci retirent de la satisfaction à prêter assistance aux démunis, et se soucient plus de la somme d’aides qu’ils peuvent apporter que de la manière dont elles peuvent être financées. Ce modèle sous-entend que ces personnes retireraient autant de plaisir à être taxées pour le bien de la communauté. Une seconde théorie, appelée « Joie de donner », soutient que les gens aiment « décider » de leur démarche caritative. Dans ce cadre, le plaisir naît du désir de contrôle, au même titre que les joueurs veulent lancer leurs dés ou choisir leur billet de loterie. Ici, la taxation obligatoire n’alimente pas forcément la joie de donner. Une troisième théorie souligne que certaines personnes donnent pour mieux briller en société. Elles aiment étaler à la fois leur aisance financière et leur générosité. Bien entendu, ces théories ne s’excluent pas les unes les autres. Quelqu’un peut fort bien faire preuve d’altruisme, tout en jouissant de son pouvoir de décision et du regard que lui portent ses pairs.
Harbaugh et son équipe conçurent leur expérience pour interroger les deux premières théories, pas la troisième. Ils recrutèrent dix-neuf jeunes femmes issues de la région d’Eugene (Oregon) et les soumirent à une batterie de transactions financières, sous l’œil objectif d’un scanner cérébral. Les sujets furent informés que personne, pas même les expérimentateurs, ne connaîtrait leurs choix ; en effet, ceux-ci étaient entrés directement sur ordinateur et codés avant analyse.
Voici comment l’expérience fut menée : 100 dollars furent d’abord alloués à chaque sujet, sous forme d’un compte virtuel ; cette somme allait servir de base aux simulations économiques, toutes centrées sur l’activité caritative d’une banque alimentaire locale ; dans certains tests, les sujets auraient le choix de « donner » ou pas ; d’autres seraient directement taxés ; d’autres encore recevraient l’argent sans contrepartie ; un premier montant (15 ou 30 dollars) apparut sur l’écran vidéo, suivi, quelques secondes plus tard, de l’enjeu du test (propre à chacun) : la somme pouvait ainsi leur être offerte, leur être retirée en tant que taxe directe, ou bien se présenter comme possible don, qu’ils pouvaient alors soit valider, soit refuser en appuyant sur un bouton. L’imagerie cérébrale montra chez tous les participants la même activité : comme le gain d’argent, le prélèvement direct et le don avaient globalement activé les mêmes zones du noyau accumbens. Toutefois, en termes d’intensité, le don eut plus d’impact sur le centre du plaisir que la taxe obligatoire (Figure 1).
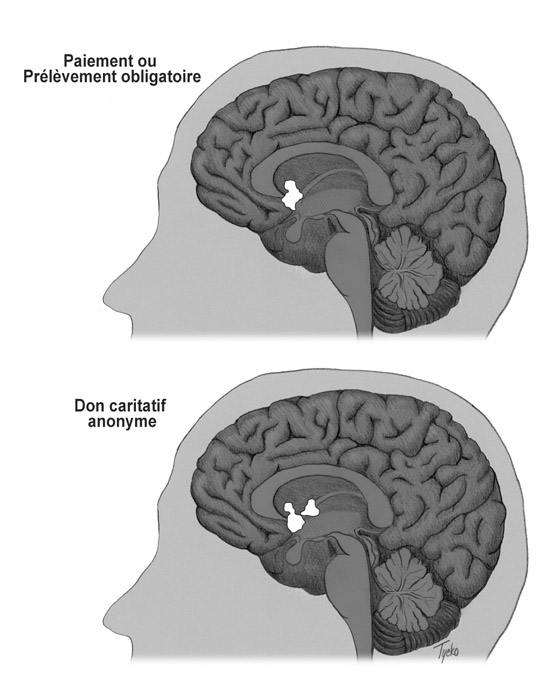
Ces conclusions viennent donc soutenir la thèse du « pur altruisme » et du « plaisir de donner » comme moteurs de la démarche caritative.
Bien entendu, cela ne signifie pas que ces mêmes personnes débordent de joie lorsqu’il s’agit de payer leurs impôts, même si ceux-ci contribuent largement à l’effort social. Cela ne veut pas dire non plus que le cerveau de chacun répond de la même manière dans les mêmes conditions. Environ la moitié des sujets de cette étude ont montré plus de plaisir à recevoir de l’argent qu’à en donner, à l’inverse de l’autre moitié. Sans surprise, ces derniers se montrèrent véritablement plus généreux que l’autre groupe.
Une question philosophique ressort de ces découvertes : si le don, même imposé et sous couvert d’anonymat, est gratifiant, cela signifie-t-il que le « pur altruisme » n’existe pas ? En d’autres termes, si nous tirons du plaisir de nos plus nobles instincts, cela les rend-il moins nobles ?
Bien que l’expérience de Harbaugh et ses collègues ait masqué les choix des sujets dans une volonté d’éliminer toute question de statut social ou d’approbation, il est évident qu’elle ne reflète pas la réalité. Tous nos comportements sont subordonnés au contexte social, et celui-ci influence profondément nos sentiments et nos décisions. Nous avons déjà souligné combien le moindre rejet social peut activer les centres de la souffrance émotionnelle, situés dans le cortex cingulaire antérieur. Cela sous-entend-il, à l’inverse, qu’une interaction sociale positive peut stimuler les centres du plaisir ?
La dimension sociale du plaisir.
L’une de ces formes d’interaction est l’acceptation, autrement dit l’évaluation positive de soi par les autres. Norihiro Sadato et ses collègues du National Institute for Physiological Sciences (Japon) ont cherché à identifier les régions cérébrales activées par ce que l’on appelle la « bonne réputation », et à les comparer à l’activité suscitée par la gratification financière34. Ici, le protocole expérimental reprit un dispositif bien connu : les sujets (reliés au scanner) devaient choisir l’une des trois cartes présentées sur un écran et recevoir des gains (variables) en retour. Le test produisit un schéma d’activité similaire à celui observé dans les études précédentes : les plus gros gains suscitèrent l’activité la plus forte au sein d’un certain nombre de zones cérébrales, dont le cortex orbitofrontal, l’insula, le striatum dorsal et le noyau accumbens.
Lorsque ces mêmes sujets revinrent pour un second jour de tests, ils commencèrent par remplir un imposant questionnaire de personnalité et enchaînèrent sur une interview vidéo. Ils retrouvèrent ensuite leur place dans le scanner, où ils prirent connaissance de l’évaluation de leur personnalité, établie, soi-disant, par un panel de huit observateurs (quatre hommes et quatre femmes) ; pour renforcer la supercherie, on leur montra des photos des membres de ce jury et on les prévint qu’ils les rencontreraient au terme de l’expérience. L’évaluation en question avait la forme d’un cliché du sujet souligné d’un simple terme descriptif ; certains mots étaient positifs (« fiable », « sincère »), d’autres plutôt neutres (« patient »). La principale découverte de ce dispositif montra que les évaluations les plus flatteuses activaient certaines parties du circuit du plaisir, plus particulièrement le noyau accumbens et le striatum dorsal, recoupant en grande partie celles stimulées par la gratification financière. Cette expérience suggère donc qu’il existe bien une correspondance nerveuse entre la reconnaissance sociale et la récompense financière.
Ces dernières années, de nombreux chercheurs en sciences sociales ont conclu que la comparaison sociale peut être un moteur important dans la prise de décision économique individuelle. Nous n’évaluons pas notre situation et notre avenir économiques selon une échelle absolue, mais bien plutôt en comparaison avec celle des gens qui nous entourent. Forts de cette constatation, Armin Falk et son équipe de l’université de Bonn ont conduit une expérience dans laquelle dix-neuf paires de sujets furent testées à l’aide de deux scanners placés côte à côte35.
Chaque sujet devait répondre à une série d’épreuves de perception et de rapidité : un groupe de points éparpillés apparaissait sur un écran vidéo, y restait durant 1,5 seconde, avant de laisser la place à un nombre (« 24 » par exemple) ; le sujet devait alors décider rapidement, à l’aide d’un des deux boutons à disposition, si le décompte réel des points était supérieur ou inférieur au nombre proposé ; après un délai très court, un résultat s’affichait sur l’écran, informant le sujet de son résultat et de celui de son voisin, ainsi que la somme récoltée par chacun. Précisons que les participants n’étaient récompensés que s’ils répondaient correctement ; si les deux échouaient, il n’y avait aucun gain ; si l’un des deux réussissait, il touchait 30 ou 60 euros, sous les yeux de son concurrent. Toutefois, lorsque les deux marquaient (ce qui advint pour 66 % des cas), l’ordinateur leur attribuait une récompense aléatoire, allant de 30 à 120 euros ; néanmoins, les sommes pouvaient être identiques ou légèrement différentes, voire très disparates.
Cette expérience montra que la comparaison sociale influence fortement l’activité des centres du plaisir. En d’autres termes, malgré l’adage biblique – « Tu ne convoiteras point la maison/la femme/les esclaves/le bœuf/l’âne/l’écran plasma/la Porsche/etc. de ton voisin » – il semble bien que nous soyons configurés pour profiter/souffrir de la comparaison avec autrui.
L’information comme fin en soi ?
L’homme se repaît d’informations. Nous adorons les chaînes d’informations en continu, les ragots, les rumeurs et, plus important encore, nous mourons d’envie de savoir de quoi demain sera fait. D’où vient ce besoin absolu de connaître l’avenir ? Les singes partagent-ils ce même désir ? Et si oui, celui-ci active-t-il les mêmes neurones dopaminergiques que la nourriture et l’eau, stimuli purement intrinsèques ?
Ces questions à ramifications multiples ont fait l’objet d’expériences menées par Ethan Bromberg-Martin et Okihide Hikosaka au sein de l’Institut national de l’œil, à Bethesda (Maryland, États-Unis)36. Ainsi, deux singes préalablement assoiffés, furent soumis à un test de prise de décision : deux cibles apparaissaient sur un écran vidéo, l’une à droite, l’autre à gauche, et l’animal devait choisir entre les deux, en clignant des yeux sur la cible sélectionnée ; après quelques secondes, le singe pouvait alors profiter d’une rasade d’eau, dont la quantité variait de manière aléatoire ; mais quel que fut le choix effectué, la récompense était au rendez-vous. Par ailleurs, le protocole prévoyait l’apparition d’un indice visuel, différent selon la décision prise : l’une produisait une icône, dont la forme variable annonçait la récompense à venir, l’autre suscitait un symbole quelconque sans aucune valeur prédictive. Dans cette configuration expérimentale, le singe conservait donc les mêmes chances de boire – et dans un délai invariable – qu’il opte pour recevoir une information ou qu’il choisisse le symbole neutre.
Pourtant, à l’instar de l’homme, lorsqu’il en eut la possibilité, le singe opta pour l’information prédictive. Sur une moyenne de dix tests, les deux singes penchèrent, presque systématiquement, pour la cible informatrice. Les mesures attachées aux neurones dopaminergiques de l’ATV et de la substantia nigra (ou substance noire) révélèrent un accroissement de la diffusion de dopamine à l’apparition du symbole prédisant une « grosse » récompense, tandis que l’annonce d’une plus petite quantité d’eau atténuait brièvement le niveau de diffusion.
D’après David Linden, cette expérience est révolutionnaire. Elle suggèrerait qu’un élément totalement abstrait est capable d’enclencher le canal du plaisir/récompense. Et nous ne parlons pas ici d’un plaisir tiré d’un besoin vital (boire, manger) ou lié à la survie de l’espèce (sexe), ni d’une gratification financière qui, bien qu’abstraite en elle-même, représente un moyen détourné pour obtenir des choses essentielles ; il ne s’agit pas non plus du plaisir de donner ou de jouir de l’admiration des autres.
Cette étude suggèrerait simplement que les idées sont addictives, comme n’importe quelle drogue. Nous l’avons déjà vu, certaines substances psychoactives détournent le circuit du plaisir pour susciter des sentiments agréables généralement déclenchés par la nourriture, le sexe et autres moteurs intrinsèques. Au cours de notre évolution récente – et nous pouvons y inclure nos cousins les singes et probablement les cétacés –, l’abstraction mentale s’est développée pour devenir un déclencheur de plaisir à part entière ; un phénomène complexe dont nous sommes passés maîtres. Le neuroscientifique Read Montague, unissant plusieurs courants de pensée en neurosciences cognitives, a qualifié de « superpouvoir » cette capacité à tirer du plaisir d’idées abstraites37. Dans cette perspective, certaines idées peuvent même s’opposer directement aux besoins les plus élémentaires. Par exemple, certains, s’appuyant sur leurs convictions religieuses, peuvent renoncer à toute activité sexuelle au service d’une idée perçue comme supérieure. De même, les grévistes de la faim, que leur démarche soit politique ou spirituelle, activent leur circuit du plaisir au service de leurs idées, au détriment de la nécessité la plus vitale.
Comment ce superpouvoir se développe-t-il au niveau cellulaire ? Pour le dire tout net, nous n’en savons vraiment rien. Toutefois, précisons que nous ne sommes qu’au début de nos spéculations, car il s’agit là d’une des manifestations de plasticité neuronale les plus élaborées et les plus récemment découvertes.
Un petit rappel s’impose : toute expérience sensorielle ou état interne se traduit dans notre cerveau par un modèle particulier d’activité neuronale ; ces schémas peuvent alors produire des changements dans la fonction nerveuse, notamment sous forme d’influx électrique. Rappelons brièvement le contenu du chapitre 2, qui soulignait l’effet de certains types de stimulation sur l’accroissement (potentialisation à long terme ou LTP) ou la diminution (dépression à long terme ou LTD) persistante d’intensité dans la communication synaptique ; ces deux processus n’étant qu’un infime aperçu de la souplesse de nos neurones. En outre, le facteur temps est un moteur important de cette plasticité : certains changements peuvent s’installer au terme d’une seule expérience, d’autres impliquent la répétition ; certains interviennent rapidement (en quelques secondes) tandis que d’autres réclament plusieurs jours ; certains ne durent pas, d’autres persistent toute la vie.
Ces modifications, suscitées par l’expérience, concernent tout le cerveau, mais il est essentiel de souligner qu’elles prennent toutes naissance dans les neurones du circuit du plaisir du télencéphale et les connexions qui en dépendent. En d’autres termes plus simples : le plaisir provoqué par les stimuli primaires (nourriture, sexe…) – pour lequel nous sommes naturellement configurés – peut être transformé par l’expérience en un phénomène bien plus complexe.
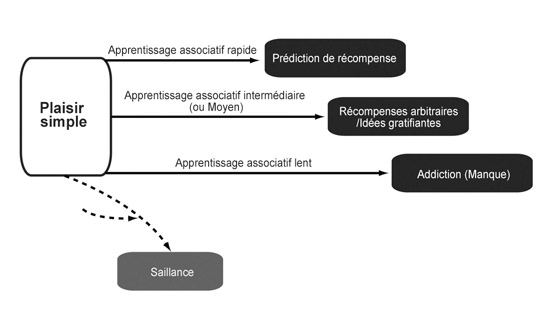
Lorsque les singes de Schultz apprennent à associer le voyant vert à la promesse d’une goutte de sirop, l’activité accrue de leurs neurones dopaminergiques (signe du plaisir) se cale rapidement sur l’apparition du signal, avant même de recevoir la récompense. En toute logique, il existe donc des axones excitateurs qui convoient le signal « voyant vert » jusqu’aux cellules dopaminergiques de l’ATV, et les synapses présentes entre ces axones et ces cellules subissent une LTP, qui crée alors l’association « voyant vert = plaisir ».
Le même modèle de base sous-tendrait le lien entre le stimulus arbitraire (l’argent, par exemple) – ou l’idée abstraite – et le plaisir. Si l’on admet qu’une idée abstraite suscite des schémas d’activité cérébrale particuliers, il est alors permis de penser que ces derniers peuvent finir dans le circuit du plaisir et y provoquer des changements. Il est probable que ce type d’association mettrait plus de temps à se développer et s’installerait plus durablement, à l’instar de souvenirs à long terme. Le stockage de cette mémoire semble être associé à des modifications microstructurelles dans le câblage neuronal, altérations qui sont précisément requises pour lier l’idée abstraite au plaisir. Enfin, nous avons vu dans le chapitre 2 comment la toxicomanie peut modifier, lentement et de façon persistante, la fonction du circuit du plaisir en la faisant glisser vers le désir maladif et le manque.
En résumé, l’interaction qui se joue dans notre cerveau entre le plaisir et l’apprentissage par association est une épée à double tranchant : la capacité de l’expérience à produire des changements durables dans le circuit du plaisir a permis de transformer les récompenses arbitraires et autres idées abstraites en d’agréables stimulants ; malheureusement, ce même processus peut nous entraîner sur les pentes de l’addiction.
[1] Drozak J, Bryła J. Dopamina–nie tylko neuroprzekaźnik [Dopamine: not just a neurotransmitter]. Postepy Hig Med Dosw (Online). 2005;59:405-20. Polish. PMID: 16106242.
[2] D. Carr and S. Sesack, “Projections from the Rat Prefrontal Cortex to the Ventral Tegmental Area: Target Specificity in the Synaptic Associations with Mesoaccumbens and Mesocortical Neurons,” J Nsci 20 (2000): 3864;
M. Stefani and B. Moghaddam, “Rule Learning and Reward Contingency Are Associated with Dissociable Patterns of Dopamine Activation in the Rat Prefrontal Cortex, Nucleus Accumbens, and Dorsal Striatum,” J Nsci 26 (2006): 8810.
* : Chez l’homme, l’activation du système dopaminergique est généralement évaluée à l’aide de techniques d’imagerie fonctionnelle comme l’IRMf, qui détectent les modifications du métabolisme dans différentes parties du cerveau. Pour être précis, si une augmentation de la demande métabolique dans ces régions est généralement due au fait que les neurones qui s’y trouvent ont beaucoup de potentiels d’action (libérant de la dopamine), les deux ne sont pas synonymes. Néanmoins, pour simplifier, j’utiliserai indifféremment les expressions “augmentation de la signalisation dopaminergique”, “activation des voies de la dopamine” et “libération de dopamine”.
[3] T. Danjo et al., “Aversive Behavior Induced by Optogenetic Inactivation of Ventral Tegmental Area Dopamine Neurons Is Mediated by Dopamine D2 Receptors in the Nucleus Accumbens,” PNAS 111 (2014): 6455;
N. Schwartz et al., “Decreased Motivation During Chronic Pain Requires Long-Term Depression in the Nucleus Accumbens,” Nat 345 (2014): 535.
[4] J. Cloutier et al., “Are Attractive People Rewarding? Sex Differences in the Neural Substrates of Facial Attractiveness,” J Cog Nsci 20 (2008): 941;
K. Demos et al., “Dietary Restraint Violations Influence Reward Responses in Nucleus Accumbens and Amygdala,” J Cog Nsci 23 (2011): 1952.
[5] Footnote: R. Deaner et al., “Monkeys Pay per View: Adaptive Valuation of Social Images by Rhesus Macaques,” Curr Biol 15 (2005): 543.
[6] V. Salimpoor et al., “Interactions Between the Nucleus Accumbens and Auditory Cortices Predicts Music Reward Value,” Sci 340 (2013): 216;
G. Berns and S. Moore, “A Neural Predictor of Cultural Popularity,” J Consumer Psych 22 (2012): 154;
S. Erk et al., “Cultural Objects Modulate Reward Circuitry,” Neuroreport 13 (2002): 2499.
[7] A. Sanfey et al., “The Neural Basis of Economic Decision-Making in the Ultimatum Game,” Sci 300 (2003): 1755.
Voir aussi : J. Moll et al., “Human Front-Mesolimbic Networks Guide Decisions About Charitable Donation,” PNAS 103 (2006): 15623;
W. Harbaugh et al., “Neural Responses to Taxation and Voluntary Giving Reveal Motives for Charitable Donations,” Sci 316 (2007): 1622.
[8] D. De Quervain et al., “The Neural Basis of Altruistic Punishment,” Sci 305 (2004): 1254; B. Knutson, “Sweet Revenge?” Sci 305 (2004): 1246.
[9] M. Delgado et al., “Understanding Overbidding: Using the Neural Circuitry of Reward to Design Economic Auctions,” Sci 321 (2008): 1849; E. Maskin, “Can Neural Data Improve Economics?” Sci 321 (2008): 1788.
[10] H. Takahasi et al., “When Your Gain Is My Pain and Your Pain Is My Gain: Neural Correlates of Envy and Schadenfreude,” Sci 323 (2009): 890;
K. Fliessbach et al., “Social Comparison Affects Reward-Related Brain Activity in the Human Ventral Striatum,” Sci 318 (2007): 1305.
[11] Lange, J., & Boecker, L. (2019). Schadenfreude as social-functional dominance regulator. Emotion, 19(3), 489–502. https://doi.org/10.1037/emo0000454 (/doi/10.1037/emo0000454)
[12] W. Schultz, “Dopamine Signals for Reward Value and Risk: Basic and Recent Data,” Behav and Brain Functions 6 (2010): 24.
[13] J. Cooper et al., “Available Alternative Incentives Modulate Anticipatory Nucleus Accumbens Activation,” SCAN 4 (2009): 409;
D. Levy and P. Glimcher, “Comparing Apples and Oranges: Using Reward-Specific and Reward-General Subjective Value Representation in the Brain,” J Nsci 31 (2011): 14693.
[14] P. Tobler et al., “Adaptive Coding of Reward Value by Dopamine Neurons,” Sci 307 (2005): 1642.
[15] W. Schultz, “Dopamine Signals for Reward Value and Risk: Basic and Recent Data,” Behav and Brain Functions 6 (2010): 24;
J. Cohen et al., “Neuron-Type-Specific Signals for Reward and Punishment in the Central Tegmental Area,” Nat 482 (2012): 85; J. Hollerman and W. Schultz, “Dopamine Neurons Report an Error in the Temporal Prediction of Reward During Learning,” Nat Nsci 1 (1998): 304;
A. Brooks et al., “From Bad to Worse: Striatal Coding of the Relative Value of Painful Decisions,” Front Nsci 4 (2010): 1.
[16] B. Knutson et al., “Neural Predictors of Purchases,” Neuron 53 (2007): 147.
[17] P. Sterling, “Principles of Allostasis: Optimal Design, Predictive Regulation, Pathophysiology and Rational Therapeutics,” in Allostasis, Homeostasis, and the Costs of Adaptation, ed. J. Schulkin (Cambridge, MA: MIT Press, 2004).
[18] B. Knutson et al., “Anticipation of Increasing Monetary Reward Selectively Recruits Nucleus Accumbens,” J Nsci 21 (2001): RC159.
[19] G. Stuber et al., “Reward-Predictive Cues Enhance Excitatory Synaptic Strength onto Midbrain Dopamine Neurons,” Sci 321 (2008): 1690;
A. Luo et al., “Linking Context with Reward: A Functional Circuit from Hippocampal CA3 to Ventral Tegmental Area,” Sci 33 (2011): 353;
J. O’Doherty, “Reward Representations and Reward-Related Learning in the Human Brain: Insights from Neuroimaging,” Curr Opinions in Neurobiol 14 (2004): 769;
M. Cador et al., “Involvement of the Amygdala in Stimulus-Reward Associations: Interaction with the Ventral Striatum,” Nsci 30 (1989): 77;
J. Britt et al., “Synaptic and Behavioral Profile of Multiple Glutamatergic Inputs to the Nucleus Accumbens,” Neuron 76 (2012): 790;
G. Stuber et al., “Optogenetic Modulation of Neural Circuits That Underlie Reward Seeking,” BP 71 (2012): 1061;
F. Ambroggi et al., “Basolateral Amygdala Neurons Facilitate Reward-Seeking Behavior by Exciting Nucleus Accumbens Neurons,” Neuron 59 (2008): 648.
[20] S. Hyman et al., “Neural Mechanisms of Addiction: The Role of Reward-Related Learning and Memory,” Ann Rev of Nsci 29 (2006): 565;
B. Lee et al., “Maturation of Silent Synapses in Amygdala-Accumbens Projection Contributes to Incubation of Cocaine Craving,” Nat Nsci 16 (2013): 1644.
Pour une considération des comportements compulsifs comme addictions : S. Rauch and W. Carlezon, “Illuminating the Neural Circuitry of Compulsive Behaviors,” Sci 340 (2013): 1174;
S. Ahmari et al., “Repeated Cortico-Striatal Stimulation Generates Persistent OCD-like Behavior,” Sci 340 (2013): 1234;
E. Burguiere et al., “Optogenetic Stimulation of Lateral Orbitofronto-Striatal Pathway Suppresses Compulsive Behaviors,” Sci 340 (2013): 1243.
[21] S. Flagel et al., “A Selective Role for Dopamine in Stimulus-Reward Learning,” Nat 469 (2011): 53; K. Burke et al., “The Role of the Orbitofrontal Cortex in the Pursuit of Happiness and More Specific Rewards,” Nat 454 (2008): 340.
[22] P. Tobler et al., “Adaptive Coding of Reward Value by Dopamine Neurons,” Sci 307 (2005): 1642; C. Fiorillo et al., “Discrete Coding of Reward Probability and Uncertainty by Dopamine Neurons,” Sci 299 (2003): 1898.
[23] B. Knutson et al., “Distributed Neural Representation of Expected Value,” J Nsci 25 (2005): 4806;
M. Stefani and B. Moghaddam, “Rule Learning and Reward Contingency Are Associated with Dissociable Patterns of Dopamine Activation in the Rat Prefrontal Cortex, Nucleus Accumbens, and Dorsal Striatum,” J Nsci 26 (2006): 8810.
[24] R. Habib and M. Dixon, “Neurobehavioral Evidence for the “Near-Miss” Effect in Pathological Gamblers,” J the Exp Analysis of Behav 93 (2010): 313;
M. Hsu et al., “Neural Systems Responding to Degrees of Uncertainty in Human Decision-Making,” Sci 310 (2006): 1680.
[25] A. Braun et al., “Dorsal Striatal Dopamine Depletion Impairs Both Allocentric and Egocentric Navigation in Rats,” Neurobiol of Learning and Memory 97 (2012): 402;
J. Salamone, “Dopamine, Effort, and Decision Making,” Behavioral Nsci 123 (2009): 463;
I. Whishaw and S. Dunnett, “Dopamine Depletion, Stimulation or Blockade in the Rat Disrupts Spatial Navigation and Locomotion Dependent upon Beacon or Distal Cues,” BBR 18 (1985): 11;
J. Salamone and M. Correa, “The Mysterious Motivational Functions of Mesolimbic Dopamine,” Neuron 76 (2012): 470;
H. Tsai et al., “Phasic Firing in Dopaminergic Neurons Is Sufficient for Behavioral Conditioning,” Sci 324 (2009): 1080;
P. Phillips et al., “Sub-second Dopamine Release Promotes Cocaine Seeking,” Nat 422 (2003): 614;
M. Pessiglione et al., “Dopamine-Dependent Prediction Errors Underpin Reward-Seeking Behavior in Humans,” Nat 442 (2008): 1042.
[26] M. Numan and D. Stoltzenberg, “Medial Preoptic Area Interactions with Dopamine Neural systems in the Control of the Onset and Maintenance of Maternal Behavior in Rats,” Front Neuroendo 30 (2009): 46.
[27] S. McClue et al., “Separate Neural Systems Value Immediate and Delayed Monetary Rewards,” Sci 306 (2004): 503;
J. Jennings et al., “Distinct Extended Amygdala Circuits for Divergent Motivational States,” Nat 496 (2013): 224.
[28] M. Howe et al., “Prolonged Dopamine Signaling in Striatum Signals Proximity and Value of Distant Rewards,” Nat 500 (2013): 575; Y. Niv, “Dopamine Ramps Up,” Nat 500 (2013): 533.
[29] W. Schultz, “Subjective Neuronal Coding of Reward: Temporal Value Discounting and Risk,” Eur J Nsci 31 (2010): 2124;
S. Kobayashi and W. Schultz, “Influence of Reward Delays on Responses of Dopamine Neurons,” J Nsci 28 (2008): 7837;
S. Kim et al., “Prefrontal Coding of Temporally Discounted Values During Intertemporal Choice,” Neuron 59 (2008): 161;
M. Roesch and C. Olson, “Neuronal Activity in Orbitofrontal Cortex Reflects the Value of Time,” J Neurophysiology 94 (2005): 2457;
M. Bermudez and W. Schultz, “Timing in Reward and Decision Processes,” Philosophical Trans of the Royal Soc of London B 369 (2014): 20120468;
B. Figner et al., “Lateral Prefrontal Cortex and Self-Control in Intertemporal Choice,” Nat Nsci 13 (2010): 538;
K. Jimura et al., “Impulsivity and Self-Control During Intertemporal Decision Making Linked to the Neural Dynamics of Reward Value Representation,” J Nsci 33 (2013): 344;
S. McClure et al., “Time Discounting for Primary Rewards,” J Nsci 27, 5796.
[30] K. Ballard and B. Knutson, “Dissociable Neural Representations of Future Reward Magnitude and Delay During Temporal Discounting,” Neuroimage 45 (2009): 143.
[31] A. Lak et al., “Dopamine Prediction Error Responses Integrate Subjective Value from Different Reward Dimensions,” PNAS 111 (2014): 2343.
[32] V. Noreika et al., “Timing Deficits in Attention-Deficit/Hyperactivity Disorder (ADHD): Evidence from Neurocognitive and Neuroimaging Studies,” Neuropsychologia 51 (2013): 235;
A. Pine et al., “Dopamine, Time, and Impulsivity in Humans,” J Nsci 30 (2010): 8888;
W. Schultz, “Potential Vulnerabilities of Neuronal Reward, Risk, and Decision Mechanisms to Addictive Drugs,” Neuron 69 (2011): 603.
[33] W. T. Harbaugh, U. Mayr & D. R. Burghart, « Neural responses to taxation and voluntary giving reveal motives for charitable donations », in Science n° 316 (2007), p. 1622-1625. ;
J. Moll, F. Krueger, R. Zahn, M. Pardini, R. de Oliveira-Souza & J. Grafman, « Human fronto-mesolimbic networks guide decisions about charitable donation », in Proceedings of the National Academy of Sciences of the USA n° 103 (2006), p. 15623-15628.
[34] K. Izuma, D. N. Saito & N. Sadato, « Processing of social and monetary rewards in the human striatum », in Neuron n° 58 (2008), p. 284-294.
[35] K. Fleissbach, B. Weber, P. Trautner, T. Dohmen, U. Sunde, C. E. Elger & A. Falk, « Social comparison affects reward-related brain activity in the human ventral striatum », in Science n° 318 (2007), p. 1305-1308.
[36] E. S. Bromberg-Martin & O. Hikosaka, « Midbrain dopamine neurons signal preference for advance information about upcoming rewards », in Neuron n° 63 (2009), p. 119-126.
[37] Montague, R. (2007). Your brain is (almost) perfect: How we make decisions. Penguin.
