Quand la vaisselle s’entasse, dites vous seulement que vous allez laver une cuillère, vous finirez par faire toute la vaisselle. Quitte à se salir les mains, autant rentabiliser au maximum le produit vaisselle et les mains de toute façon mouillées. Tout ça pour dire que, vous avez cliqué, maintenant vous n’avez plus qu’à lire.
Pourquoi s’intéresser au TDA/H.
Le trouble du déficit de l’attention avec ou sans hyperactivité (TDA/H) concerne environ 2.5% de la population adulte mondiale1 et entre 3,5% et 5.6% des jeunes de 6 à 12 ans en France2. Les dernières recherches dans le domaine montrent une espérance de vie réduite d’entre 8.4 ans et 12.7 ans pour un adulte ayant cette condition3, et nous comprendrons un peu mieux pourquoi dans la partie sur les comorbidités.
C’est un des troubles cognitifs les plus étudiés et pour lequel les traitements et médicaments sont les plus efficaces. C’est aussi un des plus mal connus du grand public, rempli d’a priori et de stigmates4, ce qui n’est pas nécessairement sans raison. Effectivement, une étude de 20125 avec 13 572 jeunes soulève la question de la criminalité en lien direct avec un TDA/H dans l’enfance, entre 5 et 12 ans. Ainsi, voir un TDA/H se développer chez un enfant de cet âge augmente fortement le risque de déboires avec la justice une fois adolescent/jeune adulte. L’impact du TDA/H sur la criminalité de ces individus est jugé dans l’étude plus fort que celui du genre, de l’éducation ou des revenus.
Ce stigma apporte évidemment son lot de conséquences sur les enfants, et les adultes, ayant un TDA/H. Une étude de 20076 montre qu’une difficulté à s’intégrer existe chez ces enfants du fait de leur trouble, et qu’une fois rejetés, s’enclenche un cercle vicieux (que l’on imagine bien être un facteur important dans l’augmentation de la criminalité et de la délinquance dans cette population). Pas moins de 50 à 70% des jeunes TDA/H connaitraient des difficultés sociales importantes. Une étude de 20137 dit aussi que ces jeunes expérimentent fréquemment la stigmatisation par les pairs, le rejet, la victimisation, ce qui est associé avec des conséquences à long terme, académiques, psychopathologiques et sociales.
C’est un des troubles neurodéveloppementaux les plus sous-diagnostiqué / sous-traité8. Par exemple, l’HAS caractérise encore ce trouble principalement par de l’hyperactivité externe9 alors que c’est un très mauvais prédicteur de l’absence ou de la présence du trouble (~40% de patients ne sont pas hyperactifs dès l’enfance et de toute façon l’hyperactivité motrice disparait en grande partie avec l’âge en étant intériorisée en hyperactivité mentale). Beaucoup disent, dans les domaines de l’enfance (éducation nationale et spécialisée, pédo-psychiatrie, etc.) que l’on sur diagnostique les enfants et que l’on labélise trop facilement de TDA/H, les médicaments étant critiqués par extension10, mais il y aurait aussi une discrimination sexiste à l’égard des femmes atteintes par ce trouble, alors que c’est étudié11 et qu’il n’est pas question, pour les experts étudiant la question, d’exclure les femmes des bienfaits de la médecine.
Et bien que l’on puisse confondre des enfants avec beaucoup d’énergie avec des enfants TDA/H, nous connaissons suffisamment ce trouble pour différencier correctement et cesser de croire que le TDA/H est une invention des vendeurs de ritaline ou encore des parents qui n’ont pas envie de s’occuper de leurs enfants.
Pour plus de lecture concernant les croyances de certains : https://scilogs.fr/ramus-meninges/les-faits-alternatifs-des-psychanalystes-sur-le-tdah/
Le TDA/H, qu’est-ce que donc que ce maléfice ?
Le nom du trouble est quelque peu trompeur puisque ce n’est pas nécessairement un problème d’attention ni d’hyperactivité. Le TDA/H n’empêche pas des moments d’hyper concentration, c’est plutôt la régulation de l’attention qui pose problème et qui dépend fortement du contexte environnemental. Le TDA/H est en effet associé avec de hauts niveaux de variabilité intra individuelle dans le processus d’attention12.
Vient s’ajouter à cela un manque de motivation dû à un fonctionnement hypo dopaminergique13, menant à une recherche constante de stimulation et une aversion pour les récompenses avec un certain délai14. Tout cela rend les tâches difficiles et délicates extrêmement compliquées à réaliser pour les personnes avec un TDA/H, surtout pour les plus jeunes qui n’ont pas encore trouvé de moyens de compensation du trouble.
Le trouble déficitaire de l’attention avec ou sans hyperactivité a deux caractéristiques principales :
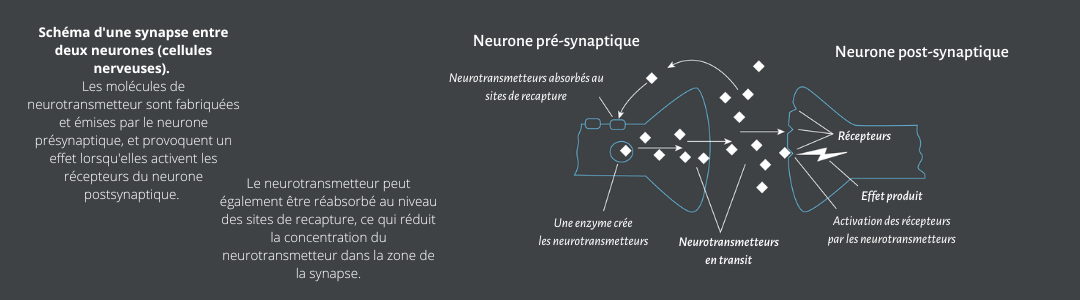
– Un dysfonctionnement au niveau de la dopamine et de la sérotonine15. Non seulement le cerveau génère moins de ces deux composants qu’un cerveau « neurotypique », mais en plus il l’élimine beaucoup plus rapidement, laissant les personnes avec un TDA/H en constant besoin de ces neurotransmetteurs.
– Des différences notamment au niveau du lobe frontal16 qui gère tout ce qui est fonctions exécutives, avec des différences filles/garçons17. Qu’est-ce que les fonctions exécutives ? Les fonctions exécutives gèrent la capacité de diriger l’attention, la mémoire immédiate, la régulation des émotions, la perception du temps et la planification18. C’est ce qui permet à l’humain de modifier son comportement pour atteindre des objectifs qui ne sont pas immédiats.
Quand on combine ces deux facteurs, qu’est-ce qu’on obtient ? Un cerveau sous-stimulé au niveau de la dopamine et de la sérotonine et qui essaie donc de faire tout ce qu’il peut pour obtenir sa dose pour fonctionner normalement. Couplé à des problèmes d’attention, cela veut dire que le cerveau essaie en permanence de trouver des choses intéressantes à faire et satisfaisantes. L’impulsivité est donc accrue, la perception du temps est fortement altérée (tout passe plus vite). La moindre tâche perçue comme inintéressante, répétitive devient un enfer à effectuer correctement et sans erreur. Si en plus cela doit se faire en plusieurs étapes et qu’il n’y a pas d’intérêt ou d’urgence pour pousser à l’accomplissement, c’est encore plus compliqué. Si vous voulez voir une personne avec un TDA/H échouer, mettez là dans un environnement sans conséquences, sans supervision et affectez-lui des tâches qu’elle trouve non stimulantes.
Pour plus d’informations sur le fonctionnement neurobiologique du TDA/H, il y a un bonus à la fin de l’article.
Les mécanismes cognitifs du TDA/H.
Le TDA/H se caractérise par des déficits dans plusieurs domaines cognitifs relativement indépendants. Les déficits du fonctionnement exécutif sont observés dans la mémoire de travail visuo-spatiale et verbale, le contrôle inhibiteur, la vigilance et la planification19. Les études sur le dérèglement des récompenses montrent que les patients atteints de TDA/H prennent des décisions sous-optimales20, préfèrent les récompenses immédiates aux récompenses différées21 et surestiment l’importance des récompenses proximales par rapport aux récompenses distales22. Le traitement de l’information temporelle et la synchronisation23, la parole et le langage24, l’empan mnésique, la vitesse de traitement et la variabilité du temps de réponse25, l’éveil et l’activation26, ainsi que le contrôle moteur27 sont d’autres domaines touchés par le TDA/H. Bien que la plupart des patients atteints du TDA/H présentent des déficits dans un ou deux domaines cognitifs, certains n’ont aucun déficit et très peu présentent des déficits dans tous les domaines28. En outre, tout au long de la vie des patients atteints de TDA/H, il a été démontré que les déficits du contrôle cognitif, de la sensibilité à la récompense et de la synchronisation sont indépendants les uns des autres29, et on ne sait pas actuellement si les déficits cognitifs sont à l’origine des symptômes du TDA/H et du développement du phénotype clinique ou s’ils reflètent les résultats pléiotropiques des facteurs de risque.
Evolution du trouble.
Selon les gens et leur environnement le développement des fonctions exécutives sera différent. Les mécanismes de gestion et de masquage seront également différents. Le trouble est de même nature pour les hommes et les femmes, mais les manifestations externes ou leur perception par la société est différente.
D’où ça vient ?
Le TDA/H est principalement d’origine génétique, hautement héréditaire30. Ce n’est pas dû à l’éducation, à l’alimentation ou aux occupations (non, regarder la télé en étant gosse ou manger du sucre ne vous contamine pas avec un TDA/H). Les facteurs favorisant l’expression de ces gènes sont principalement le tabagisme lors de la grossesse, la prématurité et le sous-poids à la naissance. C’est un trouble qui apparaît dans l’enfance, si vous n’avez pas de symptômes à vos 25 ans, il n’y a aucune chance que vous le développiez sur le tard – sauf dans de très rares cas de traumatismes crâniens ou d’AVC entrainant des dégâts cérébraux. Il est en revanche possible que les symptômes évidents aient été masqués en compensant l’usage des fonctions exécutives.
Les symptômes du TDA/H
Le DSM-V indique que la manifestation des symptômes doit durer depuis plus de 6 mois afin de pouvoir réellement parler d’un trouble déficitaire de l’attention avec ou sans hyperactivité. L’inattention, l’hyperactivité, un comportement disruptif et l’impulsivité sont des manifestations communes du TDA/H, et vont de pair avec des difficultés académiques ou sociales. Pour parler de trouble il est nécessaire que les symptômes observés aient un impact négatif sur la vie de la personne. Il faut retrouver 6 symptômes d’inattention ou d’hyperactivité/impulsivité chez les moins de 17 ans et 5 symptômes parmi les plus de 17 ans dans la liste suivante :
Dans la catégorie de l’inattention :
- Manque fréquemment des détails et fait des erreurs évitables
- Souvent difficile de maintenir une concentration sur une tâche ou une activité
- Se retrouve souvent à ne pas écouter quand on lui parle, même quand il n’y a aucune distraction particulière
- Ne finit que rarement ses tâches, ne suit pas les instructions
- Difficultés organisationnelles, difficultés à respecter les délais
- Fréquemment du mal à s’engager dans des tâches qui requièrent une attention soutenue
- Perd souvent ses affaires
- Facilement distrait par des choses sans importance
- Oublie des activités du quotidien
Dans la catégorie hyperactivité/impulsivité :
- S’agite ou se tortille souvent sur son siège
- A du mal à rester assis durant le diner, le travail
- Court fréquemment dans des situations inappropriées
- A du mal à s’engager calmement dans des activités/jeux
- Constamment en mouvement, mal à l’aise sinon
- Parle souvent trop
- Répond souvent à une question avant qu’elle soit finie
- Difficultés pour attendre son tour
- Interrompt souvent les autres
Le DSM-V n’est cependant pas sans défaut, et il existe un besoin reconnu d’affiner les critères de diagnostic du TDA/H31. Mais nous pouvons « simplifier » pour améliorer la compréhension de ce que l’on doit regarder pour penser à un TDA/H. En d’autres termes :
- L’immobilité génère une tension interne et de l’anxiété.
- Une recherche de sensations fortes (par exemple, dans les sports extrêmes, la vitesse, les drogues ou le jeu compulsif).
- Une faible capacité de concentration.
- Une difficulté à s’organiser au quotidien et à long terme.
- Une difficulté à commencer / terminer des tâches.
- Des sautes d’humeur.
- Un caractère colérique / impulsif.
- Une faible estime de soi.
- Une difficulté à gérer le stress.
- Une difficulté à tolérer la frustration.
- Peu de stabilité, tant dans la vie de couple qu’au travail.
Il est important de noter que les symptômes ne sont que la manifestation externe des troubles internes. Ce trouble est un spectre, comme l’autisme, tout le monde n’a pas les mêmes symptômes. Le sexe a une influence sur la manifestation du trouble chez les hommes et les femmes, avec une sévérité plus grande pour les hommes32 (ce qui n’est pas encore tout à fait expliqué, nature ou culture ?). En parallèle, le fait de vieillir fait disparaître chez beaucoup un certain nombre de symptômes33, ce qui peut s’expliquer en partie par des moyens de compensation développés34 par les personnes au fur et à mesure de leur évolution dans la vie. Comme r/ADHD en atteste, chacun trouve des moyens de faire avec le trouble dans divers domaines, comme le sommeil, la concentration, la motivation, etc.
J’ai des symptômes ponctuels, peut-être que je l’ai ?
Tout le monde a des symptômes de temps à autres. Tout comme tout le monde a des symptômes passagers de dépression quand ils ne vont pas bien. Ce qui définit une pathologie n’est pas juste les symptômes ponctuels mais le niveau d’handicap causé dans la vie courante, la persistance au cours du temps, et surtout le décalage entre le contexte de vie et l’état mental interne. Il faut plusieurs symptômes qui impactent plusieurs champs de vie majeurs (travail, relations, gestion du quotidien…) et une persistance sur plusieurs mois / années.
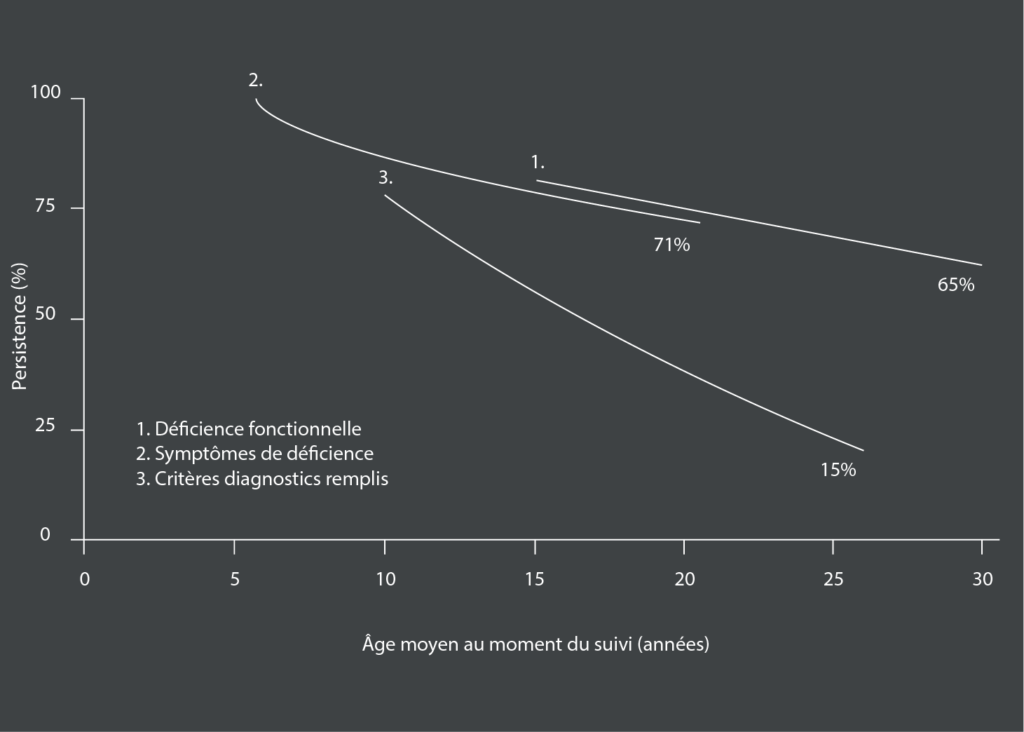
Des études de suivi ont évalué les enfants souffrant de trouble de déficit de l’attention/hyperactivité (TDA/H) à plusieurs moments après leur diagnostic initial. Bien qu’elles documentent un déclin des symptômes du TDA/H en fonction de l’âge, le TDA/H est également un trouble hautement persistant lorsqu’il est défini par la persistance d’une déficience fonctionnelle ou la persistance de symptômes altérant le fonctionnement en deçà du seuil (trois ou moins).
Vivre avec… ?
Comme tout trouble ou maladie, le TDA/H ne vient malheureusement pas seul. Il est accompagné de tout un tas de comorbidités. En médecine, la comorbidité désigne la présence d’un ou de plusieurs troubles associés à un trouble ou une maladie primaire. Ici, le TDA/H associé à divers autres problèmes.
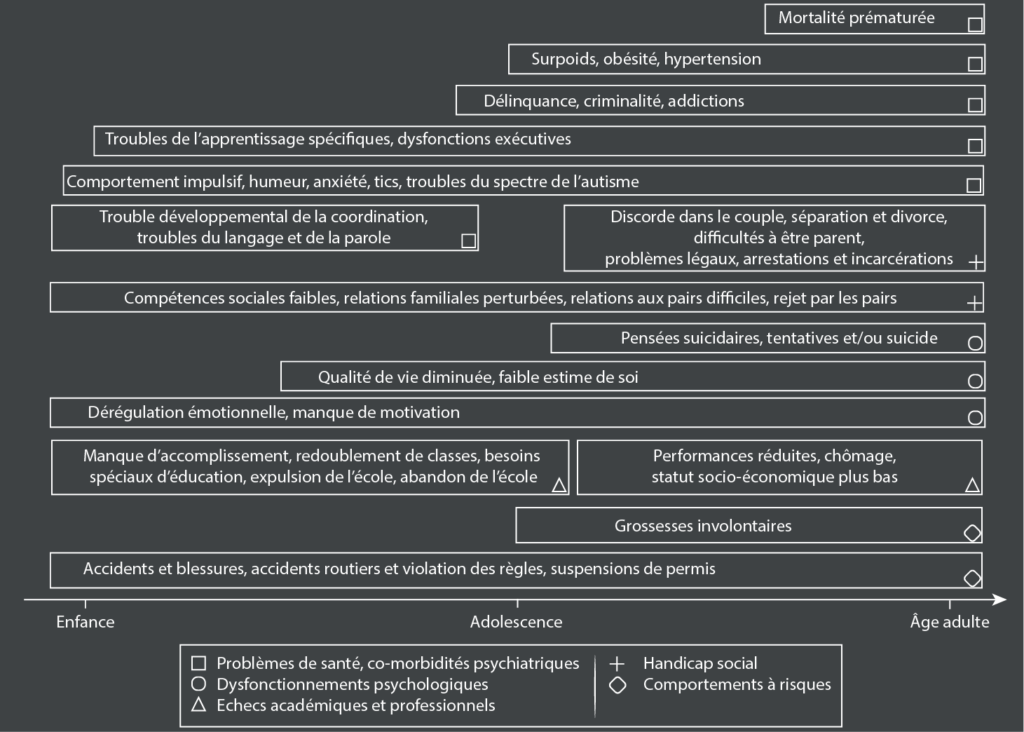
Au travers de la vie d’un individu, le TDA/H peut significativement augmenter le risque d’autres troubles psychiatriques, d’échecs, d’accidents, de criminalité, d’inhabilités sociales et d’addiction35.
Des troubles alimentaires et/ou surpoids et obésité36 ; insomnies et troubles du sommeil37 liés à un problème de cycle circadien38 ; troubles de l’humeur / anxiété, des problèmes relationnels et d’attachement39 ; des troubles de l’apprentissage40 et une anxiété liée aux examens41, et enfin : épilepsie42, migraines43, risques de suicides accrus44.
Mais ce n’est pas possible que j’ai un TDA/H, je n’ai pas de difficultés scolaires, j’ai fait des études, j’ai une belle carrière, un(e) conjoint(e) et des gosses !
Et à quel point était-ce compliqué ? A quel point est-ce difficile de faire face au quotidien ? Il faut être honnête avec soi-même et accepter que la vie n’est pas facile, mais il faut savoir pourquoi. Si c’est un élément extérieur, et qu’il suffit de changer de travail, de ville, ou que sais-je, on peut dire que c’est gérable. Mais si depuis toujours, en ayant tout essayé, c’est toujours la galère, il faut se poser les bonnes questions.
Le TDA/H n’est pas un manque de capacités cognitives, ni de capacités de communication, ni un défaut de compréhension. Il n’y a aucune corrélation entre l’intelligence/les capacités et le trouble. C’est un problème de performance, pas de connaissance ou d’acquisition de connaissance. Il est tout à fait possible de « réussir », de devenir « quelqu’un » en ayant un TDA/H, c’est juste beaucoup plus dur et épuisant que pour quelqu’un de « neurotypique » si tu n’es pas diagnostiqué / suivi / sous médocs.
Le TDA/H est juste une excuse ! Ils sont tous fainéants !
La labélisation de feignant est très peu pertinente. La perception de la fainéantise est la suivante :
· Vous savez que X doit être fait.
· Vous avez tous les outils pour faire X.
· Vous choisissez délibérément de ne pas faire X.
Le TDA/H peut affecter ces trois points soit parce que la personne atteinte oublie qu’il est nécessaire de faire X, sait que X doit être fait mais il y a un manque d’énergie ou de capacité de concentration, ou alors il/elle n’arrive pas physiquement à démarrer la tâche malgré l’envie de le faire.
Les traitements.
Il n’existe aucun traitement capable de guérir le TDA/H. La médicamentation la plus prescrite, en principe, inclue le methylphenidate, les amphétamines, et des drogues non-stimulantes.
Voici une liste45 :
Stimulants
- Methylphenidate46
- Amphetamines, lisdexamfetamine, dexamfetamine47
Non-stimulants
- atomoxetine48
- guanfacine49
- clonidine50
- desipramine51
Certains sont des stimulants, d’autres non. Dans la majorité des cas (80%), les traitements à base de stimulants sont les plus efficaces. C’est important de se faire traiter, les conséquences du TDA/H non traité sont beaucoup plus graves que les effets secondaires des médicaments. Par exemple : une estime et une image de soi dégradées, de moins bonne compétences sociales ainsi qu’une sociabilisation altérée, difficulté à démarrer des hobbys52 ; plus de risque de se blesser53 du fait de l’impulsivité, de l’inattention et de l’hyperactivité.
Il existe un nombre important de médicaments possibles, avec des modes d’actions différent sur le corps. Si celui que vous prenez n’est pas efficace ou vous cause trop d’effets secondaires, parlez-en à votre psychiatre/neurologue pour changer la posologie, la molécule ou le mode d’action. Les risques sont étudiés et il est important d’en prendre connaissance avant de consommer un de ces médicaments. Le methylphenidate, les amphetamines et l’atomoxetine sont particulièrement bien étudiés54.
En plus des médicaments, certaines psychothérapies comportementales55 peuvent s’avérer efficaces, un entrainement aux compétences sociales56, l’exercice sportif57 et certaines manières de s’alimenter58 peuvent prendre place dans le traitement du TDA/H. Il peut aussi être nécessaire de procéder à des modifications d’environnement : rendre l’information visuelle et tangible avec des plannings, des listes, des post-it, des timers.
Est-ce que les médicaments se comportent différemment sur les hommes / femmes / cis / trans ?
Effectivement, les changements hormonaux subis par les femmes (menstruation, grossesse, ménopause) peuvent nécessiter d’adapter la posologie au cours du temps. Votre médecin n’est pas forcément au courant donc parlez-en lui. Pour tout ce qui a trait à la transition de sexe, la recherche est pour le moment très faible si ce n’est quasi inexistante et donc les résultats ne sauraient pour le moment nous indiquer grand-chose de sérieux.
Je prends un traitement médicamenteux, au bout de combien de temps je peux arrêter ?
On en revient à la balance bénéfice-risque. Concrètement, rien ne vous oblige à prendre un traitement, mais si vous en avez besoin pour fonctionner au quotidien… Il n’y a que vous pour répondre à cette question. Rappelez-vous seulement que le TDA/H ne se guérit pas et ne disparaît qu’en surface, avec le temps, et si vous avez trouvé des moyens de compensation suffisamment efficaces et durables. C’est une condition chronique.
Conclusions.
J’espère que ce n’est pas trop long ou fastidieux à lire. J’ai essayé de brosser le tableau le plus globalement et clairement possible, en donnant les informations qui me paraissent les plus importantes. Les articles Wikipédia relatifs au TDA/H sont sûrement bien plus complets, mais peut-être le sont-ils un peu trop et pour autant pas suffisamment clairs, manquant parfois de sources sur des informations importantes.
Bonus.
Cette partie peut s’avérer plus complexe, donc c’est pas plus mal de la mettre de côté. La manière dont fonctionne un cerveau TDA/H est très étudié, et on a à notre disposition nombre de représentations visuelles très intéressantes.
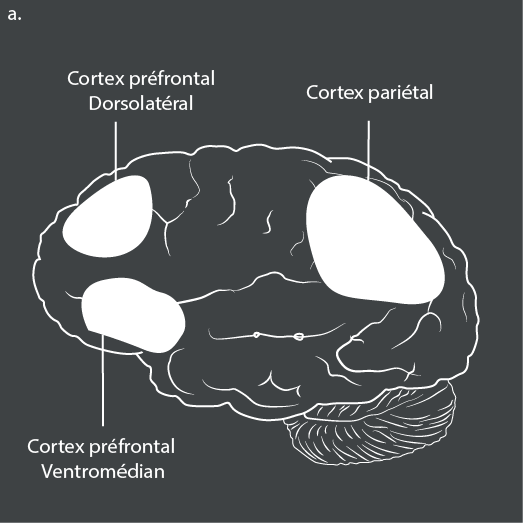
Plusieurs régions du cerveau et voies neuronales ont été impliquées dans le TDA/H. Des études d’IRM fonctionnelle menées chez des patients atteints de TDA/H et utilisant des tâches de contrôle inhibiteur, de mémoire de travail et d’attention ont montré une sous-activation des réseaux frontostriataux, frontopariétaux et ventraux de l’attention59.
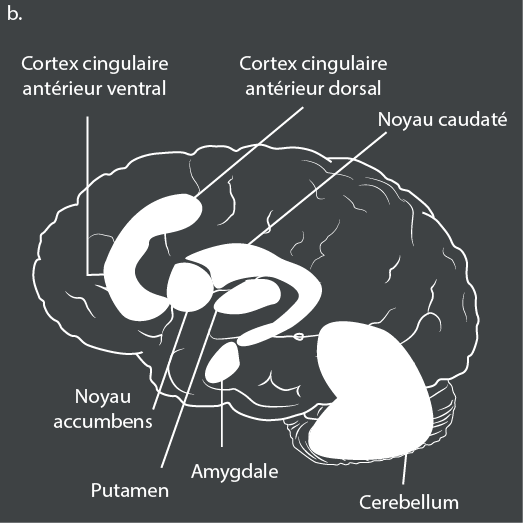
Le réseau frontopariétal est le médiateur des processus exécutifs dirigés vers un but, tandis que le réseau attentionnel ventral facilite la réorientation de l’attention vers des stimuli externes saillants et pertinents sur le plan comportemental. Dans les paradigmes de traitement de la récompense, la plupart des études rapportent une activation plus faible du striatum ventral des patients atteints de TDA/H en prévision de la récompense que chez les témoins60.
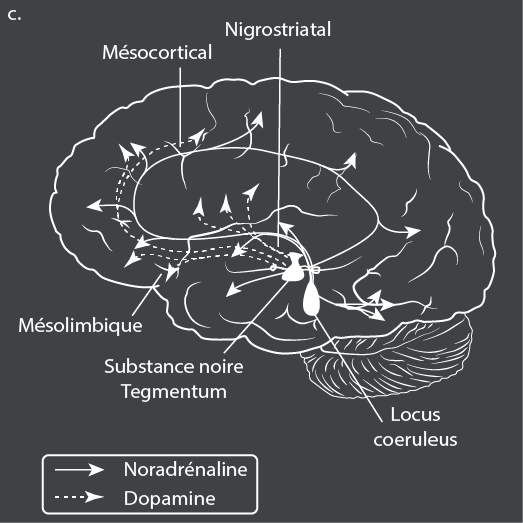
Le TDA/H est également associé à une hyperactivation des systèmes somatomoteurs et visuels, qui compense peut-être le fonctionnement déficient des cortex préfrontal et cingulaire antérieur61. Une dose unique de méthylphénidate (un stimulant) augmente de façon marquée l’activation dans le cortex frontal inférieur et l’insula bilatéralement – qui sont des zones clés du contrôle cognitif – pendant l’inhibition et la discrimination temporelle, mais n’affecte pas les réseaux de mémoire de travail62. En revanche, le traitement à long terme par des stimulants est associé à une activation normale dans le noyau caudé droit pendant l’exécution de tâches d’attention63. Des études d’IRM à l’état de repos ont montré que le TDA/H est associé à des anticorrélations moins prononcées ou absentes entre le réseau du mode par défaut (DMN) et le réseau de contrôle cognitif, à une connectivité plus faible au sein du DMN lui-même et à une connectivité plus faible au sein des boucles cognitives et motivationnelles des circuits frontostriataux64.
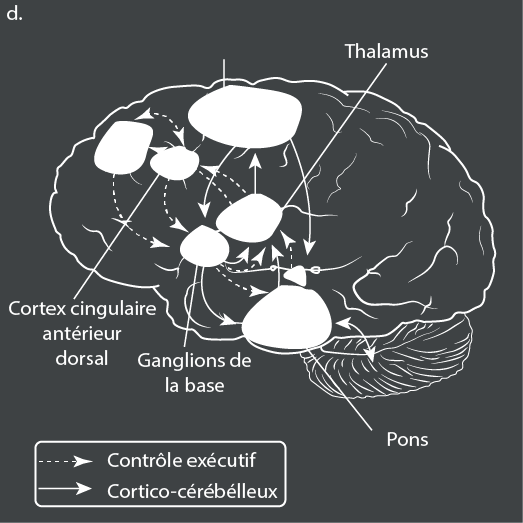
Outre les changements fonctionnels, une série d’altérations structurelles du cerveau sont également associées au TDA/H. Par exemple, le TDA/H est associé à un volume cérébral total inférieur de 3 à 5 % à celui des témoins non affectés65, ce qui peut être attribué à une réduction de la matière grise66. Conformément aux données génétiques qui appuient un modèle du TDA/H en tant que trait extrême d’une population, le volume total du cerveau présente une corrélation négative avec les symptômes du TDA/H dans la population générale67. Chez les patients atteints de TDA/H, des méta-analyses ont mis en évidence des volumes plus faibles dans plusieurs régions du cerveau, le plus souvent dans le globus pallidus droit, le putamen droit, le noyau caudé et le cervelet68. En outre, une méta-analyse des études d’imagerie par tenseur de diffusion a montré des altérations généralisées de l’intégrité de la substance blanche, en particulier dans la corona radiata antérieure droite, le forceps minor droit, la capsule interne bilatérale et le cervelet gauche69. Les résultats de l’imagerie structurelle et fonctionnelle sont très variables d’une étude à l’autre, ce qui suggère que les fondements neuronaux du TDA/H sont hétérogènes, ce qui est cohérent avec les études sur la cognition.
Tout comme la prévalence du TDA/H est associée à l’âge, il en va de même pour de nombreux changements dans le cerveau des patients atteints de TDA/H70. Certaines altérations volumétriques du cerveau observées dans l’enfance se normalisent avec l’âge, tandis que d’autres mesures restent fixes. Par exemple, une étude longitudinale par IRM a révélé des volumes de ganglions de la base plus faibles et une surface dorsale réduite chez les adolescents atteints de TDA/H par rapport aux témoins, et cette différence n’a pas changé avec l’âge des patients71. En outre, pour les surfaces striatales ventrales, les individus témoins ont montré une expansion de la surface avec l’âge, alors que les patients atteints de TDA/H ont connu une contraction progressive de la surface. Le processus encore inconnu qui sous-tend cette contraction pourrait expliquer le traitement anormal de la récompense dans le TDA/H.
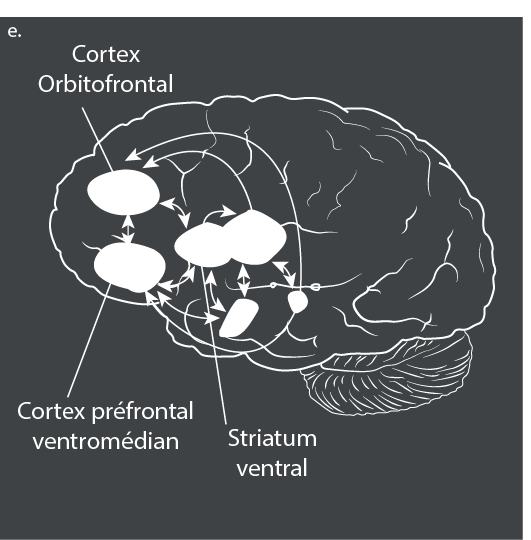
Le TDA/H est également associé à un retard de maturation du cortex cérébral. Dans une étude, l’âge auquel l’épaisseur corticale maximale est atteinte était de 10,5 ans pour les patients atteints de TDA/H et de 7,5 ans pour les personnes non affectées ; ce retard était le plus important dans les régions préfrontales qui sont importantes pour le fonctionnement exécutif, l’attention et la planification motrice72. Il a également été démontré que le développement de la surface corticale était retardé chez les patients atteints du TDA/H, mais le TDA/H n’était pas associé à des trajectoires de développement modifiées de la gyrification corticale73. La rémission du TDA/H a été associée à la normalisation des anomalies mesurées par l’activation pendant les tâches d’imagerie fonctionnelle74, l’amincissement cortical75 et la connectivité cérébrale structurelle et fonctionnelle76.
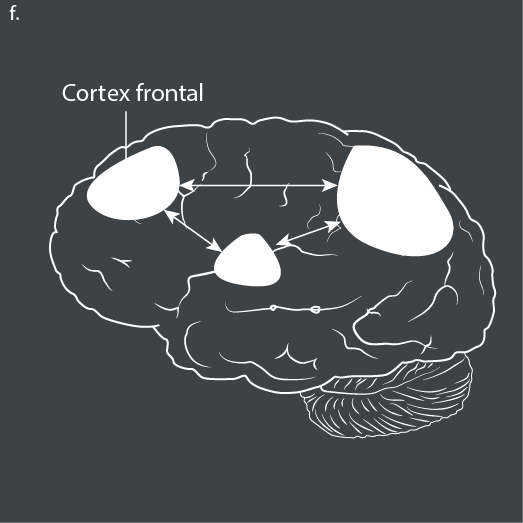
Bien que ces données puissent suggérer que la diminution de la prévalence du TDA/H en fonction de l’âge pourrait être due au développement tardif des structures et des fonctions cérébrales associées au TDA/H, la plupart des patients souffrant de TDA/H ne présentent pas de “rattrapage” développemental complet. En effet, des déviations étendues de l’épaisseur corticale persistent chez de nombreux adultes atteints de TDA/H. Les résultats comprennent à la fois un amincissement cortical (dans le cortex frontal supérieur, le cortex précentral, le cortex pariétal inférieur et supérieur, le pôle temporal et le cortex temporal médian)77 et un épaississement cortical (dans l’aire motrice pré-supplémentaire, le cortex somatosensoriel et le cortex occipital)78. D’autres travaux sont nécessaires pour déterminer comment les changements développementaux dans les schémas d’épaisseur corticale prédisent les changements développementaux dans l’expression des symptômes du TDA/H.
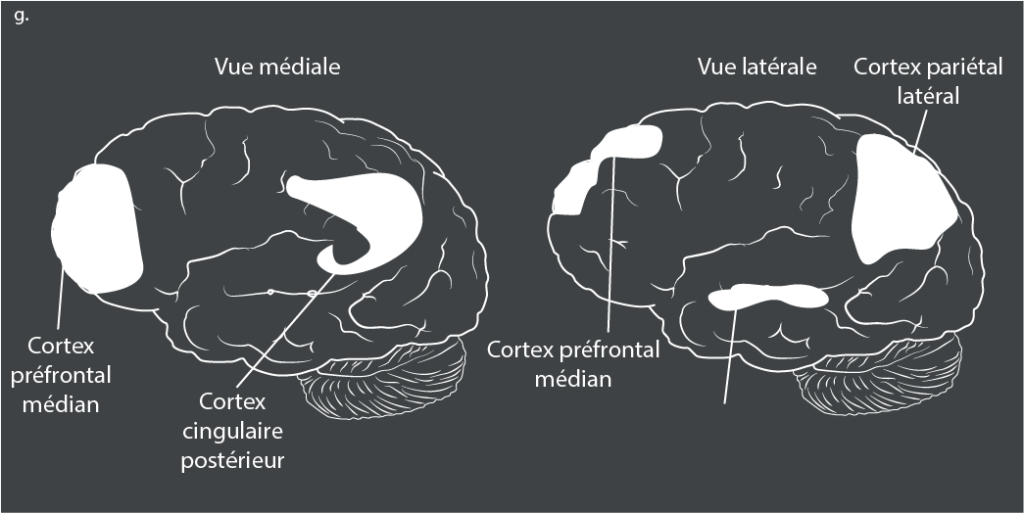
Résumé.
Les théories neurocognitives, de neuroimagerie et génétiques du TDA/H sont passées de modèles à cause unique ou à voie unique à des modèles qui délimitent les causes qui mènent au TDA/H par plusieurs voies moléculaires, neurales et neurocognitives79. Ces approches ont été clairement étayées par des études étiologiques indiquant que la plupart des cas de TDA/H découlent d’un “pool” de facteurs de risque génétiques et environnementaux. La plupart de ces facteurs de risque n’ont qu’un faible effet sur les voies causales. La vulnérabilité cumulée augmente les scores des traits du TDA/H, et notre modèle actuel suggère que le TDA/H émerge lorsque ceux-ci dépassent un certain seuil. Dans la plupart des cas, aucun facteur unique n’est nécessaire ou suffisant pour causer le TDA/H. Cependant, chez certains patients, des variantes génétiques rares80 ou des facteurs de risque environnementaux – par exemple, la privation psychosociale81 – peuvent avoir une influence majeure.
La causalité multifactorielle du TDA/H conduit à un profil hétérogène de psychopathologie, de déficits neurocognitifs et d’anomalies de la structure et du fonctionnement du cerveau. De nombreux cas impliquent probablement un dérèglement de la structure et du fonctionnement des voies frontales-sous-corticales-cérébelleuses qui contrôlent l’attention, la réponse à la récompense, les seuils de saillance, le contrôle inhibiteur et le comportement moteur. Une méta-analyse des biomarqueurs périphériques dans le sang et l’urine de patients atteints de TDA/H n’ayant jamais pris de médicaments ou n’en ayant pas pris et de personnes non affectées a révélé que plusieurs mesures – en particulier la noradrénaline, le 3-méthoxy-4-hydroxyphényléthylène glycol (MHPG), la monoamine oxydase (MAO) et le cortisol – étaient significativement associées au TDA/H82. Plusieurs de ces métabolites étaient également liés à la réponse aux médicaments contre le TDA/H et à la gravité des symptômes du TDA/H. Ces résultats soutiennent l’idée que les systèmes de neurotransmetteurs catécholaminergiques et l’axe hypothalamo-hypophyso-surrénalien sont déréglés dans le TDA/H. Enfin, des études génétiques et cliniques impliquent également d’autres systèmes, notamment les systèmes sérotoninergique, nicotinique, glutamatergique et de croissance des neurites.
Toutes les illustrations sont tirées d’une étude de 201583.
[1] Simon, V., Czobor, P., Bálint, S., Mészáros, A., & Bitter, I. (2009). Prevalence and correlates of adult attention-deficit hyperactivity disorder: meta-analysis. The British Journal of Psychiatry, 194(3), 204-211.
[2] Lecendreux, M., Konofal, E., & Faraone, S. V. (2011). Prevalence of attention deficit hyperactivity disorder and associated features among children in France. Journal of attention disorders, 15(6), 516-524.
[3] Barkley, R. A., & Fischer, M. (2019). Hyperactive child syndrome and estimated life expectancy at young adult follow-up: The role of ADHD persistence and other potential predictors. Journal of attention disorders, 23(9), 907-923.
[4] Lebowitz, M. S. (2016). Stigmatization of ADHD: a developmental review. Journal of Attention Disorders, 20(3), 199-205.
[5] Fletcher, J., & Wolfe, B. (2009). Long-term consequences of childhood ADHD on criminal activities. The journal of mental health policy and economics, 12(3), 119.
[6] Hoza, B. (2007). Peer functioning in children with ADHD. Journal of pediatric psychology, 32(6), 655-663.
[7] Gardner, D. M., & Gerdes, A. C. (2015). A review of peer relationships and friendships in youth with ADHD. Journal of attention disorders, 19(10), 844-855.
[8] Kervella, C., & Zimmermann, C. (2016). Dépistage du TDAH chez l’enfant par le médecin généraliste: revue systématique de la littérature (Doctoral dissertation, Université Toulouse lll-Paul Sabatier).
[9] https://www.has-sante.fr/upload/docs/application/pdf/2015-02/tdah_argumentaire.pdf
HAS. (2014). Conduite à tenir en médecine de premier recours devant un enfant ou un adolescent susceptible d’avoir un trouble déficit de l’attention avec ou sans hyperactivité. Saint-Denis La Plaine.
[10] Giuliano, Kimberly., & Geyer, Eric. (2017). ADHD: Overdiagnosed and overtreated, or misdiagnosed and mistreated. Cleveland Clinic journal of medicine, 84(11), 873.
[11] Young, S., Adamo, N., Ásgeirsdóttir, B.B. et al. Females with ADHD: An expert consensus statement taking a lifespan approach providing guidance for the identification and treatment of attention-deficit/ hyperactivity disorder in girls and women. BMC Psychiatry 20, 404 (2020). https://doi.org/10.1186/s12888-020-02707-9
[12] Kofler MJ, Rapport MD, Sarver DE, Raiker JS, Orban SA, et al. 2013. Reaction time variability in ADHD: a meta-analytic review of 319 studies. Clin. Psychol. Rev. 33:795–811
[13] Volkow ND, Wang G, Kollins SH, Wigal TL, Newcorn JH, et al. 2009. Evaluating dopamine reward pathway in ADHD: clinical implications. JAMA 302:1084–9 ;
Volkow ND, Wang GJ, Newcorn JH, Kollins SH, Wigal TL, et al. 2010. Motivation deficit in ADHD is associated with dysfunction of the dopamine reward pathway. Mol. Psychiatry 16:1147–54
[14] Beauchaine TP, McNulty T. 2013. Comorbidities and continuities as ontogenic processes: toward a developmental spectrum model of externalizing psychopathology. Dev. Psychopathol. 2 ;
[15] Oades, R. D. (2008). Dopamine–serotonin interactions in attention-deficit hyperactivity disorder (ADHD). Progress in brain research, 172, 543-565.
[16] Almeida, L. G., Ricardo-Garcell, J., Prado, H., Barajas, L., Fernández-Bouzas, A., Ávila, D., & Martínez, R. B. (2010). Reduced right frontal cortical thickness in children, adolescents and adults with ADHD and its correlation to clinical variables: a cross-sectional study. Journal of psychiatric research, 44(16), 1214-1223.
[17] Dirlikov, B., Rosch, K. S., Crocetti, D., Denckla, M. B., Mahone, E. M., & Mostofsky, S. H. (2015). Distinct frontal lobe morphology in girls and boys with ADHD. Neuroimage: Clinical, 7, 222-229.
[18] Diamond, A. (2013). Executive functions. Annual review of psychology, 64, 135-168.
[19] Willcutt, E. G., Doyle, A. E., Nigg, J. T., Faraone, S. V. & Pennington, B. F. Validity of the executive function theory of attention-deficit/hyperactivity disorder: a meta-analytic review. Biol. Psychiatry 57, 1336–1346 (2005). ;
Sergeant, J. A. Modeling attention-deficit/ hyperactivity disorder: a critical appraisal of the cognitive-energetic model. Biol. Psychiatry 57, 1248–1255 (2005).
[20] Sonuga-Barke, E. J. & Fairchild, G. Neuroeconomics of attention-deficit/hyperactivity disorder: differential influences of medial, dorsal, and ventral prefrontal brain networks on suboptimal decision making? Biol. Psychiatry 72, 126–133 (2012).
[21] Luman, M., Tripp, G. & Scheres, A. Identifying the neurobiology of altered reinforcement sensitivity in ADHD: a review and research agenda. Neurosci. Biobehav. Rev. 34, 744–754 (2010).
[22] Scheres, A., Lee, A. & Sumiya, M. Temporal reward discounting and ADHD: task and symptom specific effects. J. Neural Transm. 115, 221–226 (2008).
[23] Toplak, M. E. & Tannock, R. Time perception: modality and duration effects in attention-deficit/hyperactivity disorder (ADHD). J. Abnorm. Child Psychol. 33, 639–654 (2005).
[24] Tomblin, J. B. & Mueller, K. L. How can the comorbidity with ADHD aid understanding of language and speech disorders? Top. Lang. Disord. 32, 198–206 (2012).
[25] Kuntsi, J. & Klein, C. Intraindividual variability in ADHD and its implications for research of causal links. Curr. Top. Behav. Neurosci. 9, 67–91 (2012).
[26] Fair, D. A., Bathula, D., Nikolas, M. A. & Nigg, J. T. Distinct neuropsychological subgroups in typically developing youth inform heterogeneity in children with ADHD. Proc. Natl Acad. Sci. USA 109, 6769–6774 (2012)
[27] Fliers, E. A. et al. Undertreatment of motor problems in children with ADHD. Child Adolesc. Ment. Health 15, 85–90 (2009).
[28] Coghill, D. R., Seth, S. & Matthews, K. A comprehensive assessment of memory, delay aversion, timing, inhibition, decision making and variability in attention deficit hyperactivity disorder: advancing beyond the three-pathway models. Psychol. Med. 44, 1989–2001 (2014).
[29] Sonuga-Barke, E., Bitsakou, P. & Thompson, M. Beyond the dual pathway model: evidence for the dissociation of timing, inhibitory, and delay-related impairments in attention-deficit/hyperactivity disorder. J. Am. Acad. Child Adolesc. Psychiatry 49, 345–355 (2010).
[30] Grimm, O., Kranz, T. M., & Reif, A. (2020). Genetics of ADHD: what should the clinician know?. Current psychiatry reports, 22(4), 1-8.
[31] Vitola, E. S., Bau, C. H. D., Salum, G. A., Horta, B. L., Quevedo, L., Barros, F. C., … & Grevet, E. H. (2017). Exploring DSM-5 ADHD criteria beyond young adulthood: phenomenology, psychometric properties and prevalence in a large three-decade birth cohort. Psychological medicine, 47(4), 744-754.
[32] Arnett, A. B., Pennington, B. F., Willcutt, E. G., DeFries, J. C., & Olson, R. K. (2015). Sex differences in ADHD symptom severity. Journal of Child Psychology and Psychiatry, 56(6), 632-639.
[33] Wasserstein, J. (2005). Diagnostic issues for adolescents and adults with ADHD. Journal of Clinical Psychology, 61(5), 535-547.
[34] Canela, C., Buadze, A., Dube, A., Eich, D., & Liebrenz, M. (2017). Skills and compensation strategies in adult ADHD–A qualitative study. PloS one, 12(9), e0184964.
[35] Luo, Y., Weibman, D., Halperin, J. M., & Li, X. (2019). A review of heterogeneity in attention deficit/hyperactivity disorder (ADHD). Frontiers in human neuroscience, 13, 42.
[36] Cortese, S., Moreira-Maia, C. R., St. Fleur, D., Morcillo-Peñalver, C., Rohde, L. A., & Faraone, S. V. (2016). Association between ADHD and obesity: a systematic review and meta-analysis. American journal of psychiatry, 173(1), 34-43.
[37] Yoon, S. Y., Jain, U. et Shapiro, C. (2012). Sleep in attention-deficit/hyperactivity disorder in children and adults: past, present, and future. Sleep Medicine Reviews, 16(4), 371-388. ;
Miano, S. (2012). The Complex Relationship Between ADHD and Pediatric Sleep Disorders. ADHD Report, 20(6), 1-6. ;
Konofal, E., Lecendreux, M. et Cortese, S. (2010), « Sleep and ADHD », dans Sleep Med, 11(7), 652-658.
[38] Coogan, A. N., & McGowan, N. M. (2017). A systematic review of circadian function, chronotype and chronotherapy in attention deficit hyperactivity disorder. ADHD Attention Deficit and Hyperactivity Disorders, 9(3), 129-147.
[39] Kessler, R. C., Adler, L. A., Barkley, R., Biederman, J., Conners, C. K., Faraone, S. V., . . . Zaslavsky, A. M. (2005), « Patterns and predictors of attention-deficit/hyperactivity disorder persistence into adulthood : results from the national comorbidity survey replication », dans Biol Psychiatry, 57(11), 1442-1451.
[40] Taanila, A., Ebeling, H., Tiihala, M., Kaakinen, M., Moilanen, I., Hurtig, T. et Yliherva, A. (2014), « Association between childhood specific learning difficulties and school performance in adolescents with and without ADHD symptoms : a 16-year follow-up », dans J Atten Disord, 18(1), 61-72.
[41] Dan, O., & Raz, S. (2015). The relationships among ADHD, self-esteem, and test anxiety in young adults. Journal of attention disorders, 19(3), 231-239.
[42] Dunn, D. W., Austin, J. K., Harezlak, J., & Ambrosius, W. T. (2003). ADHD and epilepsy in childhood. Developmental medicine and child neurology, 45(1), 50-54.
[43] Hansen, T. F., Hoeffding, L. K., Kogelman, L., Haspang, T. M., Ullum, H., Sørensen, E., … & Burgdorf, K. (2018). Comorbidity of migraine with ADHD in adults. BMC neurology, 18(1), 1-9.
[44] Furczyk, K., & Thome, J. (2014). Adult ADHD and suicide. ADHD Attention Deficit and Hyperactivity Disorders, 6(3), 153-158.
[45] Mészáros, A., Czobor, P., Bálint, S., Komlósi, S., Simon, V., & Bitter, I. (2009). Pharmacotherapy of adult attention deficit hyperactivity disorder (ADHD): a meta-analysis. The The International Journal of Neuropsychopharmacology, 12(8), 1137-1147.
[46] Van der Oord, S., Prins, P. J., Oosterlaan, J., & Emmelkamp, P. M. (2008). Efficacy of methylphenidate, psychosocial treatments and their combination in school-aged children with ADHD: a meta-analysis. Clinical psychology review, 28(5), 783-800. ;
Carucci, S., Balia, C., Gagliano, A., Lampis, A., Buitelaar, J. K., Danckaerts, M., … & ADDUCE Consortium. (2021). Long term methylphenidate exposure and growth in children and adolescents with ADHD. A systematic review and meta-analysis. Neuroscience & Biobehavioral Reviews, 120, 509-525.
[47] Hodgkins, P., Shaw, M., McCarthy, S., & Sallee, F. R. (2012). The pharmacology and clinical outcomes of amphetamines to treat ADHD. CNS drugs, 26(3), 245-268.
[48] Cheng, J. Y., Chen, R. Y., Ko, J. S., & Ng, E. M. (2007). Efficacy and safety of atomoxetine for attention-deficit/hyperactivity disorder in children and adolescents—meta-analysis and meta-regression analysis. Psychopharmacology, 194(2), 197-209.
[49] Ruggiero, S., Clavenna, A., Reale, L., Capuano, A., Rossi, F., & Bonati, M. (2014). Guanfacine for attention deficit and hyperactivity disorder in pediatrics: a systematic review and meta-analysis. European Neuropsychopharmacology, 24(10), 1578-1590.
[50] Connor, D. F., Fletcher, K. E., & Swanson, J. M. (1999). A meta-analysis of clonidine for symptoms of attention-deficit hyperactivity disorder. Journal of the American Academy of Child & Adolescent Psychiatry, 38(12), 1551-1559.
[51] Spencer, T., Biederman, J., Coffey, B., Geller, D., Crawford, M., Bearman, S. K., … & Faraone, S. V. (2002). A double-blind comparison of desipramine and placebo in children and adolescents with chronic tic disorder and comorbid attention-deficit/hyperactivity disorder. Archives of General Psychiatry, 59(7), 649-656.
[52] Harpin, V., Mazzone, L., Raynaud, J. P., Kahle, J., & Hodgkins, P. (2016). Long-term outcomes of ADHD: a systematic review of self-esteem and social function. Journal of attention disorders, 20(4), 295-305.
[53] Ruiz-Goikoetxea, M., Cortese, S., Aznarez-Sanado, M., Magallón, S., Zallo, N. A., Luis, E. O., … & Arrondo, G. (2018). Risk of unintentional injuries in children and adolescents with ADHD and the impact of ADHD medications: A systematic review and meta-analysis. Neuroscience & Biobehavioral Reviews, 84, 63-71.
[54] Hennissen, L., Bakker, M. J., Banaschewski, T., Carucci, S., Coghill, D., Danckaerts, M., … & Buitelaar, J. K. (2017). Cardiovascular effects of stimulant and non-stimulant medication for children and adolescents with ADHD: a systematic review and meta-analysis of trials of methylphenidate, amphetamines and atomoxetine. CNS drugs, 31(3), 199-215.
[55] Fabiano, G. A., Pelham Jr, W. E., Coles, E. K., Gnagy, E. M., Chronis-Tuscano, A., & O’Connor, B. C. (2009). A meta-analysis of behavioral treatments for attention-deficit/hyperactivity disorder. Clinical psychology review, 29(2), 129-140.
[56] Watson, S. M. R., Richels, C., Michalek, A. P., & Raymer, A. (2015). Psychosocial treatments for ADHD: A systematic appraisal of the evidence. Journal of attention disorders, 19(1), 3-10.
[57] Vysniauske, R., Verburgh, L., Oosterlaan, J., & Molendijk, M. L. (2020). The effects of physical exercise on functional outcomes in the treatment of ADHD: a meta-analysis. Journal of attention disorders, 24(5), 644-654.
[58] Heilskov Rytter, M. J., Andersen, L. B. B., Houmann, T., Bilenberg, N., Hvolby, A., Mølgaard, C., … & Lauritzen, L. (2015). Diet in the treatment of ADHD in children—A systematic review of the literature. Nordic journal of psychiatry, 69(1), 1-18.
[59] Cortese, S. et al. Toward systems neuroscience of ADHD: a meta-analysis of 55 fMRI studies. Am. J. Psychiatry 169, 1038–1055 (2012).
[60] Plichta, M. M. & Scheres, A. Ventral–striatal responsiveness during reward anticipation in ADHD and its relation to trait impulsivity in the healthy population: a meta-analytic review of the fMRI literature. Neurosci. Biobehav. Rev. 38, 125–134 (2014)
[61] Fassbender, C. & Schweitzer, J. B. Is there evidence for neural compensation in attention deficit hyperactivity disorder? A review of the functional neuroimaging literature. Clin. Psychol. Rev. 26, 445–465 (2006)
[62] Rubia, K. et al. Effects of stimulants on brain function in attention-deficit/hyperactivity disorder: a systematic review and meta-analysis. Biol. Psychiatry 76, 616–628 (2014).
[63] Hart, H., Radua, J., Nakao, T., Mataix-Cols, D. & Rubia, K. Meta-analysis of functional magnetic resonance imaging studies of inhibition and attention in attention-deficit/hyperactivity disorder: exploring task-specific, stimulant medication, and age effects. JAMA Psychiatry 70, 185–198 (2013).
[64] Posner, J., Park, C. & Wang, Z. Connecting the dots: a review of resting connectivity MRI studies in attention-deficit/hyperactivity disorder. Neuropsychol. Rev. 24, 3–15 (2014).
[65] Castellanos, F. X. et al. Developmental trajectories of brain volume abnormalities in children and adolescents with attention-deficit/hyperactivity disorder. JAMA 288, 1740–1748 (2002). ;
Durston, S. et al. Magnetic resonance imaging of boys with attention-deficit/hyperactivity disorder and their unaffected siblings. J. Am. Acad. Child Adolesc. Psychiatry 43, 332–340 (2004)
[66] Greven, C. U. et al. Developmentally stable whole brain volume reductions and developmentally sensitive caudate and putamen volume alterations in participants with attention-deficit/hyperactivity disorder and their unaffected siblings. JAMA Psychiatry 72, 490–499 (2015).
[67] Hoogman, M. et al. Current self-reported symptoms of attention deficit/hyperactivity disorder are associated with total brain volume in healthy adults. PLoS ONE 7, e31273 (2012).
[68] Stoodley, C. J. & Schmahmann, J. D. Functional topography in the human cerebellum: a meta-analysis of neuroimaging studies. Neuroimage 44, 489–501 (2009). ;
Frodl, T. & Skokauskas, N. Meta-analysis of structural MRI studies in children and adults with attention deficit hyperactivity disorder indicates treatment effects. Acta Psychiatr. Scand. 125, 114–126 (2012).
[69] van Ewijk, H., Heslenfeld, D. J., Zwiers, M. P., Buitelaar, J. K. & Oosterlaan, J. Diffusion tensor imaging in attention deficit/hyperactivity disorder: a systematic review and meta-analysis. Neurosci. Biobehav. Rev. 36, 1093–1106 (2012).
[70] Faraone, S. V., Biederman, J. & Mick, E. The age dependent decline of attention-deficit/hyperactivity disorder: a meta-analysis of follow-up studies. Psychol. Med. 36, 159–165 (2006).
[71] Shaw, P. et al. Mapping the development of the basal ganglia in children with attention-deficit/hyperactivity disorder. J. Am. Acad. Child Adolesc. Psychiatry 53, 780–789.e11 (2014).
[72] Shaw, P. et al. Attention-deficit/hyperactivity disorder is characterized by a delay in cortical maturation. Proc. Natl Acad. Sci. USA 104, 19649–19654 (2007).
[73] Shaw, P. et al. Development of cortical surface area and gyrification in attention-deficit/hyperactivity disorder. Biol. Psychiatry 72, 191–197 (2012).
[74] Dreisbach, G. et al. Dopamine and cognitive control: the influence of spontaneous eyeblink rate and dopamine gene polymorphisms on perseveration and distractibility. Behav. Neurosci. 119, 483–490 (2005).
[75] Makris, N. et al. Cortical thinning of the attention and executive function networks in adults with attention[17]deficit/hyperactivity disorder. Cereb. Cortex 17, 1364–1375 (2007)
[76] Clerkin, S. M. et al. Thalamo–cortical activation and connectivity during response preparation in adults with persistent and remitted ADHD. Am. J. Psychiatry 170, 1011–1019 (2013). ;
Mattfeld, A. T. et al. Brain differences between persistent and remitted attention deficit hyperactivity disorder. Brain 137, 2423–2428 (2014). ;
Francx, W. et al. White matter microstructure and developmental improvement of hyperactive/ impulsive symptoms in attention-deficit/ hyperactivity disorder. J. Child Psychol. Psychiatry http://dx.doi.org/10.1111/jcpp.12379 (2015). ;
Shaw, P. et al. Trajectories of cerebral cortical development in childhood and adolescence and adult attention-deficit/hyperactivity disorder. Biol. Psychiatry 74, 599–606 (2013).
[77] Almeida, L. G. et al. Reduced right frontal cortical thickness in children, adolescents and adults with ADHD and its correlation to clinical variables: a cross[19]sectional study. J. Psychiatr. Res. 44, 1214–1223 (2010)
[78] Almeida Montes, L. G. et al. Brain cortical thickness in ADHD: age, sex, and clinical correlations. J. Atten. Disord. 17, 641–654 (2013).
[79] Kuntsi, J. et al. The separation of ADHD inattention and hyperactivity–impulsivity symptoms: pathways from genetic effects to cognitive impairments and symptoms. J. Abnorm. Child Psychol. 42, 127–136 (2014). ;
Faraone, S. V. & Biederman, J. Neurobiology of attention-deficit hyperactivity disorder. Biol. Psychiatry 44, 951–958 (1998). ; Makris, N., Biederman, J., Monuteaux, M. C. & Seidman, L. J. Towards conceptualizing a neural systems-based anatomy of attention-deficit/ hyperactivity disorder. Dev. Neurosci. 31, 36–49 (2009). ;
Sonuga-Barke, E. J. Causal models of attention-deficit/ hyperactivity disorder: from common simple deficits to multiple developmental pathways. Biol. Psychiatry 57, 1231–1238 (2005). ;
Castellanos, F. X. & Tannock, R. Neuroscience of attention-deficit/hyperactivity disorder: the search for endophenotypes. Nat. Rev. Neurosci. 3, 617–628 (2002). ;
Kuntsi, J. et al. Separation of cognitive impairments in attention-deficit/hyperactivity disorder into 2 familial factors. Arch. Gen. Psychiatry 67, 1159–1167 (2010).
[80] Elia, J. et al. Rare structural variants found in attention-deficit hyperactivity disorder are preferentially associated with neurodevelopmental genes. Mol. Psychiatry 15, 637–646 (2010). ;
Williams, N. M. et al. Rare chromosomal deletions and duplications in attention-deficit hyperactivity disorder: a genome-wide analysis. Lancet 376, 1401–1408 (2010).
[81] Stevens, S. E. et al. Inattention/overactivity following early severe institutional deprivation: presentation and associations in early adolescence. J. Abnorm. Child Psychol. 36, 385–398 (2008)
[82] Scassellati, C., Bonvicini, C., Faraone, S. V. & Gennarelli, M. Biomarkers and attention-deficit/ hyperactivity disorder: a systematic review and meta-analyses. J. Am. Acad. Child Adolesc. Psychiatry 51, 1003–1019.e20 (2012)
[83] Faraone, S. V., Asherson, P., Banaschewski, T., Biederman, J., Buitelaar, J. K., Ramos-Quiroga, J. A., … & Franke, B. Attention-deficit/hyperactivity disorder (2015). Nature Reviews Disease Primers, 1, e15020.