Reiff, C. M., Richman, E. E., Nemeroff, C. B., Carpenter, L. L., Widge, A. S., Rodriguez, C. I., … & Work Group on Biomarkers and Novel Treatments, a Division of the American Psychiatric Association Council of Research. (2020). Psychedelics and psychedelic-assisted psychotherapy. American Journal of Psychiatry, 177(5), 391-410.
Abstract
Objectif :
Les auteurs présentent un résumé factuel de la littérature sur l’application clinique des drogues psychédéliques dans les troubles psychiatriques.
Méthodes :
Des recherches ont été effectuées dans PubMed et PsycINFO via Ovid pour trouver des articles en anglais, dans des revues à comité de lecture, faisant état de ” psilocybine “, ” diéthylamide de l’acide lysergique “, ” LSD “, ” ayahuasca “, ” 3,4-méthylènedioxyméthamphétamine ” et ” MDMA ” chez des sujets humains, publiés entre 2007 et le 1er juillet 2019. Au total, 1 603 articles ont été identifiés et examinés. Les articles qui ne contenaient pas les termes “essai clinique”, “thérapie” ou “imagerie” dans le titre ou le résumé ont été éliminés. Les 161 articles restants ont été examinés par au moins deux auteurs. Les auteurs ont identifié 14 articles faisant état d’essais cliniques bien conçus portant sur l’efficacité du diéthylamide de l’acide lysergique (LSD), de la 3,4-méthylènedioxyméthamphétamine (MDMA), de la psilocybine et de l’ayahuasca dans le traitement des troubles de l’humeur et de l’anxiété, des troubles liés aux traumatismes et au stress, des troubles liés aux substances et à la dépendance, ainsi que dans le cadre des soins de fin de vie.
Résultats :
La base de données la plus importante concerne la MDMA et la psilocybine, qui ont été désignées par la Food and Drug Administration (FDA) des États-Unis comme des “thérapies révolutionnaires” pour le trouble de stress post-traumatique (PTSD) et la dépression résistante au traitement, respectivement. La recherche sur le LSD et l’ayahuasca est observationnelle, mais les données disponibles suggèrent que ces agents peuvent avoir des effets thérapeutiques sur des troubles psychiatriques spécifiques.
Conclusions :
Les essais cliniques randomisés soutiennent l’efficacité de la MDMA dans le traitement du PTSD et de la psilocybine dans le traitement de la dépression et de l’anxiété liée au cancer. Les recherches sur l’utilisation du LSD et de l’ayahuasca dans le traitement des troubles psychiatriques sont préliminaires, bien que prometteuses. Dans l’ensemble, la base de données est insuffisante pour que la FDA approuve un composé psychédélique pour une utilisation clinique de routine dans les troubles psychiatriques à l’heure actuelle, mais la poursuite de la recherche sur l’efficacité des psychédéliques dans le traitement des troubles psychiatriques est justifiée.
Bien que les hallucinogènes dérivés de plantes soient utilisés dans les pratiques religieuses depuis des siècles, ce n’est qu’en 1938 que le chimiste suisse Albert Hofmann a synthétisé le premier hallucinogène synthétique, le diéthylamide de l’acide lysergique (LSD), alors qu’il travaillait pour la société pharmaceutique Sandoz. Le 16 avril 1943, au cours d’une série d’expériences, Hofmann est entré par hasard en contact physique avec le LSD, ce qui a provoqué “un flot ininterrompu d’images fantastiques, de formes extraordinaires avec un jeu de couleurs intense et kaléidoscopique”. En 1947, Sandoz a commencé à commercialiser le LSD sous le nom de Delysid comme médicament d’appoint pour la psychothérapie et comme agent pour l’étude expérimentale de la nature des psychoses.
En 1960, Timothy Leary, psychologue à Harvard, a entrepris des expériences dans le cadre du Harvard Psilocybin Project afin de déterminer si la psilocybine était un adjuvant efficace pour la psychothérapie. Leary a également expérimenté le LSD et est devenu une figure polarisante qui a été renvoyée de Harvard, avec son collègue Richard Alpert, en 1963. Le dernier brevet de Sandoz pour la production de LSD a expiré en 1963, et la production illicite de LSD a augmenté, car il était largement utilisé dans des contextes médicaux non supervisés. En 1965, les gouvernements d’Europe et des États-Unis se sont inquiétés de la consommation de LSD et de psilocybine par le grand public. Le Congrès américain a adopté les Drug Abuse Control Amendments, qui ont fait de la vente et de la fabrication de LSD sans licence un délit et ont obligé tous les chercheurs qui n’avaient pas obtenu d’exemption pour les nouveaux médicaments expérimentaux de la Food and Drug Administration (FDA) à renoncer à leurs stocks de LSD. L’expérimentation clinique et la recherche sur les psychédéliques ont donc diminué et ont finalement été stoppées par la loi sur les substances contrôlées (Controlled Substances Act) de la loi de 1970 sur la prévention et le contrôle de l’abus des drogues (Comprehensive Drug Abuse Prevention and Control Act).
Bien que Timothy Leary soit décédé en 1996, les paroles de Ray Thomas des Moody Blues, écrites près de trente ans plus tôt, étaient prémonitoires : la recherche sur les psychédéliques était bel et bien morte après l’adoption de la loi sur les substances contrôlées. L’année suivante, le président Richard Nixon a déclaré la “guerre contre la drogue”, et une grande partie des expériences sur les psychédéliques se sont déroulées dans la clandestinité, au sein des mouvements de la contre-culture qui se sont répandus à travers les États-Unis et l’Europe.
Au cours de la dernière décennie, la recherche sur les bienfaits thérapeutiques potentiels des composés psychédéliques a connu un regain d’intérêt, le nombre d’articles de synthèse publiés et de rapports d’essais cliniques augmentant régulièrement. La recherche sur ces composés a été soutenue par diverses organisations, allant du Conseil de la recherche médicale du Royaume-Uni, une agence de santé financée au niveau national, à l’Association multidisciplinaire pour les études psychédéliques (MAPS), une organisation à but non lucratif fondée en 1986 pour accroître la base de connaissances sur les substances psychédéliques. Un soutien supplémentaire a été apporté par l’Institut de recherche Heffter, une organisation scientifique à but non lucratif fondée en 1993 qui encourage la recherche sur les hallucinogènes classiques et les composés apparentés, et par la Fondation Beckley, une organisation non gouvernementale basée au Royaume-Uni qui se consacre à la recherche sur les psychédéliques et à la réforme de la politique en matière de drogues fondée sur des données probantes. Ces organisations ont contribué au financement de nombreux essais fondamentaux et travaillent souvent avec des organismes de réglementation, notamment la FDA et l’Agence européenne des médicaments, afin de s’assurer que les études sont conformes aux directives réglementaires requises pour l’approbation éventuelle de l’utilisation clinique. La recherche contemporaine sur les drogues psychédéliques a été menée dans les plus grandes universités du monde, notamment l’université Johns Hopkins, l’université de New York, l’université de Californie à Los Angeles, l’Imperial College de Londres, l’université de Zurich et l’université de Bâle. Récemment, l’université Johns Hopkins et l’Imperial College London ont créé des centres de recherche sur les psychédéliques, qui visent à étudier les effets des drogues psychédéliques sur l’esprit, le cerveau et les troubles psychiatriques.
La Drug Enforcement Administration (DEA) américaine classe actuellement le LSD, l’ayahuasca, la psilocybine et la 3,4-méthylènedioxyméthamphétamine (MDMA) parmi les substances de l’annexe I, en raison de l’absence de données reconnues sur leur utilisation médicale ou leur innocuité et de leur potentiel d’abus. Cette étude a pour but de résumer les preuves, y compris toutes les recherches disponibles dans la littérature scientifique, de la sécurité et de l’efficacité des composés psychédéliques dans le traitement des troubles psychiatriques.
Méthodes
Des recherches ont été effectuées dans PubMed et PsycINFO via Ovid pour trouver des articles en anglais publiés dans des revues à comité de lecture et portant sur la psilocybine, le diéthylamide de l’acide lysergique, le LSD, l’ayahuasca, la 3,4-méthylènedioxyméthamphétamine et la MDMA chez des sujets humains, avec des dates de publication comprises entre le 1er janvier 2007 et le 1er juillet 2019. Nous avons choisi d’axer l’analyse sur ces quatre composés parce qu’ils ont récemment fait l’objet d’une couverture médiatique importante en raison de leur potentiel thérapeutique. Au total, 1 603 articles ont été identifiés et sélectionnés. Les articles qui ne contenaient pas les termes “essai clinique”, “thérapie” ou “imagerie” dans le titre ou le résumé ont été éliminés, ce qui a permis d’obtenir un total de 161 articles pour un examen plus approfondi. Pour obtenir un résumé complet des résultats cliniques pertinents, notre résumé ne s’est pas limité à ces essais cliniques randomisés, mais a également inclus des essais ouverts et des recherches sur des volontaires sains. Nous avons identifié 14 articles faisant état d’essais cliniques bien conçus sur l’efficacité du LSD, de la MDMA, de la psilocybine et de l’ayahuasca dans le traitement des troubles de l’humeur et de l’anxiété, des troubles liés aux traumatismes et au stress, des troubles liés à l’utilisation de substances psychoactives et des soins de fin de vie. Les forces et les limites méthodologiques des études évaluant l’utilisation des psychédéliques dans les troubles psychiatriques ont été identifiées et sont résumées ci-dessous pour chaque drogue. La revue a été complétée par des informations tirées de textes sur l’histoire de l’utilisation des psychédéliques en psychiatrie et des informations sur les techniques cliniques utilisées dans les études, telles que la psychothérapie psychédélique. Les informations sur les essais cliniques en cours ou prévus ont été incluses avec les informations d’enregistrement de ClinicalTrials.gov. L’organigramme de la méthodologie est présenté dans le supplément en ligne.
Composés psychédéliques
Les psychédéliques peuvent être divisés en quatre classes en fonction de leur profil pharmacologique et de leur structure chimique : les psychédéliques classiques (agonistes des récepteurs de la sérotonine 2A [5-HT2A]), les empathogènes ou entactogènes (inhibiteurs et libérateurs mixtes de la recapture de la sérotonine et de la dopamine), les agents anesthésiques dissociatifs (antagonistes du N-méthyl-d-aspartate [NMDA]) et les hallucinogènes atypiques, qui agissent sur plusieurs systèmes de neurotransmetteurs. Dans cette revue, nous examinons en détail trois psychédéliques classiques (LSD, psilocybine et ayahuasca) et un entactogène (MDMA). La kétamine, anesthésique dissociatif, a fait l’objet de publications antérieures du groupe de travail de l’American Psychiatric Association sur les biomarqueurs et les nouveaux traitements et sera comparée à ces composés dans la section consacrée aux composés psychédéliques, plus loin dans la revue.
Psilocybine
La psilocybine est un alcaloïde végétal dérivé des précurseurs de la tryptamine et présent dans diverses espèces de champignons. Elle est utilisée depuis des siècles par les populations autochtones d’Amérique centrale et d’Amérique du Sud dans un contexte sacramentel pour faciliter les expériences spirituelles. Dans les années 1950, les champignons psychédéliques ont été introduits dans la culture occidentale lorsque le mycologue amateur R. Gordon Wasson et sa femme, la pédiatre Valentina Wasson, ont publié dans le magazine Life un article décrivant leur expérience avec la psilocybine lors de leur participation à une cérémonie mazatèque au Mexique. Les composés psychoactifs psilocybine et psilocine ont été isolés pour la première fois à partir de l’espèce de champignon Psilocybe mexicana grâce à des recherches menées en collaboration par le mycologue Roger Heim et Albert Hofmann et ses collègues des laboratoires Sandoz. Après avoir déterminé les structures moléculaires de ces composés, Sandoz a commencé la production chimique synthétique de psilocybine, éliminant ainsi la nécessité de cultiver des champignons.
La psilocybine est activement métabolisée en psilocine, un inhibiteur du transporteur de la sérotonine et un agoniste partiel du récepteur 5-HT2A dont l’efficacité d’activation est inférieure à 40 % ; elle se lie également aux récepteurs 5-HT2C, 5-HT1A et 5-HT1B, avec des affinités de liaison par ordre décroissant. Pris à fortes doses (0,3-0,6 mg/kg), il peut provoquer des changements légers à profonds dans la perception sensorielle, y compris la synesthésie, l’euphorie, les illusions sensorielles et les hallucinations auditives et visuelles. Ces effets dépendent de la dose et durent de 3 à 6 heures. Les effets désagréables peuvent inclure le sentiment d’une “expérience sans fin”, ainsi que des nausées, des vomissements et des maux de tête passagers.
Les recherches systématiques sur la psilocybine ont commencé en 1962, lorsque Walter Pahnke et Timothy Leary ont mené l’expérience de la chapelle Marsh, également connue sous le nom d’expérience du Vendredi saint. Dans cet essai contrôlé randomisé, des étudiants en théologie protestants volontaires (N=20 ; 10 par groupe) ont reçu de la psilocybine ou un placebo (niacine) afin d’évaluer les propriétés enthéogéniques potentielles de la psilocybine. Bien que les drogues actives et de contrôle aient des propriétés physiologiques différentes qui ont probablement remis en cause l’aveuglement de l’expérience, la mesure des réponses des participants sur une échelle de huit catégories d’expériences mystiques a confirmé l’effet hypothétique de la psilocybine (p<0,05).
Leary et ses collègues ont également mené l’expérience de la prison de Concord pour déterminer si la psychothérapie de groupe assistée par la psilocybine pouvait réduire les taux de récidive après une période d’incarcération. Dans cette étude ouverte, des détenus (N=32) ont participé à deux séances de psychothérapie de groupe assistée par la psilocybine, chacune avec une dose de 20 à 70 mg, suivies d’une série de séances de psychothérapie. Malgré les rapports initiaux de Leary selon lesquels la psilocybine réduisait de manière significative les taux de récidive, une réanalyse ultérieure de Doblin a montré que le taux de récidive du groupe expérimental n’était pas significativement inférieur à celui de la population carcérale générale.
Récemment, la recherche sur la psilocybine a connu un regain d’intérêt aux États-Unis et en Europe pour le traitement des troubles de l’humeur réfractaires, des troubles obsessionnels compulsifs réfractaires, de l’anxiété en fin de vie et des troubles liés à la consommation de tabac et d’alcool. Carhart-Harris et al. ont mené une étude pilote ouverte pour évaluer la faisabilité et l’efficacité d’une psychothérapie assistée par la psilocybine chez des patients (N=12) souffrant de dépression modérée à sévère (définie par un score >17 sur l’échelle d’évaluation de la dépression de Hamilton [HAM-D]) et de dépression réfractaire au traitement (pas d’amélioration après des essais de deux classes différentes d’antidépresseurs d’une durée d’au moins 6 semaines dans l’épisode actuel). Les participants ont reçu deux doses orales de psilocybine en association avec des séances de psychothérapie, à 7 jours d’intervalle ; ils ont reçu une faible dose (10 mg) de psilocybine lors de la première séance et une dose plus élevée (25 mg) lors de la deuxième séance. Pendant les séances de psilocybine, les thérapeutes ont utilisé une approche non directive et de soutien. Toutes les mesures d’évaluation ont été effectuées au début de l’étude, puis une semaine et trois mois après la deuxième séance de psychothérapie assistée par la psilocybine. La principale mesure d’efficacité était l’inventaire rapide de la symptomatologie dépressive (Quick Inventory of Depressive Symptomatology, QIDS). Les scores de dépression du QIDS ont diminué de manière significative entre le début de l’étude et une semaine et trois mois après le traitement. Le changement moyen du score QIDS était de -11,8 (SD=4,9 ; p=0,002) à une semaine et de -9,2 (SD=6,0 ; p=0,003) à 3 mois. Les mesures secondaires comprenaient le HAM-D et l’inventaire de dépression de Beck (BDI). Lors du suivi à une semaine, huit patients (67 %) ont obtenu une rémission catégorique (définie par un score ≤9 sur le BDI). Lors du suivi à 3 mois, sept patients (58 %) ont obtenu une réponse catégorique (réduction de 50 % du score au BDI) et cinq patients (42 %) sont restés en rémission complète.
Dans le même échantillon, des IRM fonctionnelles (IRMf) ont été réalisées au départ et le matin suivant la séance de psychothérapie assistée par psilocybine à forte dose. Un jour avant et un jour après leurs séances de psilocybine, les patients ont reçu des images de visages avec des expressions de peur, de joie ou de neutralité sélectionnées dans l’ensemble des visages émotionnels dirigés de Karolinska. Les patients ayant reçu de la psilocybine ont montré une augmentation des réponses amygdaliennes aux visages effrayants par rapport aux visages neutres un jour après le traitement, et cette réponse a prédit un résultat clinique positif une semaine plus tard. L’activité accrue de l’amygdale après l’administration de psilocybine a été interprétée comme la preuve d’un mécanisme d’action antidépresseur différent de celui des patients traités avec des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), qui ont montré une diminution de la réponse de l’amygdale aux stimuli émotionnels. D’autres recherches en IRMf ont démontré que la psilocybine perturbe de manière aiguë la connectivité du réseau du mode par défaut, induisant des états neuroplastiques temporaires qui peuvent rendre un individu plus sensible et réceptif aux fonctions cognitives et au contenu auquel il a accès avec une psychothérapie de soutien non directive coadministrée.
Les troubles de l’humeur et de l’adaptation comorbides avec les diagnostics de cancer sont débilitants et associés à des résultats cliniques médiocres. Grob et al. ont réalisé un essai clinique randomisé (N=12, dont 11 femmes) portant sur la sécurité et l’efficacité de la psilocybine pour le traitement de l’anxiété chez des patients atteints d’un cancer du sein (N=4), du côlon (N=3), des ovaires (N=2), du péritoine (N=1) ou des glandes salivaires (N=1) ou d’un myélome multiple (N=1) à un stade avancé de la maladie. Chaque sujet a agi comme son propre témoin et a eu deux séances de traitement dans un ordre aléatoire, espacées de plusieurs semaines : une séance avec une dose modérée de psilocybine (0,2 mg/kg) et l’autre avec un placebo actif (niacine 250 mg). Bien qu’il n’y ait pas eu de changement significatif dans le score d’état de l’inventaire d’anxiété STAI (State-Trait Anxiety Inventory), les scores de trait STAI ont diminué de manière significative lors des évaluations de suivi 1 mois (p=0,001) et 3 mois (p=0,03) après la deuxième séance de traitement. Les scores BDI n’ont pas changé entre la ligne de base (1 jour avant l’administration du placebo) et l’évaluation de suivi de 2 semaines, mais ils ont chuté de manière significative à 1 mois (p=0,05) et sont restés significativement différents à 6 mois (p=0,03).
Une étude similaire, mais plus importante, menée en double aveugle, randomisée et croisée par Griffiths et al. (N=51) a étudié les effets de la psilocybine, administrée en deux séances, sur la dépression et les syndromes d’anxiété chez des patients atteints d’un cancer en phase terminale et présentant également un diagnostic de trouble de l’anxiété ou de l’humeur selon le DSM-IV. Les principaux types de cancer étaient le cancer du sein (N=13), des voies aérodigestives supérieures (N=7), gastro-intestinal (N=4), génito-urinaire (N=18), hématologique (N=8) et autre (N=1). Les participants étaient exclus s’ils prenaient des médicaments psychoactifs sur ordonnance (par exemple, ISRS, inhibiteurs de la monoamine oxydase, benzodiazépines). Pendant les séances de psilocybine, les participants ont reçu une forte dose (22 mg/70 kg) ou une faible dose (1 mg ou 3 mg/70 kg) de psilocybine, la faible dose servant de contrôle actif. Les participants ont été croisés pour recevoir la dose alternative lors d’une seconde session 5 semaines plus tard.
Avant la première séance de psilocybine, les participants ont rencontré les moniteurs de l’étude pour discuter des “aspects significatifs” de leur vie. Pendant les séances de dosage, les thérapeutes ont assuré une présence de soutien et ont encouragé les participants à “faire confiance, à se laisser aller et à s’ouvrir” à l’expérience, mais ils n’ont pas été directifs par ailleurs. Les données ont montré que la psilocybine à forte dose, mais pas à faible dose, produisait des diminutions importantes et significatives des symptômes de dépression et d’anxiété après 5 semaines, et que cet effet persistait pendant les 6 mois de suivi. Une réponse cliniquement significative a été définie comme une diminution de ≥50% du score sur le GRID-HAM-D-17 ou le HAM-A par rapport à la ligne de base, et les scores inférieurs au niveau seuil (≤7) ont défini la rémission des symptômes sur chaque mesure. Le taux de réponse à 6 mois était de 78 % pour les syndromes dépressifs en utilisant le GRID-HAM-D-17 et de 83 % pour les syndromes anxieux en utilisant le HAM-A ; les scores de rémission ont été atteints par 65 % des participants sur le GRID-HAM-D-17 et par 57 % sur le HAM-A.
Une étude croisée randomisée en double aveugle contre placebo (utilisant la niacine) menée par Ross et al. (N=29) a évalué l’efficacité d’une seule dose élevée de psilocybine (0,3 mg/kg) en conjonction avec une psychothérapie assistée par médicaments chez des patients présentant des symptômes d’anxiété et de dépression liés au cancer, mesurés par l’échelle hospitalière d’anxiété et de dépression (HADS), avec des sous-échelles pour l’anxiété (HADS-A) et pour la dépression (HADS-D). Environ deux tiers des patients souffraient d’un cancer avancé (stades II à IV), et les types de cancer comprenaient le cancer du sein ou de la reproduction (59 %), le cancer gastro-intestinal (17 %), le cancer hématologique (14 %) et d’autres types de cancer (10 %). Le BDI et les échelles d’état et de trait STAI ont également été administrés au départ et à intervalles réguliers au cours de l’étude. Après 7 semaines, le groupe placebo est passé à la psilocybine et le groupe psilocybine active au placebo. La psychothérapie assistée par médicaments comprenait une psychothérapie préparatoire, des séances de dosage des médicaments et une psychothérapie intégrative post-dosage. Pendant les séances de psychothérapie médicamenteuse, les participants ont été encouragés à s’allonger confortablement sur un canapé, à porter des lunettes de soleil, à écouter de la musique présélectionnée et à orienter leurs pensées vers leur expérience interne. Deux thérapeutes de l’étude, généralement un homme et une femme, étaient présents et disponibles pour un soutien psychologique et médical pendant toute la durée des séances expérimentales.
Des réductions significatives de toutes les mesures primaires (HADS total, HADS-A, HADS-D, BDI, STAI état, STAI trait) ont été observées dans le groupe psilocybine par rapport au groupe témoin immédiatement après la session expérimentale, et ces réductions ont été maintenues jusqu’au croisement avec le groupe témoin à la semaine 7. Le groupe ayant reçu de la psilocybine en premier a présenté des réductions significatives de l’anxiété et de la dépression à l’intérieur du groupe par rapport à la ligne de base à chacun des six points temporels, y compris le dernier point temporel à 26 semaines après l’administration de la dose. Avant de passer à la psilocybine, le groupe ayant reçu le placebo en premier n’avait pas de réduction significative soutenue sur aucune des mesures primaires. Immédiatement après avoir reçu de la psilocybine, le premier groupe placebo présentait des réductions significatives des symptômes de dépression et d’anxiété sur cinq des six mesures primaires. Ces réductions ont persisté et étaient présentes aux trois points de mesure, y compris au dernier point de mesure, 26 semaines après la deuxième dose (environ 6,5 mois). Lors du suivi, 6,5 mois après l’intervention active à la psilocybine, 60 à 80 % des participants avaient conservé leur statut de répondeur sur les échelles de dépression et d’anxiété (défini comme une réduction ≥50 % du score sur la mesure par rapport à la ligne de base).
Il existe des preuves préliminaires de l’efficacité de la psilocybine dans le traitement des troubles liés à l’utilisation de substances. Une étude ouverte menée par Johnson et al. a recruté des participants désireux d’arrêter de fumer (N=15) pour un traitement de désaccoutumance au tabac de 15 semaines associé à l’administration de psilocybine. Les 4 premières semaines de traitement consistaient en une thérapie cognitivo-comportementale, l’assignation d’une date cible d’arrêt du tabac et la tenue d’un journal du tabagisme. La psilocybine a été administrée aux semaines 5 et 7, avec une troisième séance facultative de psilocybine à la semaine 13. Les participants ont reçu une dose modérée de psilocybine (20 mg/70 kg) lors de la première séance expérimentale et une dose plus élevée de psilocybine (30 mg/70 kg) lors des deuxième et troisième séances expérimentales, à moins qu’ils ne demandent une dose modérée de psilocybine. La date cible d’arrêt du tabac coïncidait avec la première séance de psilocybine. Pendant les séances, le personnel de recherche a fourni un soutien interpersonnel non directif et n’a pas délivré de contenu spécifique au sevrage tabagique. L’abstinence tabagique a été vérifiée à tous les points de collecte de données en utilisant le monoxyde de carbone exhalé (niveau de CO ≤6 ppm) et les mesures de cotinine urinaire (niveau <200 ng/mL). Lors du suivi à 6 mois, 12 des 15 participants (80 %) ont été déclarés abstinents après vérification en laboratoire ; 10 participants (67 %) sont restés abstinents à 12 mois et 9 (75 %) à 2,5 ans. L’étude pilote a été étendue à 95 participants et devrait être achevée en 2021 (ClinicalTrials.gov identifier 01943994).
Bogenschutz et al. ont évalué la psilocybine en ouvert pour le traitement de personnes qui répondaient aux critères du DSM-IV pour la dépendance à l’alcool et qui avaient au moins deux jours de forte consommation d’alcool au cours des 30 jours précédents (N=10). Les participants ont également reçu une psychothérapie, qui comprenait 14 séances : sept séances de thérapie d’amélioration de la motivation, trois séances de préparation, deux séances de psychothérapie assistée par la psilocybine et deux séances de débriefing. Les participants ont reçu leur première dose de psilocybine (0,3 mg/kg) après les quatre premières séances de psychothérapie et leur deuxième dose (0,4 mg/kg) après les quatre séances suivantes, qui ont été suivies de quatre autres séances de psychothérapie.
Les principaux critères d’évaluation étaient l’échelle de préparation au changement et d’empressement au traitement (Stages of Change Readiness and Treatment Eagerness Scale), l’échelle d’auto-efficacité pour l’abstinence d’alcool (Alcohol Abstinence Self-Efficacy Scale), l’échelle de besoin d’alcool (Penn Alcohol Craving Scale) et le profil des états d’âme (Profile of Mood States). Deux thérapeutes étaient présents tout au long des séances de psilocybine, et leurs interactions avec les participants étaient encourageantes et non directives. L’abstinence n’était pas vérifiée biologiquement et était basée sur l’auto-déclaration. L’étude a montré que l’abstinence a augmenté de manière significative après la première séance de psilocybine à 4 semaines et qu’elle s’est maintenue jusqu’à 36 semaines. Bogenschutz et al. mènent actuellement un essai clinique randomisé sur l’efficacité de la psilocybine dans le traitement de la dépendance à l’alcool. L’étude devrait compter 180 participants et s’achever en 2020.
La thérapie assistée par la psilocybine repose sur l’idée que la réponse du participant est en corrélation avec une expérience “mystique” ou “spirituelle” induite par la psilocybine. Dans les études décrites ci-dessus, les chercheurs ont noté des corrélations entre la réduction des symptômes et l’évaluation par les participants de leurs expériences avec la psilocybine comme étant personnellement significatives, comme le reflètent leurs scores au Mystical Experience Questionnaire (MEQ-30) en 30 points. Le MEQ-30 est une mesure validée de l’expérience mystique qui évalue sept domaines de l’expérience mystique : l’unité interne, l’unité externe, la qualité noétique (sentiment de perception ou de révélation pendant l’expérience), le caractère sacré, l’humeur positive, la transcendance du temps/de l’espace et l’ineffabilité (difficulté de communiquer ou de décrire l’expérience à d’autres). Des analyses factorielles confirmatoires ont démontré la fiabilité et la validité de l’instrument, et la validité externe et convergente a été démontrée par des scores de variables latentes prédisant positivement les changements d’attitudes, de comportement et de bien-être liés à la psilocybine.
Les expériences mystiques portent de nombreux noms – expériences religieuses, expériences transcendantales, moments de transformation, épiphanies – mais elles se caractérisent toutes par des transformations personnelles qui entraînent des changements spectaculaires ou “quantiques” dans la perception de soi et le comportement. Dans une étude prospective, Griffiths et al. ont examiné les effets à long terme d’une expérience mystique liée à la psilocybine chez des personnes n’ayant jamais consommé de psilocybine, lorsqu’elle est associée à la méditation ou à des pratiques spirituelles. Les scores totaux du MEQ-30 et de l’échelle des expériences spirituelles indiquaient tous deux un fonctionnement psychologique sain après six mois, l’intensité de l’expérience mystique induite par la psilocybine contribuant le plus significativement à l’effet.
Bien que les praticiens reconnaissent que la présentation aiguë d’une personne intoxiquée à la psilocybine ressemble beaucoup à une psychose, on ne pense pas que les hallucinogènes comme la psilocybine précipitent une nouvelle maladie psychotique, mais plutôt qu’ils peuvent démasquer un trouble psychotique chez les personnes qui y sont sensibles. Dans une analyse de 110 volontaires sains ayant reçu 227 doses de psilocybine, les chercheurs n’ont trouvé aucune preuve de troubles de la perception persistants dus aux hallucinogènes, de psychose prolongée ou d’autres troubles du fonctionnement à long terme chez les sujets. La plupart des recherches sur les séquelles de l’utilisation de la psilocybine et d’autres psychédéliques classiques proviennent d’études où les participants sont soumis à un dépistage des antécédents psychiatriques, où le dosage de la drogue est réglementé et où la drogue est administrée dans un cadre contrôlé. Ces mesures de protection visent à minimiser les risques d’effets indésirables.
En revanche, les effets potentiels de la psilocybine dans un environnement communautaire non contrôlé sont différents. Dans une enquête en ligne menée auprès de près de 2 000 personnes ayant répondu positivement à la question de savoir si, après avoir pris des champignons psilocybines, elles avaient “déjà eu une expérience psychologiquement difficile ou stimulante (c’est-à-dire un mauvais voyage) – c’est-à-dire si vous avez éprouvé une peur, une anxiété ou une détresse importantes ou toute autre chose que vous avez trouvée psychologiquement difficile”, 39 % des personnes interrogées ont déclaré que cette expérience avait été l’une des plus stimulantes de leur vie. Vingt-quatre pour cent des participants ont signalé des symptômes psychologiques qui ont duré une semaine ou plus (peur, anxiété, dépression ou paranoïa), 10 % ont signalé des symptômes persistants pendant plus d’un an et 7,6 % ont demandé une aide professionnelle pour des symptômes psychologiques. Bien que cette enquête en ligne ne soit pas suffisamment rigoureuse pour servir de guide à la pratique clinique, elle souligne néanmoins les préoccupations potentielles liées à l’utilisation de psychédéliques dans des contextes non contrôlés.
En 2018, la FDA a désigné la psilocybine comme une “thérapie révolutionnaire” pour la dépression résistante au traitement, lui accordant une attention prioritaire dans le processus de réglementation. À l’heure actuelle, Compass Pathways, une société de sciences de la vie basée à Londres, entame des essais cliniques de phase 2B en Europe et en Amérique du Nord sur 216 patients répartis sur 12 à 15 sites de recherche pour la dépression résistante au traitement, avec des études supplémentaires de phase 3. L’Institut Usona, une organisation américaine de recherche médicale à but non lucratif, prévoit également des essais multisites de phase 2 et 3 enregistrés auprès de la FDA pour étudier la psilocybine en tant que traitement de la dépression, de l’anxiété et des troubles de l’humeur associés à la fin de vie. Deux essais cliniques randomisés de phase 2 en cours étudient les effets de la psilocybine chez des patients ayant un diagnostic de trouble obsessionnel compulsif afin de reproduire et d’étendre les résultats initiaux d’une étude de Moreno et al. (publiée en 2006, en dehors des critères de date de recherche de cette revue). D’autres études portent sur la psilocybine pour le traitement des troubles liés à la consommation de cocaïne, des troubles liés à la consommation d’opioïdes, de l’anorexie mentale et de la dépression dans les premiers stades de la maladie d’Alzheimer.
Diéthylamide de l’acide lysergique (LSD)
Le LSD est un dérivé de l’ergot de seigle connu pour sa capacité à induire de puissantes expériences psychédéliques, spirituelles et mystiques. Le LSD a été décrit comme un psycho-adjuvant ou un “amplificateur non spécifique de l’inconscient”, dont les effets comprennent l’affaiblissement de l’identification à l’ego, l’accélération et l’élargissement des processus et du contenu de la pensée, la promotion d’associations de pensées nouvelles et la modification de l’interprétation et de la compréhension des relations et des objets. Il peut induire un sentiment de proximité avec les autres, renforcer l’empathie émotionnelle, améliorer la socialité et altérer de manière aiguë la reconnaissance de la peur. À des doses modérées ou élevées, le LSD améliore la perception sensorielle, ce qui peut entraîner des illusions, des images oniriques au réveil, des synesthésies, des altérations de la perception des sons et des expériences mystiques.
Les effets hallucinogènes du LSD seraient dus à plusieurs mécanismes : agonisme partiel du récepteur 5-HT2A, liaison aux récepteurs 5-HT1A, 5-HT2C et 5-HT2B (par ordre décroissant d’affinité) et liaison aux récepteurs dopaminergiques D2. Il provoque également la libération de glutamate dans le cortex frontal et une augmentation de la connectivité fonctionnelle et de l’excitabilité dans les structures thalamiques et corticales. Le LSD n’interagit pas avec les transporteurs de monoamines et se lie plus puissamment que toutes les autres tryptamines aux récepteurs 5-HT2A et 5-HT1A. D’autres mécanismes pharmacodynamiques et pharmacocinétiques du LSD ont été largement explorés, mais ils n’entrent pas dans le cadre de la présente étude.
À partir des années 1940 et jusque dans les années 1960, le nombre d’études sur les utilisations potentielles du LSD chez des volontaires sains et dans le traitement des troubles psychiatriques a augmenté. On a d’abord pensé que les résultats psychologiques observés imitaient la schizophrénie, suggérant que le LSD était un modèle potentiel de psychose. Des études récentes ont montré que les symptômes psychotiques associés à l’ingestion de LSD sont plus probables chez les volontaires sains présentant des traits schizoïdes et paranoïaques prémorbides et chez les personnes ayant des antécédents familiaux de schizophrénie. Une vaste étude épidémiologique portant sur 130 000 adultes aux États-Unis n’a pas établi de lien entre la consommation de psychédéliques (y compris le LSD et la psilocybine) et les problèmes de santé mentale ou les comportements suicidaires.
Des études ont noté les effets expérientiels des changements comportementaux induits par le LSD chez des personnes souffrant de troubles liés à l’utilisation de substances, et le LSD a été reconnu comme un traitement potentiel des troubles liés à l’utilisation de l’alcool. Plusieurs groupes de recherche ont décrit le potentiel du LSD pour l’atténuation des symptômes chez les personnes souffrant de troubles de l’humeur et de syndromes douloureux associés aux soins de fin de vie. Bien que les essais préliminaires sur le LSD aient donné des résultats généralement positifs, la recherche clinique sur l’utilisation thérapeutique du LSD a été interrompue en 1968, lorsque les Drug Abuse Control Amendments ont été modifiés pour faire de la possession de LSD un délit et de la vente de LSD un crime. Le LSD est actuellement classé dans l’annexe I de la loi sur les substances contrôlées.
Récemment, quelques petites études ouvertes ont été menées en dehors des États-Unis sur l’utilisation du LSD dans le traitement des troubles de l’humeur, de l’anxiété chez les malades en phase terminale et des migraines. Un groupe de chercheurs suisses et allemands, Gasser et al., a mené un essai contrôlé randomisé pour examiner la sécurité et l’efficacité de la psychothérapie psychédélique assistée par le LSD chez des patients souffrant d’anxiété associée à une maladie médicale (N=12), y compris une tumeur maligne, la maladie de Parkinson, la maladie cœliaque et la spondylarthrite ankylosante. Le principal critère d’évaluation était le STAI trait et état, complété au début de l’étude, après 1 semaine, et après 2 mois et 12 mois de suivi. Au début de l’étude, tous les participants ont obtenu un score >40 au STAI état et trait, et la moitié d’entre eux répondaient aux critères du DSM-IV pour le trouble d’anxiété généralisée. Les participants ont cessé progressivement de prendre des antidépresseurs et des anxiolytiques et ont reçu une psychothérapie complétée par deux séances de psychothérapie psychédélique assistée par le LSD, espacées de 2 à 3 semaines. Huit participants ont reçu une dose modérée de LSD (200 μg), et quatre participants ont reçu une faible dose (20 μg), qui devait agir comme un placebo actif.
Lors du suivi après deux mois, l’anxiété trait moyenne n’a pas changé de manière significative dans le groupe LSD à forte dose par rapport au groupe placebo, mais l’anxiété état moyenne a diminué de manière significative dans le groupe LSD à forte dose par rapport au groupe à faible dose (placebo). La comparaison des scores d’anxiété de trait et d’état au début de l’étude avec ceux du suivi après deux mois a donné des tailles d’effet de 1,1 et 1,2, respectivement. Les quatre participants du groupe à faible dose (placebo) ont vu leur anxiété trait augmenter au fil du temps, et deux d’entre eux ont également vu leur anxiété état augmenter.
Les chercheurs suisses Schmid et Liechti et al. ont fait état de suivis à court et à long terme après que des volontaires sains (N=16) ont reçu une seule dose modérée de LSD (200 μg) dans le cadre d’une étude croisée randomisée en double aveugle contre placebo comportant deux séances expérimentales. Pendant les sessions expérimentales, les participants se sont reposés dans des lits d’hôpital et avaient la possibilité d’écouter de la musique au casque (aucun divertissement alternatif n’a été proposé, et aucune orientation ou thérapie spécifique n’a été fournie). Les participants ont été invités à remplir le questionnaire sur les effets persistants, l’échelle de mysticisme, version à vie, l’échelle de transcendance de la mort et l’inventaire NEO des cinq facteurs lors de la sélection de l’étude, puis 1 mois et 12 mois après leur séance de LSD.
Un mois et 12 mois après l’administration de LSD, le questionnaire sur les effets persistants a montré une augmentation significative des attitudes positives à l’égard de la vie ou de soi-même, des changements d’humeur positifs, des effets sociaux altruistes/positifs, des changements de comportement positifs et de la satisfaction à l’égard du bien-être/de la vie que les participants ont attribués à leur expérience du LSD. Le score total de l’échelle de mysticisme a augmenté, avec des augmentations significatives des scores des facteurs introvertis et extravertis. Le score total de l’échelle de transcendance de la mort et les scores de la sous-échelle de mysticisme ont également augmenté de manière significative à 1 et 12 mois, et les scores de conscienciosité de l’inventaire NEO à cinq facteurs ont été significativement plus élevés à 12 mois. Après 12 mois, 10 des 14 participants (71 %) ont classé leur expérience du LSD “parmi les 10 expériences les plus significatives” de leur vie, et cinq participants l’ont classée “parmi les cinq expériences les plus significatives sur le plan spirituel” de leur vie. Cette étude suggère des effets positifs du LSD sur les attitudes, l’humeur et le comportement, ce qui pourrait avoir des implications pour le traitement des troubles psychiatriques.
Des chercheurs en neuroimagerie, Mueller et al., ont mené une étude croisée randomisée en double aveugle contre placebo sur les effets du LSD (100 μg) sur l’activité amygdalienne pendant le traitement des stimuli de peur chez des sujets en bonne santé (N=20). Au moment de l’effet maximal attendu, 2,5 heures après l’ingestion de LSD, les participants ont subi des examens IRMf pendant qu’ils regardaient des images de visages représentant divers degrés de peur, de colère, de bonheur ou d’expressions neutres, tirées de la série d’images d’affects faciaux d’Ekman et de Friesen. Tous les participants ont été transférés dans l’autre condition et ont été scannés selon le même protocole. Comparé au placebo, le LSD a entraîné une diminution significative de la réactivité de l’amygdale gauche aux stimuli de peur et une altération de la reconnaissance des visages de peur, mais il n’a pas affecté la reconnaissance des visages neutres, heureux ou en colère. Il a également été noté que l’administration de LSD était associée à une diminution de l’activité dans le cortex préfrontal médian droit par rapport au placebo. Les chercheurs ont interprété ces résultats comme indiquant que le LSD pourrait modifier le traitement des préjugés à l’égard des stimuli négatifs, qui jouent un rôle dans la dépression et les troubles anxieux. Ils ont également suggéré que le LSD pourrait être utile pour réduire les perceptions d’émotions négatives, améliorer les déficits cognitifs sociaux et faciliter l’alliance thérapeutique.
Récemment, le microdosage du LSD a suscité un regain d’intérêt, la pratique consistant à prendre des doses inférieures au seuil de perception à des intervalles de 3 à 5 jours dans le but de déclencher une réponse cellulaire. Des publications dans les médias grand public et des rapports subjectifs ont suggéré que le microdosage de LSD à 10-20 μg pourrait induire des effets positifs, tels que la promotion de la créativité et l’amélioration de l’humeur, sans l’expérience complète des effets psychédéliques. À l’heure actuelle, aucune preuve scientifique disponible ne vient étayer la pratique du microdosage. En fait, il a été démontré que des doses de LSD de 13 et 26 μg (N=20) produisent des effets subjectifs et physiologiques mesurables avec des effets minimes sur la cognition et la créativité. Il convient de souligner que le LSD à faible dose (20 μg) reçu par le groupe placebo actif dans l’étude de Gasser et al. mentionnée ci-dessus a été associé à une aggravation de l’anxiété chez les personnes souffrant d’une maladie comorbide. Si ce résultat peut être attribué à un rééchantillonnage dans le temps ou à une absence d’attente du placebo, il peut également être attribué à un microdosage. La Beckley Foundation a l’intention d’étudier les effets neurobiologiques et cliniques du microdosage de LSD en tant que stratégie d’amélioration cognitive dans le cadre d’une prochaine enquête, mais les détails spécifiques n’étaient pas disponibles au moment de la rédaction de ce document.
Bien que la recherche clinique actuelle sur le LSD soit limitée, plusieurs nouvelles études cliniques se profilent à l’horizon en Suisse. Ces études porteront sur le LSD en tant que traitement pour les patients souffrant d’anxiété avec ou sans maladie mortelle, la psychothérapie assistée par le LSD pour les patients souffrant d’anxiété liée à la maladie, et les états de conscience modifiés induits par le LSD.
Ayahuasca
L’ayahuasca est une décoction préparée à partir de Banisteriopsis caapi et de Psychotria viridis, deux plantes originaires du bassin amazonien. Ingéré par voie orale, le mélange est connu pour induire des effets par l’action des alcaloïdes β-carboline (à savoir les dérivés de l’harmine) présents dans Banisteriopsis caapi et de la N,N-diméthyltryptamine (DMT) présente dans Psychotria viridis. La préparation agit de manière synergique, dans la mesure où les alcaloïdes de la β-carboline inhibent la monoamine oxydase A (MAO-A), empêchant la dégradation périphérique de la DMT, un inhibiteur du transporteur de la sérotonine et du transporteur de la norépinéphrine ainsi qu’un libérateur de 5-HT et un agoniste des récepteurs 5-HT1A, 5-HT2A, 5-HT2C et 5-HT2B (par ordre décroissant d’affinité). L’environnement dans lequel la substance est ingérée, les attentes de l’utilisateur et les interactions pharmacodynamiques des composants de la décoction sont autant de facteurs susceptibles d’influencer les résultats associés à l’ingestion d’ayahuasca.
L’ayahuasca est associée à un large éventail d’effets subjectifs, notamment des hallucinations auditives et visuelles, une altération du sensorium, une altération des perceptions spatiales et une euphorie, ainsi que des expériences mystiques et noétiques. Des épisodes psychotiques ont été documentés en association avec l’intoxication à l’ayahuasca, généralement chez des personnes ayant des antécédents personnels ou familiaux de troubles de l’humeur, de troubles psychotiques ou de troubles liés à l’utilisation de substances. Ces psychoses induites par l’ayahuasca ne sont généralement pas prolongées. Il a été démontré que les psychoses peuvent être atténuées par un dépistage des troubles psychiatriques préexistants, mais les conclusions concernant la relation entre l’ayahuasca et les épisodes psychotiques prolongés sont tirées à partir d’échantillons de petite taille, ce qui limite la généralisation.
La consommation d’ayahuasca a été associée à des pratiques traditionnelles parmi les groupes indigènes du nord-ouest de l’Amazonie, mais les dernières décennies ont été marquées par un intérêt international croissant pour ses effets thérapeutiques possibles. La Cour suprême des États-Unis a autorisé l’utilisation de l’ayahuasca dans le cadre de pratiques religieuses et spirituelles par des groupes tels que União do Vegetal et Santo Daime, mais les essais cliniques aux États-Unis restent inexistants car le DMT, un composant de l’ayahuasca, est une substance réglementée de l’annexe I.
Des recherches cliniques sur l’ayahuasca en dehors des États-Unis ont commencé au cours des dernières années. Les chercheurs brésiliens Osório et al. ont mené un petit essai clinique ouvert (N=6) sur l’efficacité de l’ayahuasca chez des patients souffrant de dépression et n’ayant pas répondu à au moins un essai de médicament antidépresseur. Tous les patients répondaient aux critères du trouble dépressif majeur selon l’entretien clinique structuré du DSM-IV et ont été admis dans une unité psychiatrique pendant 2 semaines pour l’élimination des médicaments avant l’administration de l’ayahuasca. L’échelle HAM-D et l’échelle d’évaluation de Montgomery-Åsberg (MADRS) ont été administrées 10 minutes avant l’administration de l’ayahuasca, puis 40, 80, 140 et 180 minutes après, avec des évaluations de suivi 1, 7, 14 et 21 jours plus tard. Les participants ont bu une dose standard (2,2 ml/kg) d’ayahuasca (contenant 0,8 mg/ml de DMT, 0,21 mg/ml d’harmine et aucune harmaline mesurée par chromatographie en phase gazeuse/spectrométrie de masse) préparée par la communauté Santo Daime. Tous les participants sont sortis de l’unité psychiatrique 24 heures après l’administration de l’ayahuasca. Le score moyen HAM-D a été réduit de 62% 1 jour après l’administration de la drogue (p=0.01), avec une réduction encore plus prononcée de 72% (p=0.01) 7 jours après l’administration de la drogue. Le score MADRS moyen a été réduit de 82 % après 7 jours (p=0,009) et l’effet s’est maintenu après 21 jours. Les investigateurs ont noté que les effets antidépresseurs les plus significatifs ont été observés pour la tristesse exprimée, les pensées pessimistes, les idées suicidaires et les difficultés de concentration.
Compte tenu du signal thérapeutique positif de leur étude pilote, la même équipe de recherche a mené une étude de réplication avec un échantillon plus important (N=17). Le score initial moyen du HAM-D pour ce groupe était de 19,4 et le score initial moyen du MADRS était de 25,6. Les symptômes, tels que mesurés par les deux échelles, ont diminué de manière significative de manière aiguë, à partir de 80 minutes après l’administration du médicament. Après 21 jours de suivi, le score moyen HAM-D était de 7,56, ce qui représente un changement moyen hautement significatif sur le plan statistique de -11,4 points (p<0,0005). Les résultats positifs de l’étude précédente ont été reproduits, mais comme aucune des deux études n’était randomisée, en double aveugle ou contrôlée par placebo, les résultats doivent être considérés comme préliminaires. Bien qu’environ la moitié des participants aient vomi, ils ont généralement décrit la séance d’ayahuasca comme une expérience agréable, et aucun événement indésirable grave n’a été observé dans l’une ou l’autre étude.
Actuellement, les données sont insuffisantes pour soutenir l’utilisation de l’ayahuasca dans un contexte clinique. La recherche clinique sur l’ayahuasca, qui comprend des résultats préliminaires prometteurs pour le traitement de la dépression, est limitée par plusieurs facteurs, notamment l’absence d’analyses chimiques permettant de confirmer les ingrédients exacts de la boisson d’ayahuasca utilisée dans les études. Une multitude de composés supplémentaires ont été décrits dans les préparations indigènes, y compris, entre autres, la caféine, la nicotine, la cocaïne et la scopolamine. En évaluant les études susmentionnées, il faut tenir compte du fait que l’ayahuasca a été administrée sous la forme d’une concoction non standardisée. Des essais cliniques randomisés utilisant des composés pharmacologiquement purs sont nécessaires pour faire progresser nos connaissances sur le potentiel thérapeutique de l’ayahuasca.
3,4-Méthylènedioxyméthamphétamine (MDMA)
La MDMA est une phénéthylamine substituée par un anneau qui présente des similitudes structurelles avec l’amphétamine et la mescaline. La MDMA a été synthétisée par Merck & Co. en 1912 comme agent thérapeutique potentiel pour réduire le temps de coagulation et prévenir les hémorragies. Le composé ne s’est pas avéré efficace en tant que médicament hémostatique, mais ses propriétés psychotropes ont été reconnues. Le chimiste Alexander Shulgin a resynthétisé la MDMA en 1976, et le premier rapport publié caractérisant les effets psychoactifs de la MDMA est paru en 1978.
Malgré l’absence de recherche systématique sur son efficacité et sa sécurité, certains psychothérapeutes ont commencé à utiliser la MDMA pour améliorer les résultats des séances de psychothérapie, dans le but de permettre à leurs patients de mieux comprendre leurs problèmes psychologiques. La MDMA a été associée à des sentiments de bien-être émotionnel et a été décrite comme une “pénicilline pour l’âme” (90).
Ces propriétés psychoactives ont encouragé l’utilisation de la MDMA comme drogue récréative. Entre le début et le milieu des années 1980, la MDMA a été synthétisée et distribuée illicitement sous le nom de rue “Ecstasy” et est devenue populaire pour faciliter un état émotionnel altéré lors de soirées dansantes appelées “raves”. En raison de préoccupations concernant les risques d’abus et la neurotoxicité, la DEA a classé la MDMA comme substance temporaire de l’annexe I en 1985, puis comme telle de manière permanente en 1988.
La MDMA et d’autres phénéthylamines substituées par des 3,4-méthylènedioxy ont été postulées comme représentant une nouvelle classe d’agents pharmacologiques, appelés entactogènes, dont les effets ne recoupent que partiellement ceux des psychostimulants et des hallucinogènes sérotoninergiques. Les effets de la MDMA seraient dus à un certain nombre de mécanismes, notamment la libération de monoamines, l’inhibition de la recapture des transporteurs de sérotonine et de norépinéphrine, l’inhibition de la monoamine oxydase, l’agonisme partiel des récepteurs de la sérotonine (récepteurs 5-HT2A, 5-HT1A et 5-HT2C) et l’augmentation des concentrations sanguines d’ocytocine. À ce jour, des études menées sur des volontaires sains ont confirmé que la MDMA produit un état de conscience altérée facilement contrôlable et réversible, caractérisé par l’euphorie, l’empathie, le bien-être, la perspicacité, l’extraversion, l’humeur positive, la grégarité, le sentiment d’authenticité, un accès accru à des contenus émotionnellement intenses, une confiance interpersonnelle accrue et de la compassion pour soi-même et pour les autres. Dans la population clinique, l’anxiété a été signalée chez la majorité des participants à l’étude, et les émotions douloureuses telles que le chagrin, la peur et la rage ne sont pas rares chez les participants ayant reçu un diagnostic de PTSD.
La première étude en double aveugle contrôlée par placebo sur la MDMA a été menée aux États-Unis en 1994 et a été suivie de deux autres essais de phase 1. Une dose unique de MDMA provoque des augmentations transitoires mais tolérables de la fréquence cardiaque, de la pression artérielle et de la température corporelle chez des sujets sains. Des études ultérieures contrôlées par placebo menées en Europe ont confirmé ces résultats généraux en matière de sécurité et de tolérance et ont démontré que le traitement des informations contextuelles reste intact après l’ingestion de MDMA.
Un essai clinique randomisé en IRMf en double aveugle chez des volontaires sains (N=9) a montré que pendant le pic d’effet de la drogue, la MDMA diminuait la réactivité amygdalienne en réponse aux visages de colère mais pas aux visages de peur et augmentait l’activité du striatum ventral en réponse aux visages heureux de la série Ekman et Friesen d’images d’affects faciaux. Les volontaires recevant de la MDMA étaient également plus à même de vérifier les expressions faciales positives et avaient plus de mal à identifier les expressions négatives, par rapport aux volontaires recevant un placebo. Ces résultats de réduction de la réponse à la menace et d’augmentation de la réponse à la récompense ont fourni des indications importantes sur les effets de la MDMA sur le traitement de l’information émotionnelle.
En 2010, Mithoefer et al. ont achevé le premier essai contrôlé randomisé de phase 2 portant sur l’efficacité de la MDMA dans le traitement du PTSD chronique (N=23). L’étude a porté sur des adultes ayant reçu un diagnostic de PTSD chronique selon le DSM-IV-TR. Les critères d’inclusion comprenaient également des symptômes résistants au traitement (définis par un score ≥50 sur l’échelle Clinician-Administered PTSD Scale [CAPS]) et l’échec antérieur d’au moins 3 mois d’un ISRS ou d’un inhibiteur sélectif de la recapture de la sérotonine et de la noradrénaline, en plus de 6 mois de psychothérapie (le type spécifique de psychothérapie n’était pas spécifié). Les participants à l’étude ont reçu deux séances expérimentales de psychothérapie manuelle assistée par la MDMA avec la drogue active (125 mg par voie orale avec une dose supplémentaire facultative de 62,5 mg) (N=12) ou un placebo (N=8). La thérapie manuelle a été développée pour l’étude sur la base des principes du travail respiratoire holotropique (114) et de la psychothérapie LSD, et elle mettait l’accent sur une approche de soutien non directive.
Le principal critère de jugement était le changement moyen des scores totaux CAPS mesurés au départ, 4 jours après chaque séance expérimentale et 2 mois après la deuxième séance expérimentale. Les scores CAPS moyens au départ étaient de 79,6 (SD=8,1) pour le groupe placebo et de 79,2 (SD=6,6) pour le groupe MDMA (p=0,966). Trois à cinq jours après la première session expérimentale, les scores CAPS des participants étaient de 74,1 (SD=10,3) pour le groupe placebo et de 37,8 (SD=8,4) pour le groupe MDMA (p=0,013). Trois à cinq jours après la deuxième séance expérimentale, les scores CAPS étaient de 66,8 (SD=8,0) pour le groupe placebo et de 29,3 (SD=6,5) pour le groupe MDMA (p=0,002). Deux mois après la deuxième session expérimentale, les scores CAPS étaient de 59,1 (SD=9,4) pour le groupe placebo et de 25,5 (SD=7,7) pour le groupe MDMA (p=0,013). Une proportion significativement plus importante du groupe MDMA (10 sur 12, 83,3 %) que du groupe placebo (2 sur 8, 25 %) répondait aux critères de réponse catégorielle (réduction ≥30 % du score CAPS par rapport à la valeur initiale). Tous les participants traités par placebo se sont vus offrir la possibilité d’un croisement ultérieur en ouvert. Sept participants sur huit ont choisi cette option et tous les sept ont présenté une réponse clinique 4 à 6 semaines après deux séances de MDMA. Le changement moyen du score CAPS dans ce groupe (N=7) était de -31,7 (SD=15) (p<0,05).
Les scores CAPS obtenus 17 à 74 mois après les deux séances de psychothérapie assistée par la MDMA ont été examinés dans le cadre d’une étude prospective de suivi à long terme. Seize participants ont effectué toutes les mesures sur une période de 3,5 ans (durée du suivi : moyenne = 45,4 mois, écart-type = 17,3). Parmi les participants ayant terminé l’étude, aucun changement significatif n’a été observé dans les scores CAPS moyens entre le moment de la sortie de l’essai (moyenne = 24,6, écart-type = 18,6) et l’évaluation de suivi finale (moyenne = 23,7, écart-type = 22,8). En moyenne, le groupe a maintenu un soulagement statistiquement et cliniquement significatif des symptômes du PTSD, suggérant un potentiel d’effet thérapeutique durable de la psychothérapie assistée par la MDMA.
Plus récemment, Mithoefer et al. ont réalisé un essai contrôlé randomisé en double aveugle de phase 2 à trois doses portant sur l’efficacité et la relation dose-réponse de la psychothérapie assistée par la MDMA pour le traitement du PTSD chronique chez le personnel de service, les pompiers, les officiers de police et les vétérans (N=26). Tous les participants avaient un diagnostic de PTSD depuis au moins 6 mois, avaient un score total CAPS de départ ≥50, et n’avaient pas répondu ou toléré des essais antérieurs de pharmacothérapie ou de psychothérapie. Les participants devaient réduire progressivement leur consommation de médicaments psychotropes et ne pas en prendre pendant la durée de l’étude. Les participants ont été répartis au hasard pour recevoir de la MDMA à faible dose (30 mg ; N=7), à dose modérée (75 mg ; N=7) ou à forte dose (125 mg ; N=12) au cours de deux séances de psychothérapie en aveugle, espacées d’un mois. Lors de toutes les séances de MDMA, les participants avaient la possibilité de recevoir une dose supplémentaire correspondant à la moitié de la dose initiale, 1,5 à 2 heures après celle-ci. Pendant les séances de MDMA, deux thérapeutes, un homme et une femme de l’équipe de cothérapie, ont effectué une psychothérapie manuelle à base de MDMA (la même approche de thérapie de soutien non directive que celle utilisée dans l’étude pilote décrite ci-dessus). Le principal critère de jugement était le changement moyen du score CAPS entre le début de l’étude et un mois après la deuxième séance expérimentale de MDMA. Les groupes à dose modérée et à dose élevée ont enregistré des réductions significativement plus importantes de la gravité des symptômes du PTSD par rapport à l’état initial que le groupe à faible dose (groupe à faible dose : -11,4, SD=12,7 ; groupe à dose modérée : -58,3, SD=9,8 ; p=0,0005 ; groupe à dose élevée : -44,3, SD=28,7 ; p=0,004). Aucune différence significative n’a été constatée entre les groupes à dose modérée et à dose élevée (p=0,185). Une rémission a été obtenue chez six des sept participants (86 %) du groupe à dose modérée et chez sept des douze participants (58 %) du groupe à dose élevée, contre deux des sept participants (29 %) du groupe à faible dose. En outre, par rapport au groupe à faible dose, davantage de participants des groupes à dose modérée et à dose élevée ont répondu aux critères de réponse clinique (définie comme une réduction > 30 % du score CAPS par rapport à la valeur initiale) : 29 % dans le groupe à faible dose, 100 % dans le groupe à dose modérée et 67 % dans le groupe à forte dose.
En 2016, la FDA a approuvé le plan des chercheurs du MAPS pour deux essais cliniques de phase 3 portant sur la MDMA pour le traitement du PTSD. En 2017, la FDA a désigné la MDMA comme une ” thérapie révolutionnaire ” sur la base de son utilisation dans l’assistance à la psychothérapie pour le traitement du PTSD, lui accordant une considération prioritaire dans le processus réglementaire.
D’autres essais portant sur l’efficacité de la MDMA dans le traitement de l’anxiété sociale chez les adultes atteints de troubles du spectre autistique et de l’anxiété associée à une maladie potentiellement mortelle ont été menés à bien mais n’entrent pas dans le cadre de la présente analyse.
Comparaison des effets psychologiques et de la neurobiologie des composés psychédéliques
Les psychédéliques classiques se subdivisent en phénéthylamines et en tryptamines. Les tryptamines comprennent l’ergoline synthétique LSD ainsi que les indoleamines d’origine végétale psilocybine et DMT. Les phénéthylamines comprennent la MDMA et la mescaline. Les tryptamines partagent leur structure centrale avec le neurotransmetteur sérotonine (5-HT) et modulent de multiples cibles, notamment les récepteurs 5-HT, les transporteurs de monoamines et les récepteurs associés aux traces d’amines. L’entactogène MDMA (une phénéthylamine) est pharmacologiquement apparenté à la mescaline, à l’amphétamine et à la méthamphétamine. Il agit comme un agoniste de la sérotonine et libère à la fois de la dopamine et de la norépinéphrine. L’anesthésique dissociatif kétamine, qui a des propriétés psychédéliques, est un antagoniste des récepteurs NMDA qui a montré une efficacité antidépressive dans de nombreux essais cliniques et une efficacité dans la diminution des idées suicidaires. Bien qu’elle ne soit pas un psychédélique classique, la kétamine peut provoquer une dissociation en fonction de la dose, des altérations de la perception de la vue et du son, une déréalisation, des effets de type “mystique”, une paranoïa et une confusion passagère.
Les structures moléculaires de la MDMA, de la psilocybine, du LSD, de l’ayahuasca et de la kétamine sont présentées dans la figure 1.
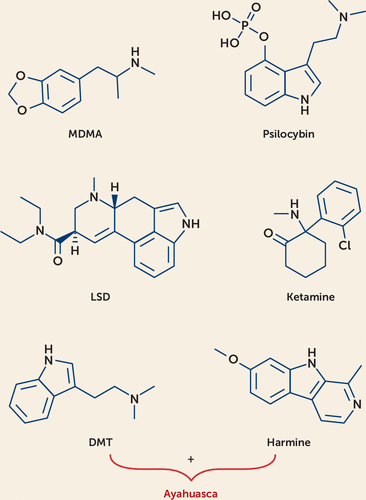
Bien que les structures et les profils pharmacologiques de ces composés soient distincts, les effets psychologiques se recoupent. Des exemples d’effets cognitifs, perceptifs, émotionnels et sociaux des psychédéliques, ainsi que leurs principaux mécanismes d’action pharmacologique, sont présentés dans le tableau 1, organisé par composé selon la classification de Garcia-Romeu et al.
[TABLEAU 1]
Comme le montre le tableau, certains des effets psychologiques des composés psychédéliques classiques, de la MDMA et de la kétamine sont similaires, alors que les principaux processus neurobiologiques sous-jacents sont distincts. Ces profils pharmacologiques divergents permettent de comprendre la neurobiologie des différents effets psychologiques et la possibilité d’utiliser ces différents effets psychologiques dans le traitement des troubles psychiatriques.
Parmi les psychédéliques classiques, le LSD a la plus grande affinité pour le récepteur 5-HT2A (qui est associé aux effets psychoactifs des psychédéliques classiques), et seul le LSD se lie avec une affinité submicromolaire au récepteur adrénergique α1 et a une affinité pour les récepteurs dopaminergiques D1-3. Les modifications de la perception visuelle chez les sujets d’étude ayant ingéré du LSD sont associées à une augmentation de la connectivité fonctionnelle dans le cortex visuel, et les effets sur la conscience (c’est-à-dire le sens du soi) sont corrélés à une diminution de la connectivité entre le parahippocampe et le cortex rétrosplénial au sein du réseau du mode par défaut. Si l’on compare ce profil à celui de la psilocybine, une tryptamine simple, le LSD est 10 à 100 fois plus puissant que la psilocybine au niveau des récepteurs 5-HT1A et 5-HT2 et plus puissant au niveau des récepteurs α-adrénergiques et dopaminergiques, tandis que la psilocybine est un inhibiteur plus puissant du transporteur de la sérotonine.
La structure chimique de l’entactogène MDMA chevauche celle de la méthamphétamine et de la mescaline et a les effets biologiques de l’épinéphrine, de la dopamine et de la sérotonine. Une déréalisation peut se produire chez les personnes qui consomment de la MDMA, mais contrairement aux composés psychédéliques classiques, les hallucinations sont rares. Ce profil pharmacologique entraîne des effets psychologiques qui se recoupent avec ceux des hallucinogènes sérotoninergiques, notamment des émotions positives et de l’euphorie. La MDMA partage les effets autonomes et cardiovasculaires d’une méthamphétamine, tels que l’augmentation de l’énergie, la tachycardie, l’augmentation de la pression artérielle systolique et diastolique et la tachypnée. Si la MDMA est considérée comme un entactogène pour sa capacité à créer un sentiment de proximité ou de connexion avec les autres et à accroître l’empathie émotionnelle, les psychédéliques classiques ont également la capacité d’accroître les sentiments d’ouverture et de confiance.
Les anesthésiques dissociatifs (kétamine, phencyclidine et protoxyde d’azote) ont également des propriétés psychologiques communes avec les psychédéliques classiques (voir tableau 1). Dans la majorité des études récentes sur la dépression, la kétamine a été administrée par perfusion intraveineuse à raison de 0,5 mg/kg pendant 40 minutes, sans psychothérapie d’appoint. Récemment, un sous-groupe de cliniciens a administré de la kétamine par voie sublinguale ou intramusculaire, à des doses relativement plus élevées que celles rapportées précédemment dans la littérature, pour traiter un large éventail de maladies psychiatriques, notamment la dépression, l’anxiété, le PTSD et les questions existentielles. Cette technique est appelée psychothérapie assistée par la kétamine. La psychothérapie assistée par la kétamine n’est pas bien définie à l’heure actuelle et les preuves objectives de son utilisation sont limitées.
La kétamine est un antagoniste du NMDA qui provoque une activation accrue des récepteurs AMPA (acide α-amino-3-hydroxy-5-méthyl-4-isoxazole propionique) et renforce indirectement l’activité dopaminergique (D2) et sérotoninergique (5-HT2). La kétamine réduit la contribution des récepteurs NMDA aux informations afférentes provenant des entrées sensorielles internes et externes et provoque une suractivité glutamatergique, et la désinhibition du cortex limbique renforce indirectement l’activité dopaminergique et sérotoninergique. Bien qu’il y ait eu un débat sur la question de savoir si l’effet antidépresseur aigu de la kétamine nécessite un fonctionnement normal du système opioïde endogène ou une activation du système opioïde, par une action directe et/ou indirecte sur les récepteurs mu-opioïdes, les effets dissociatifs de la kétamine sont principalement attribués à l’antagonisme de ses récepteurs NMDA.
Comme la kétamine, les psychédéliques classiques sont également de puissants modulateurs de l’activité glutaminergique dans les circuits préfrontaux. Vollenweider et Kometer ont comparé la psilocybine, psychédélique classique, à la kétamine et ont montré que les drogues produisaient un ensemble d’effets psychologiques qui se chevauchaient sur l’échelle des états modifiés de conscience à cinq dimensions. La psilocybine a montré des augmentations dose-dépendantes (0,15-0,27 mg/kg par voie orale) dans les dimensions de la restructuration visionnaire (c’est-à-dire les illusions visuelles et les hallucinations), illusions visuelles et hallucinations) et l’absence de limites océaniques (décrite comme un état de béatitude et une expérience d’unité), tandis que la kétamine, de manière dose-dépendante (6-12 μg/kg par minute par voie intraveineuse) a influencé les dimensions de la désintégration anxieuse du moi (décrite comme un sentiment de désincarnation et une altération du contrôle de soi) ainsi que l’imagerie vive et le changement de signification des percepts (c’est-à-dire la restructuration visuelle) et l’expérience de l’unité (par exemple, “absence de limites océaniques”). Ces chercheurs affirment qu’il existe un mécanisme d’action commun qui module la transmission glutaminergique dans le circuit préfrontal-limbique et qui conduit à des adaptations neuroplastiques via le récepteur AMPA, qui sont à la base de l’efficacité antidépressive de la psilocybine et de la kétamine.
Malgré les connaissances sur les profils pharmacodynamiques des psychédéliques, la façon dont ils modifient la conscience et l’humeur reste débattue. Vollenweider suggère que la psilocybine induit des changements métaboliques, y compris l’hyperfrontalité (c’est-à-dire l’augmentation du flux sanguin cérébral vers le cortex préfrontal), et modifie la transmission synaptique thalamocorticale par l’activation des récepteurs 5-HT2A dans la boucle cortico-striato-thalamo-corticale. Vollenweider et ses collègues proposent que la perturbation du gating thalamique désactive le filtrage des informations sensorielles et cognitives, ce qui conduit à des altérations perceptives pendant l’expérience psychédélique. Carhart-Harris et ses collègues suggèrent que la psilocybine et d’autres psychédéliques classiques sont associés à une hypofrontalité (diminution du flux sanguin vers le cortex préfrontal) et à une diminution de la connectivité et de l’activité neuronale dans des régions clés du réseau du mode par défaut immédiatement après l’administration de la drogue. Il propose que ces altérations physiologiques conduisent l’esprit vers un état plus primitif d’entropie ou de désordre qui est supprimé pendant la conscience de veille normale et qui permet de perturber les schémas stéréotypés de pensée et de comportement. Lorsque l’esprit devient plus flexible, l’individu peut remettre en question ses pensées automatiques et développer de nouvelles perspectives.
Les théories de Vollenweider et Carhart-Harris, fondées sur la recherche, ne sont pas exclusives et soulèvent de nouvelles questions sur le rôle de la perfusion cérébrale, du gating thalamique, de la connectivité et de la sérotonine dans les troubles psychiatriques. En outre, elles démontrent comment les profils pharmacologiques uniques et divers des psychédéliques, qui ne se recoupent que partiellement, peuvent être utilisés pour mieux éclairer notre compréhension des neurosciences.
Psychothérapie assistée par les psychédéliques
Le nombre d’études utilisant la psychothérapie assistée par les psychédéliques a augmenté, conduisant à des méthodologies variables d’une étude à l’autre. Les deux paradigmes de psychothérapie les plus utilisés sont la thérapie psycholytique et la thérapie psychédélique. La thérapie psycholytique, qui s’est développée en Europe entre les années 1950 et 1970, a pris la forme d’une thérapie par la parole fondée sur la psychanalyse avec des doses faibles à modérées de LSD (30-200 μg), qui ont été administrées au cours de plusieurs séances. Les séances étaient censées offrir un meilleur accès à l’inconscient dans le but de faciliter une décharge de la tension psychique chargée d’émotion. La thérapie psychédélique, qui s’est développée simultanément aux États-Unis avec les écoles de psychologie existentielle et humaniste, utilisait une thérapie préparatoire suivie d’une ou plusieurs doses élevées d’un psychédélique (>250 μg LSD) pour créer une “expérience bouleversante et transcendante”, qui était ensuite traitée dans le cadre d’une thérapie intégrative après la séance facilitée par la drogue. L’objectif était d’acquérir de nouvelles connaissances sur l’état du patient. Les études récentes sur la MDMA ont utilisé un hybride de thérapie psycholytique et de thérapie psychédélique, et la majorité des études récentes sur la psilocybine ont mis en œuvre des versions de la thérapie psychédélique, qui a récemment été étroitement alignée sur la psychologie transpersonnelle.
La psychothérapie assistée par les psychédéliques, qui comprend le spectre de la thérapie psycholytique et psychédélique, utilise généralement trois types de séances : préparatoires, médicamenteuses (une à trois séances avec des doses modérées à élevées d’un psychédélique), et d’intégration. Au cours des séances préparatoires, le thérapeute ou l’équipe de co-thérapeutes invite le patient à explorer l’histoire de sa vie et à l’aider à comprendre ses symptômes et ses intentions, en mettant l’accent sur le potentiel de croissance émotionnelle et psychologique. Ils informent également le patient sur ce qui l’attend pendant la séance psychédélique et s’efforcent de développer une alliance thérapeutique suffisante. Pendant la séance de médication, le patient est idéalement accompagné par une équipe de cothérapie homme-femme, qui a été largement adoptée dans les études sur la MDMA (104). La dyade homme-femme co-thérapeute maintient l’intégrité et la sécurité de la relation thérapeutique, ce qui ne doit pas être sous-estimé compte tenu des antécédents d’abus sexuels survenus pendant la psychothérapie avec la MDMA dans les années 1980.
La drogue psychédélique est administrée dans une pièce confortable avec un fauteuil ou un lit incliné, dans un environnement décoré et aménagé de manière à ce qu’il soit familier et non intimidant, comme pourrait l’être un cabinet médical ou un laboratoire institutionnel. Après l’ingestion du médicament, le patient est encouragé à concentrer son attention sur lui-même et il lui est proposé d’écouter de la musique et de porter des lunettes de soleil. Pendant les 6 à 8 heures suivantes, les thérapeutes écoutent le patient avec empathie et maintiennent une position thérapeutique neutre et non menaçante. Les effets de la drogue et le contenu des pensées du patient déterminent l’expérience. L’objectif des thérapeutes est de favoriser un sentiment de sécurité, de confiance et d’ouverture (3, 104). Après la séance de médication, pendant les séances d’intégration, les thérapeutes travaillent avec le patient pour interpréter le contenu de l’expérience psychédélique en vue d’un changement significatif à long terme, en identifiant les idées ou en interprétant les pensées ou les idées qui sont apparues pendant la séance psychédélique.
On sait peu de choses sur les processus et mécanismes intrapsychiques par lesquels les drogues psychédéliques sont supposées agir pour faciliter la psychothérapie ou la santé mentale en général. On pense que l’effet thérapeutique est le résultat de l’interaction entre la drogue et l’état d’esprit du patient (ensemble souvent appelé “set”), les conditions extérieures (souvent appelées “setting”) et le(s) thérapeute(s). On estime qu’un cadre et un environnement thérapeutiques réduisent les risques de résultats négatifs, même lorsque des expériences difficiles et douloureuses surviennent. En outre, surmonter une expérience douloureuse est une partie importante du processus thérapeutique, tout comme une “expérience mystique de pointe” peut être et ne doit pas être considérée comme un événement indésirable.
À l’heure actuelle, on ne sait pas si une approche psychothérapeutique est meilleure qu’une autre. Les psychédéliques peuvent être utilisés pour catalyser ou renforcer des thérapies structurées largement acceptées, telles que la thérapie d’exposition prolongée, la thérapie de traitement cognitif et la thérapie d’acceptation et d’engagement, ou des traitements moins structurés, tels que la thérapie dynamique et la psychanalyse. De plus, il n’est pas clair si c’est la drogue psychédélique elle-même, l’expérience psychothérapeutique assistée par les psychédéliques, ou les améliorations facilitées par la drogue dans l’alliance thérapeutique qui favorisent le changement. Bien qu’une association statistique entre les expériences mystiques et la résolution des symptômes ait été rapportée, l’absence d’analyse qualitative des divers éléments des séances de psychothérapie individuelles utilisées en combinaison avec des séances de drogues psychédéliques limite la validité externe et, à son tour, notre compréhension des processus cognitifs ou émotionnels qui conduisent à des résultats favorables.
Le potentiel d’abus
Toutes les drogues examinées ici, à l’exception de la kétamine, sont actuellement classées par la DEA comme substances contrôlées de l’annexe I du Controlled Substances Act (loi sur les substances contrôlées). Comme indiqué précédemment, cette classification a été créée par le Congrès américain en 1970 afin de réduire la disponibilité des drogues d’abus : “Les substances de ce tableau n’ont pas d’usage médical actuellement accepté aux États-Unis, ne sont pas reconnues comme sûres pour une utilisation sous contrôle médical et présentent un fort potentiel d’abus”. L’héroïne, la marijuana, la méthaqualone et la mescaline sont d’autres drogues classées dans cette catégorie. Les drogues psychédéliques sont restées des drogues de l’annexe I pendant près de 50 ans. La kétamine est classée comme une substance de l’annexe III, c’est-à-dire comme une drogue dont l’usage médical est reconnu (par exemple, l’anesthésie) et qui présente un risque d’abus.
En 2010, l’Independent Scientific Committee on Drugs du Royaume-Uni a publié une étude portant directement sur la prévalence et la gravité des effets indésirables des drogues potentiellement abusives sur la base d’une matrice de dommages en neuf catégories. Ils ont obtenu des scores estimant l’ampleur du préjudice global pour les utilisateurs (et pour les autres) pour chaque drogue et substance d’abus. En tête de liste figure l’alcool, avec un score de 72, suivi de l’héroïne, avec un score de 55, puis du crack, avec un score de 54. Les benzodiazépines et la kétamine ont toutes deux un score de nocivité de 15, et la méthadone un score de 13. L’ecstasy, le LSD et la psilocybine se trouvaient en fin de liste avec des scores de nocivité de 9, 7 et 5, respectivement. Cette publication a été extrêmement controversée, même si elle n’a pas été sans soutien, et a finalement conduit au renvoi de l’auteur principal, David Nutt, du Conseil consultatif britannique sur l’abus des drogues (Advisory Council on the Misuse of Drugs). En réponse à ces critiques, Nutt et ses collègues ont affiné leur méthodologie et utilisé une analyse décisionnelle multicritères pour évaluer à nouveau la nocivité des drogues, tant pour l’individu que pour la société. Les résultats sont similaires : l’alcool, l’héroïne et le crack obtiennent les scores de nocivité globale les plus élevés, tandis que l’ecstasy, le LSD et la psilocybine se classent en fin de liste. Étant donné que les scores de nocivité sociétale ont été influencés par des données provenant des coûts économiques, des dossiers de santé, des dossiers de police et de l’approche d’un groupe d’experts, leur généralisation est limitée par la disponibilité des substances analysées dans des pays spécifiques.
Une brochure “DrugFacts” du National Institute on Drug Abuse (NIDA) indique que certains hallucinogènes (par exemple, le PCP) sont potentiellement addictifs et peuvent provoquer un état de manque et une tolérance au fil du temps. Cependant, les hallucinogènes ne sont pas associés à un comportement incontrôlable de recherche de drogue et les animaux ne peuvent pas être entraînés à s’auto-administrer des hallucinogènes. D’autres hallucinogènes (par exemple, le DMT sous forme de thé ayahuasca) n’entraînent pas de dépendance ou de tolérance. L’administration médicale d’hallucinogènes doit prendre en compte le dosage approprié, le dépistage du patient et la préparation adéquate du patient, y compris la préparation et le suivi des séances de psychothérapie assistée par des psychédéliques, conformément à une procédure approuvée basée sur les résultats de la recherche.
Une autre brochure du NIDA DrugFacts reconnaît les résultats des recherches sur le potentiel d’abus de la MDMA chez les animaux, bien qu’à un degré moindre que la cocaïne. Bien que les modèles d’auto-administration de MDMA chez l’animal suggèrent des schémas d’utilisation épisodique à intervalles irréguliers, le potentiel d’abus observé semble être inférieur à celui de l’amphétamine et de la méthamphétamine. L’étude prospective de suivi à long terme de personnes souffrant de PTSD ayant reçu de la MDMA (N=19) indique qu’aucun participant à l’étude n’a développé de problème d’abus de substance (avec une quelconque drogue illicite) au cours de la période de suivi de 7 à 17 mois, ce qui suggère que, au moins dans le cadre de la recherche, la MDMA peut être administrée avec un risque minimal que les patients recherchent et s’auto-administrent par la suite de l'”ecstasy de rue”. Cependant, une évaluation plus poussée des risques à long terme de la MDMA est nécessaire.
Des chercheurs de l’Université Johns Hopkins ont récemment évalué le potentiel d’abus de la psilocybine administrée médicalement et ont déterminé que, si elle était approuvée en tant que médicament, la psilocybine pourrait être classée dans le Tableau IV. Parmi les autres substances actuellement classées dans le tableau IV figurent les benzodiazépines et les hypnotiques, dont le potentiel d’abus et de dépendance est relativement faible.
Les données disponibles plaident en faveur d’un plan de recherche plus approfondi sur le potentiel d’abus des composés psychédéliques, en tenant compte à la fois de leur potentiel thérapeutique et de leur risque d’abus ou de mésusage. Les recherches futures sur les composés psychédéliques devraient inclure des mesures du comportement de recherche de drogue au fil du temps, des dépistages urinaires pour surveiller l’utilisation de drogues illicites, et des efforts pour déterminer quelles populations de patients peuvent être vulnérables au développement de nouveaux troubles liés à l’utilisation de substances (ou à la rechute de troubles préexistants liés à l’utilisation de substances).
Recommandations pour la recherche future
Avec l’intérêt accru pour la recherche psychédélique et la procédure accélérée de la FDA pour les composés psychédéliques, ce serait un moment approprié pour les National Institutes of Health, en conjonction avec la FDA et d’autres agences de financement, comme MAPS, l’Institut Usona, et l’Institut de Recherche Heffter, de mener une série de symposiums internationaux sur la méthodologie des essais cliniques dans la recherche sur les drogues psychédéliques. Sellers et al. ont passé en revue les défis inhérents à la conduite de la recherche sur les drogues psychédéliques, et leur analyse pourrait servir de feuille de route pour ces réunions. Ils décrivent les multiples facteurs de confusion et les biais dans les essais psychédéliques. Ils soulignent la difficulté de l’insu, le manque de données sur la réponse à la dose aiguë et chronique (car les drogues peuvent avoir des effets psychologiques très différents à différentes doses), les préjugés et les attentes des patients (y compris dans les études qui incluent des patients ayant déjà consommé des hallucinogènes et qui n’en tiennent pas compte dans les analyses), les populations de patients très sélectionnées, ce qui limite la généralisation, et l’exclusion des patients présentant des facteurs de risque connus (par exemple, des antécédents personnels ou familiaux de psychose), ce qui limite la compréhension des risques réels des drogues dans les soins cliniques de routine d’une population de patients psychiatriques.
Sellers et al. s’inquiètent également du fait que de nombreuses variables dépendantes des études, telles que l’échelle d’évaluation des hallucinogènes et l’échelle des états de conscience altérés, sont caractérisées de manière incomplète et n’ont pas de validité prédictive ou d’utilité établie. Ils affirment que bon nombre des échelles couramment utilisées dans ces études ne sont pas des mesures validées des résultats rapportés par les patients et qu’il n’a pas été démontré qu’elles constituaient des marqueurs de substitution d’une quelconque mesure des résultats thérapeutiques. Il s’agit là d’une critique juste de nombreuses échelles. Cependant, certaines échelles, comme la MEQ-30, ont été validées dans des études expérimentales avec des doses contrôlées de psilocybine, bien que même la MEQ-30 ait été validée en utilisant une gamme étroite de doses de drogues et en se limitant à un seul composé hallucinogène. Une analyse plus rigoureuse des échelles d’évaluation du traitement est nécessaire pour les qualifier en tant que mesures des résultats du rapport du patient dans les essais cliniques.
La recherche sera également limitée par le fait qu’il n’existe pas actuellement de définition rigoureuse de certaines des techniques cliniques utilisées dans ces essais (par exemple, la psychothérapie assistée par les psychédéliques) et que les attentes et les expériences antérieures des participants en matière de drogues sont des variables importantes dans la réponse à la thérapie assistée par les psychédéliques (6). Les recherches futures devraient également se concentrer sur les profils pharmacodynamiques et pharmacocinétiques de ces agents, en accordant une attention particulière à la relation dose-réponse et aux effets secondaires.
Enfin, il est nécessaire de réaliser davantage d’études sur le potentiel d’abus, en particulier en ce qui concerne les populations plus vulnérables. Ces études seront importantes pour évaluer le risque que ces médicaments peuvent présenter dans le cadre d’une utilisation clinique de routine et pourraient contribuer à répondre aux exigences de la FDA en matière de changement de classification des psychédéliques.
Conclusions
Les preuves scientifiques publiées, bien qu’un peu limitées (tableau 2), soutiennent la poursuite des recherches sur les composés psychédéliques pour le traitement des troubles psychiatriques, mais elles ne soutiennent pas encore l’utilisation de ces médicaments pour les soins aux patients par des praticiens cliniques en dehors du cadre de la recherche.
[TABLEAU 2]
Il y a actuellement une pénurie de nouveaux mécanismes pharmacologiques dans le traitement de nombreux troubles psychiatriques, et certains commentateurs ont appelé à une “pharmacologie perturbatrice” pour étudier de nouveaux traitements avec de nouveaux mécanismes en utilisant des médicaments qui ont été précédemment restreints par la FDA, y compris les agents psychédéliques. Tout en soutenant la recherche sur les applications médicales de ces composés, nous sommes réalistes quant à la nécessité de mener davantage d’essais cliniques utilisant une méthodologie rigoureuse et validée dans des environnements contrôlés, afin de répondre aux préoccupations concernant le potentiel d’abus de substances et de séquelles médicales et psychiatriques importantes chez les populations vulnérables. La recherche a été entravée par le fait qu’il n’existe pas de définition rigoureuse de la psychothérapie assistée par les psychédéliques et par le fait que les attentes et les expériences personnelles des sujets de l’étude sont des variables importantes dans la réponse à la thérapie assistée par les psychédéliques. Ces variables peuvent être difficiles à prendre en compte dans un essai clinique, mais elles devraient faire partie du futur programme de recherche.
La désignation par la FDA de la MDMA pour le traitement du PTSD et de la psilocybine pour le traitement de la dépression reflète le potentiel de ces médicaments à traiter les troubles psychiatriques résistants. Des essais récents ont également montré que la psilocybine pouvait être efficace pour traiter les troubles anxieux, les troubles liés à l’utilisation de substances et la souffrance émotionnelle associée à la fin de vie. Les données de la recherche clinique sur la psilocybine sont particulièrement intéressantes, car elles montrent que plusieurs séances de psychothérapie assistée par la psilocybine peuvent avoir des effets antidépresseurs qui persistent pendant des semaines, voire des mois. Cette modalité de traitement pourrait offrir un avantage thérapeutique par rapport aux normes de soins actuelles, telles que la stimulation magnétique transcrânienne, la thérapie électroconvulsive ou la thérapie par infusion de kétamine, qui nécessitent chacune plusieurs visites par semaine pour obtenir un effet antidépresseur et souvent plusieurs visites par mois pour maintenir la rémission. Bien que le LSD et l’ayahuasca disposent actuellement de moins de preuves scientifiques à l’appui de leur utilisation dans le cadre clinique, les données disponibles au moment de la présente étude plaident clairement en faveur de futurs essais contrôlés visant à évaluer leur efficacité et leur innocuité.
Il est préoccupant de constater que l’utilisation de ces composés semble aller plus vite que la recherche fondée sur des données probantes. La pratique du microdosage de LSD ou de psilocybine, qui consiste à prendre de faibles doses de psychédéliques en dessous du seuil de perception à intervalles réguliers (environ une fois tous les 3 à 5 jours) pour améliorer la créativité, la productivité, l’humeur ou l’alliance thérapeutique, est devenue de plus en plus populaire ces dernières années. La popularité croissante du microdosage dans la population générale (non psychiatriquement malade) soulève des questions supplémentaires sur les psychédéliques qui pourraient être rencontrées dans la pratique clinique.
Dans son autobiographie de 1979 intitulée LSD : My Problem Child, Albert Hofmann décrit ses inquiétudes quant à l’enthousiasme excessif que pourrait susciter le LSD au sein du public : “Cette joie d’avoir donné naissance au LSD a été ternie après plus de dix ans de recherche scientifique ininterrompue et d’utilisation médicale lorsque le LSD a été emporté par l’énorme vague d’une manie de l’ivresse qui a commencé à se répandre dans le monde occidental, et surtout aux États-Unis, à la fin des années 1950”. À l’époque, l’usage récréatif du LSD augmentait et avait des conséquences sociétales qui ont conduit à restreindre la recherche sur ces composés psychédéliques potentiellement prometteurs pour le traitement des troubles psychiatriques. Les drogues psychédéliques ont acquis une réputation négative lorsqu’elles ont été mises à la disposition du public par des voies clandestines, sans indication médicale ni réglementation. Le corpus de données naissant examiné ici devrait être exploité pour informer la recherche de la prochaine étape qui pose des questions significatives sur le potentiel thérapeutique et le potentiel d’abus de la psychothérapie assistée par les psychédéliques dans des essais cliniques standardisés, ainsi que sur les effets thérapeutiques et indésirables potentiels des drogues psychédéliques utilisées en monothérapie.
Ce domaine de recherche, qui implique des médicaments ayant des actions pharmacologiques différentes de celles associées aux antidépresseurs actuels, a le potentiel de faire progresser notre compréhension des processus neurobiologiques et des résultats thérapeutiques obtenus par les patients souffrant d’une variété de troubles de l’humeur et du spectre anxieux. Comme nous l’avons souligné, les méthodologies d’étude présentent des limites importantes, et les preuves disponibles comprennent l’utilisation d’échantillons non représentatifs (par rapport à la population générale) par l’auto-sélection des individus dans les essais cliniques qui peuvent être biaisés pour attendre des effets bénéfiques, y compris l’expérience mystique liée à l’ingestion de psychédéliques ; des études croisées plutôt que des études en groupes parallèles, empêchant les comparaisons entre les groupes pour les résultats du suivi à long terme avec les participants ayant reçu un placebo ; des incohérences dans le dosage des médicaments entre les études ; et des méthodes d’aveuglement compromises par les effets prononcés des interventions psychédéliques. Malgré ces limites, les données préliminaires sur le potentiel thérapeutique des drogues psychédéliques justifient la poursuite des recherches.
