Strang, J., Volkow, N. D., Degenhardt, L., Hickman, M., Johnson, K., Koob, G. F., … & Walsh, S. L. (2020). Opioid use disorder. Nature reviews Disease primers, 6(1), 3.
Abstract.
Le trouble de l’usage des opioïdes (OUD) est un trouble chronique récidivant qui, s’il est initialement dû à l’activation des neurocircuits de récompense du cerveau, engage de plus en plus les neurocircuits d’antirécompense qui entraînent des états émotionnels négatifs et des rechutes. Cependant, un traitement approprié permet de se rétablir, même si la propension à la rechute persiste. Le fardeau de l’OUD sur la santé individuelle et publique est immense ; on estimait à 26,8 millions le nombre de personnes vivant avec l’OUD dans le monde en 2016, avec >100 000 décès par overdose d’opioïdes par an, dont >47 000 aux États-Unis en 2017. Des essais bien menés ont démontré que le traitement agoniste opioïde à long terme par la méthadone et la buprénorphine est très efficace pour le traitement de l’OUD et peut sauver des vies. De nouvelles formes de naltrexone, un antagoniste des récepteurs opioïdes, sont également à l’étude. Certaines approches fréquemment utilisées disposent de preuves moins solides sur le plan scientifique mais sont néanmoins considérées comme importantes, notamment les stratégies préventives communautaires, les interventions de réduction des risques visant à réduire les séquelles de la consommation continue et les groupes d’entraide. D’autres approches fréquemment utilisées, comme la désintoxication seule, manquent de preuves scientifiques. La mise en œuvre de mesures de prévention et de traitement efficaces est souvent compliquée par des comorbidités coexistantes et un soutien insuffisant, ainsi que par des opinions publiques et politiques contradictoires. La science a un rôle crucial à jouer pour éclairer les attitudes du public et développer des preuves plus complètes pour comprendre l’OUD et ses méfaits, ainsi que pour obtenir aujourd’hui les preuves qui amélioreront les interventions de prévention et de traitement de demain.
Notre compréhension du trouble de l’usage des opioïdes (OUD) est compliquée par les fortes opinions publiques et politiques sur les comportements de consommation de drogues. Il est donc particulièrement important d’utiliser la science pour guider notre réponse au fardeau mondial que représente ce trouble (Fig. 1), pour comprendre l’étiologie de l’OUD et pour examiner de manière critique les preuves scientifiques de l’effet des interventions. L’OUD est désormais reconnu comme un trouble chronique récidivant dont il est néanmoins possible de se rétablir avec succès tout en restant attentif à la propension à la rechute. Ce trouble peut impliquer l’utilisation d’opiacés sous forme de composés naturels tels que la résine du pavot à opium (utilisée pour obtenir la morphine ou la codéine), d’opioïdes pharmaceutiques synthétiques ou semi-synthétiques (tels que l’hydrocodone ou l’oxymorphone), et de substances fabriquées ou distribuées illicitement (telles que l’héroïne, le fentanyl et ses analogues). L’utilisation d’opioïdes en dehors de leurs applications cliniques appropriées (c’est-à-dire dans la gestion de la douleur aiguë sévère ou de l’anesthésie) est un problème de santé publique important étant donné la dépendance potentielle de ces médicaments, l’étendue des dommages associés (tels que les décès par surdose) et les séquelles potentielles des comportements de consommation de drogues (par exemple, l’infection et la transmission du VIH et du virus de l’hépatite C (VHC), l’endocardite bactérienne et le syndrome d’abstinence néonatale). En outre, la consommation d’opioïdes en dehors des indications cliniques est associée à des coûts sociétaux plus larges, tels que des atteintes à la cohésion familiale, une réduction de l’emploi et de la contribution économique, ainsi qu’un risque et des coûts accrus de criminalité (à la fois du fait du marché illégal des drogues en soi et des individus qui recourent à la criminalité pour financer leur consommation de drogues).
Au cours des dernières décennies, la compréhension des mécanismes qui sous-tendent le développement de la dépendance, de l’accoutumance et d’autres complications liées à la consommation d’opioïdes s’est considérablement améliorée, et l’on comprend mieux la nature interconnectée par laquelle les méfaits sont associés aux comportements de consommation de drogues. On comprend mieux l’OUD comme un trouble biopsychosocial dans lequel des facteurs génétiques, un développement précoce défavorable, des maladies mentales, des normes sociales, l’exposition aux drogues et la disponibilité sur le marché peuvent influencer le degré d’exposition et la possibilité de consommer des drogues, ainsi que la progression et le développement de l’OUD et des méfaits associés. En effet, les influences polygéniques sur la transmission familiale observée sont de plus en plus identifiées, les effets des drogues sur le cerveau et la nature des circuits neuronaux qui sous-tendent les comportements aberrants dans la dépendance peuvent être imagés et mesurés, les facteurs qui protègent de la progression de l’OUD ou qui l’aggravent peuvent être reconnus, et les influences qui créent des épidémies de drogues spécifiques à des moments particuliers dans le temps, l’espace et le contexte peuvent être comprises.
Il existe une diversité de cibles pour les interventions potentielles contre l’OUD, y compris les initiatives de prévention primaire, qui ciblent la première consommation et comprennent des interventions visant à renforcer la résilience et à atténuer les vulnérabilités, et les initiatives qui ciblent la progression vers la consommation régulière et la dépendance. D’autres interventions portent sur le développement de la tolérance et la gestion des phénomènes de sevrage ou de la force motrice de l’état de manque. Une autre cible peut être la prévention des transitions critiques pour la santé (comme le passage de la consommation orale ou par inhalation à la consommation de drogues injectables) ou l’inversion ou la diminution des pratiques nocives qui semblent bien ancrées, une approche souvent appelée réduction des risques. Les interventions peuvent également porter sur les effets sur une famille endommagée, le traitement des comorbidités médicales (y compris les maladies mentales), l’emploi et la contribution à la société, y compris la réintégration des personnes prises dans le système de justice pénale.
Plusieurs traitements dont l’efficacité et l’efficience ont été prouvées sont disponibles pour l’OUD. La solidité des preuves varie, tout comme l’ampleur des effets observés1-3. Les traitements de l’OUD comprennent plusieurs stratégies pharmacologiques (agonistes des récepteurs μ-opioïdes comme la méthadone, agonistes partiels comme la buprénorphine, antagonistes comme la naltrexone, et autres approches comme la lofexidine pour gérer le sevrage). Les interventions de réduction des risques, qui visent à réduire les dommages causés par une consommation continue, comprennent les programmes d’échange d’aiguilles et de seringues, la distribution de naloxone pour inverser le cours d’une surdose, les tribunaux pour toxicomanes et d’autres programmes de déjudiciarisation. D’autres interventions existent également en dehors de la pratique médicale courante, notamment les groupes d’entraide et les maisons de réhabilitation résidentielles, bien que ces interventions, en général, n’aient pas été soumises au même degré d’examen rigoureux de la recherche. Il a été démontré que certaines approches psychologiques, psychosociales et comportementales produisent des bénéfices indépendants et, dans certains cas, agissent en synergie avec les approches pharmacologiques. En outre, les interventions au niveau de la société et des politiques publiques influencent l’ampleur de l’OUD et des dommages associés, ce qui nécessite de prêter attention à des questions de macro-niveau telles que les pratiques de prescription médicale pour le soulagement de la douleur ainsi que les politiques de justice pénale, les stratégies de répression et d’interdiction. Le domaine de l’OUD illustre bien la nécessité d’intégrer les approches thérapeutiques individuelles, la santé publique et les politiques publiques.
Cet abécédaire traite de l’épidémiologie changeante de l’OUD ainsi que des efforts déployés pour améliorer la prévention et le traitement de ce trouble. Il aborde également les mécanismes biologiques et sociaux qui sous-tendent le développement de l’OUD et traite de la manière dont ce trouble affecte les patients, leurs pairs et la société en général.
Épidémiologie.
Prévalence
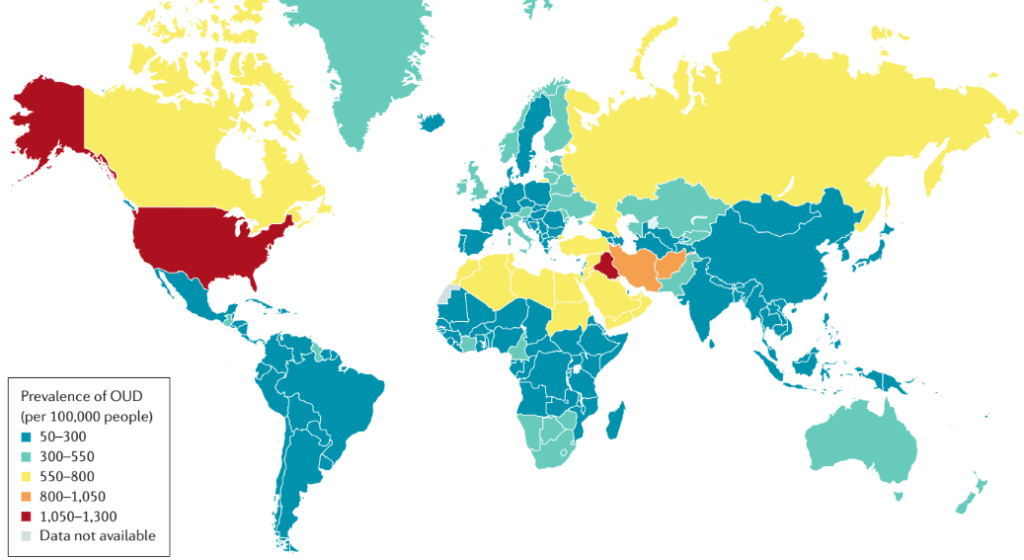
L’estimation précise de la prévalence de l’OUD dans la population est un défi, en particulier dans les pays où la consommation de drogues illicites peut conduire à l’incarcération et où la confidentialité est absente ou la divulgation pourrait déclencher des représailles. Malgré ces lacunes, diverses méthodes imparfaites peuvent être utilisées pour estimer la prévalence, notamment les enquêtes sur les ménages auprès de populations non institutionnalisées et les approches de capture-recapture. La disponibilité et la qualité des données sur l’OUD varient géographiquement, ce qui rend les estimations de prévalence incertaines pour de nombreux pays. Dans l’étude de 2016 sur la charge mondiale de morbidité, on estime que 26,8 millions de personnes vivent avec le syndrome de la surdose d’alcool dans le monde ; la prévalence standardisée par âge du syndrome de la surdose d’alcool varie considérablement d’un pays à l’autre. considérablement selon les pays, la prévalence estimée la plus la plus élevée a été observée aux États-Unis (figure 1).
Types de consommation de drogues
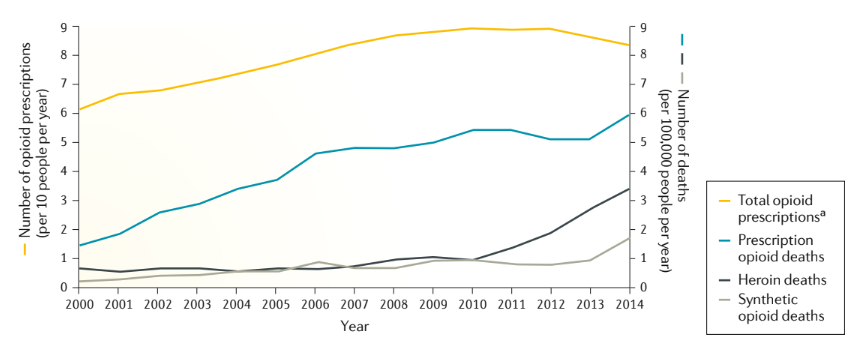
Les types d’opioïdes utilisés et les voies d’administration typiques varient selon les pays et ont évolué au fil du temps. Par exemple, l’opium (fumé ou ingéré) était historiquement l’opioïde le plus couramment consommé dans les pays du Moyen-Orient, comme en Iran, bien que l’injection d’opioïdes soit devenue une caractéristique plus importante de l’usage illicite d’opioïdes en Iran au cours des dernières décennies. En revanche, la consommation d’opioïdes sur ordonnance est plus courante en Amérique du Nord ; aux États-Unis, les prescriptions d’analgésiques opioïdes ont quadruplé entre 1999 et 2010, avec une forte augmentation des décès au cours de la même période (figure 2). En 2015, 37,8 % des adultes aux États-Unis ont utilisé des opioïdes sur ordonnance au cours de l’année précédente, 4,7 % se sont livrés à un usage non médical des opioïdes (c’est-à-dire un usage en dehors des indications d’un médecin) et on estime que 0,8 % avaient un MSO sur ordonnance. Parallèlement à l’augmentation de la consommation d’opioïdes sur ordonnance, la consommation d’héroïne aux États-Unis est en hausse depuis au moins 2002, l’éventail des efforts visant à restreindre la disponibilité des opioïdes prescrits ainsi que la disponibilité accrue d’héroïne de grande pureté et à faible coût ayant probablement contribué à cette augmentation depuis 2010. Les enquêtes de population suggèrent que la prévalence de l’usage d’héroïne au cours de la vie aux États-Unis est passée de 0,33 % en 2001-2002 à 1,6 % en 2012-2013. En outre, il existe des preuves d’une augmentation spectaculaire de l’utilisation d’opioïdes synthétiques (y compris le fentanyl illicite) aux États-Unis, avec une augmentation estimée à plus de six fois le nombre de décès par surdose causés par des opioïdes synthétiques entre 2013 (~3 105 décès) et 2016 (~20 000).
L’évolution de l’OUD
La probabilité de développer un OUD à la suite de l’utilisation d’opioïdes est élevée par rapport à la plupart des autres drogues. Certaines personnes sont très vulnérables aux OUD suite à l’utilisation d’opioïdes, tandis que d’autres ne développent pas d’OUD et arrêtent dans l’année qui suit la première utilisation. Il existe des témoignages anecdotiques de personnes qui parviennent à consommer des opioïdes de manière peu fréquente (comme les personnes qui s’adonnent au ” chipping “, défini comme la consommation occasionnelle d’héroïne ou d’autres opioïdes illicites), mais qui restent exposées au risque de contracter des infections virales transmises par le sang (et à la morbidité et à la mortalité qui en découlent), même si d’autres problèmes sanitaires et sociaux associés à l’OUD ne se développent pas.
De nombreuses personnes qui développent l’OUD présentent une évolution chronique rémittente du trouble. Les données provenant de cohortes de personnes dépendantes à l’héroïne suggèrent qu’elles peuvent entrer et sortir de l’OUD actif pendant des années ou des décennies, entrecoupées de périodes d’exposition au traitement, d’incarcération et d’abstinence. L’évolution souvent chronique et dynamique de la maladie expose également les personnes souffrant d’OUD à un risque accru d’effets indésirables graves à des moments importants ; par exemple, les périodes de risque accru d’overdose, de suicide et de blessures surviennent après la reprise de la consommation après une période d’abstinence, comme pendant l’induction du traitement, après l’arrêt du traitement et après la sortie de prison.
Il est difficile d’estimer la proportion de personnes qui consomment des opioïdes et ne développent pas d’OUD ou de celles qui consomment pendant de courtes périodes par rapport à celles qui consomment de façon chronique. Les enquêtes de population ont tendance à échantillonner des personnes qui ont cessé de consommer des opioïdes et qui n’ont peut-être pas développé d’OUD, alors que les études de cohorte sur les personnes qui consomment des opioïdes surreprésentent les personnes ayant un OUD et des périodes d’utilisation prolongées. Dans une petite étude menée au Royaume-Uni, environ deux tiers des personnes qui utilisaient des opioïdes ont déclaré un usage chronique, tandis qu’un tiers ont déclaré un usage aigu. La durée moyenne de l’OUD est incertaine et peut varier selon les populations et les environnements, certaines cohortes indiquant que la durée moyenne pourrait être >10-20 ans. Cette incertitude complique les estimations de la population totale de personnes utilisant des opioïdes et les modèles de l’effet de différentes interventions pour prévenir les dommages liés aux opioïdes.
Facteurs de risque de l’OUD
Une interaction complexe de facteurs de risque structurels, sociaux, développementaux et comportementaux joue probablement un rôle dans le développement de l’OUD. La plupart de nos connaissances sur les facteurs de risque de l’OUD proviennent d’études rétrospectives sur des populations en traitement plutôt que d’études prospectives, bien que, compte tenu de la forte prévalence de ce trouble et de l’attention accrue qu’il a reçue aux Etats-Unis, une série d’enquêtes de population aient été menées. L’OUD a une héritabilité modérée à élevée ; l’implication des facteurs génétiques est discutée plus en détail dans la section Mécanismes/pathophysiologie ci-dessous.
Un facteur de risque important pour l’OUD et les décès par overdose est la disponibilité et le volume des prescriptions d’analgésiques opioïdes. La disponibilité des opioïdes à des fins analgésiques varie considérablement à travers le monde et il n’est pas surprenant que les pays qui ont des taux de prescription d’opioïdes beaucoup plus élevés aient des taux plus élevés d’utilisation non médicale et de décès par surdose d’opioïdes, comme en Amérique du Nord, en Europe occidentale et en Australie. En effet, les États-Unis et le Canada ont connu une épidémie de prescription d’opioïdes, qui a été l’un des moteurs de l’actuelle urgence de santé publique que constitue l’OUD. Par exemple, en 2012, il y avait suffisamment de prescriptions d’opioïdes aux États-Unis (~259 millions) pour que “chaque adulte aux États-Unis ait un flacon de pilules”. Cette situation est due, en partie, aux efforts de lobbying pour que la douleur soit considérée comme le cinquième signe vital et que la douleur chronique soit traitée de manière agressive avec des opioïdes sur ordonnance. En effet, des organismes de réglementation tels que la Joint Commission for Hospital Accreditation ont publié en 2001 de nouvelles normes sur la douleur, qui approuvaient la campagne “La douleur est le cinquième signe vital” et incitaient les prestataires de soins à identifier et à traiter davantage la douleur, notamment à l’aide d’opioïdes sur ordonnance. En outre, le marketing agressif et, dans certains cas, trompeur des opioïdes pour la prise en charge de la douleur chronique non cancéreuse (définie dans les directives de 2016 des Centers for Disease Control and Prevention comme une douleur durant >3 mois) par les sociétés pharmaceutiques a encouragé la prescription d’opioïdes à travers les États-Unis. La commercialisation directe de produits opioïdes auprès des médecins a été associée à une augmentation de la prescription d’opioïdes au niveau des prestataires, qui a elle-même été corrélée aux taux de mortalité par surdose d’opioïdes au niveau des comtés. Ces efforts ont créé d’importantes variations géographiques dans la prescription d’opioïdes et certains cas de prescription criminelle par des médecins. Les conséquences de cette surprescription ont été graves. La vente sur ordonnance d’opioïdes pour le traitement de la douleur a augmenté parallèlement à l’augmentation des décès liés aux opioïdes (figure 2), avec plus de 165 000 décès aux États-Unis entre 1999 et 2014.
Les facteurs sociaux et contextuels qui augmentent le risque de consommation de substances illicites en général sont également des facteurs de risque de consommation non médicale d’opioïdes sur ordonnance ou illicites, et comprennent la disponibilité des médicaments, les facteurs de stress social, la consommation de substances par les pairs, les troubles de l’humeur et les normes sociales tolérant la consommation de substances. En particulier, l’affiliation à des pairs antisociaux et à ceux qui consomment des drogues est l’un des plus forts prédicteurs de la consommation de drogues illicites chez les adolescents, ce qui fonctionne probablement indépendamment des facteurs de risque individuels et familiaux. Le milieu socio-économique est un autre corrélat important de la consommation de drogues illicites, les personnes issues de milieux plus défavorisés étant plus susceptibles de consommer et d’abuser des opioïdes illicites et sur ordonnance. Plusieurs facteurs familiaux augmentent le risque de consommation de drogues illicites à l’adolescence, comme la mauvaise qualité des interactions (négligence) et des relations parents-enfants, les conflits parentaux, la maltraitance (abus) pendant l’enfance, l’incarcération des parents et la consommation de drogues par les parents et les frères et sœurs.
Les facteurs de risque individuels pour l’OUD comprennent le sexe masculin, les troubles d’extériorisation dans l’enfance (tels que le trouble des conduites), les mauvais résultats scolaires, le faible engagement envers l’éducation et le non-achèvement de l’enseignement secondaire. En outre, on reconnaît de plus en plus l’importance potentielle des troubles mentaux concomitants, tels que la dépression et le syndrome de stress post-traumatique, et des problèmes de santé physique, tels que la douleur chronique non cancéreuse, dans le développement de l’OUD, tant dans le contexte d’un traitement médical qu’en dehors. Ces facteurs de risque coïncident souvent, ce qui augmente le risque d’OUD ; par exemple, parmi les personnes souffrant de douleurs chroniques non cancéreuses à qui l’on a prescrit des opioïdes, celles qui présentaient un plus grand nombre de comorbidités (comme une dépression majeure) avaient un plus grand risque de recevoir des doses plus élevées d’opioïdes et de développer un OUD (appelé sélection adverse).
Parmi les troubles de l’extériorisation, les problèmes de comportement dans l’enfance et au début de l’adolescence sont une voie clé vers la consommation de substances chez les jeunes et sont une caractéristique de l’apparition de l’OUD. En effet, dans une étude cas-témoins, les personnes qui s’injectent des opioïdes étaient plus de quatre fois plus susceptibles d’avoir connu des problèmes de comportement précoces suffisamment graves pour être connus, dans la plupart des cas, des services sociaux locaux. En outre, il existe des preuves cohérentes que la prévalence des abus physiques et sexuels pendant l’enfance est plus élevée chez les personnes ayant des antécédents de consommation d’opioïdes ; cependant, la qualité des preuves n’est pas solide en raison du manque d’études solides. Plus largement, on suppose que l’OUD pourrait se développer chez certaines personnes comme une forme d’automédication pour les troubles de l’humeur et de l’anxiété, bien que le fait que la consommation d’opioïdes puisse précipiter ces troubles rende difficile le démêlage de ces voies mécanistiques. La contribution des facteurs structurels à l’usage non médical des opioïdes, tels que le manque d’opportunités économiques et l’érosion du capital social, est également mal définie.
Les facteurs de risque d’OUD sont susceptibles de varier d’un pays à l’autre, bien que peu d’études aient directement examiné ce point. Une étude qui a évalué l’initiation et la progression vers la dépendance aux drogues illicites dans 17 pays a démontré qu’un début de consommation plus précoce, la consommation de plus de types de drogues illicites et le fait d’avoir déjà développé des troubles d’externalisation ou d’internalisation prédisaient le développement de la dépendance chez les personnes qui consomment des drogues.
Charge de morbidité et séquelles de l’OUD
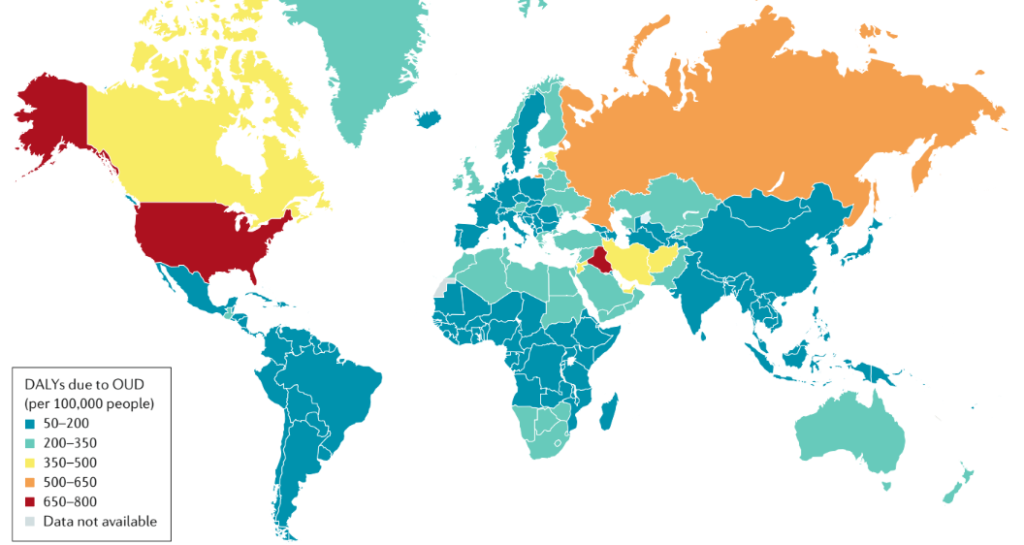
Plusieurs conséquences de l’utilisation d’opioïdes prescrits et non médicaux représentent un fardeau substantiel pour l’individu, sa famille et la communauté au sens large. Par exemple, l’OUD lui-même représente un lourd fardeau pour la santé en raison de l’incapacité associée à l’OUD et du risque d’overdose. La charge sanitaire liée à l’OUD varie considérablement d’un pays à l’autre, la charge la plus élevée étant observée aux États-Unis (figure 3).
L’évolution rapide et préoccupante des types d’opioïdes consommés dans certains pays (comme les États-Unis et le Canada) a considérablement augmenté le risque de surdose d’opioïdes et de mortalité liée aux opioïdes. Par exemple, depuis 2010 aux États-Unis, les décès dus aux opioïdes prescrits sont restés relativement constants, alors que les décès par surdose liés aux opioïdes illicites ont considérablement augmenté ; cet effet a d’abord été attribué à l’héroïne mais plus récemment au fentanyl (Fig. 2). Ce dernier point est très préoccupant étant donné la pénétration généralisée de l’adultération du fentanyl sur le marché des drogues illicites en Amérique du Nord et les preuves suggérant que de nombreuses personnes qui subissent une surdose d’opioïdes due au fentanyl pourraient avoir consommé ce médicament sans le savoir.
Par rapport à la population générale, les personnes qui ont développé une OUD courent un risque accru de subir toute une série d’autres méfaits sociaux et sanitaires, notamment l’incarcération, les blessures, le suicide, l’homicide et les infections par des virus transmissibles par le sang (tableau 1). Aux États-Unis, le nombre de cas déclarés d’infection aiguë par le VHC a doublé entre 2011 et 2015, et de multiples épidémies de VHC aiguës parmi les personnes qui s’injectent des opioïdes sur ordonnance ont été signalées. De même, le nombre de cas de syndrome d’abstinence néonatale aux opioïdes (terme utilisé pour décrire un ensemble de signes et de symptômes chez les nourrissons en sevrage de médicaments opioïdes) est passé de 1,20 pour 1 000 naissances vivantes en l’an 2000 à 3,39 en 2009, tandis que le pourcentage de jours passés en soins intensifs en raison du syndrome d’abstinence néonatale est passé de 0,6 % à 4,0 % entre 2004 et 2014.
En outre, le taux d’accidents de la route, de chutes, de noyades et de blessures connexes est plus élevé chez les personnes atteintes d’OUD que dans la population générale. Par exemple, une étude a révélé que les estimations regroupées des taux bruts de mortalité liés aux blessures accidentelles et aux suicides étaient très similaires (0,1 pour 100 personnes-années dans les deux cas ; IC à 95 % : 0,1-0,2)84.
De plus, par rapport à la population générale du même âge et du même sexe, le taux de blessures accidentelles était 6,9 fois plus élevé (IC à 95 % : 4,4-10,6) et celui du suicide 7,9 fois plus élevé (IC à 95 % : 5,7-11,0) chez les personnes atteintes d’OUD. Les taux de tentatives de suicide autodéclarées chez les personnes atteintes d’OUD sont également beaucoup plus élevés que chez leurs pairs du même âge, du même sexe et du même statut socio-économique. Cette association peut être médiée par la dépression, dont les taux sont plus élevés chez les personnes souffrant d’OUD.
À l’échelle mondiale, les opioïdes sont le principal type de drogue injectée, et on estime qu’ils sont utilisés par environ 80 % des personnes qui s’injectent actuellement des drogues, bien que l’étendue de la consommation de drogues injectables chez les personnes souffrant d’OUD soit susceptible de varier considérablement d’une région à l’autre. À l’échelle mondiale, on estime que 52,3 % des personnes qui s’injectent actuellement des drogues ont été exposées au VHC (anti-VHC positif, UI 42,4-62,1 %), 9,0 % ont une infection chronique par le virus de l’hépatite B (VHB ; antigène de surface de l’hépatite B positif, UI 5,1-13,2 %) et 17,8 % vivent avec une infection par le VIH (UI 10,8-24,8 %). Les infections chroniques et non traitées par le VIH, le VHB et le VHC sont à l’origine d’une mortalité prématurée et d’un handicap considérables ; en particulier, on pense que la consommation de drogues injectables est responsable d’une part importante de la charge due au VHC dans le monde. L’injection de drogues non stériles augmente également le risque d’une série d’autres blessures et maladies liées à l’injection, telles que la thrombose, la cellulite et l’endocardite bactérienne.
Mécanismes/pathophysiologie
L’abus d’agonistes μ-opioïdes annule la fonction de récompense des opioïdes endogènes, entraîne une tolérance et un sevrage par le biais d’altérations dans les systèmes de récompense, de stress cérébral et de douleur, et engage les voies glutamatergiques du cortex frontal et de l’allocortex pour susciter le besoin. L’administration chronique d’opioïdes génère une réactivité intense aux signaux conditionnés par les opioïdes, tout en produisant une hyperalgésie et une hyperkatifeia (détresse émotionnelle accrue chez les personnes souffrant d’OUD pendant le sevrage), ainsi qu’une réactivité intense aux signaux conditionnés par le sevrage des opioïdes, ce qui entraîne un comportement prononcé de recherche de drogues via des processus de renforcement négatif qui exacerbent la compulsion de la prise de drogues dans la dépendance aux opioïdes. Le retour de ces circuits motivationnels d’un point de consigne hédonique négatif allostatique à un point de consigne hédonique positif homéostatique grâce à l’utilisation de médicaments contre l’OUD (MOUD) permet de renforcer la fonction exécutive, y compris l’autorégulation, et d’améliorer l’humeur, facilitant ainsi la guérison de la dépendance aux opioïdes.
Les conclusions concernant les mécanismes de l’OUD sont tirées d’études animales et humaines, avec un effort explicite dans les modèles animaux pour reproduire les comportements humains. Toutes les données comportementales et les cadres neuroanatomiques et fonctionnels abordés dans cette section sont issus d’études précliniques (principalement chez les rongeurs) et cliniques d’imagerie cérébrale, ainsi que de quelques études génétiques humaines. Par souci de clarté, les études humaines seront désignées dans le texte. L’application à l’homme des progrès réalisés dans le domaine de la neurocirculation, de la neurochimie et de la biologie moléculaire l’homme reste un défi important pour les progrès futurs dans le diagnostic, la prévention et le traitement de l’OUD.
Les étapes du cycle de l’addiction
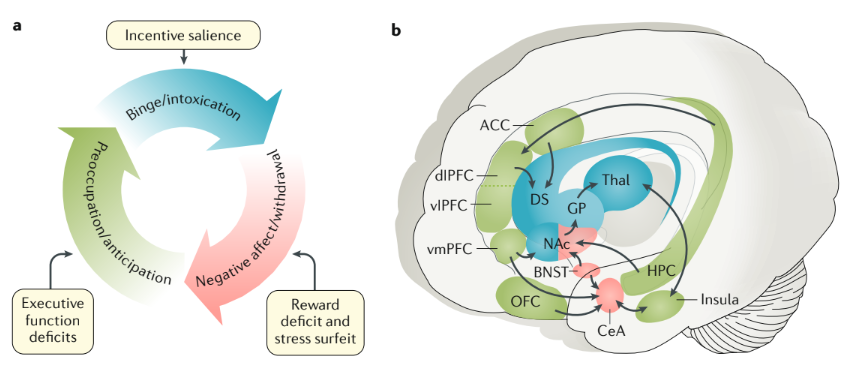
La dépendance aux opioïdes peut être définie comme une compulsion à rechercher et à prendre un médicament opioïde, une perte de contrôle pour limiter la prise de médicament et le développement d’un état émotionnel négatif (hyperkatifeia) lorsque le médicament opioïde n’est pas disponible. En se basant sur des cadres conceptuels dérivés de la neurobiologie des modèles animaux, des études cliniques d’imagerie cérébrale et de la psychologie sociale, on a émis l’hypothèse d’un cycle en trois étapes de l’OUD, comprenant les phases de frénésie/intoxication, de sevrage/affect négatif et de préoccupation/anticipation. Ces trois stades représentent un dérèglement dans trois domaines fonctionnels qui sont médiés par trois grands neurocircuits : le stade de la frénésie/intoxication représente un dysfonctionnement de la saillance des incitations/des habitudes pathologiques et est médié par les ganglions de la base ; le stade du sevrage/affect négatif représente des états émotionnels négatifs et est médié par l’amygdale étendue ; et le stade de la préoccupation/anticipation représente un dysfonctionnement de la fonction exécutive, qui est médié par le cortex préfrontal (CPF). La consommation excessive de drogues au stade de l’ivresse et de l’intoxication entraîne un processus de type allostatique qui génère le stade de sevrage et d’affect négatif et le stade de préoccupation et d’anticipation. En cas d’exposition chronique à la drogue, les trois phases s’alimentent mutuellement, s’intensifient et conduisent finalement à la dépendance (Fig. 4).
Peptides opioïdes endogènes
La dépendance aux opioïdes implique le détournement du système opioïde endogène, un système neuromodulateur complexe composé d’une famille de peptides opioïdes endogènes (β-endorphines, enképhalines et dynorphines) et de récepteurs. Les opioïdes endogènes ont un précurseur polypeptidique distinct et une distribution différentielle mais qui se chevauche dans tout le cerveau, et subissent une liaison préférentielle aux trois récepteurs opioïdes : Les récepteurs μ-opioïdes (endorphines), les récepteurs δ-opioïdes (enképhalines) et les récepteurs κ-opioïdes (dynorphines). Les peptides opioïdes et leurs récepteurs sont exprimés dans tout le système nerveux périphérique et central. Ces peptides régulent de nombreux aspects de la physiologie, notamment le traitement de la douleur, la réactivité au stress, la sensibilité à la récompense, l’humeur, la respiration et les fonctions gastro-intestinales, endocriniennes et immunitaires.
Neurocircuit de la dépendance aux opioïdes
Phase de consommation excessive/intoxication : intoxication aux opioïdes et saillance incitative.
Les agonistes μ-Opioïdes sont profondément gratifiants pour les animaux et les humains, indépendamment de la douleur ou de l’inconfort. En tant que telle, la récompense induite par les opioïdes conduit à l’association de la récompense avec des stimuli associés à la drogue, tels qu’une odeur, un indice visuel, une quelconque poudre blanche ou un contexte spécifique (par exemple,
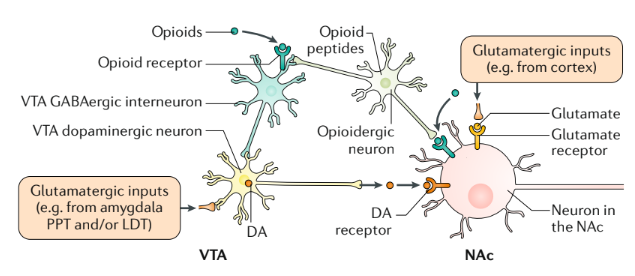
un coin de rue), ce qui déclenche le besoin de drogue (renforcement conditionné/séminence incitative). Chez l’homme, la saillance incitative a été étudiée en laboratoire, où l’on a mesuré l’état de manque et les envies de drogue en fonction de l’exposition à des indices liés à la drogue (ce que l’on appelle historiquement le comportement du “fana des aiguilles”). Les drogues opioïdes, comme l’héroïne, sont auto-administrées par voie intraveineuse par des souris, des rats, des singes et des humains. Lorsqu’elles sont administrées dans des conditions restreintes, les animaux maintiennent des niveaux stables de consommation d’opioïdes sans signes majeurs de dépendance physique ; cependant, lorsqu’elles sont administrées dans des conditions d’accès illimité, les animaux augmentent rapidement leur consommation d’opioïdes. Les drogues opioïdes favorisent également la préférence de place conditionnée (un animal passe plus de temps dans une région contenant la drogue que dans une région sans drogue), ce qui reflète les effets de renforcement des opioïdes. Les réponses conditionnées déclenchent “l’attente de la récompense” (c’est-à-dire des associations apprises) dans des environnements où la drogue a été expérimentée. Des études précliniques ont démontré que ces effets de renforcement sont médiés dans l’aire tegmentale ventrale (ATV) et le noyau accumbens (NAc) par des mécanismes à la fois dépendants de la dopamine et indépendants de la drogue (figure 5). Parmi les autres zones cérébrales où les agonistes μ-opioïdes produisent des effets gratifiants, mesurés par la préférence de lieu, figurent l’amygdale, l’hippocampe, le pallidum ventral et l’hypothalamus.
Phase de sevrage/effet négatif : tolérance aux opiacés et sevrage.
Une tolérance spectaculaire (c’est-à-dire une réponse plus faible à un médicament après une administration répétée de celui-ci ou la nécessité de doses plus importantes pour produire le même effet) se développe aux effets analgésiques, euphorisants, sédatifs et autres des opioïdes, y compris leurs effets létaux, et peut se développer après une seule administration. Les effets létaux des agonistes μ-opioïdes sont principalement dus à la dépression respiratoire via leurs actions dans les noyaux respiratoires du tronc cérébral, spécifiquement le complexe de pré-Bötzinger et le noyau parabrachial. Il est intéressant de noter que les études cliniques ont révélé des niveaux de tolérance différentiels pour les différents effets opioïdes, de sorte que les individus deviennent très tolérants aux effets gratifiants, analgésiques ou dépresseurs respiratoires, tout en présentant une sédation, un myosis (constriction de la pupille) et une constipation. On pense que la plupart des tolérances aux opiacés sont pharmacodynamiques et non dispositionnelles, ce qui signifie que la tolérance implique des adaptations neuronales plutôt qu’une augmentation du métabolisme des opiacés.
Les mécanismes neurobiologiques de la tolérance vont de la désensibilisation et de la régulation négative des récepteurs opioïdes à l’allostase des cellules et des circuits. Dans les voies descendantes de traitement de la douleur, les protéines G qui sont activées par les récepteurs μ-opioïdes après la liaison d’un peptide opioïde peuvent moduler l’activité de plusieurs seconds messagers et effecteurs cellulaires, déclenchant la désensibilisation des récepteurs μ-opioïdes, l’internalisation des récepteurs μ-opioïdes, des changements transcriptionnels dans l’expression des récepteurs opioïdes et d’autres protéines, et des changements structurels (tels que le remodelage des épines dendritiques), qui conduisent tous collectivement à la tolérance cellulaire. La dissection du rôle de l’une des principales voies de transduction du signal non liées aux protéines G pour les récepteurs μ-opioïdes a révélé un rôle clé de la voie β-arrestine dans la désensibilisation et la resensibilisation des récepteurs opioïdes. Les agonistes μ-opioïdes provoquent généralement l’activation de la voie arrestine 3 en aval de la cascade des protéines G. En effet, les souris déficientes en arrestine 3 (également connue sous le nom de β-arrestine 2) présentent une analgésie plus importante, mais une tolérance antinociceptive, une dépendance, une constipation et une suppression respiratoire significativement moindres par rapport aux souris de type sauvage, ce qui suggère que les médicaments qui activent les récepteurs μ-opioïdes sans activer la voie β-arrestine (tels que les agonistes opioïdes biaisés) pourraient avoir un potentiel analgésique élevé et des effets indésirables moindres.
Chez tous les mammifères, l’arrêt brutal ou progressif des opioïdes ou l’administration d’antagonistes compétitifs des récepteurs opioïdes (tels que la naloxone ou la naltrexone) produit un syndrome de sevrage des opioïdes. Ce syndrome de sevrage est caractérisé par des signes physiques et affectifs qui peuvent être dissociés phénotypiquement et par leurs substrats neuronaux sous-jacents. Les symptômes de sevrage physique chez l’homme comprennent la piloérection, les frissons, l’insomnie, la diarrhée, les nausées, les vomissements et les courbatures. La gravité et la durée de ces symptômes varient en fonction de la dose et de la durée de l’exposition aux opioïdes et des propriétés pharmacologiques de l’opioïde utilisé, notamment son efficacité et sa pharmacocinétique. Le syndrome de sevrage physique aigu le plus sévère est observé avec les agonistes opioïdes complets (par rapport aux agonistes opioïdes partiels) et pour les opioïdes à pharmacocinétique rapide comme le fentanyl ou l’héroïne. Chez l’homme, les symptômes affectifs du sevrage (que nous appelons hyperkatifeia), sont plus durables que les symptômes non affectifs, et comprennent l’irritabilité, la dysphorie, l’insomnie, l’anxiété, les troubles du sommeil et le retrait social. Les symptômes de retrait jouent un rôle majeur dans la rechute et peuvent également être conditionnés par les indices et le contexte de l’environnement. En effet, les symptômes émotionnels négatifs associés au sevrage aigu, à l’abstinence prolongée et au sevrage conditionné s’améliorent de manière significative avec l’utilisation du MOUD.
Les études des substrats neurobiologiques du sevrage physique dans des modèles animaux ont révélé l’implication de multiples régions, dont le gris périaqueducal, le thalamus dorsal et le locus coeruleus. Les régions cérébrales responsables du sevrage affectif (motivationnel et émotionnel) ont un point focal dans l’amygdale étendue. On a émis l’hypothèse que deux neuroadaptations produisaient l’état émotionnel négatif (tel que le malaise) qui contribue au renforcement négatif associé au sevrage des opioïdes : une perte de fonction dans les systèmes de récompense (dans l’ATV et le CNA) qui médient les effets renforçants aigus des opioïdes et un gain de fonction dans l’amygdale étendue, qui médiatise les réponses de type stress.
Le sevrage précipité des opioïdes (produit par l’administration d’un antagoniste des opioïdes qui entraîne brusquement des signes ou des symptômes de sevrage) chez les animaux est associé à une diminution de la dopamine extracellulaire dans la NAc et à une diminution du tir des neurones dopaminergiques. L’utilisation chronique de morphine chez l’animal est également associée à une taille plus petite des neurones dopaminergiques dans l’ATV et à une plus grande sensibilité aux antagonistes des récepteurs D2 de la dopamine ; des études TEP de personnes souffrant de dépendance aux opiacés ont révélé des niveaux plus faibles de récepteurs D2 dans l’ensemble du striatum par rapport aux témoins, ce qui était associé à des années d’utilisation d’opiacés. Cependant, une diminution de la libération de dopamine dans le striatum n’a pas été observée après un sevrage précipité par la naloxone ; au contraire, une tendance à l’augmentation de la dopamine dans le striatum dorsal a été constatée.
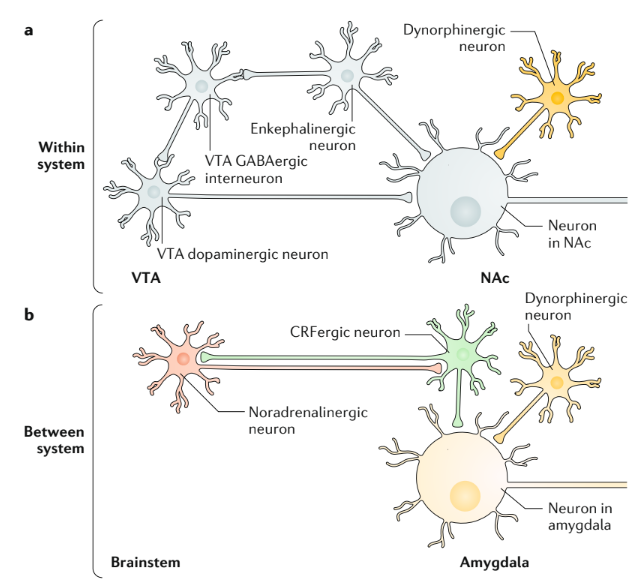
Le gain de fonction des systèmes de stress du cerveau pendant le sevrage des opioïdes est médié par des neurochimiques dans l’amygdale étendue qui sont impliqués dans les effets aversifs qui agissent en opposition aux effets aigus des opioïdes pour réduire le stress (par exemple, le facteur de libération de la corticotrophine (CRF), la dynorphine et la noradrénaline). Le blocage des récepteurs du CRF dans le noyau central de l’amygdale bloque la recherche compulsive d’opioïdes chez les animaux auxquels on a permis un accès prolongé à la drogue (modèle dit d’accès prolongé) (Fig. 6). En outre, l’administration d’un antagoniste des récepteurs κ-opioïdes dans l’enveloppe de la NAc a bloqué la potentialisation de la récompense opioïde induite par le stress et la réintégration du comportement de recherche d’opioïdes, et a interdit l’escalade de la consommation de drogue dans les modèles à accès prolongé. L’activation des récepteurs de la dynorphine-κ-opioïde peut également expliquer l’état hypodopaminergique provoqué par l’administration excessive d’opioïdes, qu’il s’agisse d’une dose unique et importante ou d’une administration chronique123 (Fig. 6). L’activation du neuropeptide Y et des systèmes endocannabinoïdes ainsi que d’autres systèmes anti-stress dans l’amygdale étendue peut moduler l’augmentation de la réactivité au stress associée au sevrage opioïde et, à ce titre, pourrait tamponner les systèmes pro-stress endogènes.
Préoccupation/anticipation : besoin d’opioïdes et rechute.
La phase de préoccupation/anticipation du cycle de la dépendance chez l’homme implique un dysfonctionnement de la fonction exécutive. La fonction exécutive est médiée par le PFC et les déficiences de l’inhibition de la réponse, de l’attribution de la saillance et de l’autorégulation ont été conceptualisées comme étant à la base de la rechute et de la frénésie alimentaire chez l’homme.
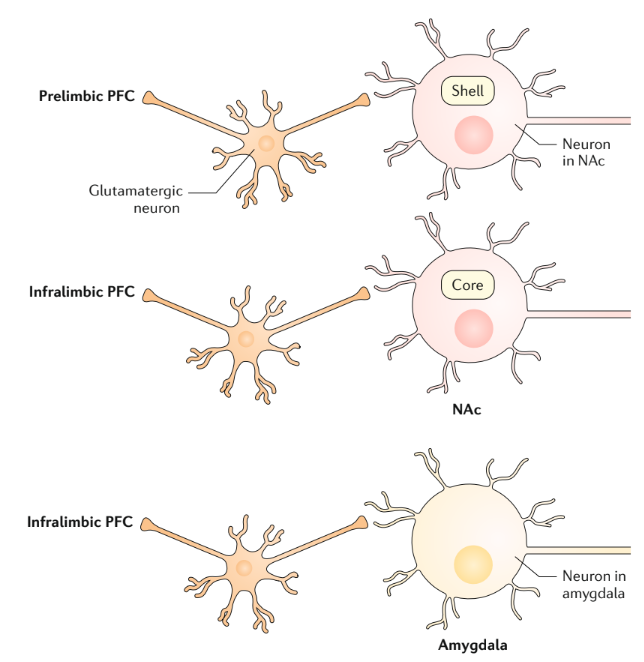
Les modèles animaux de l’état de manque ont historiquement utilisé des paradigmes de réintégration du comportement de recherche de drogue induite par la drogue, par des indices et par le stress chez des animaux non dépendants qui ont un accès limité aux opioïdes. Dans ces modèles, l’administration d’agonistes des récepteurs μ-opioïdes injectés par voie systémique ou directement dans l’ATV rétablit le comportement de recherche d’opioïdes pendant l’extinction, et le rétablissement du comportement de recherche d’opioïdes pendant l’extinction est bloqué par la naloxone. La réexposition à un indice ou à un contexte antérieur associé à l’héroïne après l’extinction peut rétablir le comportement de recherche d’héroïne chez les rats non dépendants. En outre, chez les rongeurs, la réintégration induite par les indices fait appel aux neurocircuits du PFC médian vers le NAc, et la réintégration induite par le contexte fait appel aux projections du PFC ventromédian et du subiculum vers l’enveloppe du NAc (Fig. 7). Un mécanisme moléculaire clé de la réintégration de la recherche d’opioïdes induite par les indices implique la dérégulation de l’homéostasie glutamatergique et particulièrement des récepteurs métabotropiques du glutamate 2 et 3. Chez les rats, la réintégration de l’auto-administration d’opioïdes induite par le stress (via un choc au pied) peut être bloquée en utilisant des antagonistes des récepteurs du CRF et des agonistes des récepteurs α2-adrénergiques, qui inhibent la libération de noradrénaline. Les régions cérébrales qui jouent un rôle essentiel dans le rôle du CRF et des médicaments adrénergiques dans la réintégration de l’auto-administration d’opiacés induite par le choc au pied comprennent des parties de l’amygdale étendue.
Chez l’homme, les personnes souffrant d’OUD présentent un dérèglement de l’axe hypothalamo-hypophyso-surrénalien du stress ; ce dérèglement persiste pendant les cycles de dépendance et peut être à l’origine des systèmes de stress cérébraux identifiés dans les études animales. Les indices qui sont associés au sevrage des opioïdes, tels que les lieux et les odeurs, ont également une signification motivationnelle. Ces signaux de sevrage conditionnés peuvent provoquer un état de manque chez les humains souffrant d’une dépendance aux opioïdes et peuvent provoquer une aversion pour les lieux et augmenter la recherche d’héroïne chez les animaux dépendants. Les substrats neurobiologiques du sevrage conditionné comprennent l’amygdale étendue et les systèmes de stress du cerveau qui s’y trouvent. Chez l’homme, l’état de manque et l’exposition aux indices précèdent fréquemment la rechute et la consommation de drogue, et des méta-analyses d’études d’IRM fonctionnelle ont identifié une activation fiable de l’amygdale, du striatum ventral et du PFC médian dans la médiation de l’état de manque déclenché par les indices chez l’homme.
Les perturbations moléculaires cellulaires à long terme peuvent contribuer à la vulnérabilité à la rechute dans l’OUD. L’activation aiguë des récepteurs opioïdes entraîne l’inhibition de l’adénylylcyclase et une baisse de l’activité de la protéine kinase A, tandis que l’exposition chronique augmente l’activité de l’adénylylcyclase et de la protéine kinase A. Ces perturbations finissent par provoquer une rechute à long terme. De telles perturbations finissent par provoquer des adaptations à long terme, notamment une augmentation de l’expression du facteur de transcription CREB (cyclic adenosine monophosphate response element binding protein) dans la NAc, qui peut servir de médiateur pour certains aspects de la tolérance et du sevrage142. L’activation subséquente de ΔFosB pourrait faciliter l’initiation et le maintien de l’état de dépendance et pourrait constituer un changement motivationnel moléculaire à long terme commun à toutes les classes de drogues.
Génétique
L’OUD, comme d’autres troubles liés à la consommation de substances, présente une forte héritabilité143. Le polymorphisme A118G (ou polymorphisme mononucléotidique (SNP) rs1799971-A) dans OPRM1 (codant pour le récepteur μ-opioïde) pourrait influencer l’expression des récepteurs μ-opioïdes dans le cerveau144, la sensibilité aux médicaments agonistes des récepteurs opioïdes145 et la vulnérabilité à la dépendance aux opioïdes144,146, bien que toutes les études n’aient pas démontré ces associations146. En effet, l’analyse des loci de traits quantitatifs cis-expression a démontré que d’autres SNP, comme le rs3778150, et des SNP proches, peuvent sous-tendre les associations incohérentes entre le rs1799971 et la dépendance à l’héroïne. Ici, le SNP rs3778150 a été fortement associé à un risque accru de dépendance à l’héroïne et le SNP fonctionnel rs1799971-A a été associé à la dépendance à l’héroïne uniquement chez les personnes ayant rs3778150-C146.
En se basant largement sur des études de cas, une variation génétique substantielle du métabolisme des médicaments opioïdes a été rapportée, en particulier de ceux qui utilisent le système enzymatique du cytochrome P450, comme la codéine, l’oxycodone, le tramadol et le fentanyl. Cette variation conduit à des cas extrêmes de mauvais métaboliseurs (qui ont des taux de médicament très élevés dans le plasma) ou de métaboliseurs ultra-rapides (qui ont besoin de doses de médicament beaucoup plus élevées pour obtenir une efficacité thérapeutique). Les métaboliseurs pauvres pourraient être vulnérables à une surdose lors de tentatives d’automédication mal fondées et les métaboliseurs ultra-rapides pourraient être vulnérables à une consommation excessive qui les rendrait vulnérables à la dépendance. Des études d’association à l’échelle du génome avec analyse des voies ont permis d’identifier plusieurs loci et réseaux de gènes qui pourraient expliquer la vulnérabilité héréditaire à l’OUD, notamment les gènes codant pour les canaux potassiques, les récepteurs α-amino-3 hydroxy-5-méthyl-4-isoxazolepropioniques (AMPA), les canaux calciques et les récepteurs glucocorticoïdes.
| Box 1 | Critères pour l’OUD Dans le Manuel diagnostique et statistique des troubles mentaux, 5e édition (DSM-5)174, un minimum de 2 à 3 des critères ci-dessous est requis pour un diagnostic de ” trouble léger “, tandis que 4 à 5 critères sont requis pour un diagnostic de ” trouble modéré “, et 6 à 7 critères pour un diagnostic de ” trouble sévère “. Une approche différente est adoptée avec la Classification internationale des maladies, 10e révision (CIM-10)386, qui requiert ≥3 des critères suivants 1, 2, 11, 10, la négligence progressive des plaisirs alternatifs (mesurée par une combinaison de 3, 5, 7) ou la persistance malgré le préjudice (mesurée par 6 et 9). 1. Prendre l’opioïde dans de plus grandes quantités et plus longtemps que prévu. 2. Vouloir arrêter mais ne pas y arriver. 3. Passer beaucoup de temps à tenter d’obtenir des opioïdes. 4. Craving/fort désir d’usage. 5. Impact sur les obligations professionnelles et personnelles. 6. Usage continu malgré des problèmes sociaux ou interpersonnels persistants ou récurrents causés ou aggravés par l’usage d’opioïdes 7. Arrêt ou réduction d’activités sociales, professionnelles ou récréatives importantes en raison de la consommation d’opioïdes. 8. Utilisation récurrente d’opioïdes dans des situations physiquement dangereuses 9. Utilisation constante d’opioïdes malgré la reconnaissance de difficultés physiques ou psychologiques persistantes ou récurrentes dues à l’utilisation d’opioïdes. 10. Tolérance définie par la nécessité d’augmenter sensiblement les quantités pour obtenir l’intoxication ou l’effet désiré, ou par une diminution sensible de l’effet en cas d’utilisation continue de la même quantité. 11. Sevrage se manifestant soit par un syndrome caractéristique, soit par l’utilisation de la substance pour éviter le sevrage. |
Différences entre les sexes
Les hommes sont plus nombreux à faire un mauvais usage des opioïdes et à en être dépendants que les femmes. En effet, aux États-Unis, en 2017, on a enregistré 32 337 décès par overdose d’opioïdes chez les hommes et 15 263 chez les femmes. La prévalence de l’OUD aux États-Unis montre également des différences entre les sexes ; l’enquête nationale sur la consommation de drogues et la santé de 2017 a indiqué que, parmi les personnes âgées de ≥12 ans présentant un abus ou une dépendance aux opioïdes, 1 162 090 étaient des hommes (0,96 % des hommes de ce groupe d’âge dans la population globale) et 779 050 des femmes (0,62 % des femmes de ce groupe d’âge dans la population globale).
Les rapports cliniques suggèrent que, pour les opioïdes, comme pour d’autres drogues d’abus, les femmes passent de la consommation initiale à la dépendance plus rapidement que les hommes. Des différences entre les sexes dans le système opioïde ont été signalées dans des études précliniques, ce qui pourrait sous-tendre des différences entre les sexes dans la sensibilité à la douleur ou la dépendance. En outre, des études TEP chez l’homme ont démontré des niveaux plus élevés de récepteurs μ-opioïdes dans plusieurs régions du cerveau (néocortex, caudate, amygdale, thalamus et cervelet) chez les femmes que chez les hommes, et que les femmes présentaient une activation des récepteurs μ-opioïdes induite par la douleur moins importante que les hommes dans le thalamus, les ganglions de la base et l’amygdale. Des études TEP préliminaires chez l’homme ont également signalé une disponibilité significativement plus élevée des récepteurs κ-opioïdes dans le cerveau des hommes que dans celui des femmes. Cependant, des travaux précliniques et cliniques supplémentaires sont nécessaires pour caractériser les différences entre les sexes dans le système opioïde. les différences entre les sexes dans le système opioïde, qui sont pertinentes à la fois à la douleur et à la dépendance.
Opioïdes, douleur et dépendance
Des études menées chez l’animal et chez l’homme ont révélé une hyperalgésie lors du sevrage spontané des opioïdes (c’est-à-dire lorsque l’administration du médicament cesse tout simplement) et lors du sevrage précipité des opioïdes après une exposition aiguë ou chronique aux opioïdes. D’autres altérations du système de la douleur ont été signalées, comme une faible tolérance à la douleur chez les patients sous traitement d’entretien à la méthadone, et la douleur est l’un des principaux déclencheurs de la rechute de la dépendance chez les personnes sous méthadone. En effet, chez les personnes abstinentes ayant des antécédents de dépendance aux opiacés, l’état d’hyperalgésie peut persister jusqu’à 5 mois, et les personnes plus sensibles à la douleur ont également un plus grand besoin induit par les indices. Dans une étude systématique de l’interaction entre les états émotionnels négatifs et l’hyperalgésie associée au sevrage, les personnes en sevrage aigu (24-72 heures) d’opioïdes ou en abstinence prolongée (30 mois en moyenne) avaient des seuils de douleur et une tolérance à la douleur plus faibles, et ces effets étaient exacerbés par des états émotionnels négatifs. Les cibles neurobiologiques de l’hyperalgésie induite par les opioïdes dans les études animales comprennent l’activation des systèmes glutamatergiques et de stress cérébral tels que le CRF et la dynorphine.
Une hypothèse pour expliquer la misère associée à la dépendance aux opioïdes est que le point de consigne pour l’expérience d’un état émotionnel négatif est abaissé, sous l’effet d’une faible récompense, d’un stress élevé et de déficiences de la fonction exécutive, qui sont tous médiés par des dérèglements spécifiques du neurocircuit. Sur le plan conceptuel, on a également émis l’hypothèse qu’un état émotionnel négatif hypersensible (hyperkatifeia) était parallèle à l’hyperalgésie induite par les opioïdes associée à la douleur physique169. En effet, des données suggèrent que les altérations neurales associées à la dépendance pourraient se chevaucher avec les altérations des aspects émotionnels du traitement de la douleur dans l’amygdale via la voie spino(trigemino)-ponto-amygdalienne. On pourrait soutenir, du point de vue des processus adverses, que tout moyen d’augmenter la quantité bolus d’agoniste μ-opioïde qui pénètre dans le cerveau, y compris le surdosage, l’escalade rapide (overshooting), les variables pharmacocinétiques et la sensibilité génétique, peut déclencher l’implication des processus d’hyperalgésie et d’hyperkatifeia qui sont médiés par l’interférence entre le noyau central de l’amygdale et le noyau gris périaqueducal, entre autres régions du cerveau. d’autres régions du cerveau. Un tel cadre suggère que l’hyperalgésie ou l’hyperkatife induite par les opioïdes induite par les opioïdes pourrait être un important marqueur clinique important de la vulnérabilité à la dépendance aux opioïdes.
Diagnostic, dépistage et prévention
Critères de diagnostic
Dans le Manuel diagnostique et statistique des troubles mentaux, cinquième édition (DSM-5), les deux diagnostics précédents d’abus et de dépendance aux opiacés ont été combinés en un seul trouble, l’OUD, le nombre de symptômes indiquant la gravité174 (encadré 1). De nombreux pays utilisent encore le système de classification de la 10e révision de la Classification internationale des maladies (CIM-10) dans lequel l’abus et la dépendance restent des troubles distincts, les définitions de la dépendance aux opioïdes de la CIM nécessitant plus de symptômes que l’abus (encadré 1) et l’abus d’opioïdes en l’absence de dépendance étant généralement classé comme usage nocif si les personnes sont exposées à un risque d’infection ou de dommage physique ou mental (voir ci-dessous). Les facteurs critiques de l’OUD sont que les personnes persistent à utiliser des opioïdes en dépit de problèmes physiques, mentaux, sociaux ou criminels supplémentaires résultant de leur utilisation d’opioïdes, qu’une tolérance aux effets de l’opioïde se développe, et qu’il y a un passage et une préoccupation à minimiser les effets du sevrage (dysphorie) plutôt qu’à atteindre l’euphorie.
Détection du trouble de l’usage d’opioïdes (OUD)
Les personnes atteintes d’OUD peuvent attirer l’attention de la clinique par une grande variété de moyens. Par exemple, elles peuvent s’adresser à leur médecin traitant ou à un autre prestataire de soins de santé pour demander de l’aide pour leur dépendance ou leur problème de drogue ou, selon l’organisation des services (qui diffèrent grandement dans un pays ainsi qu’au niveau international), elles peuvent s’adresser directement à des services spécialisés dans la dépendance. Cependant, le premier contact réel avec les services de traitement est souvent oblique et peut survenir à l’occasion d’un autre événement par lequel la consommation de drogue devient évidente, comme une demande de renseignements lors d’un dépistage de routine ou une demande spécifique déclenchée par une complication clinique (comme un abcès d’injection) ou un résultat inattendu d’un test sanguin (par exemple, VHB positif) ou un traumatisme. À ces moments-là, il y a souvent une plus grande réceptivité aux conseils et une fenêtre d’opportunité thérapeutique qui doit être exploitée. L’implication de la famille est fréquente lors de la première présentation (comme l’inquiétude d’un partenaire ou des parents). parents) et les cliniciens doivent déterminer dans quelle mesure le patient nouvellement identifié comme souffrant d’OUD est intrinsèquement motivé pour résoudre son problème. Cependant, les cliniciens doivent également savoir que la peur du changement et l’ambivalence sont des caractéristiques presque universelles de la réponse à toute situation de ce type, et que le soutien du clinicien, de la famille et des amis aide la personne souffrant d’OUD à faire face à son problème de façon aiguë et à long terme. Lorsqu’une personne souffrant d’OUD ne souhaite pas s’engager dans un traitement formel, il est important de l’informer des options d’auto-assistance et de s’assurer qu’elle comprend les risques associés à la consommation d’opioïdes et de lui conseiller des changements de comportement pour réduire ces risques (comme la vaccination contre le VHB et l’évitement du partage des aiguilles et des seringues), une approche souvent appelée réduction des risques.
D’autres cas d’identification oblique de l’OUD peuvent être, par exemple, des préoccupations des services d’aide sociale ou de l’école, ou suite à une arrestation pour une infraction pénale (parfois possession de drogue ou vol à l’étalage). Dans ces cas, l’offre d’un traitement assorti d’exigences de la part des tribunaux ou des organismes de réglementation professionnelle peut renforcer les avantages du traitement. On trouve une forte prévalence d’OUD (et d’autres substances) chez les personnes condamnées à une peine de prison (parfois identifiée, parfois dissimulée), ce qui peut être l’occasion d’aider la personne à traiter son OUD. Il convient de noter que certaines personnes aux premiers stades de l’OUD peuvent surmonter ce trouble sans traitement formel ou sans le soutien de groupes d’entraide ou de groupes d’entraide mutuelle. d’entraide, alors que pour d’autres, le début d’un traitement formel est essentiel. traitement formel est essentiel.
Prévention de l’utilisation et prévention des dommages
Comme nous l’avons déjà mentionné (voir Charge de morbidité et séquelles de l’OUD, ci-dessus), plusieurs complications sont associées à l’OUD et les approches de prévention secondaire doivent être prises en compte lors de la planification des initiatives de prévention. Ces complications comprennent la mortalité prématurée (notamment par overdose), l’automutilation et le suicide, la transmission de virus transmis par le sang et le risque accru d’infections bactériennes (tableau 1). Les problèmes sociaux, notamment les environnements familiaux défavorables et la criminalité liée à la drogue, sont associés à l’OUD. Les problèmes sociaux sont à la fois une caractéristique du trouble en ce qui concerne les personnes qui négligent leurs autres rôles et responsabilités (box 1) et peuvent également interagir avec le trouble et aggraver les problèmes socio-comportementaux qui étaient présents avant le début de l’utilisation des opioïdes. Ce problème est encore aggravé par une réponse sévère de la justice pénale à la consommation de drogues, avec des périodes d’incarcération et des casiers judiciaires permanents qui peuvent entraîner de graves limitations des possibilités futures.
Prévention primaire
Il est de plus en plus évident que les interventions universelles en milieu scolaire, dont certaines sont dispensées par des réseaux de pairs, sont efficaces pour réduire l’apparition et la progression de la consommation de substances (comme l’alcool, le tabac et le cannabis) chez les jeunes. Cependant, une étude systématique n’a trouvé aucune preuve ou des preuves insuffisantes de l’efficacité de ces interventions pour prévenir la consommation d’opioïdes chez les jeunes. De même, l’efficacité de la prohibition ou des interventions de la justice pénale pour réduire la consommation d’opioïdes chez les jeunes n’est pas étayée par des preuves, et des preuves de plus en plus nombreuses suggèrent que les sanctions de la justice pénale seules – en particulier l’emprisonnement – pourraient causer plus de dommages à la santé que de bénéfices chez les adultes qui consomment des opioïdes (voir ci-dessous).
En théorie, l’interruption de l’approvisionnement en drogues et l’augmentation du coût des drogues illicites réduiront la consommation, mais ces interventions sont généralement difficiles à maintenir et coûteuses à mettre en œuvre. Il existe des exemples d’approvisionnement excessif menant à des épidémies d’opioïdes, comme aux États-Unis, mais il y a peu de preuves solides soutenant l’efficacité de l’interdiction ou des interventions basées sur l’approvisionnement pour réduire la consommation à long terme. Bien que certaines expériences naturelles aient montré que la réduction de l’offre peut réduire la consommation d’opioïdes et les dommages qui y sont liés, l’effet est de courte durée et est rarement reproductible. Par conséquent, des études supplémentaires sont nécessaires pour mesurer réellement tout effet spécifique de l’interruption de l’approvisionnement en médicaments et de l’augmentation des prix, ainsi que la durée de leur effet. Une alternative potentiellement plus prometteuse aux interventions dites “basées sur l’offre” consiste à adopter une approche “à l’échelle de la société” pour lutter contre l’exclusion des populations marginalisées et vulnérables des services sociaux et de santé, même si des preuves solides doivent encore être apportées à l’appui de cette approche.
Opioïdes sur ordonnance.
La prescription d’opioïdes pour le traitement à court terme de la douleur (y compris la douleur cancéreuse) n’entraîne pas nécessairement une tolérance ou des caractéristiques de sevrage ; en outre, même l’utilisation à moyen terme ne conduit pas inévitablement au développement de l’OUD. Au niveau international, il est reconnu que de nombreux pays continuent à sous-prescrire des opioïdes pour le traitement de la douleur aiguë et cancéreuse en raison du manque de formation du personnel clinique et des craintes des praticiens et des décideurs politiques concernant le détournement et la dépendance, comme le souligne l’Organe international de contrôle des stupéfiants. La prescription d’opioïdes pour la douleur chronique, en particulier la douleur neuropathique, est plus complexe que le traitement de la douleur aiguë (voir ci-dessous), et augmente le risque d’OUD et de problèmes associés. Une approche plus intégrative est nécessaire en ce qui concerne l’utilisation des opioïdes pour le traitement de la douleur et pour conserver les avantages incontestables des opioïdes dans certaines circonstances sans augmenter par inadvertance le risque d’OUD.
Les patients qui utilisent des opioïdes pour lutter contre la douleur chronique ressentent à la fois une tolérance et un manque d’efficacité dans un délai d’un mois. Le risque d’overdose est associé à plusieurs facteurs : des doses de prescription élevées, des prescripteurs multiples et la co-prescription avec d’autres médicaments tels que les benzodiazépines. D’un point de vue critique, il n’existe pas de preuves solides des avantages à long terme de la prescription d’opioïdes pour le soulagement de la douleur chronique chez la majorité des patients, des avantages de la prescription de doses élevées d’opioïdes ou d’outils de dépistage fiables pour identifier les patients qui sont plus susceptibles de développer un OUD si on leur prescrit un opioïde. Les lignes directrices actuelles recommandent une approche de “réduction des risques” ou de “principe de précaution” pour la prise en charge de la douleur chronique non cancéreuse, qui consiste principalement à éviter de prescrire des opioïdes car les risques potentiels l’emportent sur les avantages et, à la place, à recourir à des interventions non pharmacologiques ou à un soulagement pharmacologique des symptômes sans opioïdes. Bien que les lignes directrices soient fondées sur des preuves existantes et de bonnes intentions, la réalité est que de nombreuses personnes n’ont pas facilement accès aux interventions non pharmacologiques en raison d’un manque de financement, d’installations et de praticiens qualifiés.
La prescription d’opioïdes pour la douleur chronique a diminué dans certains pays, comme les États-Unis, grâce à la prise de conscience par les médecins du fait que la prescription laxiste a contribué à la crise actuelle des overdoses et grâce aux nouvelles directives émises par les agences nationales et régionales. La directive des Centres américains de contrôle et de prévention des maladies sur la prescription d’opioïdes pour la douleur chronique a été publiée en 2016 dans le but déclaré de “réduire le nombre de personnes qui font un mauvais usage, abusent ou font une overdose de ces médicaments”. Au Canada, des lignes directrices sur la prescription d’opioïdes ont été publiées en 2017 et approuvées par l’Association médicale canadienne. Ces lignes directrices mettent l’accent sur les stratégies alternatives de gestion de la douleur et suggèrent des restrictions sur la quantité et la durée des opioïdes. Un moyen plus direct de surveiller l’utilisation des opioïdes a été introduit aux États-Unis par le biais des programmes de surveillance des médicaments sur ordonnance (PDMP), qui visent à suivre la prescription responsable des opioïdes et la pratique clinique, et à améliorer la sécurité des patients. Les PDMP sont gérés par chaque État, et l’adoption, l’application et l’effet de ces programmes varient selon les États, ce qui affecte leur efficacité. Par exemple, on a constaté que les États où l’utilisation des PDMP est obligatoire ont des niveaux de prescriptions et de doses d’opioïdes inférieurs à ceux des États où la participation au PDMP est volontaire, bien que l’étendue de cette influence ne soit pas encore claire.
Bien que l’effet des programmes visant à réduire la prescription d’opioïdes ait montré des tendances précoces à la baisse de la prescription globale, un résultat majeur a été la diminution de la disponibilité des médicaments pharmaceutiques détournés pour ceux qui sont déjà dépendants des opioïdes. En effet, comme la demande d’opioïdes est restée élevée, le marché illégal a, comme on pouvait s’y attendre, comblé le vide avec des produits plus puissants et moins réglementés comme l’héroïne et les opioïdes synthétiques (principalement le fentanyl). Toutefois, la situation varie considérablement d’un pays à l’autre et cette restriction accrue doit trouver sa place parallèlement à la reconnaissance de la nécessité, dans d’autres pays, d’améliorer le faible accès aux opioïdes pour la douleur cancéreuse et la douleur aiguë sévère.
Il est donc trop tôt pour dire si les directives sur la restriction de la prescription d’opioïdes pour le soulagement de la douleur ont permis de réduire le nombre d’OUD et de décès par overdose. L’épidémie d’OUD en Amérique du Nord est en cours et, bien qu’elle ait été initialement déclenchée par les prescriptions d’opioïdes, elle s’est ensuite étendue à l’héroïne et, plus récemment, au fentanyl illicite et à ses analogues. Par conséquent, les politiques cliniques et de santé publique doivent s’adapter et introduire de nouvelles interventions, augmenter la couverture et l’intensité des interventions, et évaluer l’efficacité tout en réduisant les dommages liés aux opioïdes. La flambée actuelle des décès par surdose en Amérique du Nord est compliquée par l’utilisation croissante d’héroïne et d’opioïdes synthétiques puissants et d’associations de médicaments (opioïdes et psychostimulants). Une relation entre l’augmentation des décès par surdose et les restrictions sur la prescription d’opioïdes a été postulée, mais elle doit faire l’objet d’une analyse temporelle minutieuse car, par exemple, l’augmentation de la consommation d’héroïne chez les utilisateurs d’opioïdes sur ordonnance a précédé la mise en œuvre de politiques visant à réduire le mauvais usage de ces derniers.
Approche de santé publique pour prévenir les dommages liés à la consommation d’opioïdes.
d’opioïdes.
Dans son examen de la recherche sur la toxicomanie, l’Institute of Medicine a recommandé l’adoption d’une approche globale de santé publique qui donne la priorité aux interventions et à la recherche visant à prévenir les méfaits de la drogue comme principal objectif politique, plutôt que de se concentrer sur la consommation de drogue en soi64. De même, la réduction des risques a été au cœur d’une réponse réussie à l’épidémie de VIH dans les années 1980 et au début des années 1990 parmi les personnes qui s’injectent des drogues dans de nombreux pays207. Une approche de santé publique ou de réduction des risques pour prévenir les dommages liés aux opioïdes englobe toute la gamme des traitements médicamenteux ainsi que la fourniture d’aiguilles et de seringues, la vaccination et le traitement des virus transmissibles par le sang, et la distribution de naloxone. À l’appui des approches de réduction des risques, certains pays, comme la Suisse et le Canada, ont montré que l’accès à des installations d’injection supervisées et les stratégies visant à réduire les facteurs de risque structurels associés à des politiques de drogues défavorables étaient bénéfiques pour l’engagement dans le traitement des OUD et du VIH et pour la prévention des effets néfastes de l’injection d’opioïdes (comme les décès par surdose). L’OMS et les organisations d’Europe et d’Amérique du Nord recommandent une approche globale de la prévention du VIH et du VHC pour les personnes qui s’injectent des drogues, comprenant des interventions multiples telles que le traitement antiviral, le traitement de substitution aux opioïdes, les programmes d’échange de seringues (PES), l’éducation par les pairs, la sensibilisation et la recherche de cas dans la communauté209. Les politiques de réduction des risques doivent être réimaginées et revitalisées en réponse à l’épidémie de décès par surdose d’opioïdes qui touche particulièrement l’Amérique du Nord.
Le traitement par agonistes opioïdes (TAO) peut jouer un rôle important dans la réduction des conséquences néfastes de l’OUD sur la santé. Bien qu’un essai contrôlé randomisé (ECR) conçu ou suffisamment puissant pour mesurer l’effet des médicaments sur la mortalité liée à la drogue ou la transmission du VIH devrait avoir une taille d’échantillon irréaliste210,211, il existe de bonnes preuves provenant d’études d’observation, et en particulier d’études de cohorte, que le MOUD (encadré 2) réduit systématiquement la mortalité, réduit la transmission du VIH et du VHC, améliore la couverture du traitement du VIH et le pronostic, et est associé à des réductions de la criminalité liée à la drogue. En outre, plusieurs revues systématiques ont suggéré que le MOUD réduit de 3 à 4 fois la mortalité par overdose, réduit de moitié l’incidence du VIH et du VHC, et double l’adhésion à la thérapie antivirale du VIH218. Les bénéfices de santé du MOUD se produisent pendant l’exposition (c’est-à-dire pendant que les patients sont sous MOUD (Encadré 2)). Le MOUD est très rentable lorsqu’il est fourni à la fois dans la communauté et en prison. Les modèles économiques qui incluent les avantages sociétaux plus larges du MOUD – en particulier une réduction de la criminalité liée à la drogue – devraient être prioritaires car cette option tend à être moins coûteuse et génère plus d’avantages que les stratégies d’état stable ou la minimisation de l’accès au MOUD.
Les personnes souffrant d’OUD ont un risque élevé de rechute. Deux périodes particulières de risque élevé sont le moment où les personnes ayant un OUD actuel ou récent quittent la prison ou lorsqu’elles cessent leur traitement contre la drogue24,224. En effet, le risque de surdose mortelle au cours du premier mois suivant la sortie de prison ou la fin du traitement de la toxicomanie peut être 4 à 8 fois plus élevé que le risque général de décès par surdose dans la communauté. L’incarcération est un risque majeur pour les personnes souffrant d’OUD ; des examens systématiques suggèrent qu’un quart à un tiers des prisonniers dans le monde ont des antécédents de consommation problématique de drogues, en particulier d’opioïdes. Des études d’observation menées au Royaume-Uni et en Australie ont montré que les personnes souffrant d’OUD qui sortent de prison sous MOUD présentent un risque de mortalité par overdose inférieur de 75 à 80 % au cours du premier mois suivant leur libération par rapport aux prisonniers souffrant d’OUD qui n’ont pas été traités ou qui ont été désintoxiqués en prison. Ces études d’observation et un essai aux États-Unis montrent également que le fait de sortir de prison sous traitement de désintoxication augmente le recours aux programmes communautaires de traitement de la toxicomanie. En outre, le traitement par MOUD en prison réduit l’automutilation et est associé à une incidence plus faible du VHC en prison.
Les études de l’OAT sur l’incidence du VIH et du VHC suggèrent qu’un plus grand bénéfice est généré en augmentant à la fois la couverture et la durée du MOUD, et en le combinant avec d’autres interventions. Les études du MOUD dans les soins primaires au Royaume-Uni ont suggéré que la durée moyenne (approximativement ≤6 mois) est trop courte pour contrecarrer le risque élevé de décès au début et à la fin du MOUD, et pour obtenir un effet à l’échelle de la population sur la réduction du nombre de décès liés à la drogue233,234. En outre, il existe de bonnes preuves théoriques provenant de projections de modèles et modèles et de certaines études écologiques que le traitement antiviral est essentiel pour la prévention du VIH et du VHC chez les personnes souffrant d’OUD et qui s’injectent des drogues231,235. Les projections de modèles (Fig. 8 ; Tableau 2) supposent que l’intensification du traitement contre le VIH ou le VHC en combinaison avec le MOUD et d’autres interventions peut minimiser la transmission du VIH ou du VHC et réduire la prévalence du VHC vers des niveaux d’élimination.
| Box 2 | Terminologie du traitement du trouble de l’usage d’opioïdes. Il existe une confusion terminologique concernant les médicaments utilisés dans le traitement et la gestion du trouble de l’usage des opioïdes (OUD). Le terme “médicaments pour l’OUD” couvre tous les médicaments utilisés spécifiquement pour traiter l’OUD et comprend les traitements agonistes opioïdes (OAT), les traitements antagonistes opioïdes (naltrexone) et les médicaments pour le sevrage aigu. Les OATs traitent le besoin répété de rechercher des drogues par la stabilisation sur une dose d’entretien d’un opioïde prescrit (généralement à action prolongée et pris oralement sous surveillance sur une base quotidienne). Le TSO est également décrit par certaines personnes comme un traitement de substitution aux opioïdes, une thérapie de remplacement des opioïdes ou avec une terminologie associée à l’opioïde spécifique utilisé comme le traitement d’entretien à la méthadone ou le traitement d’entretien à la buprénorphine. Le traitement assisté à l’héroïne ferait également partie de cette catégorie. Les traitements antagonistes des opioïdes, dont le seul médicament en usage clinique régulier est la naltrexone, sont utilisés pour offrir un blocage de l’effet de tout opioïde exogène pouvant être pris par le patient. L’intention de cette thérapie est de soutenir un état d’abstinence récemment atteint et de permettre la stabilisation du mode de vie sans nouvelle utilisation répétée et intermittente d’opioïdes. Les médicaments pour le sevrage aigu sont utilisés pour réduire la détresse liée à la dépendance physique qui apparaît lors de l’arrêt brutal des opioïdes. On y parvient parfois en diminuant la dose d’opioïdes pour éviter l’expression la plus intense des symptômes de sevrage des opioïdes (par exemple, en réduisant les doses de méthadone ou de buprénorphine). Une autre approche consiste à traiter avec des agonistes α-adrénergiques (lofexidine ou clonidine) pour soulager l’intensité des symptômes de sevrage. En plus des thérapies ci-dessus, la naloxone, un antagoniste des opioïdes, est utilisée pour inverser les effets de la surdose induite par les opioïdes. l’overdose induite par les opioïdes. |
Une approche complète de la prévention de l’OUD et des et des dommages liés à la drogue – interventions complémentaires.
Une autre intervention de prévention primaire du VIH et du VHC chez les personnes atteintes d’OUD qui s’injectent des drogues est la distribution de matériel d’injection stérile par le biais des programmes d’échanges de seringues (PS). Les preuves de l’effet des PS sur le VIH et le VHC sont moins solides que celles de l’ATO, surtout en Amérique du Nord. Cependant, il existe des preuves plus solides que la combinaison de PS et de MOUD réduit la transmission virale.
Les interventions adjointes au MOUD comprennent la distribution communautaire de naloxone (un traitement antagoniste efficace qui peut bloquer les effets des opioïdes, traiter la dépression respiratoire et inverser une surdose d’opioïdes) et l’introduction de centres d’injection supervisés. La distribution communautaire de naloxone aux personnes souffrant d’OUD (et aux membres clés de leur famille) s’est développée. Il s’agit d’une intervention que les pairs utilisateurs et les membres de la famille peuvent administrer de manière acceptable. En outre, de bonnes données modèles montrent que l’extension de la naloxone communautaire évite les décès par overdose. Les attitudes du public et des professionnels à l’égard de ces approches de réduction des risques varient considérablement selon les pays et les communautés. Dans certains pays, comme la Suisse et l’Australie, l’approche est une politique publique, tandis que dans d’autres, comme les États-Unis et le Royaume-Uni, elle reste controversée et politiquement très chargée. En dépit de ces diverses positions, le nombre de centres d’injection supervisés a augmenté dans le monde entier en réponse à l’augmentation des décès et des dommages liés à la drogue. Bien que l’évaluation scientifique rigoureuse de ces approches soit difficile, l’expérience clinique de certains des sites bien établis est généralement très positive. Pour l’avenir, il est nécessaire de mettre en place de nouvelles expériences naturelles permettant de caractériser l’intensité (dose) de l’approche de santé publique (comprenant de multiples interventions) et de vérifier si l’exposition est associée à une réduction des décès par surdose d’opioïdes et d’autres résultats négatifs dans la population.
Comme nous l’avons déjà mentionné, la criminalisation est à l’origine d’un grand nombre des méfaits associés à la consommation d’opioïdes, car elle est associée à toute une série de problèmes sociaux et ne tient pas compte de l’OUD dans une optique sanitaire et sociale. Des commissions internationales et des approches novatrices adoptées par certains pays mettent de plus en plus l’accent sur la remise en question de la ” guerre contre la drogue “. Par exemple, une première approche de la double épidémie (ou syndromie) de transmission du VIH et de décès liés à la drogue chez les personnes atteintes d’OUD qui s’injectent des drogues au Portugal consistait à accroître la disponibilité et l’accès aux interventions de prévention primaire dans la communauté et à supprimer les sanctions pénales imposées aux personnes qui consomment des drogues. Cette approche Cette approche a débuté en 2003 et la combinaison de réformes de la justice pénale et de l’investissement dans la réduction des risques a été a été considérée comme un succès, les indicateurs suggérant une baisse des des indicateurs suggérant une baisse des coûts sociaux, l’absence d’évolution négative du prix des une réduction des risques de transmission du VIH et d’overdose.
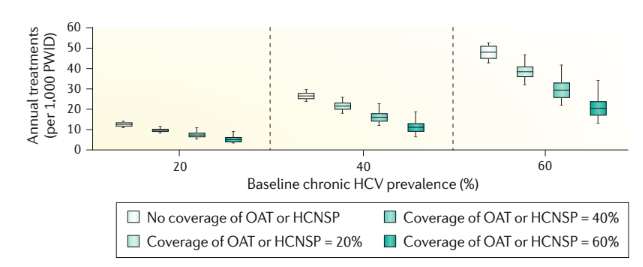
Prise en charge.
L’OUD est un trouble chronique et souvent récidivant ; par conséquent, la thérapie médicale et psychosociale doit être dispensée dans un cadre similaire à celui utilisé pour le traitement d’autres troubles chroniques. L’OUD nécessite des soins à long terme, adaptés aux besoins de chaque patient et permettant de modifier l’intensité du traitement en fonction des fluctuations de la symptomatologie (Fig. 9). La prise en charge peut comporter plusieurs étapes, dont l’intervention aiguë, la stabilisation et les soins à long terme. L’objectif du traitement doit être de stabiliser les perturbations physiologiques et psychologiques causées par l’exposition chronique aux opioïdes, ce qui permet ensuite de réduire la consommation d’opioïdes et les nombreux méfaits physiques et sociaux qui y sont associés. De cette manière, les patients peuvent entrer en rémission, ce qui leur donne l’occasion de s’attaquer à d’autres problèmes psychosociaux et médicaux liés à leur consommation de drogues, notamment les maladies infectieuses, le sous-emploi ou le chômage, les relations avec les proches, les problèmes de justice pénale et le logement.
Les effets sanitaires et sociaux plus larges qui sont souvent associés à l’OUD doivent être abordés dans le cadre de la prise en charge globale de l’OUD (tableau 1). L’attention portée à ces problèmes est vitale pour le bien-être des personnes atteintes d’OUD ainsi que pour la société en général. De plus, une santé publique et une politique publique efficaces exigent que cette attention soit accordée de manière proactive, y compris aux groupes qui sont souvent marginalisés ou mal desservis, comme les personnes âgées, les personnes handicapées et les personnes âgées. souvent marginalisés ou mal desservis, tels que les sans-abri, les personnes en prison et les personnes impliquées dans la prostitution.
L’accès au traitement
La plupart des régions du monde reconnaissent les avantages d’un traitement rapide de l’OUD et de nombreux pays utilisent des traitements dont l’efficacité est prouvée, y compris le MOUD (encadré 2), souvent associés à un soutien psychologique et social. Cependant, il existe une importante lacune en matière de traitement, seule une petite proportion des personnes ayant un problème recevant effectivement un traitement. Par exemple, aux États-Unis en 2011, sur un nombre estimé à 21,6 millions de personnes ayant besoin d’un traitement pour un problème de consommation de drogues illicites ou d’alcool, seuls 2,3 millions ont reçu un traitement dans un établissement spécialisé dans la toxicomanie. À l’échelle mondiale, les services de traitement sont souvent insuffisamment financés ou mal soutenus, ce qui a pour effet d’en freiner les effets bénéfiques. En outre, il existe un préjugé de longue date contre le MdE, et en particulier l’OAT, les professionnels et le public ayant du mal à comprendre les avantages du MdE pour réduire ou éliminer la consommation d’opioïdes, prévenir les rechutes et réduire les comportements nocifs. Ce préjugé découle probablement de l’incapacité, pendant de nombreuses décennies, à reconnaître les troubles liés à la consommation de substances comme des troubles médicaux nécessitant un traitement médical, les dépeignant plutôt comme des échecs moraux ou des pathologies de la personnalité individuelle. En partie à cause de ce préjugé contre l’utilisation de médicaments pour les troubles liés à la consommation de substances, il existe maintenant un grand nombre de preuves scientifiques soutenant l’efficacité des pharmacothérapies pour cette indication. Néanmoins, l’offre de traitement est souvent inégale, même dans les pays où l’engagement apparent est bon, et il est fréquent que l’on ne parvienne pas à saisir les moments propices à l’apprentissage de l’influence et à fournir un traitement à la demande. De plus, il y a souvent des obstacles administratifs ou financiers à l’accès au DME, des interférences politiques avec les jugements cliniques sur la durée du traitement nécessaire, et certains programmes et même pays interdisent encore l’utilisation de médicaments fondés sur des preuves.
Attention aux comorbidités
L’OUD se produit rarement de manière isolée et s’accompagne plus souvent de comorbidités médicales (comme les maladies infectieuses) et psychiatriques. La prise en charge de ces autres troubles concomitants est souvent essentielle pour la santé et le bien-être à long terme du patient et l’efficacité du traitement de l’OUD.
L’approche idéale pour le traitement des maladies infectieuses comorbides consiste à utiliser une approche de soins intégrés dans laquelle le traitement de l’OUD et des maladies infectieuses est fourni dans le même cabinet, ce qui réduit la nécessité pour les patients de naviguer entre plusieurs fournisseurs de soins et plusieurs établissements cliniques. De nombreuses approches d’intégration des soins cliniques ont été évaluées, y compris des programmes qui fournissent des soins pour les maladies infectieuses dans des établissements spécialisés dans la toxicomanie (par exemple, dans des programmes de traitement à la méthadone et d’autres programmes de traitement des opioïdes), la fourniture d’un traitement pour la consommation de substances dans une pratique généraliste ou de soins primaires, et d’autres approches novatrices telles que le dépistage et l’intervention dans les programmes de services de seringues. Cependant, ce type de programme intégré n’est pas la norme, et la plupart des prestations de services restent souvent cloisonnées. Les examens des caractéristiques et des résultats de ces modèles intégrés ont suggéré que les patients s’engagent davantage dans les soins et sont plus susceptibles de compléter et/ou de rester conformes aux régimes de médicaments pour traiter leur maladie infectieuse lorsque les soins sont fournis dans un modèle intégré, et que les patients expriment une préférence pour les soins intégrés. Les problèmes plus aigus de l’OUD comprennent les complications de la consommation de drogues injectables telles que les abcès, l’ostéomyélite, l’endocardite et même l’anévrisme mycotique, qui nécessitent souvent des soins spécialisés et une hospitalisation. Les personnes qui se présentent avec ces problèmes compliqués et parfois mortels peuvent représenter pour les prestataires un moment accessible pour discuter de l’engagement d’un traitement.
Plusieurs comorbidités psychiatriques sont plus fréquentes chez les personnes souffrant d’OUD que dans la population générale, notamment la dépression, l’anxiété, le trouble de la personnalité antisociale, la suicidalité, des antécédents d’abus ou de traumatisme sexuel et le syndrome de stress post-traumatique. Comme la dépression et l’anxiété peuvent être des antécédents de consommation de drogue ou une conséquence de la consommation continue de drogue, il est essentiel que le clinicien identifie ces troubles et élabore un plan de traitement complet, le cas échéant. Il n’est pas rare que des personnes se présentent pour un traitement de l’OUD tout en recevant une prescription de benzodiazépines ou en consommant des benzodiazépines de manière illicite. Comme l’association de tout agoniste opioïde avec des benzodiazépines présente un risque de surdose mortelle, la prise en charge clinique doit être effectuée avec précaution. Les patients qui sont prêts à cesser d’utiliser des benzodiazépines peuvent avoir besoin d’un sevrage sous surveillance médicale, alors qu’il faut prendre soin, chez les patients qui ne sont pas en mesure de cesser d’utiliser des benzodiazépines, d’assurer l’éducation du patient et la sécurité liée à la co-administration d’opioïdes et de benzodiazépines. Idéalement, il faudrait explorer d’autres approches de gestion des médicaments pour les personnes souffrant de troubles anxieux. La nécessité de recourir à des pharmacothérapies simultanées pour gérer les troubles cooccurrents exige également une évaluation minutieuse du risque d’interactions médicamenteuses potentielles. d’interactions médicamenteuses.
Sevrage des opioïdes sous surveillance médicale
L’arrêt brusque (par exemple, le sevrage immédiat) ou contrôlé des opioïdes (également connu sous le nom de “tapering”) a toujours été connu sous le nom de “désintoxication” ; cependant, les termes “sevrage sous surveillance médicale” (indiquant une surveillance médicale et le traitement des symptômes de sevrage) et “sevrage sous surveillance sociale” (indiquant un sevrage sans surveillance médicale dans un environnement de conseillers ou de pairs) sont de plus en plus préférés. Le terme ” désintoxication ” est considéré comme stigmatisant (tout comme d’autres termes utilisés dans le passé) car il suggère que la personne souffrant d’OUD est toxique plutôt que d’avoir un trouble médical. L’objectif est de parvenir à un état sans opioïdes dans un court laps de temps. Cependant, il n’existe pas de preuves que le sevrage supervisé soit un traitement efficace de l’OUD, même s’il est couramment utilisé. Il n’est pas surprenant que le sevrage aigu soit inefficace dans le traitement de l’OUD, en particulier lorsque des preuves indiquent que des adaptations neuronales durables se produisent en réponse à une exposition chronique aux opioïdes et qu’elles ne sont pas immédiatement réversibles. En outre, le sevrage supervisé, même lorsqu’il est associé à des thérapies comportementales, est associé à de mauvais résultats de traitement à moyen et long terme et à un risque accru d’overdose et de décès dans les études contrôlées. De même, les périodes d’abstinence forcée, comme l’incarcération et le sevrage résidentiel supervisé, sont souvent suivies d’une rechute avec un risque accru de surdose fatale et non fatale (probablement en raison de la perte de tolérance et de sensibilité aux effets des opioïdes).
Cependant, le sevrage sous surveillance médicale est approprié ou essentiel dans certaines circonstances. Par exemple, lorsque les patients passent d’opioïdes illicites à un traitement antagoniste des opioïdes (naltrexone), qui nécessite une abstinence avant l’initiation pour éviter un sevrage précipité. En outre, certains patients peuvent rechercher un traitement dans le but personnel de ne plus prendre de médicaments. En effet, la nécessité de s’abstenir de prendre des médicaments (en particulier l’OAT) est parfois imposée comme condition d’emploi. Dans ces cas, il est essentiel que les patients soient informés des risques accrus de rechute et de surdose, et qu’ils bénéficient d’une éducation sur l’inversion de l’overdose, de naloxone et d’une thérapie de soutien pour faciliter leur réussite.
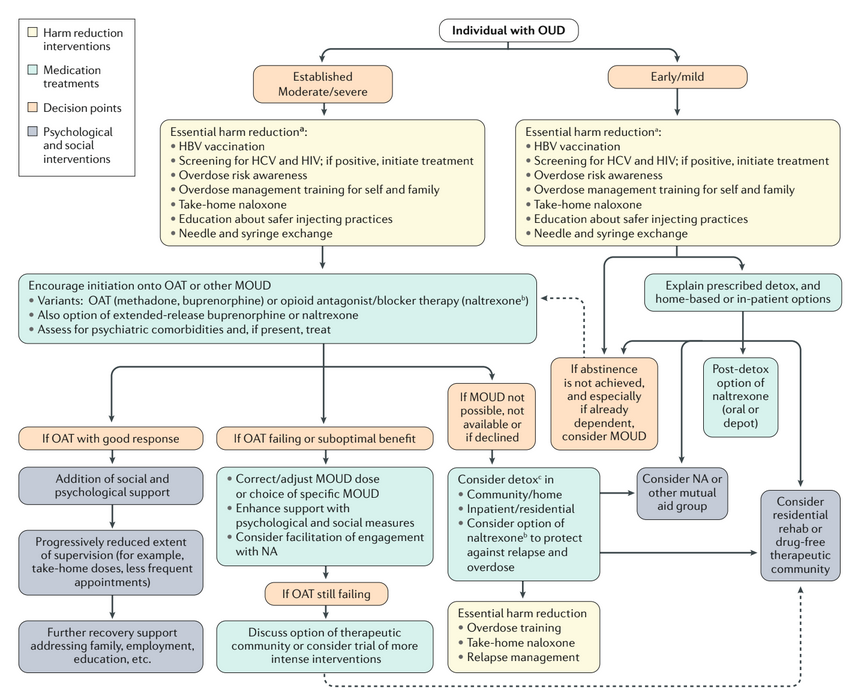
le traitement peut faire appel à des médicaments et à des interventions psychologiques et sociales. La prise en charge nécessite également d’envisager des interventions de réduction des risques.
a Les stratégies de réduction des risques ne se limitent pas à ce qui se passe avant le début de l’OUD et doivent être proposées aux personnes qui ne sont pas en traitement ainsi que pendant toute la durée du traitement de l’OUD.
b Bien qu’approuvée pour le traitement de l’OUD, la naltrexone est généralement associée à de mauvais résultats ; l’OAT est généralement préférée.
c Bien qu’il n’y ait pas de preuves à l’appui du recours à la désintoxication seule pour le traitement de l’OUD, cette approche est encore utilisée dans de nombreux pays.
Le sevrage des opioïdes se caractérise par une hyperactivité autonome, et le traitement vise généralement à atténuer les signes et symptômes du sevrage, qui comprennent l’anxiété, les nausées, les vomissements, la diarrhée, les crampes, les douleurs dorsales, les bouffées de chaleur et de froid, l’insomnie et le larmoiement. Historiquement, le sevrage sous surveillance médicale était souvent proposé comme un traitement hospitalier de durée variable. Toutefois, en raison de l’augmentation des coûts médicaux et du fait que le sevrage des opioïdes, bien que très désagréable et inconfortable, met rarement la vie en danger, le sevrage médicalement supervisé est maintenant souvent offert dans des établissements de traitement ambulatoire et résidentiel, bien que les taux d’achèvement soient généralement plus faibles dans un établissement ambulatoire. Le sevrage médicalement supervisé est souvent géré par des doses dégressives d’un agoniste opioïde (comme la méthadone) ou d’un agoniste partiel (buprénorphine) sur une période allant d’une semaine à plusieurs mois. Les agonistes α2-adrénergiques (clonidine ou lofexidine) sont également utilisés car ils suppriment les signes de sevrage des opioïdes. Les médicaments auxiliaires, tels que les agents anxiolytiques, les analgésiques, les aides au sommeil, les anti-émétiques et les anti-diarrhéiques, peuvent augmenter le confort et diminuer ces symptômes de sevrage prédominants. En général, des réductions plus lentes sur des périodes plus longues conduisent à une moindre consommation illicite pendant un sevrage sous surveillance médicale.
Traitement avec le MOUD
Les pharmacothérapies les plus courantes pour le traitement du de l’OUD (méthadone, buprénorphine et naltrexone) sont le plus souvent utilisées dans le cadre d’un traitement ambulatoire pour les adultes avec des niveaux variables de supervision et d’intensité de soins. Les politiques et les modèles de soins varient considérablement d’un pays à l’autre. pays, allant d’une approche très restrictive (telle que la médication sous supervisée par une clinique) à des fournitures étendues à emporter à la maison.
Les traitements par agonistes μ-opioïdes.
La méthadone et la buprénorphine ont des profils pharmacologiques distincts mais exercent toutes deux une activité par le biais du récepteur μ-opioïde. Ces médicaments sont les pharmacothérapies les plus couramment utilisées pour le traitement de l’OUD dans le monde et figurent sur la liste des médicaments essentiels de l’OMS273. Lorsqu’ils sont stabilisés à une dose quotidienne efficace, ces deux médicaments suppriment les signes et les symptômes de sevrage des opioïdes, réduisent l’état de manque et produisent un blocage des opioïdes (c’est-à-dire l’atténuation ou le blocage complet de l’effet de tout opioïde non prescrit, comme l’héroïne) à des doses suffisamment élevées. Dans les cas d’entretien avec des agonistes opioïdes ou des agonistes partiels, le blocage opioïde est un antagonisme fonctionnel résultant de la tolérance croisée et de l’occupation des récepteurs. Bien que la méthadone et la buprénorphine soient toutes deux efficaces, les patients peuvent choisir une thérapie plutôt que l’autre en raison de la disponibilité, de la commodité, du besoin de plus ou moins de structure (par exemple, les patients instables ou ceux qui sont au début du traitement peuvent avoir besoin de doses supervisées plus fréquentes), de la réponse thérapeutique et de la tolérance. En outre, il existe une variabilité mondiale considérable dans l’utilisation de la buprénorphine par rapport à la méthadone pour l’OUD et dans les directives sur l’induction et la surveillance post-induction. Les patients peuvent rester sous traitement à la méthadone et à la buprénorphine pendant des durées variables, beaucoup d’entre eux poursuivant le traitement pendant plusieurs années. En général, s’agissant d’un trouble chronique, il est communément admis que les patients reçoivent un traitement aussi longtemps qu’ils en ont besoin et qu’ils en tirent profit. Bien que l’OAT soit considéré comme le traitement le plus efficace disponible pour l’OUD, il n’est pas parfait, car il peut y avoir des rechutes et la rétention dans le traitement n’est pas optimale. En outre, dans de nombreux cas, le clinicien et le patient, ainsi que le décideur, doivent prendre en compte les aspects psychosociaux plus larges pour en tirer un bénéfice plus complet.
La méthadone est un agoniste complet des récepteurs μ-opioïdes et un antagoniste des récepteurs NMDA qui est efficace lorsqu’il est administré par voie orale. Ce médicament est utilisé dans de nombreux pays et est généralement délivré sous surveillance quotidienne directe, du moins au début. En raison de sa longue demi-vie (~24 heures) et de sa tendance à s’accumuler avec des doses répétées, l’initiation du traitement commence par une faible dose et augmente lentement. Des doses plus élevées de méthadone entraînent une réduction plus importante de la consommation d’héroïne et d’autres opioïdes non prescrits. L’arrêt de la méthadone entraîne un sevrage dans tous les cas et, en raison de sa longue durée d’action (demi-vie de 24-40 heures), ce syndrome de sevrage peut se prolonger. En conséquence, l’arrêt du traitement par la méthadone s’effectue généralement par une réduction lente des doses sur plusieurs semaines ou mois. La méthadone est principalement métabolisée par le CYP3A (ainsi que par le CYP2D6 et le CYP1A2) et les concentrations plasmatiques peuvent être considérablement modifiées par l’utilisation concomitante d’autres médicaments ayant des voies métaboliques communes. Les médicaments ayant des propriétés d’induction enzymatique peuvent accélérer le métabolisme de la méthadone (comme la phénytoïne et la rifampicine), diminuant ainsi les concentrations plasmatiques et entraînant des symptômes de sevrage278. À l’inverse, d’autres médicaments, tels que les inhibiteurs de P4503A, peuvent empêcher le métabolisme de la méthadone, entraînant des concentrations plasmatiques de méthadone plus élevées que prévu et augmentant la sédation et le risque de surdosage. Les médicaments qui sont souvent coprescrits avec la méthadone et qui ont le potentiel de modifier son métabolisme comprennent les inhibiteurs de la protéase pour le VIH et les agents antifongiques, ce qui justifie une surveillance supplémentaire de la sécurité. Un autre problème de sécurité lié à l’utilisation de la méthadone est sa propension à prolonger l’intervalle QT cardiaque, en particulier à des doses plus élevées, avec des recommandations cliniques suggérant une électrocardiographie de base, un dépistage des facteurs de risque préexistants et une surveillance périodique, en particulier lors des augmentations de dose.
La buprénorphine est un agoniste partiel des récepteurs μ-opioïdes ainsi qu’un antagoniste des récepteurs κ-opioïdes et possède des propriétés d’agoniste partiel des récepteurs de la nociception. Il est délivré par voie transmuqueuse sous forme de formulation sublinguale ou buccale (dans les formulations à libération immédiate) et sous forme d’injection ou d’implant (dans les formulations à libération prolongée). En tant qu’agoniste partiel des récepteurs μ-opioïdes, il constitue généralement une alternative plus sûre aux agonistes complets des récepteurs opioïdes tels que la méthadone. En tant qu’agoniste partiel des récepteurs μ-opioïdes, l’initiation de la buprénorphine peut initialement précipiter le sevrage opioïde si d’autres opioïdes occupent encore substantiellement le récepteur μ-opioïde. Par conséquent, le risque de précipitation du sevrage est réduit en prolongeant l’intervalle entre la dernière dose d’opioïde et le début de la buprénorphine pour permettre l’émergence d’un léger sevrage, en introduisant une faible dose initiale de buprénorphine et en diminuant le niveau de médication opioïde antérieure avant de commencer le traitement par la buprénorphine (en particulier pour les patients sous opioïdes à action prolongée comme la méthadone qui souhaitent passer à la buprénorphine). L’induction typique de la buprénorphine exige que le patient s’abstienne d’utiliser des opioïdes pendant une période suffisante pour permettre aux signes de sevrage des opioïdes d’apparaître (par exemple, cela peut nécessiter une abstinence d’une nuit pour une personne utilisant de l’héroïne). Des essais cliniques randomisés ont montré que la buprénorphine est aussi efficace que la méthadone en ce qui concerne l’engagement et la rétention dans le traitement et la réduction de l’usage illicite d’opioïdes, avec des résultats comparables à long terme. La buprénorphine existe également en association avec la naloxone, qui est censée dissuader un éventuel mésusage par voie parentérale en précipitant les symptômes de sevrage ; toutefois, cet effet dissuasif ne se produit pas toujours, surtout si des stratégies sont utilisées pour l’éviter ou le minimiser. La buprénorphine (seule ou associée à la naloxone) et la méthadone sont parfois détournées et mal utilisées. L’équilibre entre la disponibilité du traitement à la méthadone et à la buprénorphine et l’utilisation de la buprénorphine ou d’une combinaison buprénorphine/naloxone varie considérablement dans le monde.
Les formulations à libération prolongée de la buprénorphine sont plus récentes et, par conséquent, on ne dispose que des premières preuves de leurs avantages. Il existe au moins trois formulations à libération prolongée. Un implant sous-cutané (Probuphine en Amérique du Nord ; Sixmo en Europe, Titan Pharmaceuticals et Molteni Farma) a reçu une autorisation réglementaire aux Etats-Unis, au Canada et en Europe et offre une couverture stable à des niveaux plasmatiques modérés pendant 6 mois, un ECR ayant constaté une non-infériorité par rapport à la buprénorphine sublinguale quotidienne pour un traitement à faible dose. Une buprénorphine injectable à dépôt à action prolongée, sous-cutanée, à dose plus élevée (Sublocade, Indivior), administrée mensuellement, a reçu l’approbation réglementaire aux États-Unis. En outre, une deuxième formulation injectable sous-cutanée à action prolongée (Buvidal (Brixadi), Camurus) a été approuvée en Europe et en Australie avec une gamme de formats de dose et de formulations qui peuvent être administrées chaque semaine et chaque mois pour permettre un dosage individualisé (cette formulation a également été approuvée aux Etats-Unis mais pas encore commercialisée). Les formulations de buprénorphine à libération prolongée peuvent offrir une protection contre le détournement et améliorer l’observance du traitement par le patient ; cependant, ces résultats n’ont pas encore été évalués de manière systématique avec ces produits relativement nouveaux.
D’autres agonistes opioïdes ont également été utilisés, quoique moins fréquemment, pour le traitement de l’OUD. Par exemple, en Autriche et ailleurs, la morphine à libération lente a été utilisée d’une manière similaire à la méthadone pour le traitement d’entretien et avec des avantages similaires. En outre, la l-méthadone (le stéréoisomère l-énantiomère de la méthadone) a été utilisée en Allemagne, bien que l’étendue des avantages par rapport à la méthadone racémique reste incertaine. Les avantages du traitement d’entretien à la dihydrocodéine ont également été signalés.
Une approche sensiblement différente du traitement par la diamorphine prescrite (héroïne pharmaceutique) a gagné en crédibilité depuis que plusieurs essais randomisés en Europe et au Canada ont montré des résultats positifs. Ces essais menés en Suisse, aux Pays-Bas, en Allemagne, au Royaume-Uni et au Canada ont tous démontré un bénéfice substantiel, précoce et durable, un désengagement de la consommation d’héroïne illicite et du comportement criminel associé, ainsi qu’une réduction de la mortalité chez des personnes précédemment classées comme ne répondant pas à d’autres thérapies. Le traitement à la diamorphine est intensif, nécessitant une présence plusieurs fois par jour pendant des mois et des années pour une injection sous surveillance, et il est coûteux et politiquement difficile, mais les avantages dans une population autrement non réceptive ont conduit à son introduction au moins sur une base locale dans plusieurs pays, y compris la Suisse, les Pays-Bas, le Canada, le Royaume-Uni et le Danemark, spécifiquement pour les personnes souffrant d’OUD réfractaire chronique. Grâce à un nombre croissant d’essais cliniques randomisés démontrant la faisabilité et les avantages de cette approche, celle-ci a été sérieusement envisagée, à plus grande échelle, pour les patients ne répondant pas au traitement. Des avantages similaires ont été signalés pour les patients souffrant d’OUD qui ne répondent pas au traitement d’entretien supervisé à l’hydromorphone injectable.
Traitement par antagonistes μ-opioïdes.
La naltrexone, un antagoniste des récepteurs μ-opioïdes et des récepteurs κ-opioïdes, est disponible depuis les années 1980. Malgré sa capacité de blocage très efficace, la naltrexone orale est rarement prescrite en raison des problèmes d’initiation et de la faible adhésion au traitement. En effet, l’initiation de la naltrexone orale nécessite une abstinence d’opioïdes, sinon les symptômes de sevrage sont précipités (voir Sevrage médicalement supervisé, ci-dessus). Les instructions du médicament suggèrent une période de 7 à 10 jours d’abstinence d’opioïdes avant l’initiation de la naltrexone ; cependant, pour de nombreux patients, il est très difficile, voire impossible, de mener à bien un sevrage médicalement supervisé pour atteindre ce statut. L’adhésion à la naltrexone est améliorée lorsque l’observance du traitement est forcée305 ou renforcée. Malgré sa capacité à produire un blocage des opioïdes, un examen systématique d’études contrôlées a conclu que les données probantes n’appuient pas la supériorité de la naltrexone orale par rapport au placebo pour la prise en charge de l’OUD. De plus, le sevrage du traitement à la naltrexone peut augmenter le risque d’overdose.
La naltrexone en dépôt à action prolongée, qui est injectée par voie intramusculaire et est efficace pendant un mois, permet de contourner certains de ces défis, mais pas tous. En effet, une étude comparant cette formulation de naltrexone à la buprénorphine/naloxone sublinguale quotidienne a mis en évidence la difficulté d’initier la naltrexone, 28 % des personnes assignées à la naltrexone n’ayant pas réussi l’induction, contre seulement 6 % de celles qui n’ont pas commencé la buprénorphine/naloxone. Pour les sous-groupes qui ont réussi à initier le traitement, la rechute (définie comme 4 semaines consécutives d’utilisation d’opioïdes par dépistage de drogues dans l’urine ou par autodéclaration ou 7 jours d’utilisation autodéclarée), ne différait pas entre les groupes. Des produits de naltrexone implantés sont disponibles, mais l’approbation réglementaire de ces formulations n’a été accordée qu’en Russie et dans quelques autres pays adjacents. À ce jour, aucune étude d’efficacité comparative entre la naltrexone à libération prolongée et la buprénorphine à libération prolongée n’a été menée.
Une analyse de cohorte a évalué le rôle protecteur du MOUD dans les 12 mois suivants après que des adultes aient survécu à une surdose d’opioïdes. Dans l’ensemble, les traitements par buprénorphine et méthadone – mais pas la naltrexone orale ou en dépôt – ont été associés à une réduction de la mortalité toutes causes confondues par rapport aux personnes n’ayant pas reçu de MOUD. Enfin, une étude a révélé que le traitement par buprénorphine, mais pas par naltrexone, était associé à une réduction du risque de surdose d’opioïdes par rapport à l’absence de traitement. En résumé, ces résultats soutiennent l’efficacité supérieure de la buprénorphine et de la méthadone par rapport à la naltrexone dans la pratique clinique.
Les thérapies comportementales
Les thérapies comportementales sont de plus en plus souvent proposées comme une composante supplémentaire d’un programme de traitement complet de l’OUD, aux côtés de conseils non spécifiques et d’un soutien social général. En effet, les thérapies comportementales sont parfois une partie obligatoire de l’approbation et de la certification des programmes. Toute une gamme d’interventions comportementales a été utilisée pour le traitement de l’OUD, notamment la thérapie cognitivo-comportementale, les techniques d’adaptation, l’entretien motivationnel, les groupes d’entraide, le conseil ou le soutien par les pairs, les coachs de rétablissement et la gestion de cas. La disponibilité des preuves scientifiques soutenant l’efficacité de ces interventions varie considérablement, mais plusieurs interventions sont approuvées par des organismes nationaux.
En général, ces approches n’ont pas l’ampleur des preuves solides qui sous-tendent l’OAT et sont surtout considérées pour leurs avantages synergiques potentiels. Les méthodes de gestion des contingences ont une taille d’effet plus importante que les autres interventions comportementales et, par conséquent, cette intervention a suscité un intérêt particulier. Cependant, une revue Cochrane sur les bénéfices des interventions psychosociales en complément d’une pharmacothérapie par agonistes opioïdes a conclu que les thérapies psychosociales adjointes n’apportaient pas de bénéfices statistiquement significatifs par rapport à la pharmacothérapie seule. Diverses autres études contrôlées ont tenté de distinguer la contribution indépendante relative du conseil ou de la thérapie comportementale du MOUD mais n’ont pas toujours démontré une contribution solide des thérapies comportementales. De plus, les études sur les soins provisoires, qui consistent à fournir l’OAT uniquement lorsque les créneaux de traitement ne sont pas disponibles pendant une période donnée, à titre de mesure palliative, ont fait état de réductions significatives de la consommation d’opioïdes illicites en l’absence d’intervention comportementale.
Entraide et réhabilitation résidentielle
Les groupes d’entraide, dont les Alcooliques Anonymes (AA) et les Narcotiques Anonymes (NA) sont les plus connus, apportent un soutien important à de nombreuses personnes en voie de rétablissement. Ces programmes se distinguent par le fait qu’ils fonctionnent en dehors du cadre des services professionnels et sont souvent coordonnés par des personnes qui sont elles-mêmes en voie de guérison d’un trouble lié à la consommation de substances. Ils travaillent classiquement avec des personnes déjà abstinentes (même si c’est de manière fragile), peuvent offrir un soutien inestimable aux moments de crise et peuvent permettre une réintégration sociale plus complète. Il existe d’autres formes de ces groupes, qui incluent parfois l’intervention d’un psychologue ou d’un médecin. Ces groupes opèrent généralement dans la communauté, bien qu’on puisse également les trouver dans des environnements spécifiques tels que les prisons ou les hôpitaux. NA et AA adhèrent au travail en “12 étapes” (voir https://12step.org/references/12-step-versions/na) et, bien qu’ils soient nés et se soient développés principalement en Amérique du Nord, les groupes NA ont proliféré ces dernières décennies dans plus de 100 pays, dont l’Iran et une grande partie de l’Asie du Sud-Est. Certains éléments du soutien mutuel des 12 étapes sont applicables aux personnes suivant un traitement médicamenteux (comme la méthadone ou la naltrexone), mais cela n’est que rarement pris en compte. Les recherches rigoureuses sur l’efficacité de NA ont été rares et n’ont été menées plus sérieusement que récemment. Dans un domaine étroitement lié, une nouvelle revue Cochrane sur l’AA et le trouble de la consommation d’alcool a examiné non seulement l’AA mais aussi la facilitation des 12 étapes et a trouvé un bénéfice comparable ou supérieur de l’AA et de la facilitation des 12 étapes par rapport aux interventions formelles ambulatoires et psychologiques, avec un meilleur rapport coût-efficacité.
La réadaptation résidentielle peut s’articuler autour du travail en 12 étapes, comme dans le modèle du Minnesota ou, par exemple, dans le réseau des cliniques Betty Ford, qui exigent généralement une résidence de 28 jours suivie d’un suivi communautaire. Certains établissements de réadaptation résidentielle peuvent impliquer une résidence à plus long terme, comme c’est le cas des communautés thérapeutiques telles que Phoenix House ou DayTop, dans lesquelles la communauté, avec l’obligation de développer et de travailler sur les relations, est la thérapie elle-même. Ce type de traitement résidentiel a de fervents défenseurs et des succès individuels impressionnants, bien qu’il existe peu d’études contrôlées ayant évalué de manière indépendante l’efficacité de ces programmes. Comme pour tous les programmes de traitement, les risques de rechute, en particulier à la sortie de l’établissement, et d’issue fatale de n’importe quel traitement sont importants. l’établissement, et d’une issue fatale en cas d’overdose, doivent être doivent être pris en compte.
Interventions en cas d’overdose
L’overdose d’opioïdes est désormais l’une des principales causes de décès prématuré dans de nombreux pays. Plus de 80 % des overdoses d’opioïdes se produisent en présence d’autres personnes et peuvent donc être évitées grâce à une intervention précoce efficace. L’éducation est essentielle, tout comme la formation à la gestion provisoire des overdoses en attendant les soins médicaux d’urgence pour les personnes qui consomment des drogues, les membres de leur famille et leurs pairs afin de s’assurer qu’ils sont conscients du risque d’overdose. Une formation à la gestion des overdoses, souvent accompagnée d’une formation à l’administration de l’antidote opioïde (naloxone), est de plus en plus souvent dispensée (comparable à la formation dispensée aux familles et aux pairs des personnes souffrant d’épilepsie, de diabète sucré ou d’anaphylaxie) aux personnes en traitement et, surtout, à celles qui ne sont pas en contact avec les services de traitement des dépendances. Ce dernier point est toutefois plus difficile à atteindre, alors que c’est cette population qui est la plus exposée au risque d’overdose. Des périodes et des contextes où la mortalité par overdose est particulièrement élevée ont été identifiés, tels que la sortie de prison, la sortie de l’hôpital ou la sortie des centres de réhabilitation, et ces moments représentent des opportunités pour une action ciblée.
La naloxone est utilisée depuis des décennies, par injection, pour inverser le cours d’une surdose d’opioïdes (y compris l’héroïne) à l’hôpital, dans les services de transport d’urgence et, maintenant plus largement, dans la communauté grâce à la fourniture et à l’administration par des non-professionnels. Ce traitement est bien établi en médecine d’urgence et peut être administré par voie intraveineuse, intramusculaire ou sous-cutanée. Des sprays nasaux de naloxone concentrée efficaces ont été mis au point plus récemment, ce qui devrait élargir encore le potentiel de la réanimation communautaire. Au moins trois formulations intranasales de naloxone concentrée ont été approuvées dans le monde, avec une vitesse d’action similaire à celle de l’administration intramusculaire (c’est-à-dire un temps comparable pour atteindre la concentration maximale et le plateau plasmatique) (Narcan, Adapt Pharma ; Nalscue, Indivior ; Nyxoid, Mundipharma), ces sprays nasaux de naloxone concentrée étant désormais disponibles aux États-Unis, au Canada, en Europe et en Australie. Un dispositif d’auto-injection (Evzio, Kaleo) a également été approuvé aux États-Unis. Il est important de noter que la naloxone a une demi-vie plus courte que certains opioïdes qui pourraient être à l’origine du surdosage et qu’il existe donc un risque de retour des symptômes du surdosage, ce qui peut nécessiter une attention médicale supplémentaire.
Milieux de traitement
Bien que la plupart des traitements contre l’OUD soient dispensés dans des établissements spécialisés ou de soins primaires (généralistes), il est essentiel d’initier et/ou de dispenser le traitement dans d’autres établissements pour atteindre les patients qui n’ont peut-être pas encore de plan de soins établi. Les personnes souffrant d’OUD se présentent fréquemment aux services d’urgence des hôpitaux pour des complications liées à leur consommation de drogues. Ce point de contact est une occasion potentielle d’impliquer le patient et de l’orienter vers des soins. Par conséquent, les interventions dans les salles d’urgence ont inclus un dépistage et un diagnostic élargis des troubles liés à la consommation de substances, de brèves interventions de conseil, une formation au surdosage de naloxone, un traitement sur place du sevrage, une induction avec de la buprénorphine et un lien avec les soins communautaires. De même, l’initiation d’un traitement en milieu hospitalier, suivie d’un lien vers des soins de suivi après la sortie de l’hôpital, est une autre stratégie permettant de faire participer les patients présentant un risque élevé de morbidité et de mortalité et d’initier des soins fondés sur des données probantes.
Le système de justice pénale, y compris les prisons, les bureaux de probation, les bureaux de libération conditionnelle et les systèmes de tribunaux pour toxicomanes, est un autre point de contact important pour la prestation potentielle de soins. En raison de l’augmentation significative du risque d’overdose mortelle après la libération de la prison ou de l’établissement pénitentiaire, plusieurs pays ont mis en place un traitement avec des MDP soit pendant l’incarcération, soit au moment de la libération, y compris la méthadone, la buprénorphine et la naltrexone, et ont démontré une réduction du taux d’overdose mortelle après la libération.
Qualité de vie
Observer les trajectoires du trouble de l’usage d’opioïdes
Des études longitudinales ont montré que les personnes atteintes d’OUD passent de la vie dans la communauté et de la consommation de drogues à l’incarcération, au traitement et au rétablissement, à de multiples reprises au cours de ce que l’on appelle une carrière de toxicomane ou de traitement. Plusieurs études ont indiqué que la durée des épisodes de traitement augmente avec le temps et que le pourcentage de survivants qui parviennent à l’abstinence grâce au traitement augmente également avec le temps. En outre, plus la durée de l’abstinence est longue, plus la probabilité d’une abstinence continue est grande. Cependant, le taux de décès dans certaines études longitudinales atteint 50 % et la probabilité d’un engagement continu dans un traitement et d’une abstinence de l’utilisation d’opioïdes illicites est de 10 à 20 % de l’échantillon initial après 20 à 30 ans. Quelle que soit la cohorte ou le groupe étudié, les résultats attendus au fil du temps en dehors du traitement sont médiocres.
Les patients souffrant d’OUD ont un risque de décès nettement plus élevé que les personnes n’en souffrant pas. En effet, les taux de décès sont 10 à 14 fois plus élevés chez les personnes souffrant d’OUD que les taux ajustés selon l’âge chez les personnes sans OUD. Le risque principal est le décès par overdose, mais les décès dus à d’autres causes, par exemple le suicide ou les maladies infectieuses (tant aiguës, comme la pneumonie ou la septicémie, que chroniques, comme l’hépatite ou le VIH), sont également plus fréquents chez les personnes souffrant d’OUD. L’augmentation du nombre de personnes atteintes d’OUD qui meurent d’overdose a été identifiée comme une cause de la réduction de l’espérance de vie des Américains blancs de la classe moyenne et de la classe ouvrière, la première diminution depuis l’effet initial du VIH dans les années 1980. En effet, les Etats-Unis ont connu une augmentation sans précédent des décès dus à l’empoisonnement aux opioïdes depuis 1999, avec des taux de croissance exponentiels au cours des 5 dernières années (voir Epidémiologie, ci-dessus). D’autres pays n’ont pas été aussi sévèrement touchés, bien que des augmentations des taux de mortalité aient été rapportées dans de nombreux pays, en particulier au Canada, en Australie et au Royaume-Uni. Aux États-Unis, les décès dus à l’épidémie de surdoses d’opioïdes, combinés à l’augmentation des taux de suicide et de décès liés à l’alcool chez les personnes d’âge moyen, ont été décrits comme des “morts de désespoir”.
Effet du traitement sur les trajectoires d’OUD
Il a été démontré que le traitement du TUT réduit le risque de décès22, de contraction de maladies infectieuses, d’engagement dans le système de justice pénale354, et améliore la santé globale et la qualité de vie (QV). Cependant, à un moment donné, <25% des personnes ayant souffert d’un OUD actif au cours de l’année précédente se sont engagées dans un traitement au cours de cette année, et seulement un tiers de celles qui ont reçu un traitement aux Etats-Unis ont reçu un MOUD, bien que les traitements incluant des médicaments donnent des résultats nettement meilleurs que le traitement psychosocial seul. En fait, malgré une utilisation répandue aux États-Unis, les interventions psychosociales sans MOUD n’ont pas démontré une efficacité suffisante pour être recommandées.
La rétention continue du MOUD est un facteur de protection essentiel contre le retour à la consommation d’opioïdes, le risque de décès et d’autres conséquences négatives augmentant à l’arrêt du traitement. Bien qu’il soit initié comme un traitement à long terme, la rétention du traitement MOUD est souvent réduite par l’abandon ou la sortie du programme et devient de courte durée, avec des séjours moyens dans le traitement maintenu à la méthadone souvent à <1 an et pour la buprénorphine à <3 mois dans les études d’observation ; la plupart des études ont démontré un taux de rétention à 6 mois de <50%. Le nombre modal de doses dans une étude sur les injections mensuelles de dépôt de naltrexone était de une, et près de 60 % des patients abandonnaient après la première ou la deuxième injection. Il est urgent d’améliorer la rétention des patients dans les soins afin d’augmenter l’espérance de vie et de réduire le cycle entre le traitement, l’utilisation active dans la communauté et l’incarcération, qui conduit à une augmentation de l’espérance de vie. et l’incarcération, qui entraîne un risque accru de décès et une baisse de la moins bonne qualité de vie.
Récupération
Ces dernières années, l’accent mis sur le rétablissement en tant que concept multifactoriel comprenant la réduction de la consommation ou l’abstinence, mais aussi d’autres stratégies d’adaptation, l’amélioration des relations, un but ou un sens à la vie, et la santé physique, mentale et spirituelle325,367 a gagné en popularité en tant qu’objectif du traitement plutôt que la simple rémission des symptômes, en particulier aux États-Unis et au Royaume-Uni368,369. Dans la perspective du rétablissement, la rémission des symptômes du DSM-5 n’est pas, en soi, une mesure adéquate du résultat du traitement, qui devrait être plus large et inclure les composantes supplémentaires qui définissent le rétablissement. L’intérêt porté aux multiples facettes du rétablissement a conduit à l’élaboration de systèmes axés sur le rétablissement et de stratégies de soins centrées sur le patient.
L’accent mis sur le rétablissement et l’amélioration de la qualité de vie en tant que résultats du traitement a conduit à la reconnaissance de la nécessité de disposer d’outils permettant de mesurer ces concepts de manière adéquate. Les études sur ce que les patients souhaitent obtenir des programmes de traitement et de rétablissement présentent une forte corrélation avec les mesures de la qualité de vie, et le concept de soins axés sur le rétablissement ou centrés sur le patient s’articule autour de la réalisation des objectifs du patient en matière d’amélioration du fonctionnement dans de multiples domaines. Quelques études ont utilisé des mesures de la qualité de vie liées à la santé, comme le SF-6D ou l’EQ-5D, pour évaluer l’efficacité du traitement. Des efforts sont en cours pour mettre au point une mesure de la qualité de vie ou du rétablissement spécifique à l’OUD, bien qu’il y ait des avantages à mesurer la qualité de vie à l’aide d’un instrument de base qui couvre de multiples domaines autres que la santé, comme le WHOQOL-B, et qui peut être utilisé pour comparer la qualité de vie des patients atteints d’OUD à celle des personnes atteintes d’autres troubles ou des personnes en bonne santé. Un instrument de mesure de la guérison à cinq facteurs et 21 items, rapporté par les patients, a été élaboré et validé et est en cours d’adoption au Royaume-Uni et dans d’autres pays ; il pourrait s’avérer être une mesure qui répond au critère de saisie des résultats de la QDV centrée sur le patient et spécifique à la guérison de la dépendance.
Les corrélats de la guérison à long terme sont l’engagement dans un traitement continu, le soutien social pour l’abstinence et l’engagement dans des activités de vie significatives comme le travail. Des tentatives ont été faites On a tenté d’établir un lien entre la QV et la réduction de la consommation de substances, mais les premières recherches semblent indiquer que les améliorations de la QV sont davantage liées au développement d’un réseau social soutenant l’abstinence. qu’elle conduise à l’arrêt de toute consommation de drogue.
Perspectives
La science continue à apporter une contribution essentielle à l’avancement de la compréhension clinique, publique et politique de l’OUD. Cette compréhension est d’autant plus importante qu’il y a souvent un décalage entre la croyance publique de l’impact et la réalité réelle des preuves de l’impact fort de certains traitements et des preuves de l’impact faible d’autres approches, y compris la prévention primaire, malgré leur soutien populaire. Avec une estimation de 26,8 millions de personnes vivant avec l’OUD dans le monde, plus de 100 000 décès par overdose d’opioïdes par an et 50% des personnes qui s’injectent des drogues étant séropositives pour le VHC, l’OUD constitue un fardeau majeur pour les systèmes de santé ainsi qu’un fardeau individuel et familial. En outre, l’ampleur du problème ne cesse de croître. Un leadership public et politique, s’appuyant sur la science, est nécessaire pour obtenir le meilleur rendement des interventions existantes fondées sur des preuves et pour soutenir l’exploration et le développement d’interventions nouvelles ou améliorées.
Notre compréhension de l’OUD a fait un bond en avant ces dernières années. Une connaissance accrue des mécanismes cérébraux, de l’interaction entre la vulnérabilité génétique et familiale, des voies de développement et de l’influence du contexte et de l’environnement a approfondi notre compréhension de l’OUD. En outre, il est de plus en plus reconnu que ces facteurs peuvent exercer des influences différentes, pour le même individu, à différents moments, comme les influences sur l’initiation initiale de l’usage des opioïdes, ou la progression vers un usage plus problématique des opioïdes ou l’interaction entre le développement des problèmes et la recherche de traitement. En outre, ces facteurs auront une influence sur la vulnérabilité ultérieure à la rechute, même après que les problèmes d’OUD semblent initialement s’être résolus. semblent initialement avoir été résolus.
Malgré l’amélioration des connaissances en matière d’OUD, de nouveaux défis émergent. Les problèmes de dépendance aux opioïdes sur ordonnance sont de plus en plus reconnus comme un comme un défi majeur pour la santé individuelle et publique. Sur En outre, le marché des opioïdes fabriqués de manière illicite s’étend désormais bien au-delà de l’héroïne, avec une opioïdes synthétiques tels que le fentanyl et ses dérivés. dérivés. Le commerce sur Internet accroît encore la diversité diversité des voies d’accès à ces drogues, et la frontière entre les drogues la frontière entre les drogues fabriquées de façon pharmaceutique et les drogues n’est pas aussi clairement délimitée qu’on le pensait auparavant.
Heureusement, plusieurs traitements efficaces contre l’OUD sont disponibles. Cependant, il existe des aspects de l’OUD sur lesquels notre influence est plus faible, comme la persistance du comportement d’injection, les comorbidités de l’infection par le VIH et de l’infection chronique par le VHC, et le taux élevé de mortalité par surdose chez les personnes qui consomment des opioïdes. Même avec des traitements efficaces, l’adhésion aux médicaments est faible, les taux d’abandon sont élevés et le risque de rechute est important lorsque le traitement prend fin. En outre, les attitudes politiques et professionnelles à l’égard des traitements scientifiquement établis sont très variables d’un pays à l’autre, voire au sein d’un même pays. En conséquence, les scientifiques doivent s’engager dans un débat public et politique pour faire en sorte que la compréhension de l’OUD soit améliorée et que des traitements efficaces soient disponibles au moment où l’on en a besoin, sans que des effets dissuasifs contre-productifs n’entravent la recherche d’un traitement. Des liens plus larges avec les soins de santé et un engagement plus complet dans le traitement profiteront sans aucun doute aux individus et à la société.
Les points d’influence potentiels sur l’OUD sont multiples. La prévention doit inclure la prévention de la progression (par exemple, de l’usage initial à l’usage régulier, ou de l’usage oral à l’usage injectable) et la prévention des dommages associés tels que le VIH et le VHC (qui peuvent être évités, par exemple, par des changements dans le comportement sexuel et d’injection). Le traitement doit intégrer des interventions sociales et psychologiques aux côtés de médicaments à l’efficacité prouvée, le cas échéant. Il convient d’accorder une attention particulière aux points de transition critiques pour la santé, où il existe un risque de passage à un comportement plus gravement nocif, notamment parce que ces points de transition sont souvent associés à un changement d’organisation (comme la sortie de prison vers la communauté, ou le retour à la maison après un séjour à l’hôpital ou une rééducation). De nombreux dommages sont associés au mode de consommation de la drogue (c’est-à-dire qu’ils ne découlent pas nécessairement de la dépendance en soi) et les approches de réduction des dommages sont de plus en plus introduites pour réduire les dommages qui peuvent résulter même lorsque le comportement de consommation de drogue persiste. Parallèlement à l’attention portée aux médicaments, combinée aux efforts de la famille, de la communauté et de la société pour soutenir le rétablissement, il est important qu’il y ait une prise de conscience permanente du risque de rechute ultérieure et de la nécessité de prendre des mesures pour surveiller le bien-être et réduire le risque.
Nous avons aujourd’hui la chance de disposer d’une science de haute qualité qui nous permet de mieux comprendre le comportement des personnes souffrant d’OUD et d’orienter l’élaboration et la mise en œuvre d’interventions plus efficaces. Cela crée l’opportunité d’une politique intelligente pour augmenter le bien public. Elle nécessite souvent une coordination entre différents secteurs (par exemple, entre la santé et les forces de l’ordre ou entre la politique publique et la communauté locale) qui souvent problématique, et nécessite un engagement public et politique public et politique, ainsi que des progrès constants dans les des connaissances scientifiques et des améliorations de la prévention et des traitements.
