Koob, G. F. (2020). Neurobiology of opioid addiction: opponent process, hyperkatifeia, and negative reinforcement. Biological psychiatry, 87(1), 44-53.
Abstract.
Les opioïdes sont des drogues puissantes qui usurpent et dominent la fonction de récompense des opioïdes endogènes et engagent une tolérance et un sevrage dramatiques via des neuroadaptations moléculaires et neurocircuitaires au sein du même système de récompense. Cependant, elles font également appel aux systèmes cérébraux du stress et de la douleur (somatique et émotionnelle) en produisant une hyperalgésie et une hyperkatifeia, qui entraînent un comportement prononcé de recherche de drogue par le biais de processus de renforcement négatif. L’hyperkatifeia (dérivé du grec “katifeia” qui signifie abattement ou état émotionnel négatif) est définie comme une augmentation de l’intensité de la constellation de signes et de symptômes émotionnels ou motivationnels négatifs du sevrage des drogues. Dans les modèles animaux, l’accès répété et prolongé aux drogues ou aux opioïdes entraîne des états émotionnels négatifs, reflétés par l’élévation des seuils de récompense, l’abaissement des seuils de douleur, un comportement de type anxieux et des réponses de type dysphorique. On suppose que ces états émotionnels négatifs qui entraînent un renforcement négatif découlent d’un dérèglement au sein du système des circuits neurochimiques clés qui interviennent dans les systèmes d’incitation, d’appréciation et/ou de récompense (dopamine, peptides opioïdes) dans le striatum ventral et du recrutement intersystème des systèmes de stress du cerveau (facteur de libération de la corticotropine, dynorphine, norépinéphrine, hypocrétine, vasopressine, glucocorticoïdes et facteurs neuroimmunitaires) dans l’amygdale étendue. L’hyperkatifeia peut s’étendre à une abstinence prolongée et interagir avec les processus d’apprentissage sous la forme d’un sevrage conditionné pour faciliter la rechute vers une recherche compulsive de drogues. Des preuves irréfutables indiquent que la plasticité des systèmes émotionnels de la douleur cérébrale est déclenchée par la prise aiguë de drogues excessives et se sensibilise au cours du développement de la consommation compulsive de drogues avec des sevrages répétés. Elle persiste ensuite dans l’abstinence prolongée et contribue au développement et à la persistance du comportement de recherche compulsive d’opioïdes.
La dépendance aux opiacés : Cadre heuristique
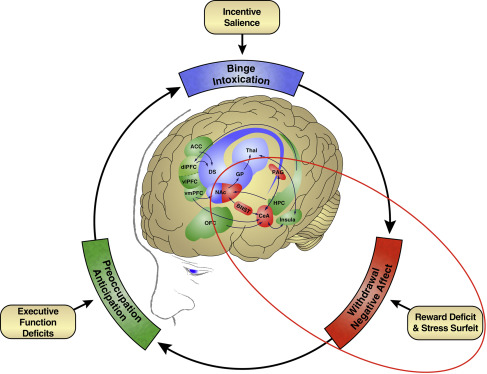
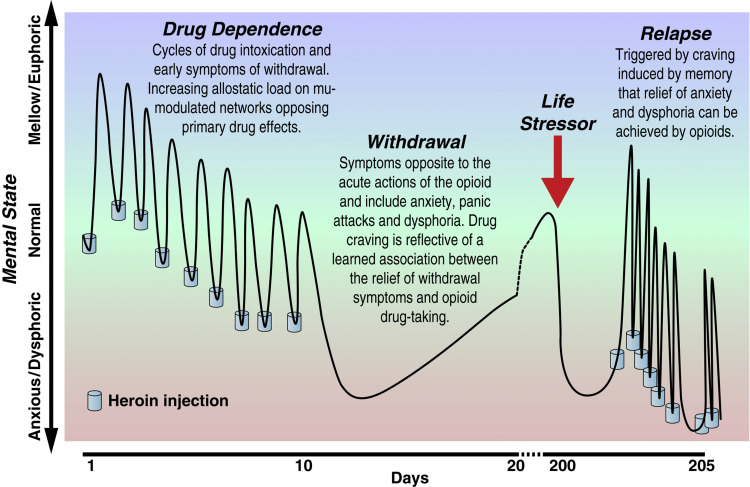
Le cadre heuristique de la dépendance aux opioïdes consiste en un cycle en trois étapes – ivresse/intoxication, sevrage/affect négatif et préoccupation/anticipation – qui représente un dérèglement dans trois domaines fonctionnels (saillance et/ou habitudes d’incitation, états émotionnels négatifs et fonction exécutive, respectivement) et qui est médié par trois éléments majeurs du neurocircuit (ganglions de la base, amygdale étendue et cortex préfrontal, respectivement). Les opioïdes sont une drogue classique de la dépendance, dans laquelle un modèle évolutif d’utilisation comprend une intoxication initiale intense associée à la prise de drogues par voie intraveineuse ou fumée, le développement d’une tolérance profonde et l’escalade conséquente de la consommation. L’abstinence entraîne une profonde dysphorie, un inconfort physique et des signes somatiques de sevrage. Une préoccupation intense pour obtenir des opioïdes (craving) se développe alors, précédant souvent les signes somatiques de sevrage. Ce besoin est lié aux stimuli associés à l’obtention de la drogue et aux stimuli associés au sevrage et aux états de stress internes et externes. Un modèle se développe dans lequel la drogue doit être administrée pour éviter la dysphorie et l’inconfort sévères de l’abstinence. Ainsi, la dépendance aux opiacés peut être définie comme une compulsion à rechercher et à prendre une drogue, une perte de contrôle dans la limitation de la consommation et l’émergence d’un état émotionnel négatif lorsque l’accès à la drogue est empêché.
D’un point de vue conceptuel, la prise excessive de drogue au stade de la frénésie/intoxication entraîne un processus de type allostatique, dans lequel la rupture de l’homéostasie de la récompense déclenche des réponses compensatoires dans les systèmes de récompense et de stress du cerveau pour générer le stade de sevrage/affect négatif et le stade de préoccupation/anticipation. Ces trois stades s’alimentent mutuellement, deviennent plus intenses et conduisent finalement à l’état pathologique connu sous le nom de dépendance (figure 1). Dans le cas des opioïdes en particulier, l’arrêt de la consommation de drogue entraîne inévitablement des états émotionnels négatifs de sevrage aigu et prolongé au stade de sevrage/affect négatif, qui génère une deuxième motivation à partir d’un renforcement négatif. L’abstinence prolongée incorpore des éléments résiduels d’états émotionnels négatifs et de besoin de repères et de contexte pour former la phase de préoccupation/anticipation. Le trouble de l’usage des opioïdes est désormais considéré comme un trouble à spectre tel que décrit par le DSM-5, qui fournit un cadre pour l’intensité des symptômes par rapport au nombre de symptômes présentés, montrant qu’un individu peut entrer dans le cycle de la dépendance à différents stades. Par exemple, dans le cas du trouble lié à l’utilisation d’opioïdes, tout comme dans le cas d’autres troubles liés à l’utilisation de substances, les personnes peuvent commencer à utiliser les opioïdes à des fins récréatives et passer au stade du sevrage et de l’effet négatif à mesure que le renforcement négatif évolue. Cependant, les opioïdes diffèrent de nombreuses autres substances addictives car le renforcement négatif peut être le point de départ, via l’automédication ou la douleur chronique. Cette étude se concentre sur le stade de sevrage/affect négatif, la relation avec la douleur émotionnelle et les circuits neurobiologiques qui sont engagés pour produire les états émotionnels négatifs qui conduisent au renforcement négatif.
Renforcement négatif dans la dépendance aux opiacés
Le renforcement négatif qui est associé à la recherche compulsive d’opioïdes découle du cadre bien établi des processus adverses. Dans ce cas, l’euphorie (processus a) produite par l’opioïde est suivie d’une dysphorie (processus b) qui s’accroît avec l’administration répétée et qui peut être assimilée au développement du sevrage et de la dépendance (voir le supplément pour plus de détails sur la théorie des processus adverses). Le développement du processus b reflète le développement d’un état émotionnel négatif en opposition aux effets hédoniques (processus a) de l’opioïde, y compris le malaise, l’irritabilité, l’alexithymie, l’anxiété, la dysphorie et les sentiments subjectifs de malaise et tout simplement de ne pas se sentir “hédoniquement normal”, qui sont tous également des symptômes de sevrage. Il a été proposé que cet état émotionnel hypernégatif, appelé hyperkatifeia, s’aggrave avec l’expérience répétée et que l’hyperkatifeia sensibilisée soit dissociable des signes somatiques de sevrage et des principaux troubles psychiatriques. Dans ce cas, le renforcement négatif devient la source de motivation de la recherche de drogues, dans laquelle l’individu s’efforce de réduire, de mettre fin ou de prévenir cet état émotionnel négatif sensibilisé. Par conséquent, une plus grande quantité et une utilisation plus fréquente de la substance précédemment gratifiante sont nécessaires pour maintenir ou approcher l’euthymie.
Ainsi, l’intoxication et le sevrage répétés des opioïdes entraînent une hypohédonie, une hyperkatifeia et une hyperalgésie répétées, ainsi que des réponses comportementales plus prononcées au stress que l’individu régule mal en prenant davantage de drogue (figure 1, figure supplémentaire S1 et supplément). Dans ce cadre, la consommation de substances est intensifiée ou renouvelée de manière compulsive (en cas de rechute) par des mécanismes de renforcement négatif parce qu’elle empêche ou soulage temporairement les symptômes émotionnels négatifs du sevrage ou de l’hyperkatifeia, et cette recherche compulsive de drogues défend un point de consigne hédonique qui gagne progressivement en charge allostatique et passe d’un état hédonique homéostatique à un état hédonique allostatique (voir le supplément pour une définition de l’allostase).
Des états émotionnels négatifs de type processus d’opposition ont été caractérisés chez l’homme par une abstinence aiguë et prolongée d’opioïdes, et des résultats similaires ont été observés dans des modèles animaux avec des opioïdes. Des réponses de type dysphorique chez les rongeurs, mesurées par des élévations des seuils de récompense par stimulation cérébrale, accompagnent le sevrage aigu des opioïdes. Un exemple peut-être plus convaincant de la dérégulation de type allostatique de la prise de drogue qui entraîne une hypohédonie est l’élévation des seuils de récompense qui est observée au cours de l’escalade de la prise d’héroïne chez les rats pendant un accès prolongé aux opioïdes (figure supplémentaire S2).
Hyperkatifeia : Bases neurobiologiques
L’hyperalgésie et l’hyperkatifeia sont des symptômes bien documentés du sevrage aigu et prolongé des drogues opioïdes, et tous deux reflètent directement des processus adverses qui ont une signification motivationnelle (voir le supplément). Le pouvoir motivationnel de ces états émotionnels douloureux et négatifs dans la conduite du renforcement négatif nécessite une élucidation plus approfondie des mécanismes neurobiologiques.
Une étude d’imagerie du connectome chez la souris a révélé une influence majeure de l’inactivation du gène du récepteur opioïde μ (Oprm1), montrant un changement spectaculaire dans la connectivité liée à l’aversion et/ou à la douleur plutôt que dans la connectivité de la récompense en utilisant une analyse sans hypothèse de la tractographie de diffusion combinée de l’imagerie par résonance magnétique fonctionnelle en état de repos. Ces résultats peuvent refléter un tonus plus fort des récepteurs opioïdes μ inhibiteurs ou une influence développementale sur les neurocircuits de l’affect négatif, du moins dans des conditions d’état de repos. Les altérations prédominantes dans les voies de récompense/aversion sont corrélées à des modifications comportementales majeures chez les souris mutantes Oprm1 en ce qui concerne les comportements liés à la douleur, aux émotions et à la récompense. L’examen des altérations de l’état des concentrateurs et les comparaisons statistiques directes entre groupes ont indiqué un remodelage prédominant des réseaux connus pour traiter les informations de valence négative. Ces réseaux comprenaient des structures telles que le gris périaqueducal (PAG), l’hippocampe, l’amygdale, le cortex cingulaire, le raphé médian et l’habenula.
En accord avec les résultats du connectome, des études de neurochimie et de neurocircuit ont montré que les neuroadaptations qui médient l’hyperkatifeia ont un point focal dans l’amygdale étendue. L’amygdale étendue comprend plusieurs structures de la partie basale du cerveau antérieur, notamment le noyau de la stria terminalis, le noyau central de l’amygdale, la substantia innominata sublenticulaire et une zone de transition dans la partie médiane du noyau accumbens (par exemple, la coquille). Les lésions du noyau central de l’amygdale ont bloqué le développement de l’aversion de place conditionnée induite par le sevrage de la morphine mais ont eu moins d’effet sur les signes somatiques du sevrage.
Un cadre conceptuel qui a été adopté pour expliquer les systèmes neuronaux qui sont censés servir de médiateurs à l’hyperkatifeia et conduire la composante motivationnelle des processus adverses de l’usage excessif d’opioïdes implique la régulation négative au sein du système des circuits cérébraux de récompense et le recrutement entre les systèmes des circuits cérébraux de stress. Une neuroadaptation intra-système a été définie comme un processus par lequel l’élément de réponse cellulaire primaire à la drogue dans un circuit neurochimique donné s’adapte lui-même pour neutraliser les effets de la drogue. En revanche, la neuroadaptation intersystème a été définie comme un changement de circuit dans lequel un autre circuit (c’est-à-dire un circuit de stress ou un circuit anti-récompense) est activé par un circuit de récompense. La persistance des effets opposés après le retrait de la drogue se traduit par le syndrome de sevrage émotionnel négatif décrit ci-dessus.
Neuroadaptations intra-système
Une source de neuroadaptations au sein du système implique des éléments de la fonction des récepteurs opioïdes qui médient la tolérance aux opioïdes, et cette tolérance s’étendrait aux effets gratifiants de la drogue. Les protéines G qui sont activées par le récepteur opioïde μ modulent l’activité de plusieurs seconds messagers et effecteurs cellulaires, ce qui peut générer des neuroadaptations à court et à long terme qui sont pertinentes pour la tolérance aux niveaux moléculaire et cellulaire. D’autres événements moléculaires et/ou cellulaires, en plus des cascades de signalisation des protéines G, contribuent à la signalisation des récepteurs opioïdes μ, y compris la désensibilisation des récepteurs, l’internalisation des récepteurs, les changements transcriptionnels et les changements structurels tels que le remodelage des épines dendritiques, et la tolérance au niveau cellulaire peut être la somme de ces multiples événements.
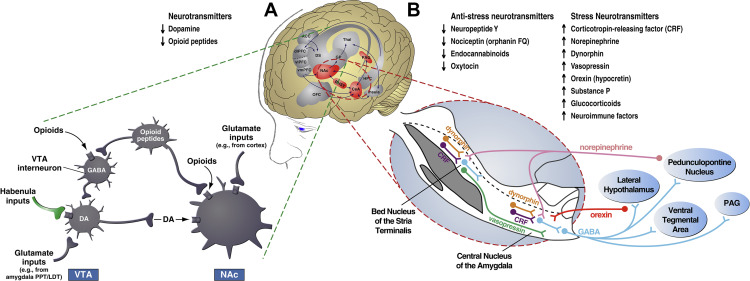
Au niveau du neurocircuit, les premières études ont montré que le sevrage précipité aux opiacés était associé à des diminutions des niveaux de dopamine extracellulaire dans le noyau accumbens et le système dopaminergique mésolimbique, avec des diminutions du tir des neurones dopaminergiques et des niveaux de dopamine extracellulaire pendant le sevrage aux opiacés (figure 2A). L’administration chronique de morphine est également associée à une diminution de la taille des neurones à dopamine dans l’aire tegmentale ventrale et à une augmentation de la sensibilité aux antagonistes des récepteurs de la dopamine. Ces changements cellulaires qui se produisent au cours du sevrage opioïde s’accompagnent d’une augmentation de l’activité de l’acide γ-aminobutyrique et d’une augmentation de la sensibilité aux récepteurs métabotropiques du glutamate, qui diminuent toutes deux la libération de glutamate dans l’aire tegmentale ventrale et entraînent une diminution du tir des cellules dopaminergiques.
Des études de tomographie par émission de positrons chez l’homme ont révélé une disponibilité de base plus faible des récepteurs D2 de la dopamine dans le striatum dorsal chez les sujets dépendants des opioïdes par rapport aux sujets témoins. Dans une étude qui a montré une diminution de la disponibilité des récepteurs D2 dans le noyau caudé gauche, la disponibilité des récepteurs D2 dans le putamen était corrélée négativement avec les années d’utilisation d’opioïdes. Un mécanisme permettant d’expliquer l’état hypodopaminergique est que les opioïdes déclenchent une cascade d’événements moléculaires qui impliquent l’adénosine monophosphate cyclique et finissent par activer la dynorphine, en particulier dans l’enveloppe du noyau accumbens.
L’habenula latéral est une structure cérébrale avec des connexions aux systèmes de récompense du cerveau, et il joue un rôle clé dans la médiation et le codage des états aversifs (Figure 2A ; voir également le supplément). L’activation de l’habenula latéral inhibe fortement les neurones dopaminergiques de l’aire tegmentale ventrale. On a donc émis l’hypothèse que la régulation de l’activité dopaminergique de l’aire tegmentale ventrale par l’habenula latéral était à la base des effets aversifs des drogues consommées et, par extrapolation, des effets aversifs du sevrage des drogues. L’administration dans l’habenula latéral de KN-62, un inhibiteur spécifique de la protéine kinase II dépendante du calcium/calmoduline, a éliminé l’aversion conditionnée par la naloxone chez des souris morphinodépendantes, une découverte qui est cohérente avec l’observation que l’utilisation chronique de morphine a induit la surexpression de la protéine kinase II dépendante du calcium/calmoduline dans l’habenula latéral. Chez l’homme, une augmentation de la connectivité habenula-striatum a été observée chez les patients consommateurs d’opioïdes qui présentaient un évitement et une aversion au retrait.
Neuroadaptations intersystèmes
En ce qui concerne les neuroadaptations intersystèmes, le recrutement des systèmes de stress cérébraux, y compris le facteur de libération de la corticotrophine (CRF), la noradrénaline et la dynorphine, est un substrat clé majeur qui est responsable des effets de stimulus aversifs du sevrage des opioïdes qui entraînent une recherche compulsive d’opioïdes (figure 2B). Les premiers travaux ont montré que l’antagonisme des récepteurs du CRF et des récepteurs noradrénergiques dans l’amygdale étendue bloquait les effets du stimulus aversif du sevrage opioïde. L’administration d’un antagoniste des récepteurs peptidiques CRF1/CRF2 dans le noyau central de l’amygdale a bloqué l’aversion de place conditionnée précipitée qui était produite par le sevrage aux opiacés. Le blocage de la fonction noradrénergique dans le noyau central de la stria terminalis a également bloqué les aversions de place induites par le sevrage des opioïdes. Ces mêmes systèmes neuropharmacologiques qui sont impliqués dans les effets aversifs du sevrage des opioïdes sont également impliqués dans la prise et la recherche compulsives de drogues qui sont associées à l’auto-administration intraveineuse à accès prolongé dans des modèles animaux. Les antagonistes des récepteurs du CRF et les antagonistes des récepteurs α1-adrénergiques ont tous deux diminué de manière dose-dépendante la prise de drogue de type compulsif chez les rats ayant un accès prolongé aux opioïdes.
À ce jour, aucune étude clinique n’a révélé l’efficacité des antagonistes des récepteurs CRF1 dans le traitement des troubles psychiatriques liés au stress, tels que la dépression majeure, l’anxiété généralisée, l’anxiété sociale ou l’état de stress post-traumatique. Les résultats de quelques études limitées menées en laboratoire sur des humains pour le trouble de la consommation d’alcool ont également été négatifs (41). Aucune étude en double aveugle sur le traitement de la dépendance n’a été réalisée. Une discussion approfondie de la raison de ces échecs thérapeutiques dépasse le cadre de cette revue, mais il est possible qu’il faille tester l’efficacité des antagonistes des récepteurs CRF1 pour des troubles ou symptômes psychiatriques particuliers, des sous-groupes de patients ou des circonstances dans lesquelles les circuits CRF-CRF1 pro-stress sont dynamiquement activés.
La dynorphine est libérée par les facteurs de stress, et le blocage du système des récepteurs opioïdesκ de la dynorphine bloque les effets aversifs du stress et produit des effets de type antidépresseur dans des modèles animaux de dépression. L’activation des récepteurs opioïdes κ induite par la dynorphine diminue la libération de dopamine dans le noyau accumbens et produit des aversions conditionnées. Peut-être plus convaincant encore, des études comportementales ont démontré de façon constante que les antagonistes des récepteurs κ opioïdes ne bloquent pas les effets gratifiants aigus (” de type euphorique “) des opioïdes, mais qu’ils bloquent la potentialisation de la récompense opioïde induite par le stress, la réintégration du comportement de recherche d’opioïdes induite par le stress et l’escalade de la consommation de drogues dans des modèles d’accès prolongé (figure supplémentaire S3).
L’activation du neuropeptide Y, de l’ocytocine et des systèmes endocannabinoïdes dans l’amygdale étendue peut atténuer l’augmentation de la réactivité au stress qui est associée au sevrage des opioïdes. Ainsi, l’administration chronique d’opioïdes dérègle les systèmes neuropharmacologiques qui interfèrent avec les systèmes de récompense et de stress dans le noyau accumbens et l’amygdale étendue pour diminuer la fonction de récompense et augmenter le stress et la douleur. Les systèmes de stress peuvent entraîner l’hyperkatifeia, et les systèmes antistress peuvent inverser l’hyperkatifeia.
Une étude d’imagerie humaine portant sur des personnes dépendantes des opioïdes sur ordonnance a révélé des altérations frappantes de la structure et de la connectivité de l’amygdale (51). Cette étude comprenait un sous-groupe de sujets appariés dépendants aux opioïdes sur ordonnance qui ont subi une imagerie par résonance magnétique structurelle, une imagerie par tenseur de diffusion et une imagerie par résonance magnétique fonctionnelle à l’état de repos. Par rapport aux sujets témoins sains, les sujets dépendants des opioïdes présentaient une perte volumétrique bilatérale de l’amygdale, une diminution significative de l’anisotropie dans les voies efférentes et afférentes de l’amygdale, et des diminutions de la connectivité fonctionnelle dans les réseaux cérébraux impliquant l’amygdale, l’insula et le noyau accumbens, y compris une diminution de la connectivité fonctionnelle entre l’amygdale et le PAG.
Une sortie importante de l’amygdale étendue est le PAG. Le PAG est également connu pour jouer un rôle clé dans le traitement de la douleur, à la fois par la voie classique de la douleur spinothalamique et par la voie émotionnelle de la douleur parabrachiale, via ses connexions avec l’amygdale (53). La douleur peut entraîner un comportement motivé, dans lequel la douleur et d’autres processus aversifs entraînent l’évitement et la fuite. Le PAG est également associé depuis longtemps au classique syndrome de sevrage précipité de la morphine qui se produit chez les animaux traités de façon chronique par la morphine. L’administration locale d’inhibiteurs de l’enképhalinase dans le PAG a bloqué le sevrage précipité par la naloxone. Un mécanisme qui pourrait entraîner certaines de ces neuroadaptations dans le PAG implique des réponses neuroinflammatoires. Le développement de la tolérance à la morphine s’accompagne d’une augmentation de l’expression génétique de plusieurs facteurs pro-inflammatoires dans le PAG, tels que le récepteur 4 de type Toll, le facteur α de nécrose tumorale et l’interleukine-1β. L’augmentation de l’activité pro-inflammatoire entraîne une augmentation significative de la neurotransmission excitatrice qui est médiée par des augmentations du tonus glutamatergique, ce qui est supposé s’opposer activement à l’effet analgésique de la morphine. De même, le sevrage des opioïdes est médié par l’activation des systèmes pro-inflammatoires dans le PAG. L’induction du gène de l’interleukine-4 (Il4) par un vecteur recombinant atténue le syndrome de sevrage de la morphine chez la souris. La micro-injection d’un vecteur du virus de l’herpès simplex dans le PAG pour diminuer le facteur α de nécrose tumorale avant le début du traitement à la morphine a réduit de manière significative le sevrage précipité par la naloxone chez les souris. Ainsi, le PAG est le médiateur de l’hyperkatifeia et a été impliqué dans la médiation des erreurs de prédiction aversive qui sont associées à la peur. Dans l’apprentissage aversif, une erreur de prédiction aversive se produit lorsque l’écart entre la valeur prédite et la valeur expérimentée de l’état aversif est pire que prévu. Il reste à déterminer si le PAG est impliqué dans les erreurs de prédiction aversive qui sont associées à l’hyperkatifeia dans le sevrage des opioïdes.
Intersection neurocircuitaire des opioïdes, de la douleur et de la toxicomanie
Un mécanisme d’action comportemental des opioïdes qui constitue un thème commun unifié est le soulagement de la douleur et de la souffrance, y compris le soulagement des états émotionnels négatifs. Les opioïdes sont reconnus comme les médicaments les plus puissants et les plus efficaces pour soulager la douleur aiguë chez l’homme. Cependant, les opioïdes sont nettement moins efficaces contre la douleur chronique, comme la douleur neuropathique, la fibromyalgie ou la lombalgie. La tolérance aux effets analgésiques des opioïdes nécessite des doses de plus en plus élevées pour maintenir l’analgésie. Plus important encore pour la présente thèse, les opioïdes peuvent également soulager la douleur émotionnelle, et c’est l’un des mécanismes comportementaux qui est fortement impliqué dans la conduite de la phase de retrait/affect négatif du cycle de la dépendance. Les personnes qui ont subi ou exprimé des abus physiques et des comportements violents ont décrit la façon dont les opioïdes les aidaient à se sentir normaux, calmes, adoucis, apaisés et détendus.
Le sevrage d’une auto-administration chronique d’opioïdes produit une hyperalgésie (c’est-à-dire une diminution des seuils de douleur). Les patients qui reçoivent un traitement opioïde à long terme pendant des semaines ou des années peuvent développer une douleur anormale inattendue et une hyperalgésie lors du sevrage du traitement opioïde. Chez l’homme, le sevrage des opioïdes peut abaisser les seuils de douleur et exacerber la douleur, et une perception accrue de la douleur a été observée depuis longtemps chez les personnes ayant des antécédents de dépendance aux opioïdes. Les patients sous traitement d’entretien à la méthadone ont une faible tolérance à la douleur, et la douleur est l’un des principaux déclencheurs de rechute de la dépendance chez ces personnes. Dans une étude sur l’interaction entre les états émotionnels négatifs et l’hyperalgésie de sevrage, les sujets qui étaient en sevrage aigu (24-72 heures) ou en abstinence prolongée (30 mois en moyenne) d’opioïdes ont présenté des diminutions des seuils de douleur et de la tolérance à la douleur, mesurées par la procédure du tourniquet ischémique de douleur sous-maximale, et ces effets ont été exacerbés par des états émotionnels négatifs. Les individus de tous les groupes (c’est-à-dire les non-utilisateurs, les ex-utilisateurs et les utilisateurs retirés) ont présenté une tolérance à la douleur plus faible après avoir vu des images négatives, par rapport aux latences de tolérance qui ont été observées après avoir vu des images positives et neutres. L’administration aiguë d’opioïdes peut produire une hyperalgésie. Des hommes qui n’étaient pas dépendants des opioïdes et qui ont été soumis à un paradigme de défi de dépendance physique aiguë aux opioïdes en recevant de la naloxone ont montré la présence d’une hyperalgésie en réponse à une douleur expérimentale provoquée par un compresseur à froid.
Dans les modèles animaux, lorsque l’opioïde est administré de façon répétée (par exemple, une fois par jour pendant 2 semaines), on observe une diminution graduelle et dose-dépendante du seuil nociceptif qui dure plusieurs semaines après l’administration du médicament. Une petite dose d’héroïne, par ailleurs inefficace pour déclencher une hyperalgésie retardée chez des rats non traités à l’héroïne, a augmenté la sensibilité à la douleur pendant plusieurs jours après une série d’injections d’héroïne, ce qui suggère l’apparition d’une sensibilisation à la douleur. Ainsi, une mémoire neuronale caractérisée par un état vulnérable peut subsister longtemps après l’élimination complète de la drogue et lorsque l’équilibre apparent proche de l’état antérieur à la drogue a été rétabli. Une telle hyperalgésie a également été observée avec une injection unique d’héroïne chez les rats.
Les mécanismes neurobiologiques de l’hyperalgésie induite par les opioïdes comprennent l’activation des systèmes glutamatergiques et des mêmes systèmes de stress cérébral (par exemple, CRF et dynorphine) qui sont impliqués dans l’hyperkatifeia (voir ci-dessus). Dans un modèle animal d’hyperalgésie durable après exposition à l’héroïne, un antagoniste non compétitif des récepteurs du glutamate a inversé l’hyperalgésie. Un antagoniste non compétitif des récepteurs du glutamate a également empêché l’augmentation durable de la sensibilité à la douleur induite par l’héroïne et l’hyperalgésie précipitée par la naloxone chez l’homme. L’hyperalgésie associée au sevrage de la morphine dans le test de la pulsion de la queue a été bloquée par des micro-injections d’un antagoniste des récepteurs peptidiques CRF1/CRF2 dans le noyau central de l’amygdale, sans affecter les réponses plasmatiques à la corticostérone. Conformément à cette observation, l’hyperalgésie pendant le sevrage chez les animaux qui ont développé une réponse de type compulsif après un accès prolongé à l’héroïne a été bloquée par l’administration systémique d’un antagoniste des récepteurs du CRF1. Des souris knock-out pour la dynorphine ont présenté un retour plus facile à des bases nociceptives normales après une lésion d’un nerf périphérique, ce qui suggère un rôle pronociceptif de la dynorphine dans la douleur chronique, contrairement aux effets antinociceptifs de l’administration aiguë d’un agoniste des récepteurs κ opioïdes.
Un lien entre l’hyperalgésie et l’hyperkatifeia peut être trouvé, avec un accent sur le CRF et la dynorphine dans l’amygdale étendue. Le CRF dans l’amygdale, en particulier dans le noyau central de l’amygdale, joue un rôle important dans la modulation de la douleur et l’affect lié à la douleur (81). Le blocage des récepteurs CRF1 dans le noyau central de l’amygdale a inhibé les comportements de type douleur et anxiété dans un modèle animal de douleur arthritique.
Le système des récepteurs opioïdes dynorphine-κ est également engagé dans les états émotionnels négatifs qui sont associés à la douleur chronique. Les preuves qui appuient cette hypothèse comprennent les résultats d’études sur des souris knock-out, l’engagement spécifique du neurocircuit des neurones à dynorphine et le blocage neuropharmacologique des récepteurs opioïdes κ. La stimulation de neurones contenant spécifiquement de la dynorphine dans la coque ventrale du noyau accumbens par l’expression sélective de la channelrhodopsin-2 chez des souris dynorphin-Cre+ a diminué la motivation à s’auto-administrer du saccharose. La perfusion locale de microgrammes de nor-binaltorphimine, un antagoniste des récepteurs opioïdes κ, dans l’enveloppe du noyau accumbens ventral, a bloqué l’aversion pour le lieu produite par une inflammation combinée à l’activation des neurones à dynorphine de l’enveloppe du noyau accumbens ventral. Les auteurs de ces deux rapports ont soutenu que le recrutement in vivo de neurones dynorphines de l’enveloppe du noyau accumbens qui agissent par l’intermédiaire des récepteurs opioïdes κ peut conduire à un affect négatif induit par la douleur. Le système des récepteurs opioïdes κ à la dynorphine joue donc un rôle évident dans la modulation de l’interaction entre la douleur, le stress et le traitement de la récompense. La comorbidité élevée entre la douleur chronique, la toxicomanie, la dépression et le suicide constitue un argument convaincant en faveur de la poursuite des études dans ce domaine.
Sevrage conditionné
La rupture de l’homéostasie émotionnelle, définie comme l’hyperkatifeia, ne s’arrête pas au sevrage aigu et peut se prolonger par une abstinence prolongée, comme dans le cas de l’hypersensibilité à la douleur décrite ci-dessus. Ce cadre est soutenu par plusieurs sources : la théorie de l’allostasie, les réseaux affectifs négatifs et les associations apprises. En effet, les perturbations des systèmes cérébraux de récompense et de stress peuvent engager les systèmes d’apprentissage et laisser une trace neuroadaptative résiduelle qui permet une rechute rapide, même des mois et des années après la désintoxication et l’abstinence. Bien que l’état de manque dans la dépendance soit souvent lié à des indices et à des contextes qui sont associés aux effets hédoniques positifs de la drogue, l’état de manque et la recherche de drogue peuvent également être provoqués par des indices et des contextes qui sont liés au sevrage par le biais d’un sevrage conditionné. Dans une étude classique, une odeur de menthe poivrée auparavant neutre (stimulus conditionné), associée à des réactions de sevrage (réponse non conditionnée), a provoqué des manifestations subjectives et physiologiques du syndrome de sevrage des narcotiques (réponse conditionnée). Après de nombreux couplages de l’odeur de menthe poivrée avec le sevrage précipité produit par la naloxone chez des individus maintenus sous méthadone, l’odeur de menthe poivrée seule a précipité le sevrage.
Le sevrage conditionné a également été observé dans des modèles animaux utilisant le paradigme de l’aversion de place conditionnée et l’auto-administration opérante intraveineuse d’opioïdes ou d’autres récompenses. Chez des rats autorisés à consommer de l’héroïne pendant 23 heures (figure supplémentaire S2), des stimuli auparavant neutres (odeur et lumière) qui ont été associés de façon répétée à un sevrage précipité par la naloxone ont produit un sevrage conditionné, reflété par des élévations des seuils d’autostimulation intracrânienne et une augmentation de la consommation d’héroïne (figure supplémentaire S4). L’activation de Fos dans l’amygdale étendue est parallèle à la réponse d’aversion conditionnée. De plus, l’inactivation bilatérale de l’amygdale basolatérale (c.-à-d. une entrée majeure de l’amygdale étendue) a bloqué le développement du retrait conditionné des opioïdes (91). Des lésions bilatérales de l’amygdale basolatérale induites par l’acide quinolinique ont bloqué la capacité d’un stimulus tonalité-lumière qui avait été associé à un sevrage opioïde précipité (stimulus conditionné) à supprimer la réponse à la nourriture. Dans l’ensemble, ces résultats suggèrent une voie clé de l’amygdale basolatérale à l’amygdale étendue dans la médiation de l’envie de manger induite par la valence négative.
Différences entre les sexes
Les hommes sont plus nombreux à consommer et à être dépendants des opioïdes et d’autres drogues d’abus. Néanmoins, les rapports cliniques indiquent que les femmes qui deviennent dépendantes des opioïdes progressent plus rapidement que les hommes à travers les étapes de la dépendance, de la consommation initiale à la dépendance. Dans les modèles animaux, les rongeurs femelles acquièrent généralement l’auto-administration de morphine et d’héroïne plus rapidement que les rongeurs mâles, et elles présentent une motivation plus élevée pour s’auto-administrer des opioïdes. Cependant, les sujets femelles sont moins sensibles aux effets analgésiques des agonistes des récepteurs opioïdes μ. Les signes physiques du sevrage des opioïdes sont plus prononcés chez les souris mâles que chez les souris femelles, bien que peu ou pas de travaux aient porté sur les études précliniques des différences entre les sexes dans les modèles animaux d’hyperkatifeia et de renforcement négatif.
Implications pour l’étiologie et le traitement du trouble de l’usage des opioïdes
La thèse exposée ici est que la connaissance des neuroadaptations qui se produisent dans le cadre de la phase de sevrage/affect négatif constitue un terrain fertile pour le développement de nouveaux traitements du trouble de l’usage des opioïdes. L’administration chronique d’opioïdes a de nombreux effets sur les systèmes neuropharmacologiques qui interfèrent avec l’amygdale étendue, une voie clé qui est associée à la phase de retrait/affect négatif du cycle de la dépendance. Les opioïdes agissent directement et indirectement via les systèmes de l’acide γ-aminobutyrique et du glutamate pour activer les voies de la récompense. En cas d’usage excessif, ces mêmes systèmes subissent des neuroadaptations avec une exposition chronique aux opioïdes qui diminuent la fonction de récompense, augmentent la fonction de stress et la composante d’affect négatif de la douleur, ce qui contribue à l’hyperkatifeia. L’argument est que ces dérèglements spécifiques du neurocircuit contribuent aux liens qui ont été supposés exister entre les mécanismes neuronaux responsables d’un état émotionnel négatif hypersensible (hyperkatifeia) et l’hyperalgésie induite par les opioïdes.
Comme nous l’avons vu plus haut, l’hypothèse est que la dépendance aux opioïdes entraîne une recherche compulsive de drogues par le biais de mécanismes de renforcement négatif, car la consommation d’opioïdes prévient ou soulage temporairement les symptômes émotionnels négatifs ou l’hyperkatifeia. Cette recherche compulsive de drogues défend un point de consigne hédonique qui gagne progressivement en charge allostatique et passe d’un état hédonique homéostatique à un état hédonique allostatique. D’autres ont soutenu que l’un des deux principaux déterminants des “envies” de drogue est un réseau d'”affect négatif”. Ce réseau d’affect négatif est activé non seulement pendant le sevrage, mais aussi par les prédicteurs conditionnés du sevrage (par exemple, les indices de la drogue) et les conséquences non appétissantes (par exemple, la punition, la non-récompense frustrante) ou leurs indices conditionnés. Dans ce modèle, la fuite et l’évitement de l’affect négatif sont des motifs puissants de la consommation compulsive de drogues. Evans et Cahill ont soutenu que la dépendance aux opioïdes est entretenue par une association apprise entre les opioïdes et le soulagement d’un état dysphorique existant, une association apprise qui est formée par un renforcement négatif. Ils ont également avancé que des événements stressants survenant ultérieurement au cours d’une abstinence prolongée peuvent se généraliser à un tel état dysphorique et provoquer le souvenir que les drogues opioïdes peuvent soulager un tel état négatif (figure 3).
Un domaine négligé dans le domaine de l’hyperkatifeia est le développement de médicaments et de stratégies comportementales qui ciblent spécifiquement la composante affective de l’abstinence prolongée d’opioïdes. Comme indiqué plus haut, des études ont signalé une hypersensibilité à la douleur et à l’inconfort des opioïdes qui peut durer plus d’un an après la désintoxication. Le traitement doit tenir compte de la dysrégulation des systèmes de douleur et de stress pendant le sevrage aigu et pendant une longue période de récupération. D’après les études précliniques, les médicaments et les thérapies comportementales qui réinitialisent l’axe hypothalamo-hypophyso-surrénalien et/ou les systèmes cérébraux CRF et ramènent le système des récepteurs opioïdes dynorphine-κ à l’homéostasie seraient de nouvelles cibles prometteuses pour le développement de médicaments.
En outre, les indices associés au sevrage peuvent avoir un pouvoir de motivation important pour stimuler l’envie de fumer et la rechute. Des indices associés à un sevrage conditionné ont activé les circuits amygdaliens et hypothalamiques étendus dans une étude d’imagerie préclinique. Très peu de travaux ont porté sur la neurobiologie du sevrage conditionné et sur la façon dont elle peut être appliquée au traitement durable du trouble de l’usage des opiacés. L’accent mis sur la compréhension du déficit de récompense et/ou de l’excès de stress dans la phase de sevrage/affect négatif du trouble lié à l’utilisation d’opioïdes peut également permettre de déterminer quels traitements comportementaux peuvent être plus efficaces dans le cas d’un trouble lié à l’utilisation d’opioïdes modéré à grave. Par exemple, les versions de la thérapie cognitivo-comportementale qui traitent des mécanismes d’adaptation au stress et à la douleur (physique et affective) peuvent être plus importantes que les perfectionnements de la gestion des contingences.