Müller, C. P. (2020). Drug instrumentalization. Behavioural Brain Research, 390, 112672. doi:10.1016/j.bbr.2020.112672
Ceci est la traduction de l’article.
Abstract.
Les substances psychoactives ayant un potentiel de dépendance sont largement utilisées par des personnes de pratiquement toutes les cultures de manière non addictive. Afin de comprendre ce comportement, sa pénétration dans la population et sa persistance, l’instrumentalisation des drogues a été proposée comme moteur de cette consommation. Selon la théorie de l’instrumentalisation des drogues, les substances psychoactives sont consommées de manière très systématique afin de rendre plus efficaces d’autres comportements non liés aux drogues. Nous passons ici en revue l’origine évolutive de ce comportement et ses mécanismes psychologiques et explorons les mécanismes neurobiologiques et neuropharmacologiques qui les sous-tendent. Nous discutons des objectifs d’instrumentalisation, pour lesquels une consommation de substances psychoactives, sélective du point de vue environnemental et dépendante de l’état mental, peut être apprise et maintenue de manière non addictive. Un petit pourcentage de personnes qui instrumentalisent régulièrement des drogues psychoactives font une transition vers la dépendance, qui commence souvent par des changements qualitatifs et quantitatifs dans les objectifs d’instrumentalisation. Ainsi, il est proposé que la dépendance se développe à partir d’une instrumentalisation des drogues préalablement établie à long terme. Ainsi, la prévention et le traitement de la toxicomanie dans une approche de médecine individualisée peuvent essentiellement nécessiter de comprendre et de soutenir les objectifs d’instrumentalisation personnels.
1. Introduction
Les substances psychoactives peuvent être définies comme des composés chimiques qui modifient le comportement d’un organisme ou son expérience subjective de lui-même et du monde extérieur après avoir consommé la substance. Les êtres humains et de nombreuses espèces animales consomment activement des substances psychoactives. Ils peuvent consommer accidentellement et faire l’expérience des changements de comportement et de l’expérience subjective qui en résultent. de la drogue, de sa consommation et des effets qui en résultent. Nous pouvons facilement supposer que ces souvenirs donnent lieu à une régularité dans le fait que les substances psychoactives sont volontairement recherchées et consommées.
Dans un contexte naturel, la disponibilité des substances psychoactives est limitée, mais ce problème a été surmonté par les humains, qui ont également développé un comportement conduisant à la production industrielle et au raffinement de ces substances en quantité pratiquement illimitée. Chez les humains, la disponibilité naturelle ne contrôle plus la consommation de substances psychoactives, mais d’autres facteurs [2]. Le groupe des substances psychoactives peut comprendre des ingrédients nutritionnels et des produits pharmaceutiques, mais le sous-groupe des drogues addictives en particulier a suscité de grandes inquiétudes. Ces substances sont définies par leur capacité à provoquer la toxicomanie, un trouble psychiatrique majeur [7]. Il convient de noter que la classification d’une “drogue addictive” ne décrit qu’une propriété potentielle de la substance. Cela ne signifie pas que tous les consommateurs, ou même la majorité d’entre eux, développeront une dépendance après la consommation. une dépendance après la consommation.
Lorsque l’on considère la consommation de drogues addictives par les humains, il faut répondre à deux grandes questions : 1.) Pourquoi les humains consomment-ils des drogues psychoactives à une échelle qui affecte pratiquement tous les habitats et avec une persistance qui traverse toutes les époques des archives humaines ? 2.) Pourquoi les humains deviennent-ils dépendants de certaines drogues psychoactives ? Chacune de ces questions peut trouver des réponses différentes à des niveaux explicatifs distincts. Les niveaux évolutif, psychologique et neurobiologique abordent des aspects distincts de ce phénomène multi-niveaux plutôt complexe. Idéalement, tous ces niveaux d’explication fournissent des réponses qui sont logiquement cohérentes entre les niveaux explicatifs. L’objectif de cette revue est de fournir une réponse aux questions clés de la consommation de drogues psychoactives et de la dépendance qui relie les niveaux d’explication évolutionniste et psychologique et tente de décrire comment cela découle d’une approche niveau neurobiologique et neuropharmacologique.
2. Usage de drogue et addiction à un niveau évolutionnaire.
La consommation de drogues addictives est souvent considérée comme un comportement inadapté, car les personnes présentant un risque génétique ou vivant dans certaines conditions environnementales peuvent développer une toxicomanie [39,213,285-287]. Un grand nombre des substances psychoactives susceptibles de créer une dépendance et consommées par l’homme sont des toxines végétales. Les drogues naturelles, comme la nicotine, la cocaïne ou le cannabis, ont été développées par les plantes comme défense chimique pour éviter leur consommation. L’adaptation évolutive de ces toxines à l’autodéfense des plantes est largement acceptée pour dissuader les herbivores [211]. On ne sait toujours pas pourquoi un grand nombre de ces composés végétaux ont des effets gratifiants, qui peuvent en fait renforcer la consommation de plantes. D’un autre côté, les mangeurs de plantes ne devraient pas avoir évolué vers des mécanismes cérébraux susceptibles d’être renforcés par des toxines qui mettent leur vie en danger.
Cette contradiction dans la coévolution plante-animal est encore un paradoxe non résolu de la récompense par la drogue [95,307,308] qui peut être résolu au niveau des effets dose-réponse neuropharmacologiques et de l’hormèse psychologique. Par exemple, des drogues comme la cocaïne n’ont des effets hédoniques et euphorisants qu’à des doses faibles ou moyennes. À des doses élevées, mais encore inférieures au seuil de létalité, la cocaïne a des effets aversifs. Elle peut provoquer une psychose induite par la drogue avec paranoïa, hallucinations et stéréotypies comportementales [81,82,155]. Ainsi, la consommation de concentrations faibles à moyennes peut être bénéfique pour l’organisme consommateur, alors que des quantités élevées l’endommagent gravement et protègent la plante d’origine. Ceci peut être confirmé par des drogues addictives dont les effets induisant le plaisir sont plutôt faibles, comme la nicotine et la caféine, qui ne sont volontairement consommées qu’à des doses faibles et non toxiques. faible dose non toxique [43].
Les individus non dépendants consomment généralement des drogues addictives à des doses non toxiques [78,95]. En conséquence, le paradoxe évolutif de la récompense par la drogue peut être résolu : dans une gamme de doses faibles à moyennes, l’effet de la drogue n’est pas toxique au sens où il met la vie en danger. Tant que cette gamme de doses est maintenue, la consommation de drogues psychoactives peut constituer une adaptation fonctionnelle en termes d’évolution, car elle peut améliorer la survie et la reproduction de soi-même ou de ses proches [45].
Il a été avancé que les drogues psychoactives qui induisent des émotions positives génèrent un faux signal de fitness-benefit (avantage du point de vue de la survie). Ce signal détourne les mécanismes de saillance des incitations dans le cerveau qui contrôlent le comportement de recherche et de prise de drogue [213, 257, 322]. Les émotions positives et négatives et leurs mécanismes neurobiologiques apportent un avantage indiscutable à l’individu sur le plan de la condition physique, car ils permettent de faire face de manière spécifique à des conditions environnementales avantageuses ou dangereuses [213]. Toutefois, la fonction naturelle de tout type d’émotion est artificiellement corrompue ou “détournée”, ce qui peut compromettre la santé de l’organisme [213,228].
Il a été suggéré que les drogues psychoactives sont prises pour gonfler la “capacité de survie et la capacité de reproduction auto-perçues” (SPFit) [217]. Ainsi, le concept SPFit décrit la motivation à améliorer et à protéger la capacité de survie et de reproduction. Ce concept est lié aux sentiments de pouvoir personnel et d’attractivité sexuelle. Cette idée est soutenue par des résultats montrant que des drogues comme l’alcool à des doses modérées augmentent la perception subjective du pouvoir chez les humains. Il a également été reconnu que les drogues psychoactives peuvent augmenter le sentiment subjectif de pouvoir et de contrôle, mais les bénéfices évolutifs de la consommation de ces substances ont été niés [217].
Les effets bénéfiques potentiels à court et à long terme de la consommation de drogues psychoactives ont été discutés précédemment [95,164]. Il a été suggéré que le comportement de consommation de drogues était une adaptation évolutive potentielle au niveau comportemental [164,210]. Il a été avancé que la fonction adaptative de la consommation de drogues est de fournir à un individu un plaisir prévisible à court terme dans un environnement dangereux. Dans ces circonstances, la recherche de renforçateurs naturels est difficile à établir. La toxicomanie a été considérée comme une inadaptation causée par l’absence d’une fonction de régulation contrôlant la signalisation de la saillance dans le système mésolimbique de dopamine (DA) du cerveau [164]. Une analyse par interview de la fonction comportementale perçue dans une population de gros consommateurs de méthamphétamine à Atlanta (USA) a identifié trois fonctions principales : 1.) amélioration du fonctionnement, 2.) productivité accrue, et 3.) permettre un fonctionnement normal. Les consommateurs réguliers de méthamphétamine qui ne sont pas toxicomanes n’ont pas déclaré percevoir leur leur consommation de drogue comme une entrave à leur fonctionnement quotidien ; c’était perçu comme les améliorant dans l’ensemble [165]. Bien que des explications évolutives distinctes de la consommation de drogues psychoactives et de la dépendance aient été suggérées, aucune d’entre elles n’a fourni un compte-rendu cohérent de la façon dont la consommation non dépendante peut apporter des avantages, alors que le passage à la dépendance à la même drogue peut constituer un comportement inadapté et nuisible.
Nous discutons ici du concept d’instrumentalisation des drogues en tant qu’approche évolutive de la consommation non-addictive de drogues psychoactives. La théorie de l’instrumentalisation des drogues affirme que les utilisateurs non dépendants consomment des drogues parce que les effets ultérieurs sur les états mentaux peuvent être utilisés pour améliorer la performance des comportements dirigés vers un objectif [2,201,202,207]. Les substances psychoactives peuvent être “instrumentalisées”. Un instrument est considéré comme ” quelque chose qui aide à atteindre un objectif, qui ne serait pas réalisable ou nécessiterait une charge de travail plus importante sans l’utilisation de l’instrument ” [201]. L’instrumentalisation des drogues consiste en un processus en deux étapes : A.) la recherche et la consommation d’une drogue psychoactive afin de changer l’état mental actuel d’une personne en un état mental précédemment appris, et directement après le changement d’état mental induit ; et B.) l’amélioration de la performance d’un autre comportement précédemment établi [201,202,207]. Une analyse évolutive du comportement d’instrumentalisation des drogues en tant que réalisation culturelle principalement humaine [210,216] peut nécessiter quatre niveaux d’analyse différents : I.) son évolution ultime dans un environnement ancestral, II.) sa fonction pour la reproduction et la survie, III.) sa causalité immédiate, et IV.) son développement ontogénétique dans l’histoire de la vie d’un seul individu [109,214,317].
2.1 L’évolution ultime de l’instrumentalisation des drogues.
L’une des principales revendications de la psychologie évolutionniste est que les comportements humains actuels sont des adaptations à notre environnement ancestral [53,54]. Ainsi, une adaptation doit permettre de résoudre un problème et, en fin de compte, d’améliorer la reproduction de soi-même ou de ses proches au niveau génétique [53] et comportemental [210]. Des preuves de la consommation humaine de plantes et de préparations végétales contenant des substances psychoactives sont apparues dans certains des plus anciens documents humains connus. Elles suggèrent une consommation systématique de drogues addictives pendant au moins dix mille ans dans les régions où elles étaient naturellement disponibles [1,66,67,105,289,307]. Ainsi, une origine évolutive possible de l’instrumentalisation des drogues psychoactives peut être trouvée dans l’ingestion sélective de composés psychoactifs dérivés de plantes avec l’intention supposée de changer l’état mental et d’améliorer ensuite l’efficacité du comportement [201,202]. La consommation sélective de substances psychoactives peut trouver son origine dans la capacité humaine de recherche sélective de nourriture et de comportement de consommation, ainsi que dans sa modification flexible par des processus d’apprentissage psychologique [66,171].
Le comportement de recherche et de consommation de substances psychoactives apparaît tôt dans l’évolution, ce qui suggère un fort héritage génétique. Il peut être observé chez les mouches à fruits [60], les rongeurs [12,344,355,345], les chiens [251] et les singes [73,113,128,252,341] lorsqu’ils ont accès à une drogue. Un grand nombre d’études expérimentales sur les animaux montrent qu’ils apprennent facilement à rechercher et à consommer pratiquement toutes les drogues psychoactives qui sont également consommées par les humains [183,293,322,331]. Cette observation peut suggérer que la capacité comportementale à consommer des drogues – c’est-à-dire le mécanisme d’apprentissage – n’est pas propre à l’homme, mais s’est développée au cours de l’évolution.
La recherche et la consommation d’un nutriment particulier peuvent être très spécifiques en fonction des besoins physiologiques. La recherche et la consommation d’aliments peuvent être très sélectives en raison de la capacité d’apprentissage, vieille de plusieurs siècles, d’associer les paramètres sensoriels d’un nutriment, tels que l’odeur et le goût, à ses ingrédients et à ses effets ultérieurs sur l’organisme. Ce phénomène est mis en évidence lorsque le besoin d’un nutriment particulier peut inciter à rechercher et à consommer uniquement un aliment sélectionné. La consommation de substances psychoactives donne lieu à la perception soit d’un effet positif qui maintient l’homéostasie, soit d’un effet négatif qui la menace. Sur la base de cette perception, de l’apprentissage de l’association et de sa récupération ultérieure, cet aliment particulier sera recherché ou évité à l’avenir [130,171,265].
Les animaux ont accès à des substances psychoactives et en consomment beaucoup. Par exemple, l’alcool est très répandu dans les structures reproductives de nombreuses plantes angiospermes ou dérivé de la fermentation du nectar ou des fruits mûrs, qui est couramment consommé par les primates [341]. Il existe également des preuves de l’évolution ultime de l’instrumentalisation des drogues chez les animaux non humains. Dans des circonstances spécifiques, le choix de la nourriture des chimpanzés peut être orienté par les propriétés non nutritionnelles des composés végétaux, tels que les métabolites secondaires des plantes [258]. Plusieurs études rapportent que les chimpanzés sauvages s’automédicamentent pour soigner des infections, des problèmes gastro-intestinaux et d’autres conditions de stress physique en consommant des plantes sélectionnées [84,227,260,353]. Ce phénomène est connu sous le nom de zoopharmacognose [114,261]. Il ne s’agit pas d’un comportement génétiquement déterminé, mais d’un comportement appris [171], et les chimpanzés présentent déjà cette capacité.
L’automédication peut être interprétée comme un comportement qui dépend essentiellement de l’état physique de l’organisme. Dans ce contexte, un aliment particulier est consommé uniquement lorsque l’organisme a besoin d’atténuer un état de stress [168,328]. La consommation de nourriture peut être dirigée par une automédication prophylactique/préventive, qui peut réduire le risque de détresse physique, ou une automédication thérapeutique/curative, qui peut réduire la détresse physique après son apparition [95,142,297,309]. Il a été suggéré que cette capacité à adapter dynamiquement le choix de la nourriture en fonction de l’état physique réel d’un organisme est un trait adaptatif chez les mammifères qui améliore la survie et la reproduction [47,95,309]. Sur cette base, il a été suggéré que l’adaptation des systèmes d’apprentissage qui régulent dynamiquement le comportement individuel de choix de nourriture pour les besoins nutritionnels et l’automédication peut être la même que celle impliquée dans le choix de nourriture pour changer l’état mental de l’organisme [201,202,207].
Ce n’est que récemment que la chimie analytique a permis d’isoler et de purifier des composés psychoactifs uniques à partir de produits végétaux. Ainsi, les drogues psychoactives sont devenues disponibles sous forme pure (par exemple, la cocaïne, l’amphétamine) ou sous une forme hautement concentrée (par exemple, l’alcool). L’amélioration sélective des plantes productrices de drogues a permis d’augmenter considérablement leur teneur en composés (par exemple, le Δ9-THC dans les plants de cannabis). Les environnements actuels où les substances psychoactives purifiées sont facilement accessibles peuvent représenter une nouvelle “niche” évolutive [160,161]. La disponibilité de substances psychoactives purifiées fait désormais partie de l’environnement de nombreuses sociétés et cultures [166,210]. Elle peut donc interagir avec une prédisposition à la consommation de drogues et à la toxicomanie déterminée par l’évolution [18,139,140,209,287,311].
Dans les sociétés industrialisées actuelles, les compétences comportementales requises sont complexes et les charges de travail individuelles sont très élevées, de sorte que de nombreux comportements différents doivent être exécutés avec beaucoup d’efforts [210]. Un nombre croissant de comportements sophistiqués doivent être établis par des individus individuels et réalisés avec plus d’efforts que par le passé. Des outils plus complexes doivent être manipulés, et les résultats attendus du travail sont de plus en plus nombreux. L’environnement moderne des sociétés industrialisées contient davantage de micro-environnements qui sont plus fortement différenciés et ont des exigences comportementales spécifiques. Les outils techniques disponibles sont de plus en plus spécifiques aux microenvironnements d’un seul individu et leur utilisation requiert un degré croissant d’expertise comportementale (par exemple, l’utilisation d’un logiciel pour le contrôle d’une machine dans l’environnement de travail par rapport à un jeu sur ordinateur dans un environnement de loisirs). Il est important de noter que l’on peut également supposer que les transitions entre ces micro-environnements se produisent à un rythme beaucoup plus rapide que pour nos ancêtres pré-agricoles. Cela constitue la croissance de la culture humaine, mais exerce également une pression de sélection sur les comportements individuels et leurs résultats [210].
2.2 Mécanismes de proximité de la consommation de substances psychoactives.
Un certain nombre de mécanismes proximaux différents dans l’évolution de la consommation de drogues psychoactives ont été suggérés, qui fournissent des adaptations uniques à des micro-environnements particuliers [166,201,332]. Il a été suggéré que l’homme moderne doit s’adapter à une multitude d’environnements distincts, ce qui nécessite des adaptations comportementales spécifiques dans un organisme [53,54,210]. Ainsi, l’environnement de l’homme peut être considéré comme la somme de ses micro-environnements [33]. Pour chacun d’eux, des adaptations comportementales sont nécessaires, qui peuvent être considérées comme des microadaptations. En outre, pour les microenvironnements qui changent fréquemment, des états mentaux distincts peuvent être avantageux car ils permettent une meilleure expression du comportement “microadapté”. Il a été suggéré que les problèmes adaptatifs immédiats qui peuvent être résolus par la consommation de drogues psychoactives sont : i.) la facilitation de la transition entre différents états mentaux, et ii.) l’augmentation de l’ampleur ou de la durée de l’état mental [2,201,207].
Les micro-environnements propices à l’instrumentalisation des drogues ont été identifiés par des études par questionnaire qui demandent aux non-dépendants pourquoi et dans quelles circonstances ils ont consommé des substances psychoactives et quels bénéfices/effets indésirables ils ont rencontrés. Dans ces études, les répondants fournissent de nombreux motifs de consommation qui peuvent être facilement traduits en objectifs d’instrumentalisation [35,36,44,51,58,105,165,173,222,231,300]. Tous ces buts d’instrumentalisation servent des efforts visant à son propre développement, à son maintien ou à la reproduction génétique ou culturelle de soi-même et de ses proches [201,202,210].
3. Usage de drogue et addiction au niveau psychologique.
Pratiquement tous les consommateurs réguliers non dépendants de substances psychoactives reconnaissent les avantages psychologiques subjectivement perçus de leur consommation de drogues [15, 44, 231]. Les drogues psychoactives ne sont pas consommées de manière arbitraire, c’est-à-dire réparties de manière égale dans tous les micro-environnements, mais plutôt de manière très organisée [2]. Si la consommation de drogues était uniquement déterminée par les propriétés pharmacologiques d’une drogue, on s’attendrait à ce que la consommation d’une drogue particulière émerge dans toutes les prédispositions individuelles (ensembles) et tous les contextes environnementaux (milieux/microenvironnements) à un degré comparable. Au lieu de cela, il est plutôt évident que la grande majorité des utilisateurs humains non dépendants consomment des drogues psychoactives comme une partie normale de leur vie avec un haut degré de sélectivité environnementale [225,301] et d’utiliser les effets ultérieurs de la drogue pour leurs objectifs personnels dans ces microenvironnements.
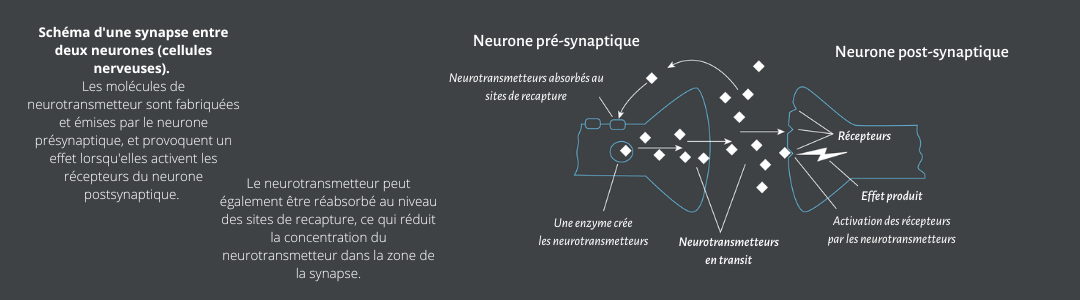
Mais en quoi les drogues psychoactives peuvent-elles servir d'”instrument” ? Dans ce cas, l’instrument est l’effet de la drogue sur l’état mental. Le système nerveux humain fonctionne selon différents modes d’action, que l’on peut qualifier d’états mentaux. Ils ont également été qualifiés d’états internes ou affectifs. Les états mentaux sont les modes de fonctionnement du cerveau, qui sont stables sur des périodes de quelques minutes à quelques heures. Pendant cette période, ils constituent le cadre fonctionnel des processus de signalisation neuronale rapides, de l’ordre de la milliseconde. Les états mentaux contrôlent des processus tels que la perception subjective, la récupération de la mémoire et les réponses autonomes et comportementales d’un organisme [340].
Au niveau neurobiologique, il existe un équivalent de ce concept psychologique. Il s’agit de l’activité sommative et des différents états fonctionnels des systèmes de transmetteurs modulateurs du cerveau. Ceux-ci comprennent les systèmes dopaminergique (DA), sérotoninergique (5-HT), acétylcholinergique (ACh), noradrénergique (NA), et divers systèmes neuropeptidergiques et lipidergiques [278]. Ils sont connus pour contrôler l’activité synaptique de la transmission excitatrice et inhibitrice rapide et réguler le traitement de l’information dans les régions cibles diencéphaliques et télencéphaliques du cerveau [41,203]. Les systèmes de neurotransmetteurs modulateurs présentent intrinsèquement différents modes d’activité basale et induite. Cependant, leur activité dépend également de divers facteurs externes (par exemple, l’heure du jour, la saison ou l’environnement), ainsi que de facteurs internes (par exemple, les niveaux de glucose, d’oxygène ou d’hormones dans le sang) [13,122,273,284,304]. Leur activité tonique et phasique détermine l’efficacité du traitement des stimuli et des réponses comportementales dans le cerveau. Un état mental particulier prédispose les réponses d’un organisme aux stimuli environnementaux, ce qui détermine également l’efficacité et le succès d’un comportement dirigé vers un but. Ainsi, les états mentaux ont une profonde influence sur l’efficacité avec laquelle les objectifs comportementaux peuvent être atteints.
Lorsqu’un organisme poursuit un objectif spécifique, il existe très probablement un état mental parmi de nombreux autres, qui permet à l’organisme d’exécuter le comportement dirigé vers l’objectif de la meilleure façon possible. Par exemple, si l’objectif comportemental est d’aller d’un lieu X à un lieu Y en utilisant le comportement “conduire une voiture”, le comportement spécifique est mieux exécuté lorsqu’on est dans un état mental attentif, peu stressé et peu anxieux. En revanche, la performance est probablement moins bonne lorsque l’on est dans un état mental fatigué, épuisé, stressé, anxieux ou inattentif [201].
Lorsqu’elles sont consommées, toutes les drogues psychoactives modifient de façon aiguë l’état mental du consommateur, et ce, de façon dose-dépendante [77,240]. Cependant, pour une appréciation suffisante de la recherche et de la consommation de drogues et du changement d’état mental qui en résulte, il faut prendre en compte l’ensemble de l’organisme, les milieux/microenvironnements environnants [358] et le comportement qui suit le changement d’état mental [201]. La consommation d’une drogue spécifique a lieu dans un microenvironnement particulier et par une personne qui se trouve dans un état mental particulier. Des comportements non liés à la drogue sont réalisés dans ce microenvironnement lorsque la drogue est consommée et qu’un changement d’état mental se produit. En soi, ces comportements peuvent être considérés comme indépendants de la drogue dans la mesure où ils sont établis indépendamment de la consommation de drogue. Ils peuvent également être réalisés sans consommation préalable de drogue.
Par exemple, conduire une voiture d’un lieu X à un lieu Y est un comportement complexe. La plupart des adultes le font sans avoir de drogue psychoactive à bord. Néanmoins, dans une situation et un état mental spécifiques, une performance après un changement d’état mental induit par une drogue est non seulement possible, mais souvent souhaitée. Par exemple, après une longue journée de travail comportant des activités stressantes et épuisantes, la consommation d’un café qui “rafraîchit” un esprit fatigué permet souvent au consommateur de caféine de mieux conduire jusqu’à son domicile qu’en étant dans un état mental fatigué. Ainsi, l’action de la caféine sur l’état mental est l’instrument. En termes psychologiques, le processus A de l’instrumentalisation des drogues psychoactives serait le “comportement de préparation et de consommation de la caféine”. Le processus B serait la “conduite de la voiture” qui s’ensuit. Dans cet exemple, l’objectif de l’instrumentalisation serait de “conduire jusqu’à la maison”, ce qui fait partie de la classe d’objectifs “amélioration des performances cognitives et lutte contre la fatigue”.
4. Objectifs de l’instrumentalisation et leur neuropharmacologie.
Alors que la théorie classique du renforcement suppose que l’action pharmacologique des médicaments dans le cerveau est fondamentalement la même en toutes circonstances, des découvertes récentes suggèrent que des actions pharmacologiques et des voies cérébrales bien distinctes peuvent servir différents objectifs d’instrumentalisation des médicaments dans des micro-environnements spécifiques [2]. Nous discutons des progrès actuels dans la compréhension de l’instrumentalisation des médicaments et examinons les mécanismes neurobiologiques et neuropharmacologiques sous-jacents qui ont commencé à émerger [206]. Pour les objectifs d’instrumentalisation humaine pour lesquels aucune preuve neurobiologique n’est disponible, les mécanismes plausibles dérivés des profils neuropharmacologiques des médicaments utilisés sont discutés.
4.1 Interactions sociales améliorées.
Les êtres humains sont des individus sociaux. Les interactions sociales comprennent de nombreux comportements orientés vers un but précis qui ont des effets gratifiants innés [182,229]. Il existe plusieurs substances psychoactives connues qui peuvent transformer un état mental actuel en un état qui facilite les interactions sociales efficaces entre les humains [331]. Ces substances comprennent l’alcool [28,85,159], la marihuana [19,101,359], la cocaïne [166,224], d’autres psychostimulants [57,102,339], la nicotine et la caféine [43,69]. Toutes ces drogues ont une fenêtre de dose efficace pour cet objectif qui est bien en dessous des niveaux toxiques dans une gamme basse à moyenne [[25], [26], [27],42,196,290,296].
Chez l’homme, l’alcool peut atténuer l’inhibition sociale, le malaise dans les situations sociales et l’anxiété sociale. En même temps, il augmente le comportement d’approche sociale [15,20,40,231]. Ces effets se produisent spécifiquement à une dose relativement faible d’alcool. Un médiateur important de ces effets est l’interaction de l’alcool avec le récepteur de l’acide γ-butyrique (GABA) de type A (GABAA) dans le cerveau. Le GABA est le transmetteur inhibiteur le plus abondant dans le cerveau et est essentiel pour la suppression naturelle ou conditionnée du comportement [99,184,303,319].
L’activité du GABA au niveau des récepteurs GABAA est renforcée par l’alcool. Cet effet est considéré comme responsable de la réduction de l’anxiété naturelle et acquise. Il peut conduire directement à une désinhibition du comportement. Il a également été démontré que l’alcool augmente l’activité des neurotransmetteurs modulateurs monoaminergiques au niveau des synapses du système mésolimbique du cerveau [61,204,302]. Ces effets neurochimiques peuvent abaisser le seuil de récompense du cerveau [149] et augmenter la récompense sociale [121,263]. Cependant, dans cette gamme de doses, l’alcool peut également avoir des effets négatifs, notamment sur la cognition sociale. Ces effets sont très probablement médiés par l’action de l’alcool dans les zones corticales supérieures [38,323].
Les humains consomment également des psychostimulants dans un contexte social, par exemple dans des clubs ou lors de fêtes. Cette consommation comprend des drogues comme la cocaïne, l’amphétamine, le méthylphénidate, la méthamphétamine et la méthylènedioxyméthamphétamine (MDMA/ecstasy) [32,339]. Lorsqu’ils sont consommés à des doses faibles ou moyennes, les psychostimulants peuvent accroître l’attention et améliorer le niveau d’éveil général. Pendant les interactions sociales, ils suppriment la fatigue [76]. Cependant, ils peuvent également augmenter l’agressivité sociale [70]. Des études animales ont montré que les rats augmentent leur consommation de cocaïne après avoir été exposés à un animal résident dominant et agressif qu’ils ne peuvent ni éviter ni fuir [190]. Ceci peut être considéré comme une démonstration expérimentale d’une tentative d’instrumentaliser certains des effets psychopharmacologiques de la cocaïne afin de mieux faire face à l’expérience psychologique négative d’un facteur de stress social incontrôlable.
Les psychostimulants sont bien connus pour leurs effets neurochimiques prononcés sur l’activité modulatrice des neurotransmetteurs dans le cerveau. Ils augmentent de manière dose-dépendante les niveaux extracellulaires de dopamine (DA), de sérotonine (5-HT) et de noradrénaline (NA) dans le système mésolimbique [252,253]. Ce phénomène est médié soit par le blocage des transporteurs de monoamines correspondants, soit en agissant comme un substrat compétitif pour le transport [89,129,199,221,244,291]. En particulier, les effets noradrénergiques peuvent expliquer les effets sur l’attention [13]. L’action sérotoninergique peut être à l’origine des effets anxiolytiques [110,200,288] et de l’augmentation de l’agressivité de ces drogues [167,245]. En outre, l’action dopaminergique peut renforcer les effets gratifiants des stimuli sociaux et des interactions sociales [16]. Dans l’ensemble, plusieurs classes de médicaments psychoactifs sont actuellement utilisées par des non-dépendants pour faciliter le comportement social. Cependant, la consommation exagérée de drogues dans ce but d’instrumentalisation peut également faciliter la transition vers la consommation habituelle de drogues et la dépendance [207,333].
4.2 Facilitation du comportement sexuel.
Le comportement d’accouplement est un comportement orienté vers un objectif qui possède naturellement des propriétés hautement gratifiantes [230]. Chez l’homme, le comportement d’accouplement va de la recherche d’un partenaire et du comportement d’approche aux rapports sexuels proprement dits. Pratiquement toutes les drogues qui sont utilisées pour améliorer les interactions sociales sont également utilisées pour faciliter les comportements d’accouplement dans des micro-environnements distincts. Ces drogues comprennent l’alcool, le cannabis, les amphétamines, l’ecstasy et la cocaïne [[25], [26], [27],172]. Pour l’alcool en particulier, une forte association a été rapportée entre la consommation d’alcool, un changement d’état mental vers l’ivresse, et la perception des chances de rapports sexuels chez les adolescents et les jeunes adultes [162,230,338]. Une facilitation du comportement d’accouplement pourrait avoir été fortement sélectionnée au cours de l’évolution.
Les psychostimulants sont également utilisés pour améliorer les chances de recherche de partenaire et de comportement d’approche. Cependant, ils peuvent ultérieurement altérer les performances physiques pendant les rapports sexuels, en particulier l’érection chez les hommes [172,334]. On peut supposer que les effets aigus des psychostimulants sur l’activité dopaminergique dans le système mésolimbique pourraient rendre un individu plus sensible aux signaux sexuels. Un partenaire potentiel peut sembler plus attirant [121,149]. Cependant, la consommation de psychostimulants dans ce contexte peut également accroître la vulnérabilité au développement ultérieur de la toxicomanie, comme cela a été démontré chez les rats mâles [158].
4.3 Amélioration des performances cognitives et contrer la fatigue.
Des compétences cognitives sophistiquées sont nécessaires pour de nombreux comportements culturels dans les sociétés humaines actuelles [210]. Le suivi cognitif améliore le résultat des comportements complexes dirigés vers un but chez les animaux et les humains [11,126,127]. Cependant, la capacité cognitive humaine n’est pas constante tout au long de la journée. Même pendant la période d’éveil, et selon la charge de travail, la capacité cognitive fluctue et peut diminuer vers la fin de la période. Ainsi, les moyens pharmacologiques permettant de prolonger artificiellement les périodes de haute capacité cognitive sont bénéfiques pour la plupart des autres comportements manifestés pendant cette période.
À l’heure actuelle, il existe peu de preuves d’une augmentation significative des performances cognitives chez un individu en bonne santé et doté de toutes ses capacités mentales après l’absorption d’un quelconque médicament psychoactif. Cependant, de nombreuses études montrent aujourd’hui que les déficiences légères dues à l’épuisement, à la fatigue ou aux sautes d’humeur peuvent parfois être compensées par les drogues psychoactives [27,29,30,165,196,226,275,298]. Une forte pression sur l’efficacité de l’activité cognitive et du comportement qui en résulte est évidente dans de nombreux micro-environnements, que ce soit sur le lieu de travail ou pendant les activités de loisirs. Cette situation est souvent perçue comme stressante, et le soulagement de ce stress après la consommation de substances psychoactives est un effet de renforcement négatif. Les drogues psychoactives sont utilisées comme “dopage quotidien” pour le renforcement neurologique [264,347]. Pendant de nombreuses décennies, dans le débat sur le neuro-amélioration, la recherche active, le développement et l’utilisation autorisée de substances psychoactives ont été présentés comme une utilisation instrumentale des drogues pour améliorer explicitement les performances cognitives [277].
La caféine, composant psychoactif du café, du thé, du chocolat et des boissons gazeuses, est une drogue psychoactive légale largement utilisée pour maintenir les gens éveillés [30]. Il a même été démontré qu’elle améliore la consolidation de la mémoire à long terme chez l’homme lorsqu’elle est consommée après l’essai [21]. L’action neuropharmacologique a lieu dans le système de l’adénosine. Les niveaux d’adénosine dans le cerveau augmentent régulièrement pendant la période d’éveil. Après une longue période durant cette période, l’adénosine finit par déclencher la fatigue et le sommeil par son action sur les récepteurs A1- et A2A de l’adénosine [112,116,239]. La caféine agit comme un antagoniste des récepteurs A1 et A2A et bloque l’action de l’adénosine accumulée [43].
La nicotine est un des principaux composés psychoactifs du tabac [163]. Elle est légale et également utilisée dans ce but d’instrumentalisation. Des études comparatives ont montré que les rats peuvent apprendre à augmenter leur consommation de nicotine avant une tâche exigeante sur le plan cognitif [212]. Ce comportement peut être interprété comme une tentative d’instrumentaliser les effets d’amélioration cognitive de la nicotine pour un effort cognitif élevé anticipé. La nicotine est un agoniste des récepteurs nicotiniques ACh- [179]. La stimulation des récepteurs ACh nicotiniques dans le cerveau est un mécanisme majeur pour stimuler l’attention, qui est également une condition préalable à l’apprentissage et à la mémoire [274,316]. Dans des études animales, la nicotine a amélioré l’attention et la réalisation de tâches cognitives [59,96]. Des effets similaires ont également été rapportés chez des humains non fumeurs [250]. Cependant, chez les fumeurs humains, les capacités cognitives diminuent généralement après l’arrêt du tabac. Cet effet peut être inversé par une nouvelle dose de nicotine [175].
Une fois que la nicotine a atteint le cerveau, elle augmente l’activité acétylcholinergique et noradrénergique [193,349]. Ces deux systèmes de transmetteurs agissent en synergie pour maintenir l’éveil et l’attention. De plus, comme les récepteurs nicotiniques ACh sont localisés au niveau des neurones dopaminergiques, leur stimulation peut directement augmenter l’activité DA mésolimbique, bien qu’à un degré moindre que d’autres substances, comme les psychostimulants [179,183,238,350]. Par cet effet, la nicotine peut renforcer les propriétés de récompense d’un renforçateur non médicamenteux [100,141].
Les psychostimulants sont bien connus pour augmenter les performances cognitives pendant plusieurs heures [11,57,90,165,185,248,310,314,339]. Cet effet peut être observé dans une gamme de doses qui n’induit pas d’effets euphoriques majeurs. Il a été démontré que les psychostimulants augmentent l’éveil et l’attention chez l’homme pendant de longues périodes et sont utilisés pour améliorer les performances cognitives et comportementales [108,264,306]. Ils peuvent également atténuer les déficits cognitifs causés par la privation de sommeil [76]. On suppose que les effets aigus sur l’activité noradrénergique en particulier sont à l’origine de cette action [89,129,291,324]. Dans l’ensemble, plusieurs sources de données soutiennent l’idée que divers groupes de substances psychoactives peuvent être utilisés pour améliorer les performances cognitives. Cependant, l’utilisation régulière et à long terme de ces drogues peut induire une tolérance aux effets d’amélioration cognitive et même conduire à des déficits cognitifs [104,207,330,348].
4.4 Facilitation de la récupération et stratégie d’adaptation au stress.
Dans les sociétés actuelles, les humains sont tenus d’exécuter des comportements complexes ou des activités cognitives pendant de longues périodes de temps [10], ce qui mobilise leurs ressources de performance. Pendant la période d’éveil, les gens ont peu de temps pour récupérer efficacement et faire face au stress psychologique causé par ces activités. Dans les études d’interviews, les personnes rapportent plusieurs drogues psychoactives qui peuvent améliorer la récupération et la gestion du stress [8,15,196,231,290]. Les drogues utilisées pour l’objectif d’instrumentalisation ” faciliter la récupération et la gestion du stress psychologique ” sont l’alcool [49,50,159], le cannabis [19,360], la cocaïne [166,334], la méthamphétamine [165], les barbituriques, les benzodiazépines et d’autres anxiolytiques sédatifs [24,299].
La dévalorisation de la récompense et l’extinction du comportement précédemment récompensé peuvent induire un stress et une légère dépression [117,118]. Cela renforce également la préférence pour l’alcool et les benzodiazépines dans un paradigme d’automédication chez les rats [176,177]. L’alcool peut atténuer les niveaux de stress en inhibant la transmission glutamatergique excitatrice et en augmentant l’activité GABAergique inhibitrice dans le cerveau [303]. En outre, les barbituriques et les benzodiazépines exercent très probablement leurs effets réducteurs de stress par la modulation des récepteurs GABAA [119], bien que sur des sites de liaison différents de ceux de l’alcool. Ils augmentent également de manière allostérique les réponses au GABA [5]. On sait que l’amélioration de la signalisation des récepteurs GABAA atténue l’anxiété. En outre, les médicaments sédatifs comme l’alcool peuvent atténuer la mémoire des événements aversifs par leur interaction avec les récepteurs GABAA néocorticaux [56].
L’auto-administration de substances psychoactives ayant pour effet d’améliorer la gestion du stress a été observée dans divers modèles animaux. L’héroïne est auto-administrée par voie intraveineuse par des rats. Cette auto-administration augmente lorsque les rats sont exposés à un choc alimentaire inévitable [292]. Cependant, la question de savoir si les marqueurs biologiques du stress sont atténués et si le comportement lié au stress est réduit n’a pas été étudiée. Dans une autre étude sur des souris, il a été démontré que le stress de la défaite sociale peut augmenter la consommation de morphine. Dans les zones mésocorticolimbiques du cerveau, le stress induit une augmentation de l’immunoréactivité ΔFosB [52,219]. Cet effet a également été observé lors de l’établissement de la toxicomanie [233]. Néanmoins, la mesure dans laquelle la morphine réduit le comportement lié au stress ou rétablit l’homéostasie dans le cerveau reste à étudier.
Une drogue psychoactive largement utilisée pour l’objectif d’instrumentalisation de l’adaptation au stress est le cannabis [25,26], qui contient du Δ9-tétrahydrocannabinol (THC) comme principal composé psychoactif [120]. Le THC se lie aux récepteurs cannabinoïdes (CB) [188]. En particulier, l’activité du THC sur le récepteur CB1 peut améliorer l’extinction des souvenirs aversifs [180].
Le stress social peut également entraîner une augmentation de l’auto-administration de drogues non sédatives ayant un profil d’action stimulant, comme la cocaïne. Il a été suggéré que cela pourrait soutenir une stratégie d’adaptation active en renforçant la réaction de ” fuite ou de combat ” [201]. Le stress modifie la fonction du système DA mésolimbique [156,191], ainsi que ses entrées excitatrices [80] et inhibitrices [187,237]. Il peut provoquer une sensibilisation croisée de ce système aux effets comportementaux des psychostimulants et améliorer le comportement d’auto-administration de drogues [55,191]. Il a été démontré qu’un seul épisode de stress lié à une défaite sociale peut augmenter l’expression mésocorticolimbique du gène précoce immédiat cFos, qui est un indicateur de l’activation neuronale [52,191].
Les psychostimulants augmentent l’expression de cFos [191,279]. Cependant, la cocaïne peut contrecarrer les effets d’activation de c-fos du stress de la défaite sociale dans des régions cérébrales distinctes [191,219]. Ceci illustre comment la cocaïne induit un effet apparemment paradoxal qui peut contribuer au rétablissement de l’homéostasie chez un animal stressé. Cependant, plusieurs jours après l’adaptation initiale au stress, un effet accru a été observé. Cela peut suggérer qu’un effet d’instrumentalisation aiguë de la drogue peut revenir après une consommation répétée de drogue et rendre un état sensibilisé dans un organisme qui peut faciliter le développement d’une addiction [191]. Dans le cerveau, la signalisation des récepteurs μ- et κ-opioïdes et leur activation par les neurotransmetteurs endogènes, l’encéphaline et la dynorphine, sont renforcées après un stress [187,219,237]. Cet effet pourrait être le médiateur direct de l’immobilité et de l’analgésie induites par le stress. Il peut également augmenter la sensibilité à la récompense de la cocaïne et la réintégration de l’auto-administration de drogues lorsqu’il émerge dans la projection mésolimbique VTA-NAc [187,191,237].
Il existe des différences interindividuelles entre les organismes qui les rendent vulnérables au stress et à ses effets comportementaux [134]. L’adaptation au stress social par une auto-administration accrue de cocaïne a été principalement observée chez les animaux ayant une faible activité spontanée [131]. Cela pourrait suggérer une dépendance de l’efficacité de l’instrumentalisation des drogues par rapport aux traits de personnalité. Dans l’ensemble, plusieurs classes de médicaments psychoactifs sont actuellement utilisées pour faciliter la guérison et la gestion du stress chez les consommateurs de drogues non dépendants. Toutefois, l’utilisation chronique et croissante de substances psychoactives dans ce but d’instrumentalisation peut finir par entraîner une agitation et un état d’hyper-anxiété pendant le sevrage, ainsi qu’une consommation compulsive de drogues [207].
4.5 Auto-médicamentation pour les troubles psychiatriques et problèmes mentaux.
Les troubles mentaux se caractérisent par un état mental persistant qui est perçu comme aversif ou qui cause des problèmes importants. Un trouble mental entraîne une souffrance pour l’individu affecté et compromet le bien-être et l’interaction avec les autres. Les fondements neurobiologiques d’un état mental altéré de façon permanente peuvent être un dysfonctionnement temporaire, récurrent ou continu de l’homéostasie d’un ou plusieurs systèmes de transmetteurs modulateurs du cerveau [137,144,157,246,278]. Des troubles psychiatriques spécifiques sont associés à une consommation accrue de certains types de drogues et à un risque accru de développer une toxicomanie [254]. L’action des médicaments chez ces personnes est souvent différente de celle des personnes sans troubles psychiatriques comorbides. Chez ces patients, un médicament psychoactif peut soulager, au moins temporairement, la souffrance liée au trouble et améliorer, dans une certaine mesure, le “fonctionnement” dans la vie quotidienne [165,226]. Cela peut également s’appliquer aux états mentaux qui donnent lieu à des problèmes psychologiques, comme une humeur dépressive, mais qui ne remplissent pas les critères diagnostiques d’un trouble psychiatrique [23,26,27,196].
Dans les sociétés occidentales, une drogue légale fréquemment utilisée pour cet objectif d’instrumentalisation est l’alcool. La consommation modérée d’alcool a été associée à une meilleure santé, à plus d’amitiés proches et à plus de soutien familial que l’abstinence totale [195,201,231,259,301,313,318]. Elle a également été associée à des taux plus faibles de dépression induite par le stress [318] et semble réduire le risque de troubles somatiques, de troubles anxieux et de dépression par rapport aux personnes qui s’abstiennent totalement d’alcool [231,301]. Par conséquent, il a été suggéré que l’alcool pouvait soulager les affects négatifs chez les consommateurs non dépendants [231]. Dans les échantillons cliniques, cependant, une comorbidité élevée apparaît entre les diagnostics de “dépression majeure” et de “dépendance à l’alcool” [37,242]. Néanmoins, cela peut concerner des populations différentes avec des voies pathogéniques éventuellement distinctes. Le trouble dépressif majeur peut donner lieu à un comportement d’abus d’alcool et fréquemment à une dépendance à l’alcool. Dans la majorité des cas de comorbidité, il semble qu’une dépendance établie à l’alcool puisse induire une dépression majeure [262, [280], [281], [282], [283].
Les mécanismes neurobiologiques de la manière dont un trouble psychiatrique peut façonner les comportements de consommation d’alcool ont été récemment caractérisés. Les membranes des cellules de mammifères sont principalement constituées de sphingolipides, de cholestérol et de (glycéro)-phospholipides. Les sphingolipides sont composés d’un groupe de tête hydrophile et d’une molécule de céramide. La céramide est constituée de D-érythro-sphingosine et d’un acide gras de longueur variable avec 2 à 36 atomes de carbone dans la chaîne acyle [271]. Les interactions moléculaires des sphingolipides sont médiées par le cholestérol membranaire dans les membranes cellulaires, entre autres [34,170,189]. Les interactions entre le cholestérol et les sphingolipides donnent lieu à une structure membranaire ordonnée avec des domaines membranaires stables [34, 98, 170, 189, 295]. Ces domaines membranaires sont séparés bien qu’adjacents à d’autres glycérophospholipides dans la membrane. En raison de leurs propriétés de flottaison de la membrane, ces domaines ont été appelés radeaux lipidiques [68,295].
Le sphingolipide le plus abondant dans le cerveau est la sphingomyéline [118,208]. Elle peut être hydrolysée en céramide, qui a tendance à s’auto-associer spontanément, ce qui entraîne la formation de microdomaines membranaires enrichis en céramide. Ces microdomaines peuvent même fusionner pour former des macrodomaines plus grands enrichis en céramides [75,87,88,327]. Les protéines réceptrices situées dans de petits domaines de la membrane plasmique sont une condition préalable majeure à la signalisation transmembranaire induite par les neurotransmetteurs [91]. Après l’apprentissage ou le stress, le cholestérol ou la sphingomyéline diminue temporairement de manière sélective dans la zone du cerveau dans les études animales [118,223]. Cela modifie la composition des radeaux lipidiques, ce qui peut affecter directement les fonctions des récepteurs [74,220,247].
La génération de céramides dans la membrane plasmique peut être médiée par l’enzyme sphingomyélinase acide (ASM) [107]. Plusieurs sphingomyélinases neutres et alcalines ont été identifiées en fonction de leur pH optimal pour l’activité enzymatique [107,153]. Il a été signalé que la perturbation du rhéostat des sphingolipides dans le cerveau peut induire une dépression majeure et des troubles anxieux [[92], [93], [94],152,205,359]. Les souris surexprimant l’ASM (tgASM) présentent une activité ASM et une production de céramides plus élevées dans l’hippocampe [92]. Une augmentation de la céramide hippocampique peut atténuer directement la neurogenèse locale, la maturation neuronale et la survie neuronale [92,93]. Cet effet est un marqueur neurobiologique associé à un phénotype de type dépression [272].
Les souris tgASM présentent un phénotype de type dépression/anxiété dans les tests comportementaux [92,152,208]. De nombreux antidépresseurs agissent comme des inhibiteurs fonctionnels de l’ASM [3,150,151] et peuvent atténuer les effets dépressogènes du stress chronique imprévisible sur le comportement des souris de type sauvage (WT) et tgASM. Cependant, ils n’ont aucun effet sur les souris dépourvues d’ASM (ASM knockout). Ces résultats suggèrent une nouvelle voie de dépression médiée par les sphingolipides qui peut être déclenchée soit par une mutation génétique, soit par le stress [88,92,94,152,208].
Dans une sous-population de patients présentant une comorbidité alcoolisme/dépression majeure, la dépression se manifeste d’abord. Ensuite, une consommation accrue d’alcool est observée et peut finalement conduire à une dépendance [262, 280, 281, 282, 283]. Il a été suggéré que chez ces patients, l’alcool est utilisé et instrumentalisé pour atténuer la souffrance de la dépression ou de l’anxiété [201,204]. Des modèles animaux ont montré que l’auto-administration volontaire d’alcool peut réduire les symptômes dépressifs, et cet effet peut soutenir des taux de consommation élevés [46,318].
Un mécanisme expliquant les effets thérapeutiques paradoxaux de l’alcool a été suggéré. Les souris présentant une hyperfonction de l’ASM sont non seulement déprimées, mais elles consomment également beaucoup plus d’alcool dans un paradigme de libre choix. En outre, elles augmentent leur consommation après le sevrage [208]. La consommation d’alcool à volonté a partiellement inversé l’hyperactivité de l’ASM chez les souris tgASM, mais pas les injections forcées de quantités équivalentes d’alcool. L’auto-titration d’alcool a normalisé les symptômes comportementaux dépressifs chez ces animaux. L’hyperactivité de l’ASM a réduit les niveaux de l’espèce de sphingomyéline la plus abondante dans la NAc et l’hippocampe dorsal (DH). La consommation d’alcool chez les souris WT a eu un effet similaire sur le rhéostat des sphingolipides. Chez les souris tgASM, cependant, la consommation d’alcool a eu un effet paradoxal : elle a inversé le déficit en sphingolipides génétiquement induit dans la NAc, mais pas dans la DH.
Les souris tgASM dépressives ont également montré une atténuation importante des niveaux tissulaires de DA et de 5-HT dans le cerveau [208], mais la réactivité de DA à un défi alcoolique aigu était améliorée [133,134]. La consommation d’alcool a presque complètement inversé le déficit tissulaire en monoamines chez les souris tgASM, mais a eu l’effet inverse chez les souris WT [208]. Ces études ont montré comment un médicament psychoactif peut entraîner une inversion paradoxale des symptômes d’une maladie psychiatrique en ayant une action différente dans un cerveau affecté par rapport à un cerveau sain. Cela peut également suggérer que les médicaments psychoactifs peuvent avoir des effets différents selon l’état mental de l’organisme [206].
La consommation accrue de substances psychoactives et les diagnostics de dépendance ont également été associés au syndrome de stress post-traumatique (SSPT) [255,305]. Un stress sévère peut entraîner une réactivité accrue aux facteurs de stress légers au niveau endocrinien et comportemental. Le stress renforce également les effets de renforcement des drogues psychostimulantes, comme l’alcool et les opiacés. Il augmente l’auto-administration et la résistance à l’extinction de façon aiguë et pendant une longue période après la fin du stress [169,235,236].
L’apparition du Syndrome de Stress Post-Traumatique (PTSD) peut déclencher le développement de l’abus de drogues et de la dépendance. Cependant, l’abus de drogues peut également renforcer la vulnérabilité aux événements stressants qui provoquent le PTSD. L’hypothèse de l’automédication suggère que les patients consomment des substances psychoactives pour mieux contrôler leurs symptômes de PTSD [143,144]. On rapporte fréquemment que l’alcool atténue l’excitation et réduit la réactivité physiologique aux facteurs de stress [293,303]. La réduction de la tension qui s’ensuit est considérée comme un facteur de renforcement négatif, ce qui favorise la consommation d’alcool [48]. En outre, l’alcool peut réduire les comportements de peur et d’évitement ainsi que les symptômes cognitifs intrusifs chez les humains, tels que les souvenirs pénibles de l’événement aversif [304]. Dans les modèles animaux, l’augmentation de la consommation d’alcool ne se produit pas immédiatement, mais avec un certain retard. Cela dépend également du type de stress utilisé pour modéliser les symptômes du PTSD [325,326]. Un stress aigu et sévère sensibilise le système de récompense aux effets des drogues psychoactives et rend ainsi une personne plus vulnérable au développement d’une dépendance [174,354].
La schizophrénie est un autre trouble psychiatrique majeur. Les patients présentent souvent une consommation accrue de nicotine et de cannabis [115,194]. Cependant, ces drogues peuvent exacerber les symptômes positifs de la maladie, comme les hallucinations [234]. En revanche, la nicotine pourrait améliorer les symptômes négatifs, tels que l’atténuation de l’affect et les troubles cognitifs [241,250]. Des rapports de patients et des études expérimentales suggèrent que certains médicaments psychoactifs peuvent atténuer les symptômes négatifs en particulier, ainsi qu’améliorer les déficiences cognitives dans une certaine mesure [65,216].
Une amélioration des déficits cognitifs a été démontrée dans un modèle de schizophrénie chez le rat. L’activation immunitaire maternelle (MIA) par le lipopolysaccharide (LPS) pendant la gestation peut induire des déficits cognitifs semblables à ceux de la schizophrénie, mesurés dans les paradigmes de l’inhibition latente et du test de non-appariement différé à un échantillon. Chez la progéniture, le MIA n’a pas augmenté l’auto-administration de nicotine. Dans le groupe MIA, l’auto-administration de nicotine a pu améliorer les déficits cognitifs, mais pas dans le groupe de contrôle salin [335].
La nicotine a également amélioré les déficits cognitifs dans un modèle murin de schizophrénie qui ressemble à un génotype humain spécifique. Une étude d’association à l’échelle du génome humain sur des patients atteints de schizophrénie a identifié le polymorphisme nucléotidique unique (SNP) rs16969968 dans le gène CHRNA5 comme étant significativement associé à la maladie. Le gène CHRNA5 code pour la sous-unité α5 du récepteur nicotinergique de l’ACh (nAChR) [276]. Ce polymorphisme SNP entraîne une substitution de l’acide aspartique par l’asparagine au niveau du locus 398 de la sous-unité α5 du nAChR humain. Un modèle de souris a été utilisé pour étudier les implications fonctionnelles de ce SNP.
Des souris transgéniques exprimant le SNP α5 humain ont présenté un comportement social altéré et une perturbation du déclenchement sensorimoteur, qui sont tous deux des symptômes typiques de la schizophrénie. L’altération de la fonction de la sous-unité α5 du nAChR a entraîné une diminution de l’activité des microcircuits des couches II/III du cortex préfrontal, qui dépendait des interneurones GABAergiques. Cet effet imite l’hypoactivité du cerveau frontal telle qu’elle est observée chez les patients atteints de schizophrénie. Chez les souris déficientes en α5, l’administration continue de nicotine a normalisé le tir des neurones, mais pas chez les souris normales [154]. Ces résultats suggèrent que l’auto-administration de nicotine est particulièrement efficace pour améliorer le dysfonctionnement cortical dans une sous-population de schizophrènes : ceux qui présentent un polymorphisme du α5 nAChR [154,206].
Au total, on peut identifier plusieurs substances psychoactives utilisées par les personnes souffrant de troubles psychiatriques pour améliorer au moins certains symptômes de la maladie ou la souffrance subjective pendant un certain temps. L’utilisation continue et croissante de substances psychoactives dans ce but peut toutefois finir par potentialiser les symptômes de la maladie et entraîner un trouble de dépendance comorbide [207,254]. La consommation de substances psychoactives à des fins d’automédication peut également accroître le risque de passer à côté de pharmacothérapies cliniques plus efficaces et fondées sur des preuves pour les troubles concernés.
4.6 Curiosité sensorielle – un horizon de perception élargi.
En l’absence de nouvelles entrées sensorielles, les humains perçoivent l’ennui comme un état mental légèrement aversif. La recherche d’informations nouvelles et de nouveaux environnements est une force motrice qui expose un individu à de nouveaux stimuli et environnements. Dans ces environnements, de nouvelles contingences stimulus-récompense peuvent exister et être apprises, ce qui procure ensuite un avantage direct à l’individu [138,201,315]. La nouveauté et les nouvelles sensations peuvent fonctionner comme un renforçateur primaire [336,361]. Chez l’homme, la recherche de la nouveauté s’est avérée être un phénotype à risque pour la toxicomanie, avec une base génétique commune [192,361]. Lorsqu’une drogue psychoactive est consommée pour la première fois ou dans un nouvel environnement, l’état mental induit par la drogue peut servir de nouveauté. Jusqu’à un certain temps, cet effet de nouveauté peut inciter à une consommation répétée de la drogue. Après une exposition répétée, les effets de la drogue sur l’état mental ne sont plus nouveaux, et des effets de nouveauté autres que la récompense sont nécessaires pour maintenir la recherche et la consommation de drogue. Si aucun autre objectif d’instrumentalisation n’est établi pour une drogue psychoactive particulière, sa consommation peut finalement cesser [218].
Les drogues hallucinogènes utilisées par les humains comprennent des composés naturels, comme la mescaline et la psilocybine, ainsi que des drogues semi-synthétiques, comme le diéthylamide de l’acide lysergique (LSD). Ces drogues sont utilisées pour modifier la sensation et la perception du monde extérieur et pour accroître la compréhension et la découverte de soi [[25], [26], [27],42,196,218,320,321]. La drogue entactogène MDMA exerce des effets hallucinogènes mais induit également un sentiment unique d'”unité divine” avec le monde [97] et est utilisée dans ce but d’instrumentalisation [25,26]. Parmi les autres drogues, on peut citer la phencyclidine, la kétamine et le γ-hydroxybutyrate (GHB), qui sont utilisés dans le milieu des clubs et des raves. À fortes doses, ces drogues peuvent avoir des effets hallucinogènes profonds [32,102,103,337,346]. Certains rapports suggèrent également l’utilisation du cannabis pour élargir la perception de l’environnement et de soi [19,360]. La consommation chronique et croissante de drogues dans ce but d’instrumentalisation peut entraîner des comportements dangereux et des perceptions aversives, y compris des psychoses de type schizophrénique [207].
4.7 Euphorie, hédonisme et défonce.
Les êtres humains montrent une forte motivation à rechercher l’euphorie et le bonheur tout au long de leur vie [178,312]. L’être humain est la seule espèce connue qui peut faire état de l’état subjectif du bonheur. D’après ces rapports, on sait que ce sentiment subjectif peut survenir pendant ou après la réception d’une récompense primaire ou secondaire ou lors d’un changement inattendu des contingences de la récompense. Cela se produit lorsqu’un stimulus auparavant dénué de sens prédit maintenant la disponibilité de la récompense. La fonction biologique de la perception subjective de l’euphorie est loin d’être claire car elle ne contrôle pas directement les adaptations comportementales [4]. Néanmoins, la quantité de bonheur subjectivement perçue par un individu détermine son bien-être [132]. Le bien-être peut servir de perception subjective d’un signal d’adaptation endogène, qui informe le système nerveux central de l’état général de l’organisme et de la fonctionnalité des comportements établis [210].
Il a été avancé que l’amélioration de l’humeur et l’euphorie peuvent faciliter pratiquement tous les types de comportements dirigés vers un but préalablement établi [164,201,231]. De nombreuses drogues psychoactives peuvent induire un sentiment profond mais temporaire d’euphorie et de bien-être à des doses moyennes ou élevées, comme l’héroïne, la morphine, la cocaïne, les amphétamines, la méthamphétamine, le méthylphénidate et la MDMA [123,249]. En outre, les non-dépendants peuvent utiliser ces drogues dans ce but [23,186,314,357]. Une euphorie moins intense peut également être induite par d’autres drogues comme l’alcool, le cannabis, le LSD, les benzodiazépines et la nicotine [[25], [26], [27],294]. Les niveaux d’euphorie n’étant pas très élevés, ces drogues ne sont pas principalement consommées dans ce seul but.
On suppose que les substances psychoactives produisent des effets euphorisants par une augmentation massive de l’activité DA extracellulaire dans la NAc [61,63]. Le NAc est une structure clé du système DA mésolimbique qui est crucial pour l’apprentissage par renforcement dans le cerveau [64,267,343,344]. Des descriptions détaillées ont été fournies sur la façon dont différentes classes de drogues psychoactives addictives convergent vers le signal DA mésolimbique [9,62,147,183,329]. L’euphorie induite par les drogues est généralement plus intense que l’euphorie naturelle, ce qui s’accompagne d’une augmentation considérable de l’AD dans la NAc après la prise de la plupart des drogues par rapport aux stimuli naturels [6,198,199,269].
Cependant, le rôle majeur de la dopamine dans l’euphorie et l’apprentissage induits par les drogues a été remis en question [268], et ce point de vue a été approfondi par une différenciation psychologique entre le “désir” et le “goût” induits par le stimulus [16,256]. En conséquence, la dopamine peut ne pas être un signal d’euphorie, mais plutôt un code pour le ” désir ” de stimulus et informer sur l’erreur de prédiction de récompense dans l’évaluation du résultat comportemental [111,284]. Cela a été démontré pour les stimuli appétitifs agréables ainsi que pour les stimuli aversifs [31,181,356]. En revanche, l’euphorie et l’appréciation d’un stimulus peuvent être médiées par des signaux opioïdes et GABAergiques endogènes [16,17]. Les opinions actuelles reconnaissent également le rôle important d’autres systèmes de neurotransmetteurs dans les effets subjectifs d’euphorie et de renforcement du comportement des substances psychoactives [72,106,135,148,204,209,215,342]. La sur-instrumentation d’un médicament psychoactif dans ce but entraîne très probablement le développement d’une tolérance aux effets euphorisants et une augmentation de la consommation de médicaments. Les effets aigus du sevrage se caractérisent par une dysphorie et un état mental proche de la dépression, qui peuvent évoluer vers une toxicomanie [106,201,207].
4.8 Attractivité et apparence physique améliorées.
Dans les sociétés modernes, des concepts cognitifs idéalisés des hommes et des femmes ont émergé et sont maintenus comme guide de développement. Ils comprennent des attentes en matière de “comportementomes” non génétiquement hérités spécifiques au sexe [210] et des normes “idéales” en matière d’apparence physique. Compte tenu de la variation naturelle, d’origine génétique/épigénétique et environnementale, des phénotypes physiques humains, les gens se sentent poussés à adopter des comportements qui adaptent également leur apparence physique à ces normes [210]. Il existe des effets distincts des drogues psychoactives utilisées pour servir l’objectif d’instrumentalisation consistant à ” améliorer l’apparence physique et l’attrait “.
Dans les sociétés occidentales, il existe une pression en faveur d’une apparence maigre chez les femmes et d’une apparence musclée chez les hommes. La réduction du poids corporel est un motif fréquemment invoqué pour fumer du tabac. Les données épidémiologiques suggèrent que les fumeurs pèsent en moyenne moins que les non-fumeurs, même si les fumeurs ne mangent pas moins ou ne consomment pas moins de calories que les non-fumeurs. Il a été suggéré que la nicotine pourrait entraîner un stockage moins efficace des calories par son action dans l’intestin, [331]. La nicotine réduit également la prise de poids après l’arrêt du tabac [232]. Il a été suggéré que l’action de la nicotine sur les récepteurs ACh dans l’hypothalamus latéral est le mécanisme neuropharmacologique prédominant de la façon dont la nicotine peut contrôler la faim et le comportement alimentaire [125].
L’utilisation de médicaments psychostimulants a également été rapportée pour leur action anorexigène (c’est-à-dire des effets de suppression de la faim et de l’alimentation), y compris la cocaïne, l’amphétamine et ses dérivés [[25], [26], [27],79]. Ces effets anorexigènes sont très probablement médiés par les effets noradrénergiques plutôt que par les effets sérotoninergiques ou dopaminergiques des psychostimulants. En particulier, la stimulation des récepteurs α1 hypothalamiques a été considérée comme cruciale pour la réduction de la prise alimentaire induite par les médicaments [22,270].
Une apparence musclée est considérée comme un idéal chez les hommes. S’il existe des moyens naturels d’atteindre cet objectif, comme l’exercice physique ou la musculation, les médicaments psychoactifs peuvent également y contribuer. Les stéroïdes androgènes-anabolisants, comme la testostérone ou la nandrolone, sont utilisés dans le but d’obtenir une apparence plus musclée [86]. Les stéroïdes anabolisants-androgènes augmentent la croissance musculaire, très probablement par un mécanisme périphérique [146]. Néanmoins, ils ont également des effets psychoactifs directs, comme une augmentation de l’estime de soi [351,352]. L’amélioration de l’apparence physique est perçue par l’individu et peut donner lieu à un retour psychologique. Cela peut augmenter la confiance en soi et ainsi affecter d’autres comportements, tels que les interactions sociales ou les comportements d’accouplement [351]. Ces effets agissent lentement et peuvent faire appel aux systèmes opiacés endogènes. Dans les études animales, le traitement chronique avec des stéroïdes androgènes-anabolisants a augmenté les niveaux de l’opioïde endogène β-endorphine dans le système limbique et a modifié les densités des récepteurs opiacés. Les stéroïdes androgènes-anabolisants ont également des effets modulateurs sur le système 5-HT, ce qui pourrait expliquer les effets sur les niveaux d’agressivité [136,245].
Au total, plusieurs substances psychoactives sont utilisées pour faciliter ou inhiber un comportement visant à modifier l’apparence physique. La réduction du poids semble être un objectif soutenu chez les femmes, tandis qu’une apparence musclée est un objectif prédominant chez les hommes. Le choix de la drogue est spécifique au sexe pour cet objectif d’instrumentalisation, car la réduction du poids peut être obtenue par la stimulation des récepteurs nicotiniques ou l’activation de la NA. La facilitation de la croissance musculaire nécessite la stimulation d’un mécanisme périphérique impliquant les récepteurs aux androgènes.
4.9 Facilitation des activités religieuses et spirituelles.
La religion apparaît comme un phénomène humain unique. Elle fournit une base métaphysique et un ensemble cognitif de croyances qui peuvent expliquer le monde et le moi dans ce monde. D’un point de vue biologique, les religions peuvent effectivement “synchroniser” les ensembles cognitifs et le comportement des groupes sociaux. Elles peuvent favoriser l’altruisme au sein du groupe et renforcer la résistance aux menaces extérieures. Ainsi, les religions peuvent offrir des avantages en matière de santé et de bien-être, ce qui constitue un avantage adaptatif potentiel [14].
Dans les religions mono- et polythéistes, il existe des dieux qui ont une compréhension supérieure du monde et un pouvoir surhumain d’influencer l’environnement ou le destin des humains. Toutes les religions se caractérisent généralement par un échange restreint avec la divinité suprême. Dans des circonstances normales et dans un état mental normal, les croyants ordinaires n’ont pas accès au “divin” et ne peuvent pas comprendre ses actions ou le diriger de quelque manière que ce soit. Bien que ces deux aspects soient hautement souhaités par les croyants, certaines religions ont mis en place un mécanisme de médiation. Cela peut permettre à certains croyants d’avoir un contact dont on pense qu’il est de nature causale. Cet échange spécial est ressenti comme permettant une meilleure compréhension des intentions et des plans divins ou comme un moyen perçu d’influencer leur action et de résoudre les problèmes de l’individu ou du groupe.
Moro et Noreika [197] ont suggéré que dans un contexte défini, le but des drogues hallucinatoires peut être d’accroître la compréhension de soi et la découverte de soi et d’aborder des questions ultimes qui façonnent ou ébranlent la vision fondamentale du monde. Changer son état mental pour mieux communiquer avec l’entité divine peut être réalisé par des moyens naturels, comme la méditation et des schémas de pensée particuliers, mais un moyen plus puissant est l’utilisation de drogues psychoactives [201,202]. Ce comportement a été largement abandonné avec l’arrivée des religions monothéistes, comme le judaïsme, le christianisme et l’islam, et a été remplacé par la méditation et la prière. Cependant, il est encore en place dans certaines religions naturelles, comme celles du bassin amazonien [124] ou les religions amérindiennes [243].
Les drogues utilisées dans ce but d’instrumentalisation sont le THC [1], la cocaïne [307] et la nicotine [124]. Les drogues hallucinogènes utilisées sont la psilocybine, ainsi que la mescaline, que l’on trouve dans le cactus peyotl dans le sud et le centre de l’Amérique. En Amérique du Sud, la diméthyltryptamine (DMT) est utilisée comme un hallucinogène puissant [83,124,218]. Les drogues ont même été qualifiées d'”enthéogènes” (du grec ancien, “créer le divin en soi”), indiquant spécifiquement leur utilisation pour l’instrumentalisation religieuse [266]. L’instrumentalisation pour faciliter les pratiques spirituelles et religieuses pourrait en fait avoir été l’un des premiers exemples documentés d’instrumentalisation des drogues chez l’homme [1,105,332].
5. De l’instrumentalisation des drogues à la sur-instrumentalisation et à l’addiction.
La grande majorité des humains consommateurs de substances psychoactives contrôlent plutôt bien leur consommation avec des ajustements de dose et des périodes d’abstinence en fonction de la perception des effets négatifs de la drogue [334]. Cependant, un petit pourcentage de personnes passe de la consommation contrôlée et de l’instrumentalisation de la drogue à la dépendance. Un facteur crucial dans ce processus est potentiellement une tentative de sur-instrumentalisation avec une utilisation croissante de la drogue [145]. Avec l’exposition croissante à la drogue, de nombreux changements dans les fonctions cérébrales se produisent et induisent une inflexibilité comportementale et une consommation compulsive de drogue [71,204]. À ce stade, les effets toxiques et nocifs des drogues prédominent sur les avantages potentiels de l’instrumentalisation et les dépassent [2,201,207].
Les mécanismes cérébraux de l’établissement de la recherche de drogues et de l’usage contrôlé sont de mieux en mieux compris [135,183,204], ainsi que les facteurs de personnalité qui facilitent leur émergence au niveau neurobiologique [302]. Néanmoins, on sait peu de choses sur le mécanisme causal de la transition de la consommation contrôlée à la consommation compulsive de drogues. Nous proposons un mécanisme psychologique qui découle de l’instrumentalisation contrôlée des drogues. La sur-instrumentalisation d’une drogue psychoactive décrit la tentative d’une personne de renforcer l’instrumentalisation d’une drogue précédemment établie à un niveau où elle ne fournit plus de bénéfice net.
Le développement personnel des humains modifie les objectifs de développement en fonction de l’âge. Il en résulte des motifs distincts pour le “comportementome” d’une personne [210]. Par exemple, à l’âge de 18 ans, la socialisation, la recherche d’un partenaire et l’éducation professionnelle peuvent être des motifs comportementaux prédominants et des objectifs d’instrumentalisation des drogues. Une fois la période d’accouplement passée avec succès, une famille est fondée, et les enfants doivent être élevés. Parallèlement, la carrière professionnelle s’établit et peut s’accompagner de responsabilités croissantes et de stress au travail. Cela exige de nouveaux comportements et donne lieu à d’autres objectifs d’instrumentalisation des drogues. Il y a donc des changements quantitatifs dans les buts d’instrumentalisation. Ainsi, un objectif donné est poursuivi plus intensément, ce qui peut entraîner une fréquence plus élevée des épisodes de consommation, une augmentation de la dose de drogue et de la consommation totale de drogue. Parallèlement, il peut y avoir des changements qualitatifs lorsque le nombre de buts d’instrumentalisation augmente et que la consommation de drogues s’étend à d’autres drogues.
Bien que l’instrumentalisation des drogues soit un processus dynamique en ce qui concerne l’évolution des objectifs et des drogues utilisées à cette fin, il n’existe qu’une petite fenêtre de dose pour l’état mental optimal pour chaque drogue qui sert un objectif d’instrumentalisation particulier. Si l’on quitte cette fenêtre de dose en augmentant la dose de la drogue ou la fréquence d’utilisation, l’instrumentalisation de la drogue peut ne plus être possible. Par exemple, une consommation régulière mais bien contrôlée d’alcool est établie et maintenue dans le but de faciliter la gestion du stress après les heures de travail. Si la charge de travail augmente, par exemple à la suite d’une promotion ou d’un accroissement des responsabilités, l’outil d’adaptation bien établi peut être étendu quantitativement dans son utilisation, par exemple en augmentant le nombre de verres à chaque occasion.
Il peut aussi connaître une expansion qualitative, par exemple en ajoutant des épisodes de consommation de marihuana. Cette consommation peut alors sortir de la plage de dose/fréquence dans laquelle l’instrumentalisation est possible. Les effets toxiques et les effets sur les organes de la drogue apparaissent et deviennent les effets prédominants. Un effet indésirable majeur est le risque accru de perdre le contrôle de la consommation de drogue au-delà de toute utilité pour l’instrumentalisation et de développer une toxicomanie. On peut conclure que l’instrumentalisation de la drogue nécessite un processus d’apprentissage fin pour s’établir. Elle est soumise à des changements développementaux et ne peut être maintenue que par une auto-titration permanente entre ses bénéfices nets et ses effets indésirables potentiels [201,207].
6. Résumé.
Les substances psychoactives ayant un potentiel de dépendance sont largement utilisées par des personnes de pratiquement toutes les cultures de manière non addictive. Pour comprendre ce comportement, sa pénétration dans la population et sa persistance, l’instrumentalisation des drogues a été proposée comme moteur de cette consommation. Un petit pourcentage de personnes qui instrumentalisent régulièrement des drogues psychoactives font une transition vers la dépendance, qui commence souvent par des changements qualitatifs et quantitatifs dans les objectifs d’instrumentalisation. Ainsi, il est proposé que l’addiction se développe à partir d’une instrumentalisation des drogues préalablement établie à long terme. Ainsi, la prévention et le traitement de la toxicomanie par une approche de médecine individualisée peuvent essentiellement passer par la compréhension et le soutien non pharmacologique des objectifs personnels d’instrumentalisation.
Références :
[1] Abel E.L. Marihuana, The First Twelve Thousand Years, Plenum Press, New York, 1980.
[2] S.H. Ahmed, A. Badiani, K.A. Miczek, C.P. Müller, Non-pharmacological factors that determine drug use and addiction, Neurosci. Biobehav. Rev. (2018).
[3] S. Albouz, F. Le Saux, D. Wenger, J.J. Hauw, N. Baumann, Modifications of sphingomyelin and phosphatidylcholine metabolism by tricyclic antidepressants and phenothiazines, Life Sci. 38 (1986) 357–363.
[4] A. Alcaro, J. Panksepp, The SEEKING mind: primal neuro-affective substrates for appetitive incentive states and their pathological dynamics in addictions and depression, Neurosci. Biobehav. Rev. 35 (2011) 1805–1820.
[5] C. Allison, J.A. Pratt, Neuroadaptive processes in GABAergic and glutamatergic systems in benzodiazepine dependence, Pharmacol. Ther. 98 (2003) 171–195.
[6] D. Amato, S. Natesan, L. Yavich, S. Kapur, C.P. Müller, Dynamic regulation of dopamine and serotonin responses to salient stimuli during chronic haloperidol treatment, Int. J. Neuropsychopharmacol. 14 (2011) 1327–1339.
[7] American Psychiatrtric Association, Diagnostic Statistical Manual of Mental Disorders, 5th ed., (2013) (DSM-5), Washington DC.
[8] G. Amendt, No Drugs No Future. Drogen Im Zeitalter Der Globalisierung, Europa Verlag, Hamburg, 2003.
[9] A. Ameri, The effects of cannabinoids on the brain, Prog. Neurobiol. 58 (1999) 315–348.
[10] G. Anders, Die Antiquiertheit Des Menschen, Band 1: Über Die Seele Im Zeitalter Der Zweiten Industriellen Revolution [The Obsolescence of Human Beings, Volume 1: the Soul in the Age of the Second Industrial Revolution], Beck, Munich, 1956.
[11] A.M. Arria, E.D. Wish, Nonmedical use of prescription stimulants among students, Pediatr. Ann. 35 (2006) 565–571.
[12] M. Arroyo, A. Markou, T.W. Robbins, B.J. Everitt, Acquisition, maintenance and reinstatement of intravenous cocaine self-administration under a second-order schedule of reinforcement in rats: effects of conditioned cues and continuous access to cocaine, Psychopharmacology 140 (1998) 331–344.
[13] G. Aston-Jones, J. Rajkowski, J. Cohen, Role of locus coeruleus in attention and behavioral flexibility, Biol. Psychiatry 46 (1999) 1309–1320.
[14] S. Atran, A. Norenzayan, Religion’s evolutionary landscape: counterintuition, commitment, compassion, communion, Behav. Brain Sci. 27 (2004) 713–730.
[15] C. Baum-Baicker, The psychological benefits of moderate alcohol consumption: a review of the literature, Drug Alcohol Depend. 15 (1985) 305–322.
[16] K.C. Berridge, T.E. Robinson, Parsing reward, Trends Neurosci. 26 (2003) 507–513.
[17] K.C. Berridge, M.L. Kringelbach, Pleasure systems in the brain, Neuron 86 (2015) 646–664.
[18] L.J. Bierut, S.H. Dinwiddie, H. Begleiter, R.R. Crowe, V. Hesselbrock, J.I. Nurnberger, et al., Familial transmission of substance dependence: alcohol, marijuana, cocaine, and habitual smoking: a report from the Collaborative Study on the Genetics of Alcoholism, Arch. Gen. Psychiatry 55 (1998) 982–988.
[19] M.O. Bonn-Miller, M.J. Zvolensky, A. Bernstein, Marijuana use motives: concurrent relations to frequency of past 30-day use and anxiety sensitivity among young adult marijuana smokers, Addict. Behav. 32 (2007) 49–62.
[20] C. Booth, P. Hasking, Social anxiety and alcohol consumption: the role of alcohol expectancies and reward sensitivity, Addict. Behav. 34 (2009) 730–736.
[21] D. Borota, E. Murray, G. Keceli, A. Chang, J.M. Watabe, M. Ly, J.P. Toscano, M.A. Yassa, Post-study caffeine administration enhances memory consolidation in humans, Nat. Neurosci. 17 (2014) 201–203.
[22] F. Borsini, C. Bendotti, M. Carli, E. Poggesi, R. Samanin, The roles of brain noradrenaline and dopamine in the anorectic activity of diethylpropion in rats: a comparison with d-amphetamine, Res. Commun. Chem. Pathol. Pharmacol. 26 (1979) 3–11.
[23] C.J. Boyd, S.E. McCabe, J.A. Cranford, A. Young, Adolescents’ motivations to abuse prescription medications, Pediatrics 118 (2006) 2472–2480.
[24] C.J. Boyd, C.J. Teter, B.T. West, M. Morales, S.E. McCabe, Non-medical use of prescription analgesics: a three-year national longitudinal study, J. Addict. Dis. 28 (2009) 232–242.
[25] A. Boys, J. Marsden, P. Griffiths, J. Fountain, G. Stillwell, J. Strang, Substance use among young people: the relationship between perceived functions and intentions, Addiction 94 (1999) 1043–1050.
[26] A. Boys, J. Marsden, J. Strang, Understanding reasons for drug use amongst young people: a functional perspective, Health Educ. Res. 16 (2001) 457–469.
[27] A. Boys, J. Marsden, Perceived functions predict intensity of use and problems in young polysubstance users, Addiction 98 (2003) 951–963.
[28] C.M. Bradizza, A. Reifman, G.M. Barnes, Social and coping reasons for drinking: predicting alcohol misuse in adolescents, J. Stud. Alcohol 60 (1999) 491–499.
[29] R. Brand, W. Wolff, M. Ziegler, Drugs As Instruments: Describing and Testing a Behavioral Approach to the Study of Neuroenhancement, Front. Psychol. 7 (2016) 1226.
[30] R. Brand, H. Koch, Using Caffeine Pills for Performance Enhancement. An Experimental Study on University Students’ Willingness and Their Intention to Try Neuroenhancements, Front. Psychol. 7 (2016) 101.
[31] F. Brischoux, S. Chakraborty, D.I. Brierley, M.A. Ungless, Phasic excitation of dopamine neurons in ventral VTA by noxious stimuli, Proc. Natl. Acad. Sci. U.S.A. 106 (2009) 4894–4899.
[32] G.C. Britt, E.F. Cance-Katz, A brief overview of the clinical pharmacology of “club drugs”, Subst. Use Misuse 40 (2005) 1189–1201.
[33] U. Bronfenbrenner, Ecological models of human development, International Encyclopedia of Education, Elsevier Sciences, Oxford, 1994, pp. 1643–1647.
[34] D.A. Brown, E. London, Functions of lipid rafts in biological membranes, Annu. Rev. Cell Dev. Biol. 14 (1998) 111–136.
[35] S.A. Brown, M.S. Goldman, A. Inn, L.R. Anderson, Expectations of reinforcement from alcohol: their domain and relation to drinking patterns, J. Consult. Clin. Psychol. 48 (1980) 419–426.
[36] S.A. Brown, Expectancies versus background in the prediction of college drinking patterns, J. Consult. Clin. Psychol. 53 (1985) 123–130.
[37] S.A. Brown, R.K. Inaba, J.C. Gillin, M.A. Schuckit, M.A. Stewart, M.R. Irwin, Alcoholism and affective disorder: clinical course of depressive symptoms, Am. J. Psychiatry 152 (1995) 45–52.
[38] S. Burnett, C. Sebastian, K.K. Cohen, S.J. Blakemore, The social brain in adolescence: evidence from functional magnetic resonance imaging and behavioral studies, Neurosci. Biobehav. Rev. 35 (2010) 1654–1664.
[39] J.C. Campbell, K.K. Szumlinski, T.E. Kippin, Contribution of early environmental stress to alcoholism vulnerability, Alcohol 43 (7) (2009) 547–554.
[40] M.H. Carrigan, L.S. Ham, S.E. Thomas, C.L. Randall, Alcohol outcome expectancies and drinking to cope with social situations, Addict. Behav. 33 (2008) 1162–1166.
[41] E. Castren, Is mood chemistry? Nat. Rev. Neurosci. 6 (2005) 241–246.
[42] B.M. Cato, Youth’s recreation and drug sensations: is there a relationship? J. Drug Educ. 22 (1992) 293–301.
[43] O. Cauli, M. Morelli, Caffeine and the dopaminergic system, Behav. Pharmacol. 16 (2005) 63–77.
[44] J. Chick, Can light or moderate drinking benefit mental health? Eur. Addict. Res. 5 (2009) 74–81.
[45] J.S. Chisholm, Death, Hope, and Sex: Steps to an Evolutionary Ecology of Mind and Mortality, Cambridge University Press, Cambridge, 1999.
[46] R. Ciccocioppo, I. Panocka, R. Froldi, G. Colombo, G.L. Gessa, M. Massi, Antidepressant-like effect of ethanol revealed in the forced swimming test in Sardinian alcohol-preferring rats, Psychopharmacology (Berl.) 144 (1999) 151–157.
[47] D.H. Clayton, N.D. Wolfe, The adaptive significance of self-medication, Trends Evol Ecol 8 (2) (1993) 60–63.
[48] J.J. Conger, The effects of alcohol on conflict behavior in the albino rat, Q. J. Stud. Alcohol 12 (1) (1951) 1–29.
[49] M.L. Cooper, M. Russell, W.H. George, Coping, expectancies, and alcohol abuse: a test of social learning formulations, J. Abnorm. Psychol. 97 (1988) 218–230.
[50] M.L. Cooper, M. Russell, J.B. Skinner, M.R. Frone, P. Mudar, Stress and alcohol use: moderating effects of gender, coping, and alcohol expectancies, J. Abnorm. Psychol. 101 (1992) 139–152.
[51] M.L. Cooper, M.R. Frone, M. Russell, P. Mudar, Drinking to regulate positive and negative emotions: a motivational model of alcohol use, J. Pers. Soc. Psychol. 69 (1995) 990–1005.
[52] S.E. Cooper, M. Kechner, D. Caraballo-Perez, S. Kaska, A.J. Robison, M.S. Mazei-Robison, Comparison of chronic physical and emotional social defeat stress effects on mesocorticolimbic circuit activation and voluntary consumption of morphine, Sci. Rep. 7 (2017) 8445.
[53] L. Cosmides, J. Tooby, Origins of domain specificity: the evolution of functional organization, in: L. Hirschfeld, S. Gelman (Eds.), Mapping the Mind: Domain Specificity in Cognition and Culture, Cambridge University Press, New York, 1994, pp. 85–116.
[54] L. Cosmides, J. Tooby, Toward an evolutionary taxonomy of treatable conditions, J. Abnorm. Psychol. 108 (1999) 453–464.
[55] F.C. Cruz, I.M. Quadros, K. Hogenelst, C.S. Planeta, K.A. Miczek, Social defeat stress in rats: escalation of cocaine and “speedball” binge self-administration, but not heroin, Psychopharmacology (Berl.) 215 (2011) 165–175.
[56] H.V. Curran, Benzodiazepines, memory and mood: a review, Psychopharmacology (Berl.) 105 (1991) 1–8.
[57] J. Davey, N. Richards, J. Freeman, Fatigue and beyond: patterns of and motivations for illicit drug use among long-haul truck drivers, Traffic Inj. Prev. 8 (2007) 253–259.
[58] J.B. Davies, The Myth of Addiction, 2nd edn., Routledge, London, 1997.
[59] M.W. Decker, J.D. Brioni, A.W. Bannon, S.P. Arneric, Diversity of neuronal nicotinic acetylcholine receptors: lessons from behavior and implications for CNS therapeutics, Life Sci. 56 (1995) 545–570.
[60] A.V. Devineni, U. Heberlein, Preferential ethanol consumption in Drosophila models features of addiction, Curr. Biol. 19 (2009) 2126–2132.
[61] G. Di Chiara, A. Imperato, Drugs abused by humans preferentially increase synaptic dopamine concentrations in the mesolimbic system of freely moving rats, Proc. Natl. Acad. Sci. U.S.A. 85 (1988) 5274–5278.
[62] G. Di Chiara, R.A. North, Neurobiology of opiate abuse, Trends Pharmacol. Sci. 13 (1992) 185–193.
[63] G. Di Chiara, The role of dopamine in drug abuse viewed from the perspective of its role in motivation, Drug Alcohol Depend. 38 (1995) 95–137.
[64] G. Di Chiara, Nucleus accumbens shell and core dopamine: differential role in behavior and addiction, Behav. Brain Res. 137 (2002) 75–114.
[65] P. Dome, J. Lazary, M.P. Kalapos, Z. Rihmer, Smoking, nicotine and neuropsychiatric disorders, Neurosci. Biobehav. Rev. 34 (3) (2010) 295–342.
[66] R. Dudley, Evolutionary origins of human alcoholism in primate frugivory, Q. Rev. Biol. 75 (2000) 3–15.
[67] R. Dudley, Fermenting fruit and the historical ecology of ethanol ingestion: is alcoholism in modern humans an evolutionary hangover? Addiction 97 (2002) 381–388.
[68] C. Eggeling, C. Ringemann, R. Medda, G. Schwarzmann, K. Sandhoff, S. Polyakova, et al., Direct observation of the nanoscale dynamics of membrane lipids in a living cell, Nature 457 (2009) 1159 1162.
[69] T. Eissenberg, R.L. Balster, Initial tobacco use episodes in children and adolescents: current knowledge, future directions, Drug Alcohol Depend. 59 (Suppl 1) (2000) S41–S60.
[70] G.S. Emley, R.R. Hutchinson, Unique influences of 10 drugs upon post-shock biting attack and preshock manual responding, Pharmacol. Biochem. Behav. 19 (1983) 5–12.
[71] K.D. Ersche, A. Barnes, P.S. Jones, S. Morein-Zamir, T.W. Robbins, E.T. Bullmore, Abnormal structure of frontostriatal brain systems is associated with aspects of impulsivity and compulsivity in cocaine dependence, Brain 134 (2011) 2013–2024.
[72] B.J. Everitt, M.E. Wolf, Psychomotor stimulant addiction: a neural systems per- spective, J. Neurosci. 22 (9) (2002) 3312–3320.
[73] W.E. Fantegrossi, W.L. Woolverton, M. Kilbourn, P. Sherman, J. Yuan, G. Hatzidimitriou, G.A. Ricaurte, J.H. Woods, G. Winger, Behavioral and neurochemical consequences of long-term intravenous self-administration of MDMA and its enantiomers by rhesus monkeys, Neuropsychopharmacology 29 (2004) 1270–1281.
[74] J. Fantini, F.J. Barrantes, Sphingolipid/cholesterol regulation of neurotransmitter receptor conformation and function, Biochim. Biophys. Acta 1788 (2009) 2345–2361.
[75] J.C. Fanzo, M.P. Lynch, H. Phee, M. Hyer, A. Cremesti, H. Grassmé, J.S. Norris, K.M. Coggeshall, B.R. Rueda, A.B. Pernis, R. Kolesnick, E. Gulbins, CD95 rapidly clusters in cells of diverse origins, Cancer Biol. Ther. 2 (2003) 392–395.
[76] M.W. Fischman, C.R. Schuster, Cocaine effects in sleep-deprived humans, Psychopharmacology (Berl.) 72 (1980) 1–8.
[77] M.W. Fischman, C.R. Schuster, Cocaine self-administration in humans, Fed. Proc. 41 (1982) 241–246.
[78] R.S. Gable, Comparison of acute lethal toxicity of commonly abused psychoactive substances, Addiction 99 (2004) 686–696.
[79] S. Garattini, E. Borroni, T. Mennini, R. Samanin, Differences and similarities among anorectic agents, in: S. Garattini, R. Samanin (Eds.), Central Mechanisms of Anorectic Drugs, Raven Press, New York, 1978.
[80] C. Garcia-Keller, Y.M. Kupchik, C.D. Gipson, R.M. Brown, S. Spencer, F. Bollati, et al., Glutamatergic mechanisms of comorbidity between acute stress and cocaine self-administration, Mol. Psychiatry 21 (2016) 1063–1069.
[81] F.H. Gawin, H.D. Kleber, Abstinence symptomatology and psychiatric diagnosis in cocaine abusers. Clinical observations, Arch. Gen. Psychiatry 43 (1986) 107–113.
[82] F.H. Gawin, Cocaine addiction: psychology and neurophysiology, Science 251 (1991) 1580–1586.
[83] M.A. Geyer, F.X. Vollenweider, Serotonin research: contributions to understanding psychoses, Trends Pharmacol. Sci. 29 (2008) 445–453.
[84] K.E. Glander, Nonhuman primate self-medication with wild plant foods, in: N.L. Etkin (Ed.), Eating on the Wild Side: The Pharmacological, Ecological, and Social Implications of Using Noncultigens, University of Arizona Press, Tuscon, 1994, pp. 239–256.
[85] R.J. Glynn, J.S. Lo Castro, J.A. Hermos, R. Bosse, Social contexts and motives for drinking in men, J. Stud. Alcohol 44 (1983) 1011–1025.
[86] P.J. Goldstein, Anabolic steroids: an ethnographic approach, NIDA Res. Monogr. 102 (1990) 74–96.
[87] H. Grassmé, V. Jendrossek, J. Bock, A. Riehle, E. Gulbins, Ceramide-rich membrane rafts mediate CD40 clustering, J. Immunol. 168 (2002) 298–307.
[88] H. Grassme, P.L. Jernigan, R.S. Hoehn, B. Wilker, M. Soddemann, M.J. Edwards, C.P. Müller, J. Kornhuber, E. Gulbins, Inhibition of acid sphingomyelinase by antidepressants counteracts stress-induced activation of P38-Kinase in major depression, Neurosignals 23 (2015) 84–92.
[89] A.R. Green, A.O. Mechan, J.M. Elliott, E. O’Shea, M.I. Colado, The pharmacology and clinical pharmacology of 3,4-methylenedioxymethamphetamine (MDMA, “ecstasy”), Pharmacol. Rev. 55 (2003) 463–508.
[90] L. Grinspoon, P. Hedblom, N. Harris (Ed.), A Historical Overview of Amphetamines, Amphetamines, Thomson Gale, Detroit, 2005, pp. 19–30.
[91] E. Gulbins, R. Kolesnick, Raft ceramide in molecular medicine, Oncogene 22 (2003) 7070–7077.
[92] E. Gulbins, M. Palmada, M. Reichel, A. Luth, C. Bohmer, D. Amato, et al., Acid sphingomyelinase ceramide system mediates effects of antidepressant drugs, Nat. Med. 19 (2013) 934–938.
[93] E. Gulbins, S. Walter, K.A. Becker, R. Halmer, Y. Liu, M. Reichel, et al., A central role for the acid sphingomyelinase/ceramide system in neurogenesis and major depression, J. Neurochem. 134 (2015) 183–192.
[94] A. Gulbins, F. Schumacher, K.A. Becker, B. Wilker, M. Soddemann, F. Boldrin, et al., Antidepressants act by inducing autophagy controlled by sphingomyelin-ceramide, Mol. Psychiatry 23 (2018) 2324–2346.
[95] E.H. Hagen, R.J. Sullivan, R. Schmidt, G. Morris, R. Kempter, P. Hammerstein, Ecology and neurobiology of toxin avoidance and the paradox of drug reward, Neuroscience 160 (2009) 69–84.
[96] B. Hahn, I.P. Stolerman, Nicotine-induced attentional enhancement in rats: effects of chronic exposure to nicotine, Neuropsychopharmacology 27 (2002) 712–722.
[97] A.L. Halberstadt, D.E. Nichols, Serotonin and serotonin receptors in hallucinogen action, in: C.P. Müller, K.A. Cunningham (Eds.), Handbook of the Behavioral Neurobiology of Serotonin, 2nd ed., Academic Press, London, 2020, pp. 843–863.
[98] T. Harder, K. Simons, Caveolae, DIGs, and the dynamics of sphingolipid-cholesterol microdomains, Curr. Opin. Cell Biol. 9 (1997) 534–542.
[99] R.A. Harris, J.R. Trudell, S.J. Mihic, Ethanol’s molecular targets, Sci. Signal. 1 (2008) re7.
[100] A.A. Harrison, F. Gasparini, A. Markou, Nicotine potentiation of brain stimulation reward reversed by DH beta E and SCH 23390, but not by eticlopride, LY 314582 or MPEP in rats, Psychopharmacology (Berl.) 160 (2002) 56–66.
[101] K.J. Hartwell, S.E. Back, A.L. McRae-Clark, S.R. Shaftman, K.T. Brady, Motives for using: a comparison of prescription opioid, marijuana and cocaine dependent individuals, Addict. Behav. 37 (2012) 373–378.
[102] Z. Hassan, M. Muzaimi, V. Navaratnam, N.H. Yusoff, F.W. Suhaimi, R. Vadivelu, et al., From Kratom to mitragynine and its derivatives: physiological and behavioral effects related to use, abuse, and addiction, Neurosci. Biobehav. Rev. 37 (2013) 138–151.
[103] Z. Hassan, O.G. Bosch, D. Singh, S. Narayanan, B.V. Kasinather, E. Seifritz, et al., Novel psychoactive substances-recent progress on neuropharmacological mechanisms of action for selected drugs, Front. Psychiatry 8 (2017) 152.
[104] M.M. Havranek, M. Vonmoos, C.P. Müller, J.R. Buetiger, E. Tasiudi, L.M. Hulka, et al., Serotonin transporter and tryptophan hydroxylase gene variations mediate working memory deficits of cocaine users, Neuropsychopharmacology 40 (2015) 2929–2937.
[105] D.B. Heath, Drinking Occasions: Comparative Perspectives on Alcohol and Culture, Brunner/Mazel, Philadelphia, 2000.
[106] M. Heilig, G.F. Koob, A key role for corticotropin-releasing factor in alcohol dependence, Trends Neurosci. 30 (2007) 399–406.
[107] B. Henry, R. Ziobro, K.A. Becker, R. Kolesnick, E. Gulbins, Acid sphingomyelinase, Handb. Exp. Pharmacol. 215 (2013) 77–88.
[108] S.T. Higgins, W.K. Bickel, J.R. Hughes, M. Lynn, M.A. Capeless, J.W. Fenwick, Effects of intranasal cocaine on human learning, performance and physiology, Psychopharmacology (Berl.) 102 (1990) 451–458.
[109] E.M. Hill, D.B. Newlin, Evolutionary approaches to addiction: introduction, Addiction 97 (2002) 375–379.
[110] Y.J. Ho, C.R. Pawlak, L.H. Guo, R.K.W. Schwarting, Acute and long-term con- sequences of single MDMA administration in relation to individual anxiety levels in the rat, Behavioral Brain Research 149 (2004) 135–144.
[111] J.R. Hollerman, W. Schultz, Dopamine neurons report an error in the temporal prediction of reward during learning, Nat. Neurosci. 1 (1998) 304–309.
[112] Z.Y. Hong, Z.L. Huang, W.M. Qu, N. Eguchi, Y. Urade, O. Hayaishi, An adenosine A(2A) receptor agonist induces sleep by increasing GABA release in the tuberomammillary nucleus to inhibit histaminergic systems in rats, J. Neurochem. 92 (2005) 1542–1549.
[113] L.L. Howell, L.D. Byrd, Serotonergic modulation of the behavioral effects of cocaine in the squirrel monkey, J. Pharmacol. Exp. Ther. 275 (1995) 1551–1559.
[114] M.A. Huffman, Animal self-medication and ethno-medicine: exploration and exploitation of the medicinal properties of plants, Proc. Nutr. Soc. 62 (2003) 371–381.
[115] J.R. Hughes, D.K. Hatsukami, J.E. Mitchell, L.A. Dahlgren, Prevalence of smoking among psychiatric outpatients, Am. J. Psychiatry 143 (1986) 993–997.
[116] J.P. Huston, H.L. Haas, F. Boix, M. Pfister, U. Decking, J. Schrader, R.K. Schwarting, Extracellular adenosine levels in neostriatum and hippocampus during rest and activity periods of rats, Neuroscience 73 (1996) 99–107.
[117] J.P. Huston, M.A. Silva, M. Komorowski, D. Schulz, B. Topic, Animal models of extinction induced depression: loss of reward and its consequences, Neurosci. Biobehav. Rev. 37 (2013) 2059–2070.
[118] J.P. Huston, J. Kornhuber, C. Mühle, L. Japtok, M. Komorowski, C. Mattern, et al., A sphingolipid mechanism for behavioral extinction, J. Neurochem. 137 (2016) 589–603.
[119] T. Ito, T. Suzuki, S.E. Wellman, I.K. Ho, Pharmacology of barbiturate tolerance/dependence: GABAA receptors and molecular aspects, Life Sci. 59 (1996) 169–195.
[120] L.L. Iversen, The Science of Marijuana, Oxford University Press, Oxford, 2000.
[121] S. Ikemoto, J. Panksepp, The role of nucleus accumbens dopamine in motivated behavior: a unifying interpretation with special reference to reward-seeking, Brain Res. Brain Res. Rev. 31 (1999) 6-41.
[122] B.L. Jacobs, C.A. Fornal, Activity of brain serotonergic neurons in relation to physiology and behavior, in: C.P. Müller, B.L. Jacobs (Eds.), Handbook of the Behavioral Neurobiology of Serotonin, Academic Press, London, 2010, pp. 153–162.
[123] J.I. Javaid, M.W. Fischman, C.R. Schuster, H. Dekirmenjian, J.M. Davis, Cocaine plasma concentration: relation to physiological and subjective effects in humans, Science 202 (1978) 227 228.
[124] M. Jay, High society, Mind-Altering Drugs in History and Culture, Thames & Hudson, 2010.
[125] Y.H. Jo, D.A. Talmage, L.W. Role, Nicotinic receptor-mediated effects on appetite and food intake, J. Neurobiol. 53 (2002) 618–632.
[126] G. Jocham, T.A. Klein, M. Ullsperger, Dopamine-mediated reinforcement learning signals in the striatum and ventromedial prefrontal cortex underlie value-based choices, J. Neurosci. 31 (2011) 1606–1613.
[127] G. Jocham, L.T. Hunt, J. Near, T.E. Behrens, A mechanism for value-guided choice based on the excitation-inhibition balance in prefrontal cortex, Nat. Neurosci. 15 (2012) 960–961.
[128] C.E. Johanson, R.L. Balster, K. Bonese, Self-administration of psychomotor stimulant drugs: the effects of unlimited access, Pharmacol. Biochem. Behav. 4 (1976) 45–51.
[129] C.E. Johanson, M.W. Fischman, The pharmacology of cocaine related to its abuse, Pharmacol. Rev. 41 (1989) 3–52.
[130] C. Johnson, R. Beaton, K. Hall, Poison-based avoidance learning in nonhuman primates: use of visual cues, Physiol. Behav. 14 (1975) 403–407.
[131] M. Kabbaj, C.S. Norton, S. Kollack-Walker, S.J. Watson, T.E. Robinson, H. Akil, Social defeat alters the acquisition of cocaine self-administration in rats: role of individual differences in cocaine-taking behavior, Psychopharmacology (Berl.) 158 (2001) 382–387.
[132] D. Kahneman, E. Diener, N. Schwarz (Eds.), Well Being. The Foundations of Hedonic Psychology, Russell Sage, New York, 1999.
[133] L.S. Kalinichenko, E. Gulbins, J. Kornhuber, C.P. Müller, The role of sphingolipids in psychoactive drug use and addiction, J. Neural Transm. Vienna (Vienna) 125 (2018) 651–672.
[134] L.S. Kalinichenko, J. Kornhuber, C.P. Müller, Individual differences in inflammatory and oxidative mechanisms of stress-related mood disorders, Front. Neuroendocrinol. (2019) 100783.
[135] P.W. Kalivas, N.D. Volkow, The neural basis of addiction: a pathology of motivation and choice, Am. J. Psychiatry 162 (2005) 1403–1413.
[136] G. Kanayama, K.J. Brower, R.I. Wood, J.I. Hudson, H.G. Pope Jr, Anabolic-androgenic steroid dependence: an emerging disorder, Addiction 104 (2009) 1966–1978
[137] S. Kapur, Psychosis as a state of aberrant salience: a framework linking biology, phenomenology, and pharmacology in schizophrenia, Am. J. Psychiatry 160 (2003) 13–23.
[138] A.E. Kelley, M. Cador, L. Stinus, Exploration and its measurement. A psycho-pharmacological perspective, in: A.A. Boulton, G.B. Baker, A.J. Greenshaw (Eds.), Neuromethods 13 – Psychopharmacology, Humana Press, 1990, pp. 95–143.
[139] K.S. Kendler, C.A. Prescott, J. Myers, M.C. Neale, The structure of genetic and environmental risk factors for common psychiatric and substance use disorders in men and women, Arch. Gen. Psychiatry 60 (2003) 929–937.
[140] K.S. Kendler, K.C. Jacobson, C.A. Prescott, M.C. Neale, Specificity of genetic and environmental risk factors for use and abuse/dependence of cannabis, cocaine, hallucinogens, sedatives, stimulants, and opiates in male twins, Am. J. Psychiatry 160 (2003) 687–695.
[141] P.J. Kenny, A. Markou, Nicotine self-administration acutely activates brain reward systems and induces a long-lasting increase in reward sensitivity, Neuropsychopharmacology 31 (2006) 1203–1211.
[142] K.M. Kester, P. Barbosa, Behavioral responses to host foodplants of two populations of the insect parasitoid Cotesia congregata (say), Oecologia 99 (1994) 151–157.
[143] E.J. Khantzian, The self-medication hypothesis of addictive disorders: focus on heroin and cocaine dependence, Am. J. Psychiatry 142 (1985) 1259–1264.
[144] E.J. Khantzian, The self-medication hypothesis of substance use disorders: a reconsideration and recent applications, Harv. Rev. Psychiatry 4 (1997) 231–244.
[145] T.E. Kippin, Does drug mis-instrumentalization lead to drug abuse? Behav, Brain Sci. 34 (2011) 316–317.
[146] C.D. Kochakian, History of anabolic-androgenic steroids, NIDA Res. Monogr. 102 (1990) 29–59.
[147] G.F. Koob, Drugs of abuse: anatomy, pharmacology and function of reward pathways, Trends Pharmacol. Sci. 13 (1992) 177–184.
[148] G.F. Koob, Stress, corticotropin-releasing factor, and drug addiction, Ann. N. Y. Acad. Sci. 897 (1999) 27–45.
[149] G.F. Koob, P.P. Sanna, F.E. Bloom, Neuroscience of addiction, Neuron 21 (1998) 467–476.
[150] J. Kornhuber, P. Tripal, M. Reichel, C. Mühle, C. Rhein, M. Muehlbacher, T.W. Groemer, E. Gulbins, Functional Inhibitors of Acid Sphingomyelinase (FIASMAs): a novel pharmacological group of drugs with broad clinical applications, Cell. Physiol. Biochem. 26 (2010) 9–20.
[151] J. Kornhuber, M. Muehlbacher, S. Trapp, S. Pechmann, A. Friedl, M. Reichel, et al., Identification of novel functional inhibitors of acid sphingomyelinase, PLoS One 6 (2011) e23852.
[152] J. Kornhuber, C.P. Müller, K.A. Becker, M. Reichel, E. Gulbins, The ceramide system as a novel antidepressant target, Trends Pharmacol. Sci. 35 (2014) 293–304.
[153] J. Kornhuber, C. Rhein, C.P. Müller, C. Mühle, Secretory sphingomyelinase in health and disease, Biol. Chem. 396 (2015) 707–736.
[154] F. Koukouli, M. Rooy, D. Tziotis, K.A. Sailor, H.C. O’Neill, J. Levenga, et al., Nicotine reverses hypofrontality in animal models of addiction and szophrenia, Nat. Med. 23 (2017) 347–354.
[155] J.C. Kramer, V.S. Fischman, D.C. Littlefield, Amphetamine abuse – pattern and effects of high doses taken intravenously, J. Am. Med. Assoc. 201 (1967) 89–93.
[156] A.S. Kreibich, L. Briand, J.N. Cleck, L. Ecke, K.C. Rice, J.A. Blendy, Stress-induced potentiation of cocaine reward: a role for CRF R1 and CREB, Neuropsychopharmacology 34 (2009) 2609–2617.
[157] V. Krishnan, E.J. Nestler, The molecular neurobiology of depression, Nature 455 (2008) 894–902.
[158] L.B. Kuiper, L.N. Beloate, B.M. Dupuy, L.M. Coolen, Drug-taking in a socio-sexual context enhances vulnerability for addiction in male rats, Neuropsychopharmacology 44 (2019) 503–513.
[159] E. Kuntsche, R. Knibbe, G. Gmel, R. Engels, Why do young people drink? A review of drinking motives, Clin. Psychol. Rev. 25 (2005) 841–861.
[160] K.N. Laland, J. Odling-Smee, M.W. Feldman, Niche construction, biological evolution, and cultural change, Behav. Brain Sci. 23 (2000) 131–146.
[161] K.N. Laland, J. Odling-Smee, S. Myles, How culture shaped the human genome: bringing genetics and the human sciences together, Nat. Rev. Genet. 11 (2010) 137–148.
[162] H.M. Lavikainen, T. Lintonen, E. Kosunen, Sexual behavior and drinking style among teenagers: a population-based study in Finland, Health Prom. Int. 24 (2) (2009) 108–119.
[163] B. Le Fol, S.R. Goldberg, Nicotine as a typical drug of abuse in experimental animals and humans, Psychopharmacology (Berl.) 184 (2006) 367–381.
[164] D.H. Lende, E.O. Smith, Evolution meets biopsychosociality: an analysis of addictive behavior, Addiction 97 (2002) 447–458.
[165] D.H. Lende, T. Leonard, C.E. Sterk, K. Elifson, Functional methamphetamine use: the insider’s perspective, Addiction Research and Therapy 15 (5) (2007) 465–477.
[166] D.H. Lende, Evolution and modern behavioral problems, in: E.O. Wenda Trevathan, E.O. Smith, J.J. McKenna (Eds.), Evolutionary Medicine and Health: New Perspectives, Oxford University Press, New York, 2007, pp. 277–290.
[167] A. Licata, S. Taylor, M. Berman, J. Cranston, Effects of cocaine on human aggression, Pharmacol. Biochem. Behav. 45 (1993) 549–552.
[168] L.D. Lisonbee, J.J. Villalba, F.D. Provenza, J.O. Hall, Tannins and self-medication: implications for sustainable parasite control in herbivores, Behav. Processes 82 (2009) 184–189.
[169] M.L. Logrip, E.P. Zorrilla, G.F. Koob, Stress modulation of drug self-administration: implications for addiction comorbidity with post-traumatic stress disorder, Neuropharmacology 62 (2012) 552 564.
[170] M. London, E. London, Ceramide selectively displaces cholesterol from ordered lipid domains (rafts): implications for lipid raft structure and function, J. Biol. Chem. 279 (2004) 9997–10004.
[171] G.A. Lozano, Parasitic stress and self-medication in wild animals, Adv.Stud.Behav. 27 (1998) 291–317.
[172] H.W. Maier, Der Kokainismus, Georg Thieme, Leipzig, 1926.
[173] D. Maloff, H.S. Becker, A. Fonaroff, J. Rodin, Informal social controls and their influence on substance use, in: N.E. Zinberg, W. Harding (Eds.), Control Over Intoxicant Use: Pharmacological, Psychological and Social Considerations, Human Science Press, U.S, 1981, pp. 5–35.
[174] H. Manjoch, E. Vainer, M. Matar, G. Ifergane, J. Zohar, Z. Kaplan, H. Cohen, Predator-scent stress, ethanol consumption and the opioid system in an animal model of PTSD, Behav. Brain Res. 306 (2016) 91–105.
[175] H.D. Mansvelder, K.I. van Aerde, J.J. Couey, A.B. Brussaard, Nicotinic modulation of neuronal networks: from receptors to cognition, Psychopharmacology (Berl.) 184 (2006) 292–305.
[176] L. Manzo, M.J. Gomez, J.E. Callejas-Aguilera, A. Fernandez-Teruel, M.R. Papini, C. Torres, Anti-anxiety self-medication induced by incentive loss in rats, Physiol. Behav. 123 (2014) 86–92.
[177] L. Manzo, R. Donaire, M. Sabariego, M.R. Papini, C. Torres, Anti-anxiety self- medication in rats: oral consumption of chlordiazepoxide and ethanol after reward devaluation, Behav. Brain Res. 278 (2015) 90–97.
[178] L. Marcuse, Philosophie Des Gluecks, 2nd edn., Diogenes, Zuerich, 1984.
[179] A. Markou, Review. Neurobiology of nicotine dependence, Philos. Trans. R. Soc. Lond., B, Biol. Sci. 363 (2008) 3159–3168.
[180] G. Marsicano, C.T. Wotjak, S.C. Azad, T. Bisogno, G. Rammes, M.G. Cascio, H. Hermann, J. Tang, C. Hofmann, W. Zieglgansberger, V. Di Marzo, B. Lutz, The endogenous cannabinoid system controls extinction of aversive memories, Nature 418 (2002) 530–534.
[181] M. Matsumoto, O. Hikosaka, Two types of dopamine neuron distinctly convey positive and negative motivational signals, Nature 459 (2009) 837–841.
[182] T.J. Matthews, P. Abdelbaky, D.W. Pfaff, Social and sexual motivation in the mouse, Behav. Neurosci. 119 (2005) 1628–1639.
[183] W.J. McBride, J.M. Murphy, S. Ikemoto, Localization of brain reinforcement mechanisms: intracranial self-administration and intracranial place-conditioning studies, Behav. Brain Res. 101 (1999) 129–152.
[184] W.J. McBride, A.D. Le, A. Noronha, Central nervous system mechanisms in alcohol relapse, Alcohol. Clin. Exp. Res. 26 (2002) 280–286.
[185] S.E. McCabe, J.R. Knight, C.J. Teter, H. Wechsler, Non-medical use of prescription stimulants among US college students: prevalence and correlates from a national survey, Addiction 100 (2005) 96–106.
[186] S.E. McCabe, J.A. Cranford, C.J. Boyd, C.J. Teter, Motives, diversion and routes of administration associated with nonmedical use of prescription opioids, Addict. Behav. 32 (2007) 562–575.
[187] J.P. McLaughlin, M. Marton-Popovici, C. Chavkin, Kappa opioid receptor antagonism and prodynorphin gene disruption block stress-induced behavioral responses, J. Neurosci. 23 (2003) 5674–5683.
[188] R. Mechoulam, E. Fride, V. Di Marzo, Endocannabinoids, Eur. J. Pharmacol. 359 (1998) 1–18.
[189] B.O. Megha, E. London, Cholesterol precursors stabilize ordinary and ceramide-rich ordered lipid domains (lipid rafts) to different degrees. Implications for the Bloch hypothesis and sterol biosynthesis disorders, J. Biol. Chem. 281 (2006) 21903–21913.
[190] K.A. Miczek, N.H. Mutschler, Activational effects of social stress on IV cocaine self- administration in rats, Psychopharmacology (Berl.) 128 (3) (1996) 256–264.
[191] K.A. Miczek, E.M. Nikulina, A. Takahashi, H.E. Covington III, J.J. Yap, C.O. Boyson, A. Shimamoto, R.M. de Almeida, Gene expression in aminergic and peptidergic cells during aggression and defeat: relevance to violence, depression and drug abuse, Behav. Genet. 41 (2011) 787–802.
[192] D. Mielenz, M. Reichel, T. Jia, E.B. Quinlan, T. Stockl, M. Mettang, D. Zilske, E. Kirmizi-Alsan, et al., EFhd2/Swiprosin-1 is a common genetic determinator for sensation-seeking/low anxiety and alcohol addiction, Mol. Psychiatry 23 (2018) 1303–1319.
[193] S.N. Mitchell, Role of the locus-ceruleus in the noradrenergic response to a systemic administration of nicotine, Neuropharmacology 32 (1993) 937–949.
[194] A. Mobascher, G. Winterer, The molecular and cellular neurobiology of nicotine abuse in schizophrenia, Pharmacopsychiatry 41 (Suppl 1) (2008) S51–S59.
[195] N. Mondaini, T. Cai, P. Gontero, A. Gavazzi, G. Lombardi, V. Boddi, R. Bartoletti, Regular moderate intake of red wine is linked to a better women’s sexual health, J. Sex. Med. 6 (10) (2009) 2772–2777.
[196] C.J. Morgan, L.A. Noronha, M. Muetzelfeldt, A. Fielding, H.V. Curran, Harms and benefits associated with psychoactive drugs: findings of an international survey of active drug users, J. Psychopharmacol. (Oxford) 27 (2013) 497–506.
[197] L. Moro, V. Noreika, Sacramental and spiritual use of hallucinogenic drugs, Behav. Brain Sci. 34 (2011) 319–320.
[198] C.P. Müller, J.P. Huston, Dopamine activity in the occipital and temporal cortices of rats: dissociating effects of sensory but not pharmacological stimulation, Synapse 61 (2007) 254–258.
[199] C.P. Müller, M.A. De Souza Silva, J.P. Huston, Double dissociating effects of sensory stimulation and cocaine on serotonin activity in the occipital and temporal cortices, Neuropharmacology 52 (2007) 854–862.
[200] C.P. Müller, R.J. Carey, M. Wilkisz, S. Schwenzner, G. Jocham, J.P. Huston, M.A. De Souza Silva, Acute anxiolytic effects of cocaine: the role of test latency and activity phase, Pharmacol. Biochem. Behav. 89 (2008) 218–226.
[201] C.P. Müller, G. Schumann, Drugs as instruments: a new framework for non-addictive psychoactive drug use, Behav. Brain Sci. 34 (2011) 293–310.
[202] C.P. Müller, G. Schumann, To use or not to use: expanding the view on non-addictive psychoactive drug consumption and its implications, Behav. Brain Sci. 34 (2011) 328–347.
[203] C.P. Müller, M.E. Pum, D. Amato, J. Schüttler, J.P. Huston, M.A. Silva, The in vivo neurochemistry of the brain during general anesthesia, J. Neurochem. 119 (2011) 419–446.
[204] C.P. Müller, J.R. Homberg, The role of serotonin in drug use and addiction, Behav. Brain Res. 277C (2015) 146–192.
[205] C.P. Müller, M. Reichel, C. Mühle, C. Rhein, E. Gulbins, J. Kornhuber, Brain membrane lipids in major depression and anxiety disorders, Biochim. Biophys. Acta 1851 (2015) 1052–1065.
[206] C.P. Müller, J. Kornhuber, Biological evidence for paradoxical improvement of psychiatric disorder symptoms by addictive drugs, Trends Pharmacol. Sci. 38 (2017) 501–502.
[207] C.P. Müller, Non addictive drug use: the way forward, in: K. Wolff, J. White, S. Karch (Eds.), The SAGE Handbook of Drugs & Alcohol Studies – Biological Approaches, SAGE, London, 2017, pp. 411–434.
[208] C.P. Müller, L.S. Kalinichenko, J. Tiesel, M. Witt, T. Stöckl, E. Sprenger, et al., Paradoxical antidepressant effects of alcohol are related to acid sphingomyelinase and its control of sphingolipid homeostasis, Acta Neuropathol. 133 (2017) 463–483.
[209] C.P. Müller, C. Chu, L. Qin, C. Liu, B. Xu, H. Gao, et al., The cortical neuroimmune regulator TANK affects emotional processing and enhances alcohol drinking: a translational study, Cereb. Cortex 29 (2019) 1736–1751.
[210] C.P. Müller, Mechanisms of a near-orthogonal ultra-fast evolution of human behavior as a source of culture development, Behavioral Brain Research (2020), https://doi.org/10.1016/j.bbr.2020.112521.
[211] J.A. Nathanson, E.J. Hunnicutt, L. Kantham, C. Scavone, Cocaine as a naturally occurring insecticide, Proc. Natl. Acad. Sci. U. S. A 90 (1993) 9645–9648.
[212] T. Nesil, L. Kanit, S. Pogun, Nicotine intake and problem solving strategies are modified during a cognitively demanding water maze task in rats, Pharmacol. Biochem. Behav. 138 (2015) 156–163.
[213] R.M. Nesse, K.C. Berridge, Psychoactive drug use in evolutionary perspective, Science 278 (1997) 63–66.
[214] R.M. Nesse, Evolution and addiction, Addiction 97 (2002) 470–471.
[215] E.J. Nestler, G.K. Aghajanian, Molecular and cellular basis of addiction, Science 278 (1997) 58–63.
[216] P.A. Newhouse, A.S. Potter, J.A. Dumas, C.M. Thiel, Functional brain imaging of nicotinic effects on higher cognitive processes, Biochem. Pharmacol. 82 (8) (2011) 943–951.
[217] D.B. Newlin, The self-perceived survival ability and reproductive fitness (SPFit) theory of substance use disorders, Addiction 97 (2002) 427–445.
[218] D.E. Nichols, Hallucinogens. Pharmacol. Ther. 101 (2004) 131–181.
[219] E.M. Nikulina, I. Arrillaga-Romany, K.A. Miczek, R.P. Hammer Jr, Long-lasting alteration in mesocorticolimbic structures after repeated social defeat stress in rats: time course of mu-opioid receptor mRNA and FosB/DeltaFosB immunoreactivity, Eur. J. Neurosci. 27 (2008) 2272–2284.
[220] C. Nothdurfter, S. Tanasic, B. Di Benedetto, G. Rammes, E.M. Wagner, T. Kirmeier, V. Ganal, J.S. Kessler, T. Rein, F. Holsboer, R. Rupprecht, Impact of lipid raft integrity on 5-HT3 receptor function and its modulation by antidepressants, Neuropsychopharmacology 35 (2010) 1510–1519.
[221] D.J. Nutt, A. Lingford-Hughes, D. Erritzoe, P.R. Stokes, The dopamine theory of addiction: 40 years of highs and lows, Nat. Rev. Neurosci. 16 (2015) 305–312.
[222] C.P. O’Brien, A.R. Childress, R. Ehrman, S.J. Robbins, Conditioning factors in drug abuse: can they explain compulsion? J. Psychopharmacol. (Oxford) 12 (1998) 15–22.
[223] T.G. Oliveira, R.B. Chan, F.V. Bravo, A. Miranda, R.R. Silva, B. Zhou, F. Marques, V. Pinto, J.J. Cerqueira, P.G. Di, N. Sousa, The impact of chronic stress on the rat brain lipidome, Mol. Psychiatry 21 (2016) 80–88.
[224] P.M. O’Malley, L.D. Johnston, J.G. Bachman, Cocaine use among American adolescents and young adults, NIDA Res. Monogr. 61 (1985) 50–75.
[225] P.M. O’Malley, L.D. Johnston, Epidemiology of alcohol and other drug use among American college students, J. Stud. Alcohol Suppl. (2002) 23–39.
[226] H. Padwa, Y.M. Ni, Y. Barth-Rogers, L. Arangua, R. Andersen, L. Gelberg, Barriers to drug use behavior change among primary care patients in urban United States community health centers, Subst. Use Misuse 49 (2014) 743–751.
[227] J.E. Page, F. Balza, T. Nishida, G.H. Towers, Biologically active diterpenes from Aspilia mossambicensis, a chimpanzee medicinal plant, Phytochemistry 31 (1992) 3437–3439.
[228] J. Panksepp, B. Knutson, J. Burgdorf, The role of brain emotional systems in addictions: a neuro evolutionary perspective and new’ self-report’ animal model, Addiction 97 (2002) 459–469.
[229] J.B. Panksepp, G.P. Lahvis, Social reward among juvenile mice, Genes Brain Behav. 6 (2007) 661–671.
[230] M.E. Patrick, J.L. Maggs, Short-term changes in plans to drink and importance of positive and negative alcohol consequences, J. Adolesc. 31 (2008) 307–321.
[231] S. Peele, A. Brodsky, Exploring psychological benefits associated with moderate alcohol use: a necessary corrective to assessments of drinking outcomes? Drug Alcohol Depend. 60 (2000) 221–247.
[232] K.A. Perkins, Effects of tobacco smoking on caloric intake, Br. J. Addict. 87 (1992) 193–205.
[233] L.I. Perrotti, R.R. Weaver, B. Robison, W. Renthal, I. Maze, S. Yazdani, R.G. Elmore, D.J. Knapp, D.E. Selley, B.R. Martin, L. Sim-Selley, R.K. Bachtell, D.W. Self, E.J. Nestler, Distinct patterns of DeltaFosB induction in brain by drugs of abuse, Synapse 62 (2008) 358–369.
[234] E.K. Perry, R.H. Perry, Acetylcholine and hallucinations: disease-related compared to drug-induced alterations in human consciousness, Brain Cogn. 28 (1995) 240–258.
[235] P.V. Piazza, J.M. Deminiere, M.M. Le, H. Simon, Factors that predict individual vulnerability to amphetamine self-administration, Science 245 (1989) 1511–1513.
[236] C.L. Pizzimenti, T.M. Navis, K.M. Lattal, Persistent effects of acute stress on fear and drug-seeking in a novel model of the comorbidity between post-traumatic stress disorder and addiction, Learn. Mem. 24 (2017) 422–431.
[237] A.M. Polter, K. Barcomb, R.W. Chen, P.M. Dingess, N.M. Graziane, T.E. Brown, J.A. Kauer, Constitutive activation of kappa opioid receptors at ventral tegmental area inhibitory synapses following acute stress, Elife. (2017) 6.
[238] F.E. Pontieri, G. Tanda, G. Di Chiara, Intravenous cocaine, morphine, and amphetamine preferentially increase extracellular dopamine in the “shell” as compared with the “core” of the rat nucleus accumbens, Proc. Natl. Acad. Sci. U. S. A 92 (1995) 12304–12308.
[239] T. Porkka-Heiskanen, R.E. Strecker, M. Thakkar, A.A. Bjorkum, R.W. Greene, R.W. McCarley, Adenosine: a mediator of the sleep-inducing effects of prolonged wakefulness, Science 276 (1997) 1265–1268.
[240] R.M. Post, J. Kotin, F.K. Goodwin, The effects of cocaine on depressed patients, Am. J. Psychiatry 131 (1974) 511–517.
[241] S. Potvin, E. Stip, J.Y. Roy, Schizophrenia and addiction: an evaluation of the self-medication hypothesis, Encephale 29 (2003) 193–203.
[242] U.W. Preuss, M.A. Schuckit, T.L. Smith, G.R. Danko, A.C. Dasher, M.N. Hesselbrock, V.M. Hesselbrock, J.I. Nurnberger Jr, A comparison of alcohol- induced and independent depression in alcoholics with histories of suicide attempts, J. Stud. Alcohol 63 (2002) 498–502.
[243] M.A. Prince, M.B. O’Donnell, L.R. Stanley, R.C. Swaim, Examination of recreational and spiritual peyote use among american indian youth, J. Stud. Alcohol Drugs 80 (2019) 366–370.
[244] M. Pum, R.J. Carey, J.P. Huston, C.P. Müller, Dissociating effects of cocaine and d-amphetamine on dopamine and serotonin in the perirhinal, entorhinal, and prefrontal cortex of freely moving rats, Psychopharmacology (Berl.) 193 (2007) 375–390.
[245] I.M. Quadros, A. Takahashi, K.A. Miczek, Serotonin and aggression, in: C.P. Müller, K.A. Cunningham (Eds.), The Behavioral Neurobiology of Serotonin, 2nd ed., Academic Press, London, 2020, pp. 635–663.
[246] B.B. Quednow, M.A. Geyer, A.L. Halberstadt, Serotonin and schizophrenia, in: C.P. Müller, K.A. Cunningham (Eds.), Handbook of the Behavioral Neurobiology of Serotonin, 2nd ed., Academic Press, London, 2020, pp. 711–743.
[247] B. Ramstedt, J.P. Slotte, Sphingolipids and the formation of sterol-enriched ordered membrane domains, Biochim. Biophys. Acta 1758 (2006) 1945–1956.
[248] D. Repantis, P. Schlattmann, O. Laisney, I. Heuser, Modafinil and methylphenidate for neuroenhancement in healthy individuals: a systematic review, Pharmacol. Res. 62 (2010) 187–206.
[249] R.B. Resnick, R.S. Kestenbaum, L.K. Schwartz, Acute systemic effects of cocaine in man: a controlled study by intranasal and intravenous routes, Science 195 (1977) 696–698.
[250] A.H. Rezvani, E.D. Levin, Cognitive effects of nicotine, Biol. Psychiatry 49 (2001) 258–267.
[251] M.E. Risner, B.E. Jones, Intravenous self-administration of cocaine and norcocaine by dogs, Psychopharmacology 71 (1980) 83–89.
[252] M.C. Ritz, M.J. Kuhar, Relationship between self-administration of amphetamine and monoamine receptors in brain – comparison with cocaine, J. Pharmacol. Exp. Ther. 248 (1989) 1010–1017.
[253] M.C. Ritz, E.J. Cone, M.J. Kuhar, Cocaine inhibition of ligand binding at dopamine, norepinephrine and serotonin transporters: a structure-activity study, Life Sci. 46 (1990) 635–645.
[254] T.W. Robbins, B.J. Everitt, Drug addiction: bad habits add up, Nature 398 (1999) 567–570.
[255] N.P. Roberts, P.A. Roberts, N. Jones, J.I. Bisson, Psychological interventions for post-traumatic stress disorder and comorbid substance use disorder: a systematic review and meta-analysis, Clin. Psychol. Rev. 38 (2015) 25–38.
[256] T.E. Robinson, K.C. Berridge, The neural basis of drug craving: an incentive-sensitization theory of addiction, Brain Res. Brain Res. Rev. 18 (1993) 247–291.
[257] T.E. Robinson, K.C. Berridge, Addiction, Annu. Rev. Psychol. 54 (2003) 25–53.
[258] M. Robles, M. Aregullin, J. West, E. Rodriguez, Recent studies on the zoo-pharmacognosy, pharmacology and neurotoxicology of sesquiterpene lactones, Planta Med. 61 (1995) 199–203.
[259] B. Rodgers, A.E. Korten, A.F. Jorm, H. Christensen, S. Henderson, P.A. Jacomb, Risk factors for depression and anxiety in abstainers, moderate drinkers and heavy drinkers, Addiction 95 (2000) 1833–1845.
[260] E. Rodriguez, M. Aregullin, T. Nishida, S. Uehara, R. Wrangham, Z. Abramowski, A. Finlayson, G.H. Towers, Thiarubrine A, a bioactive constituent of Aspilia (Asteraceae) consumed by wild chimpanzees, Experientia 41 (1985) 419–420.
[261] E. Rodriguez, R. Wrangham, Zoopharmacognosy: the use of medicinal plants by animals, Recent Adv.Phytochem. 27 (1993) 89–105.
[262] R. Room, The more drinking, the more fun; but is there a calculus of fun, and should it drive policy? Drug Alcohol Depend. 60 (2000) 249–250.
[263] H.E. Ross, L.J. Young, Oxytocin and the neural mechanisms regulating social cognition and affiliative behavior, Front. Neuroendocrinol. 30 (2009) 534–547.
[264] M.M. Ross, A.M. Arria, J.P. Brown, C.D. Mullins, J. Schiffman, L. Simoni-Wastila, S. dosReis, College students’ perceived benefit-to-risk tradeoffs for nonmedical use of prescription stimulants: implications for intervention designs, Addict. Behav. 79 (2018) 45–51.
[265] P. Rozin, J.W. Kalat, Specific hungers and poison avoidance as adaptive specializations of learning, Psychol. Rev. 78 (1971) 459–486.
[266] C.A. Ruck, J. Bigwood, D. Staples, J. Ott, R.G. Wasson, Entheogens, J. Psychedelic Drugs 11 (1979) 145–146.
[267] J.D. Salamone, The involvement of nucleus accumbens dopamine in appetitive and aversive motivation, Behav. Brain Res. 61 (1994) 117–133.
[268] J.D. Salamone, M.S. Cousins, B.J. Snyder, Behavioral functions of nucleus accumbens dopamine: empirical and conceptual problems with the anhedonia hypothesis, Neurosci. Biobehav. Rev. 21 (1997) 341–359.
[269] A.N. Samaha, T.E. Robinson, Why does the rapid delivery of drugs to the brain promote addiction? Trends Pharmacol, Sci. 26 (2005) 82–87.
[270] R. Samanin, S. Garattini, Neurochemical mechanism of action of anorectic drugs, Pharmacol. Toxicol. 73 (1993) 63–68.
[271] R. Sandhoff, Very long chain sphingolipids: tissue expression, function and synthesis, FEBS Lett. 584 (2010) 1907–1913.
[272] L. Santarelli, M. Saxe, C. Gross, A. Surget, F. Battaglia, S. Dulawa, et al., Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants, Science 301 (2003) 805–809.
[273] M. Sarter, J.P. Bruno, Cognitive functions of cortical acetylcholine: toward a unifying hypothesis, Brain Res. Brain Res. Rev. 23 (1997) 28–46.
[274] M. Sarter, M.E. Hasselmo, J.P. Bruno, B. Givens, Unraveling the attentional functions of cortical cholinergic inputs: interactions between signal-driven and cognitive modulation of signal detection, Brain Res. Brain Res. Rev. 48 (2005) 98–111.
[275] S. Sattler, R. Schunck, Associations between the big five personality traits and the non-medical use of prescription drugs for cognitive enhancement, Front. Psychol. 6 (2015) 1971.
[276] Schizophrenia working group of the Psychiatric Genomics Consortium, Biological insights from 108 schizophrenia-associated genetic loci, Nature 511 (2014) 421–427.
[277] S. Schleim, B.B. Quednow, How realistic are the scientific assumptions of the neuroenhancement debate? Assessing the pharmacological optimism and neuroenhancement prevalence hypotheses, Front. Pharmacol. 9 (3) (2018), https://doi.org/10.3389/fphar.2018.00003.
[278] M. Schneider, B. Levant, M. Reichel, E. Gulbins, J. Kornhuber, C.P. Müller, Lipids in psychiatric disorders and preventive medicine, Neurosci. Biobehav. Rev. 76 (2017) 336–362.
[279] I. Schöpf, A.C. Easton, J. Solati, Y. Golub, J. Kornhuber, K.P. Giese, C.P. Müller, alphaCaMKII autophosphorylation mediates neuronal activation in the hippo- campal dentate gyrus after alcohol and cocaine in mice, Neurosci. Lett. 591 (2015) 65–68.
[280] M.A. Schuckit, J.E. Tipp, M. Bergman, W. Reich, V.M. Hesselbrock, T.L. Smith, Comparison of induced and independent major depressive disorders in 2,945 alcoholics, Am. J. Psychiatry 154 (1997) 948–957.
[281] M.A. Schuckit, T.L. Smith, Y. Chacko, Evaluation of a depression-related model of alcohol problems in 430 probands from the San Diego prospective study, Drug Alcohol Depend. 82 (2006) 194–203.
[282] M.A. Schuckit, T.L. Smith, G.P. Danko, J. Pierson, R. Trim, J.I. Nurnberger J. Kramer, S. Kuperman, L.J. Bierut, V. Hesselbrock, A comparison of factors associated with substance-induced versus independent depressions, J. Stud. Alcohol Drugs 68 (2007) 805–812.
[283] M.A. Schuckit, T.L. Smith, J. Kalmijn, Relationships among independent major depressions, alcohol use, and other substance use and related problems over 30 years in 397 families, J. Stud. Alcohol Drugs 74 (2013) 271–279.
[284] W. Schultz, Multiple reward signals in the brain, Nat. Rev. Neurosci. 1 (2000) 199–207.
[285] G. Schumann, M. Johann, J. Frank, U. Preuss, N. Dahmen, M. Laucht, et al., Systematic analysis of glutamatergic neurotransmission genes in alcohol dependence and adolescent risky drinking behavior, Arch. Gen. Psychiatry 65 (2008) 826–838.
[286] G. Schumann, L.J. Coin, A. Lourdusamy, P. Charoen, K.H. Berger, D. Stacey, et al., Genome-wide association and genetic functional studies identify autism susceptibility candidate 2 gene (AUTS2) in the regulation of alcohol consumption, Proc. Natl. Acad. Sci. U. S. A 108 (2011) 7119–7124.
[287] G. Schumann, C. Liu, P. O’Reilly, H. Gao, P. Song, B. Xu, et al., KLB is associated with alcohol drinking, and its gene product beta-Klotho is necessary for FGF21 regulation of alcohol preference, Proc. Natl. Acad. Sci. U. S. A 113 (2016) 14372–14377.
[288] R.K. Schwarting, C.M. Thiel, C.P. Müller, J.P. Huston, Relationship between anxiety and serotonin in the ventral striatum, Neuroreport 9 (1998) 1025–1029.
[289] M. Seefelder, Opium, Eine Kulturgeschichte, 3 edn., Nikol, Hamburg, 1996.
[290] B. Segal, Confirmatory analyses of reasons for experiencing psychoactive drugs during adolescence, Int. J. Addict. 20 (1985) 1649–1662.
[291] L.S. Seiden, K.E. Sabol, G.A. Ricaurte, Amphetamine – effects on catecholamine systems and behavior, Annu. Rev. Pharmacol. Toxicol. 33 (1993) 639–677.
[292] Y. Shaham, J. Stewart, Exposure to mild stress enhances the reinforcing efficacy of intravenous heroin self-administration in rats, Psychopharmacology (Berl.) 114 (3) (1994) 523–527.
[293] Y. Shaham, U. Shalev, L. Lu, H. de Wit, J. Stewart, The reinstatement model of drug relapse: history, methodology and major findings, Psychopharmacology 168 (2003) 3–20.
[294] K.J. Sher, E.R. Grekin, N.A. Williams, The development of alcohol use disorders, Annu. Rev. Clin. Psychol. 1 (2005) 493–523.
[295] K. Simons, E. Ikonen, Functional rafts in cell membranes, Nature 387 (1997) 569–572.
[296] J. Simons, C.J. Correia, K.B. Carey, A comparison of motives for marijuana and alcohol use among experienced users, Addict. Behav. 25 (2000) 153–160.
[297] M.S. Singer, K.C. Mace, E.A. Bernays, Self-medication as adaptive plasticity: in- creased ingestion of plant toxins by parasitized caterpillars, PLoS One 4 (2009) e4796.
[298] D. Singh, C.P. Müller, B.K. Vicknasingam, Kratom (Mitragyna speciosa) dependence, withdrawal symptoms and craving in regular users, Drug Alcohol Depend. 139 (2014) 132–137.
[299] D. Singh, S. Narayanan, C.P. Müller, M.T. Swogger, N.J.Y. Chear, E.B. Dzulkapli, et al., Motives for using Kratom (Mitragyna speciosa Korth.) among regular users in Malaysia, J. Ethnopharmacol. 233 (2019) 34–40.
[300] O.J. Skog, Addicts’ choice, Addiction 95 (2000) 1309–1314.
[301] J.C. Skogen, S.B. Harvey, M. Henderson, E. Stordal, A. Mykletun, Anxiety and depression among abstainers and low-level alcohol consumers, The Nord-Trondelag Health Study. Addiction 104 (2009) 1519–1529.
[302] M.N. Skóra, T. Pattij, A. Beroun, G. Kogias, D. Mielenz, T. de Vries, K. Radwanska, C.P. Müller, Personality driven alcohol and drug abuse: new mechanisms revealed. submitted.
[303] R. Spanagel, Alcoholism: a systems approach from molecular physiology to addictive behavior, Physiol. Rev. 89 (2009) 649–705.
[304] M. Steriade, S. Datta, D. Pare, G. Oakson, R.C. Curro Dossi, Neuronal activities in brain-stem cholinergic nuclei related to tonic activation processes in thalamo-cortical systems, J. Neurosci. 10 (1990) 2541–2559.
[305] S.H. Stewart, Alcohol abuse in individuals exposed to trauma: a critical review, Psychol. Bull. 120 (1996) 83–112.
[306] R. Stillman, R.T. Jones, D. Moore, J. Walker, S. Welm, Improved performance 4 hours after cocaine, Psychopharmacology (Berl.) 110 (1993) 415–420.
[307] D. Streatfeild, Cocaine. An unauthorized biography. St martin’s press, New York (2001).
[308] R.J. Sullivan, E.H. Hagen, Psychotropic substance-seeking: evolutionary pathology or adaptation? Addiction 97 (2002) 389–400.
[309] R.J. Sullivan, E.H. Hagen, P. Hammerstein, Revealing the paradox of drug reward in human evolution, Proc. Biol. Sci. 275 (2008) 1231–1241.
[310] S. Sussman, M.A. Pentz, D. Spruijt-Metz, T. Miller, Misuse of “study drugs:” pre- valence, consequences, and implications for policy, Subst. Abuse Treat. Prev. Policy 1 (2006) 15.
[311] S. Talukdar, B.M. Owen, P. Song, G. Hernandez, Y. Zhang, Y. Zhou, et al., FGF21 regulates sweet and alcohol preference, Cell Metab. 23 (2016) 344–349.
[312] W. Tatarkiewicz, Analysis of Happiness, Kluwer Academic Publishers, 1976.
[313] B. Taylor, J. Rehm, G. Gmel, Moderate alcohol consumption and the gastro- intestinal tract, Dig. Dis. 23 (2005) 170–176.
[314] C.J. Teter, S.E. McCabe, K. LaGrange, J.A. Cranford, C.J. Boyd, Illicit use of specific prescription stimulants among college students: prevalence, motives, and routes of administration, Pharmacotherapy 26 (2006) 1501–1510.
[315] C.M. Thiel, C.P. Müller, J.P. Huston, R.K. Schwarting, High versus low reactivity to a novel environment: behavioral, pharmacological and neurochemical assessments, Neuroscience 93 (1999) 243–251.
[316] C.M. Thiel, Cholinergic modulation of learning and memory in the human brain as detected with functional neuroimaging, Neurobiol. Learn. Mem. 80 (2003) 234–244.
[317] N. Tinbergen, On aims and methods of ethology, Z. Fã¼r Tierpsychol. 20 (1963) 410–433.
[318] Y. Tizabi, B. Getachew, C.L. Ferguson, A.B. Csoka, K.M. Thompson, A. Gomez-Paz, J. Ruda-Kucerova, R.E. Taylor, Low Vs. High alcohol: central benefits Vs. Detriments, Neurotox. Res. (2018).
[319] E. Tupala, J. Tiihonen, Dopamine and alcoholism: neurobiological basis of ethanol abuse, Prog. Neuropsychopharmacol. Biol. Psychiatry 28 (2004) 1221–1247.
[320] K.W. Tupper, Entheogens and existential intelligence: the use of plant teachers as cognitive tools, Can. J. Educ. / Rev. Can. L Éducation 27 (4) (2002) 499–516.
[321] K.W. Tupper, Entheogens & education: exploring the potentials of psychoactives as educational tools, Journal of Drug Education and Awareness 1 (2) (2003) 145–161.
[322] T.M. Tzschentke, Measuring reward with the conditioned place preference (CPP) paradigm: update of the last decade, Addict. Biol. 12 (2007) 227–462.
[323] J. Uekermann, I. Daum, Social cognition in alcoholism: a link to prefrontal cortex dysfunction? Addiction 103 (2008) 726–735.
[324] M. Usher, J.D. Cohen, D. Servan-Schreiber, J. Rajkowski, G. Aston-Jones, The role of locus coeruleus in the regulation of cognitive performance, Science 283 (1999) 549–554.
[325] A.M. van Erp, N. Tachi, K.A. Miczek, Short or continuous social stress: suppression of continuously available ethanol intake in subordinate rats, Behav. Pharmacol. 12 (2001) 335–342.
[326] A.M. van Erp, K.A. Miczek, Persistent suppression of ethanol self-administration by brief social stress in rats and increased startle response as index of withdrawal, Physiol. Behav. 73 (2001) 301 311.
[327] M.P. Veiga, J.L. Arrondo, F.M. Goni, A. Alonso, Ceramides in phospholipid membranes: effects on bilayer stability and transition to nonlamellar phases, Biophys. J. 76 (1999) 342–350.
[328] J.J. Villalba, F.D. Provenza, J.O. Hall, L.D. Lisonbee, Selection of tannins by sheep in response to gastrointestinal nematode infection, J. Anim. Sci. 88 (2010) 2189–2198.
[329] N.D. Volkow, G.J. Wang, M.W. Fischman, R.W. Foltin, J.S. Fowler, N.N. Abumrad, S. Vitkun, J. Logan, S.J. Gatley, N. Pappas, R. Hitzemann, C.E. Shea, Relationship between subjective effects of cocaine and dopamine transporter occupancy, Nature 386 (1997) 827–830.
[330] M. Vonmoos, L.M. Hulka, K.H. Preller, D. Jenni, M.R. Baumgartner, R. Stohler, K.I. Bolla, B.B. Quednow, Cognitive dysfunctions in recreational and dependent cocaine users: role of attention-deficit hyperactivity disorder, craving and early age at onset, Br. J. Psychiatry 203 (2013) 35–43.
[331] J.T. Wack, J. Rodin, Smoking and its effects on body weight and the systems of caloric regulation, Am. J. Clin. Nutr. 35 (1982) 366–380.
[332] G. Wadley, How psychoactive drugs shape human culture: a multi-disciplinary perspective, Brain Res. Bull. 126 (2016) 138–151.
[333] F.A. Wagner, J.C. Anthony, From first drug use to drug dependence; developmental periods of risk for dependence upon marijuana, cocaine, and alcohol, Neuropsychopharmacology 26 (2002) 479–488.
[334] D. Waldorf, C. Reinarman, S. Murphy, Cocaine Changes: the Experience of Using and Quitting, Temple University Press, Philadelphia, 1991.
[335] U. Waterhouse, K.A. Brennan, B.A. Ellenbroek, Nicotine self-administration reverses cognitive deficits in a rat model for schizophrenia, Addict. Biol. 23 (2018) 620–630.
[336] A.T. Weil, The Natural Mind, Houghton Mifflin Co., 1998.
[337] E. Weir, Raves: a review of the culture, the drugs and the prevention of harm, CMAJ. 162 (2000) 1843–1848.
[338] B.E. Wells, B.C. Kelly, S.A. Golub, C. Grov, J.T. Parsons, Patterns of alcohol consumption and sexual behavior among young adults in nightclubs, Am. J. Drug Alcohol Abuse 36 (2010) 39–45.
[339] B.P. White, K.A. Becker-Blease, K. Grace-Bishop, Stimulant medication use, misuse, and abuse in an undergraduate and graduate student sample, J. Am. Coll. Health 54 (2006) 261–268.
[340] N.M. White, Addictive drugs as reinforcers: multiple partial actions on memory systems, Addiction 91 (1996) 921–949.
[341] F. Wiens, A. Zitzmann, M.A. Lachance, M. Yegles, F. Pragst, F.M. Wurst, et al., Chronic intake of fermented floral nectar by wild treeshrews, Proc. Natl. Acad. Sci. U. S. A 105 (2008) 10426–10431.
[342] M.J. Williams, B. Adinoff, The role of acetylcholine in cocaine addiction, Neuropsychopharmacology (2007).
[343] R.A. Wise, A brief history of the anhedonia hypothesis, in: C.R. Legg, D.A. Both (Eds.), Appetite: Neural and Behavioral Base, Oxford University Press, Oxford, 1994, pp. 234–263.
[344] R.A. Wise, Brain reward circuitry: insights from unsensed incentives, Neuron 36 (2002) 229–240.
[345] J.M. Witkin, N. Savtchenko, M. Mashkovsky, M. Beekman, P. Munzar, M. Gasior, et al., Behavioral, toxic, and neurochemical effects of sydnocarb, a novel psychomotor stimulant: comparisons with methamphetamine, J. Pharmacol. Exp. Ther. 288 (1999) 1298–1310.
[346] K. Wolff, A.R. Winstock, Ketamine: from medicine to misuse, CNS Drugs 20 (2006) 199–218.
[347] W. Wolff, R. Brand, Subjective stressors in school and their relation to neuroenhancement: a behavioral perspective on students’ everyday life “doping”, Subst. Abuse Treat. Prev. Policy 8 (2013) 23.
[348] W. Wolff, R. Brand, F. Baumgarten, J. Losel, M. Ziegler, Modeling students’ instrumental (mis-) use of substances to enhance cognitive performance: neuroenhancement in the light of job demands[349] S. Wonnacott, Presynaptic nicotinic ACh receptors, Trends Neurosci. 20 (1997) 92–98.
[350] S. Wonnacott, S. Kaiser, A. Mogg, L. Soliakov, I.W. Jones, Presynaptic nicotinic receptors modulating dopamine release in the rat striatum, Eur. J. Pharmacol. 393 (2000) 51–58.
[351] R.I. Wood, Reinforcing aspects of androgens, Physiol. Behav. 83 (2004) 279–289.
[352] R.I. Wood, Anabolic-androgenic steroid dependence? Insights from animals and humans, Front. Neuroendocrinol. 29 (2008) 490–506.
[353] R. Wrangham, T. Nishida, Aspilla spp. Leaves: A puzzle in the feeding behavior of wild chimpanzees, Primates 24 (2) (1983) 276–282.
[354] J.J. Yap, K.A. Miczek, Stress and rodent models of drug addiction: role of VTA- Accumbens-PFC-Amygdala circuit, Drug Discov. Today Dis. Models 5 (2008) 259–270.
[355] R.A. Yokel, R. Pickens, Self-administration of optical isomers of amphetamine and methylamphetamine by rats, J. Pharmacol. Exp. Ther. 187 (1973) 27–33.-resources theory, Biopsychosoc. Med. 8 (2014) 12.
[356] A.M. Young, M.H. Joseph, J.A. Gray, Latent inhibition of conditioned dopamine release in rat nucleus accumbens, Neuroscience 54 (1993) 5–9.
[357] J.P. Zacny, S.A. Lichtor, Nonmedical use of prescription opioids: motive and ubiquity issues, J. Pain 9 (2008) 473–486.
[358] N.E. Zinberg, Drug, Set, and Setting: the Basis for Controlled Intoxicant Use, Yale University Press, New Haven, 1984.
[359] I. Zoicas, S.E. Huber, L.S. Kalinichenko, E. Gulbins, C.P. Müller, J. Kornhuber, Ceramides affect alcohol consumption and depressive-like and anxiety-like behavior in a brain region- and ceramide species-specific way in male mice, Addict. Biol. (2019) e12847.
[360] M.J. Zvolensky, A.A. Vujanovic, A. Bernstein, M.O. Bonn-Miller, E.C. Marshall, T.M. Leyro, Marijuana use motives: a confirmatory test and evaluation among young adult marijuana users, Addict. Behav. 32 (2007) 3122–3130.
[361] M. Zuckerman, The psychophysiology of sensation seeking, J. Pers. 58 (1990) 313–345.