Volkow, N. D., Michaelides, M., & Baler, R. (2019). The neuroscience of drug reward and addiction. Physiological reviews, 99(4), 2115-2140.
La consommation de drogues est motivée par leurs effets pharmacologiques, qui sont ressentis comme gratifiants, et est influencée par des facteurs génétiques, développementaux et psychosociaux qui déterminent l’accessibilité des drogues, les normes et les systèmes de soutien social ou l’absence de ceux-ci. Les effets renforçants des drogues dépendent principalement de la signalisation de la dopamine dans le noyau accumbens, et l’exposition chronique aux drogues déclenche des neuroadaptations à médiation glutamatergique dans les voies dopaminergiques striato-thalamo-corticales (principalement dans les régions corticales préfrontales, y compris le cortex orbitofrontal et le cortex cingulaire antérieur) et limbiques (amygdale et hippocampe) qui, chez les individus vulnérables, peuvent aboutir à une dépendance. Parallèlement, les modifications de l’amygdale étendue entraînent des états émotionnels négatifs qui perpétuent la prise de drogue pour tenter de les atténuer temporairement. De manière contre-intuitive, chez la personne dépendante, la consommation réelle de drogue est associée à une augmentation atténuée de la dopamine dans les régions cérébrales de récompense, ce qui pourrait contribuer au comportement de prise de drogue pour compenser la différence entre l’ampleur de la récompense attendue déclenchée par le conditionnement aux indices de drogue et l’expérience réelle de cette récompense. Combinés, ces effets se traduisent par une motivation accrue à “rechercher la drogue” (stimulée par les augmentations de dopamine déclenchées par les indices de drogue) et une autorégulation préfrontale descendante altérée qui favorise la prise compulsive de drogue sur fond d’émotivité négative et d’une conscience intéroceptive accrue de la “faim de drogue”. Les interventions thérapeutiques visant à inverser ces neuroadaptations sont prometteuses en tant qu’approches thérapeutiques de la toxicomanie.
La recherche en neurosciences a révélé que l’addiction est une maladie chronique et récidivante du cerveau déclenchée par l’exposition répétée à des drogues chez les personnes vulnérables en raison de leur génétique et de leur développement ou d’une exposition sociale défavorable. En conséquence, la capacité du circuit de récompense à répondre à la récompense et à motiver des actions qui ne sont pas liées à la drogue est diminuée, la sensibilité des circuits émotionnels au stress est augmentée et la capacité d’autorégulation est altérée. Il en résulte une recherche compulsive de drogue et une prise de drogue malgré des dommages importants et une incapacité à contrôler les fortes envies de consommer la drogue, même lorsqu’il y a un fort désir d’arrêter. Les changements dans le cerveau responsables de ces comportements inadaptés peuvent persister pendant des mois, voire des années, après l’arrêt de la drogue, mais ils peuvent être traités. Le traitement doit viser à améliorer l’autorégulation, à aider à contrôler l’état de manque et l’émergence d’émotions pénibles, y compris la dépression et l’anxiété, et à améliorer la sensibilité à des renforçateurs alternatifs. La dépendance étant une maladie chronique, son traitement doit suivre un modèle d’intervention soutenu, dont l’intensité doit être adaptée au stade de la maladie. Le traitement doit également être personnalisé et calibré en fonction de la gravité de la dépendance, de la présence de comorbidités et des systèmes de soutien de l’individu. Il est essentiel de savoir que la dépendance peut être prévenue et que des stratégies universelles et personnalisées peuvent réduire de manière significative les troubles liés à l’utilisation de substances chez l’individu et dans la population.
1. INTRODUCTION
Tous les êtres sensibles ont un besoin inhérent de rechercher des stimuli positifs et d’éviter les stimuli négatifs, une formule universelle qui a évolué pour maximiser la capacité d’adaptation et les chances de survie. La réussite des stratégies visant à atteindre ou à éviter ces stimuli dépend d’interactions complexes entre un organisme et son environnement, orchestrées par le système nerveux. La neurobiologie utilise des processus affinés au cours de l’évolution, tels que l’homéostasie, la perception sensorielle, l’apprentissage associatif et non associatif, les émotions et la prise de décision, pour façonner la réponse d’un organisme aux stimuli environnementaux et maximiser sa capacité à exploiter leurs caractéristiques prévisibles et à s’adapter à celles qui sont imprévisibles. Bien que les types de stimuli varient d’une espèce à l’autre, il existe des similitudes frappantes entre les différentes espèces, dans leurs réponses aux stimuli positifs (par exemple, la nourriture et le sexe) et négatifs (par exemple, la douleur et les menaces environnementales). Cette représentation commune, qui reflète le rôle critique de ces stimuli dans l’augmentation des chances de survie, se retrouve souvent au niveau neurobiologique, où les différentes espèces exploitent des stratégies structurelles, neurochimiques et fonctionnelles similaires pour résoudre des problèmes similaires (77, 284).
L’ingéniosité a permis à l’homme d’extraire et d’affiner des stimuli hautement renforçateurs contre lesquels les renforçateurs naturels ne peuvent pas facilement rivaliser. L’exemple le plus notable est notre capacité à purifier et à délivrer des drogues (par exemple, les boissons à forte teneur en alcool, les cigarettes, les seringues pour les injections de drogue et, plus récemment, les dispositifs de vapotage), ainsi que les progrès de la chimie qui ont donné naissance à de nouveaux composés psychoactifs d’une puissance sans précédent (par exemple, les opioïdes synthétiques, les cannabinoïdes et les stimulants). L’accès à ces drogues très renforçantes, associé à des environnements propices (par exemple, l’omniprésence des drogues légales et illégales, le stress chronique, la pression des pairs) et à des vulnérabilités individuelles (par exemple, une maladie mentale préexistante, une douleur chronique, une prédisposition génétique, le genre, le jeune âge), influe sur l’expérimentation des drogues ainsi que sur le risque et la prévalence des troubles liés à l’utilisation de substances (TUS). Le dernier exemple en date des conséquences potentielles de ces environnements propices à la drogue est la marée montante des décès dus aux opioïdes, initialement alimentée par le mésusage d’analgésiques opioïdes sur ordonnance, puis par l’héroïne, et aujourd’hui exacerbée par le mésusage d’opioïdes synthétiques très puissants tels que le fentanyl. L’épidémie actuelle d’opioïdes [dont on estime qu’elle a entraîné plus de 71 000 décès par surdose d’opioïdes en 2017 (57) et qui ne montre aucun signe d’apaisement en 2018 (2)], associée au taux de mortalité de fond élevé lié à la consommation d’alcool (~88 000 décès annuels) (56, 310) et de tabac (>480 000 décès annuels) (58), met en évidence l’impact dévastateur des drogues et de l’addiction dans notre société.
L’application des technologies neuroscientifiques chez l’homme et les animaux de laboratoire a permis des avancées remarquables dans notre compréhension des fondements neurobiologiques du renforcement par la drogue et de la dépendance. En conséquence, la dépendance, qui a été considérée historiquement comme une “déficience morale”, est de plus en plus considérée comme un trouble chronique récurrent caractérisé par un besoin impérieux de consommer des drogues et par la perte progressive de contrôle et l’escalade de la consommation de drogues malgré des tentatives répétées (infructueuses) de résister à la consommation (334). Il est également reconnu que la dépendance émerge dans le contexte d’interactions biopsychosociales complexes entre les effets pharmacologiques d’une drogue, les vulnérabilités individuelles (par exemple, génétique/épigénétique, stade de développement, pathologie existante), une connectivité sociale inadéquate et d’autres facteurs socioculturels (par exemple, les comportements normatifs concernant la consommation de drogues, l’accessibilité financière et la disponibilité des drogues, le statut juridique). La recherche sur les mécanismes qui sous-tendent l’influence modulatrice des environnements sociaux défavorables, des expériences de l’enfance et de la variabilité génétique est fondamentale pour nous aider à comprendre pourquoi toutes les personnes exposées régulièrement à une drogue ne deviennent pas dépendantes (54, 231) et pourquoi certaines personnes dépendantes peuvent se rétablir alors que d’autres n’y parviennent pas (47, 210, 287).
2. LA RÉCOMPENSE DE LA DROGUE
La dopamine (DA) est au cœur de la récompense de la drogue (85, 182). Toute drogue ayant un potentiel de dépendance augmente la DA, soit par des effets directs ou indirects sur les neurones DA dans l’aire tegmentale ventrale (VTA) avec la libération conséquente de DA dans le noyau accumbens (NAc) (357) (FIGURE 1). Les drogues d’abus augmentent la DA par leur action initiale sur différentes cibles moléculaires et, en fonction de leurs effets pharmacologiques (TABLEAU 1), engagent également d’autres neurotransmetteurs. Certains d’entre eux, comme les opioïdes endogènes (ENCADRE 1) ou les cannabinoïdes endogènes (ENCADRE 2) (FIGURE 2), contribuent également aux effets renforçants des drogues par la modulation des réponses hédoniques ou l’inhibition des états affectifs négatifs (232). L’importance des influences non dopaminergiques sur le traitement de la récompense n’a pas fait l’objet d’études aussi approfondies que celles de l’AD, mais ne doit pas être sous-estimée. En fait, les souris déficientes en dopamine (DD) ont montré une préférence de place conditionnée pour la cocaïne [également montrée pour la morphine chez les rats naïfs (157)], qui semble être médiée par la sérotonine à travers un mécanisme qui implique les neurones DA, probablement à travers leur libération de glutamate ou de neuropeptides comme la cholécystokinine et la neurotensine (156). Par ailleurs, des études menées sur des souris génétiquement modifiées ont montré que le récepteur opioïde mu (MOR) n’est pas seulement la principale cible de l’héroïne et d’autres drogues opioïdes, mais qu’il est également essentiel pour les propriétés gratifiantes de drogues non opioïdes, comme l’alcool, la cocaïne et la nicotine (62, 153).
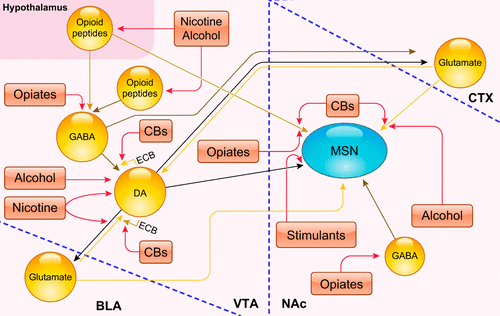
Représentation schématique des principaux sites cibles de diverses drogues dans le circuit de la récompense. Les neurones dopaminergiques (DA) de l’aire tegmentale ventrale (VTA) se projettent vers des cibles du cerveau antérieur telles que l’amygdale basolatérale (BLA), l’aire préfrontale médiane du cortex (CTX) ou mPFC, et le noyau accumbens (NAc). Ces neurones reçoivent des entrées synaptiques excitatrices du mPFC (mais aussi de l’hypothalamus latéral et du noyau tegmental pédonculo-pontin/noyau tegmental dorso-latéral ; non montré). Les neurones GABAergiques de la VTA ciblent les neurones DAergiques voisins et se projettent vers le mPFC et le NAc (d’autres entrées inhibitrices vers ces neurones DAergiques proviennent probablement des structures de sortie de l’amygdale étendue ; non montré). Les neurones GABAergiques à épines moyennes (MSN) du NAc, qui se projettent soit vers le globus pallidus externus/ventral pallidum (VP) principalement via des neurones exprimant la D2R mais aussi la D1R, soit vers la VTA/SN via des neurones exprimant la D1R, reçoivent des entrées dopaminergiques en provenance de la VTA. Ils reçoivent également des entrées excitatrices du mPFC et de l’amygdale basolatérale (BLA) (mais aussi de l’hippocampe et du thalamus). L’activité des MSN est modulée par des interneurones cholinergiques et des interneurones GABAergiques à stimulation rapide (non montré) (312). Les drogues, malgré des actions initiales diverses, ont des effets communs sur la VTA et le NAc. Les stimulants augmentent directement la transmission dopaminergique dans le NAc. Les opiacés augmentent indirectement la DA en inhibant les interneurones GABAergiques dans la VTA, en les désinhibant et en stimulant les récepteurs opioïdes mu (MOR) sur les neurones du NAc (244). La nicotine stimule le déclenchement des neurones DA par ses effets sur les récepteurs ionotropiques (nicotiniques) de l’acétylcholine (314). L’alcool, entre autres effets, augmente le tir des neurones DA de la VTA se projetant vers le NAc via leur désinhibition par l’inhibition des neurones GABA (238). Les cannabinoïdes (CB) perturbent la signalisation endocannabinoïde (ECB) normale – des neurones DA sur les terminaux glutamatergiques (via la suppression rétrograde de l’excitation) et GABAergiques (via la suppression rétrograde de l’inhibition) voisins – qui est responsable de l’ajustement fin de l’activité des projections dopaminergiques mésolimbiques (31). [Modifié d’après Nestler (244), avec l’autorisation de Springer Nature].
Le système opioïde endogène
Le système opioïde endogène module le système DA mésolimbique (107, 328) et est impliqué dans l’attribution de valeurs hédoniques aux récompenses et dans l’intégration d’informations liées à la récompense pour guider la prise de décision et l’exécution de comportements orientés vers un but (193). Il se compose de peptides opioïdes endogènes et de leurs récepteurs, à savoir les β-endorphines, les enképhalines et les dynorphines, qui se signalent de préférence par l’intermédiaire des récepteurs opioïdes mu (MOR), delta (DOR) et kappa (KOR), respectivement. Les MOR sont responsables des effets gratifiants des opioïdes et de l’analgésie, les DOR sont impliqués dans l’analgésie et l’anxiolyse, tandis que les KOR sont impliqués dans les réponses dysphoriques associées à la dépendance (194) et dans la rechute induite par le stress (136). Les MOR de la VTA et de la NAc, ainsi que de l’amygdale basolatérale, sont impliquées dans les effets gratifiants des opioïdes (FIGURES 1 et 2). Le système opioïde module également l’humeur, la stimulation des MOR et des KOR ayant des effets antidépresseurs et dysphoriques prédominants, respectivement (250).
Le système cannabinoïde endogène
Le système cannabinoïde endogène (ECS) module d’autres systèmes de neurotransmetteurs, notamment le GABA, le glutamate et la DA, dans des zones clés du circuit mésolimbique (209, 348). L’ECS se compose de cannabinoïdes endogènes [anandamide (AEA) et 2-arachidonoylglycérol (2-AG)] et de leurs récepteurs (CB1R et CB2R) (337). Des études récentes corroborent l’importance fonctionnelle de l’ECS dans la modulation des circuits de la récompense (252). Par exemple, l’activation du CB1R dans les afférences glutamatergiques corticales a inhibé la libération de DA dans le NAc et atténué les comportements motivés par la récompense (225). Dans la VTA, le 2-AG et, dans une moindre mesure, l’AEA, libérés par les neurones DA, activent de manière rétrograde les CB1R au niveau des entrées GABA de la VTA provenant des interneurones GABAergiques (FIGURE 2), ou des terminaux du pallidum ou du noyau tegmental rostromédian (252, 271). Le 2-AG active également les CB1R au niveau des entrées de glutamate de la VTA provenant du cortex (252). Les cannabinoïdes agissent également dans le NAc où les neurones à épines moyennes (MSN) sont modulés par les interneurones GABAergiques exprimant le CB1R et par les terminaux à glutamate exprimant le CB1R provenant de l’amygdale, de l’hippocampe et du cortex préfrontal (3, 79, 152).
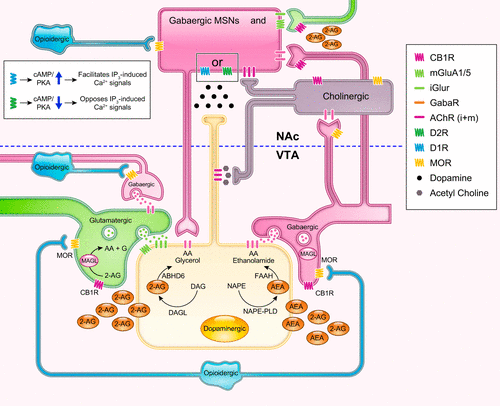
Dessin simplifié schématique montrant certains des effets modulateurs indirects des signaux opioïdes et endocannabinoïdes du mésencéphale (aire tegmentale ventrale, VTA) sur la transmission dopaminergique dans le noyau accumbens (NAc). Les stimuli liés à la récompense véhiculés par les afférences glutamatergiques (en vert) favorisent la mise à feu en rafale des neurones dopaminergiques (en jaune), principalement sous l’effet de l’activation de la liaison des récepteurs ionotropiques du glutamate (iGluR) au niveau de la cellule dopaminergique. Le niveau d’activation est normalement contrôlé par des entrées GABAergiques compensatrices (rose), mais aussi par des entrées GABAergiques inhibitrices directes inhibant la libération présynaptique de glutamate (66). Les opioïdes endogènes [libérés par les neurones opioïdes (bleu clair), qui se projettent principalement à partir de l’hypothalamus] ou exogènes (molécules opioïdes naturelles ou synthétiques) activent les récepteurs mu opioïdes endogènes (MOR) sur les interneurones GABAergiques. Le MOR est couplé à des protéines G inhibitrices, dont l’activation (par un peptide endogène comme l’endorphine ou des agonistes exogènes comme la morphine et le fentanyl) conduit à une dissociation entre les sous-unités Gα et Gβγ et à l’activation de voies effectrices intracellulaires. L’une de ces voies conduit à l’inhibition de la libération de GABA en raison de l’augmentation de la conduction des ions potassium, qui hyperpolarise la cellule, la rendant moins sensible aux entrées dépolarisantes et inhibant l’influx de calcium (123). En outre, l’activation des MOR augmente la signalisation de la protéine kinase activée par les mitogènes (MAPK), tandis que leur phosphorylation active la voie des arrestines (5), qui a la capacité de désensibiliser, d’activer et de contrôler le trafic des récepteurs couplés aux protéines G (GPCR) (140). Une baisse du tonus GABAergique entraîne une désinhibition nette du neurone dopaminergique voisin et la libération d’un excès de dopamine (points noirs) sur les neurones épineux moyens directs et indirects [neurone épineux moyen rose (MSN)], ce qui renforce les effets euphorisants des opioïdes. L’activation ionotropique du neurone DA médiée par les GluR entraîne un afflux de Ca2+ (via les canaux calciques voltage-gated), qui est soit facilité soit entravé dans les populations de MSN exprimant D1R vs D2R, respectivement (317) (encart), ce qui conduit à leurs rôles différentiels dans la plasticité. Parallèlement, l’afflux de Ca2+, associé à l’activation de mGluA1/5, déclenche la production “à la demande” de 2-arachidonoylglycérol (2-AG) à partir du diacylglycérol (DAG) [ou d’anandamide (AEA) à partir des N-acyl-phosphatidyléthanolamines (NAPE)]. La transmission rétrograde du 2-AG par la liaison des récepteurs CB1 aux neurones afférents (GABA et Glu) contenant de la monoacylglycérol lipase (MAGL) a pour effet net de désinhiber les neurones dopaminergiques et de faciliter la libération phasique de DA (63). En effet, les cannabinoïdes (par exemple, le tétrahydrocannabinol, le 2-AG) agissent comme des agonistes complets au niveau des terminaux GABA [qui présentent un rapport CB1R/vésicules élevé (188)] mais comme des agonistes partiels au niveau des terminaux Glu [où le rapport CB1R/vésicules est beaucoup plus faible (295, 296)]. Comme on l’a vu, on suppose que l’AEA est rétrograde malgré les données montrant que la FAAH est principalement postsynaptique alors que la NAPE PLD est présynaptique. La véritable nature de la neurotransmission de l’AEA reste incertaine, en partie parce qu’il existe d’autres voies de synthèse de l’AEA. Dans le NAc, les projections GABAergiques, envoyées par la VTA, font également synapse sur les interneurones cholinergiques (gris foncé), inhibant ainsi leur entrée excitatrice sur les terminaux DA. L’activation des récepteurs CB1 ou MOR sur ces neurones GABA peut stimuler les terminaux DA (indépendamment de l’activation des neurones DA de la VTA) en désinhibant la libération d’ACh, tandis que l’activation de ces récepteurs, qui sont également exprimés sur les interneurones ACh, pourrait en théorie avoir l’effet inverse sur les niveaux de DA dans l’accumbens (351). Les terminaux GABAergiques et glutamatergiques dans le NAc ont également la capacité de moduler directement l’activité de la DA accumbens sur les MSN. Étant donné que ces neurones expriment également MOR [mais certains également CB1R (226, 361)], leur activation sur les entrées GABA pourrait augmenter la libération de DA, tandis que leurs effets inhibiteurs sur les entrées glutamatergiques pourraient réduire la libération accumulée de DA.
À son tour, la stimulation dopaminergique répétée due à la consommation de drogues induit des neuroadaptations dans de multiples systèmes de neurotransmetteurs, notamment le système glutamatergique, qui augmente l’excitabilité neuronale et module la neuroplasticité (286) ; le système GABAergique, qui inhibe la transmission du potentiel d’action (168) ; et les systèmes opioïde, endocannabinoïde (232, 337, 351), cholinergique (78, 204), sérotonine (36, 215) et noradrénergique (109), qui modulent les circuits affectifs, hédoniques et aversifs dans le cerveau.
Les neurones DA du mésencéphale et leurs projections dans le NAc et le striatum dorsal, ainsi que leurs sorties GABAergiques, sont impliqués dans la motivation et le maintien de comportements renforcés (y compris vis-à-vis de la nourriture et des drogues), mais aussi dans l’évitement de stimuli ou d’états aversifs (262). Les neurones DA de la VTA se projettent dans l’ANc, qui est une plaque tournante du circuit de la récompense et un moteur majeur des actions dirigées vers un but qui sont sensibles à la saillance actuelle (valeur estimée) d’un but associé (281). Parallèlement, les neurones DA de la substantia nigra (SN) se projettent dans le striatum dorsal et traduisent les signaux de récompense récurrents en actions habituelles qui deviennent de plus en plus insensibles aux valeurs réelles ou actualisées de l’objectif et sont plutôt sélectionnées en fonction de l’expérience antérieure du renforcement associé à cette action. Le comportement répété associé à la récompense peut, au fil du temps, aboutir à l’émergence d’habitudes (103), le striatum dorsal prenant progressivement le pas sur le striatum ventral. En outre, à la suite d’expositions répétées à la drogue, les habitudes pourraient également résulter d’une réduction des entrées du cortex préfrontal (PFC) dans le striatum qui perturbe le contrôle de la sélection des actions (269). Cependant, la notion selon laquelle la formation d’une ” habitude ” est nécessaire à l’établissement d’une dépendance a été récemment remise en question par une étude qui a montré que les rongeurs qui devaient résoudre un problème original avant d’avoir accès à la cocaïne ne transféraient pas le contrôle comportemental du striatum ventral au striatum dorsal, même s’ils exprimaient des comportements semblables à ceux de la dépendance (300). Les résultats de cette étude sont cohérents avec les observations selon lesquelles les personnes dépendantes peuvent faire preuve de solutions très créatives pour se procurer la drogue, tout en tombant dans des comportements rituels une fois qu’elles l’ont consommée. Cela indique que les comportements liés à la dépendance sont probablement une combinaison complexe de réponses adaptatives (principalement pour se procurer la drogue) et de réponses automatiques aux stimuli.
Les neurones DA de la VTA se projettent également vers l’amygdale et l’hippocampe, qui assurent la médiation des associations émotionnelles et mémorielles, et vers les régions du PFC, qui assurent la médiation de l’attribution de la saillance et de l’autorégulation, tous ces éléments participant au renforcement et au conditionnement qui suivent la consommation chronique de drogue. Les neurones DA de la VTA et du SN sont influencés par des projections provenant de plusieurs zones du cerveau qui contrôlent leurs tirs toniques et phasiques (112). Des preuves récentes indiquent une diversité significative au sein de la population des neurones DA de la VTA en ce qui concerne leur connectivité afférente et efférente (235), leur co-libération de GABA ou de glutamate (ou des deux), et les récepteurs présynaptiques exprimés dans leurs terminaux, qui modulent de manière différentielle la libération de DA en présence d’autres neurotransmetteurs comme le GABA ou l’acétylcholine (228). La diversité est également apparente dans les caractéristiques cytoarchitectoniques, neurochimiques et électrophysiologiques des neurones DA de la VTA, ainsi que dans leur sensibilité aux stimuli gratifiants ou aversifs (159). En général, le déclenchement tonique des neurones DA (1-8 Hz) établit le ton dopaminergique de fond, qui est suffisant pour stimuler les récepteurs DA D2 à haute affinité (D2R), tandis que le déclenchement phasique (<500 ms ; >15 Hz) code les réponses aux stimuli saillants (gratifiants, inattendus, nouveaux, aversifs) et entraîne des niveaux plus élevés de DA (120) qui sont capables de stimuler les récepteurs DA D1 à faible affinité (D1R). Ainsi, une drogue comme la cocaïne qui bloque le transport de la DA vers le terminal, favorisant son accumulation dans l’espace extracellulaire, tout en augmentant la fréquence des événements de libération de DA dans le NAc (9), déclenche des niveaux élevés de DA qui peuvent activer à la fois les D1R et les D2R.
Le modèle traditionnel des voies directes et indirectes dans le striatum dorsal, avec leurs effets opposés sur la facilitation ou l’inhibition du mouvement, a été appliqué au traitement de la récompense par le NAc. Selon ce modèle, les neurones à épines moyennes du NAc exprimant le D1R (D1R-MSN) dans la voie directe (projetant vers le mésencéphale) seraient à l’origine des comportements de récompense et d’orientation vers un but, tandis que les MSN exprimant le D2R (D2R-MSN) dans la voie indirecte (projetant vers le pallidum ventral) seraient associés aux comportements d’évitement (155). Cependant, des études récentes remettent en question cette séparation claire de la fonction et des projections anatomiques pour le striatum dorsal et le striatum ventral (187). Par exemple, des études ont montré que dans le striatum dorsal, les D1R-MSN (directs) et les D2R-MSN (indirects) sont activés lors de l’initiation d’une action (75). De plus, dans le NAc, ces voies sont moins séparées que dans le striatum dorsal et les D1R-MSN se projettent directement à la fois vers le mésencéphale et vers le pallidum ventral, qui est modulé à la fois par les D1R-MSN et les D2R-MSN (277), et les D2R-MSN qui se projettent vers le pallidum ventral désinhibent directement le thalamus (186). Dans le NAc, des études chez les rongeurs ont rapporté l’existence d’une sous-population de neurones qui coexpriment D1R et D2R (145) et forment un complexe D1R-D2R qui, lorsqu’il est activé, inhibe la récompense naturelle basale et la récompense de la cocaïne (146).
Dans la VTA, le déclenchement spontané des neurones DA établit des niveaux toniques de DA, qui stimulent principalement les D2R (ainsi que les D3R, qui ont une grande affinité pour la DA) dans la NAc, sur lesquels le déclenchement phasique de DA peut être superposé, entraînant des niveaux plus élevés de DA qui stimulent en outre les D1R (262). Bien qu’une récompense inattendue déclenche une excitation DA phasique, sa présentation répétée la transforme en une récompense attendue et provoque l’excitation phasique du neurone DA lors de l’exposition à l’indice prédictif (ce qui en fait un indice conditionné). En revanche, il y a une pause dans l’excitation du neurone DA lorsque la récompense attendue ne se matérialise pas (ce qui la rend discordante). Ainsi, lorsqu’un résultat diffère de celui attendu, la DA signale une “erreur de prédiction de récompense”, indépendamment de sa valence positive ou négative, qui, selon des études récentes, pourrait refléter non seulement la valeur scalaire de la récompense, mais aussi d’autres dimensions du résultat attendu, telles que ses caractéristiques ou sa séquence de présentation (189). Les drogues déclenchent un déclenchement phasique de la DA qui, dans le NAc, se lie à la fois aux MSN exprimant la D1R, où la DA est stimulante (elle augmente l’AMPc et la signalisation intracellulaire du Ca), et aux MSN exprimant la D2R, où la DA est inhibitrice (elle diminue l’AMPc et la signalisation intracellulaire du Ca) (213, 245, 297, 298), ce qui déclenche la motivation pour initier des comportements orientés vers la récompense (346). Bien que l’on ait cru que les stimuli aversifs ou leurs indices, en réduisant l’activité tonique des neurones DA et la libération de DA dans le NAc, diminuaient l’inhibition par le D2R des MSN de la voie indirecte, entraînant un comportement d’évitement, cette hypothèse, comme nous l’avons vu plus haut, est aujourd’hui remise en question. En effet, certains neurones DA sont activés et non inhibés par des stimuli aversifs (352), mais des recherches supplémentaires sont nécessaires pour caractériser leurs projections dans le NAc et dans d’autres régions du cerveau (186). En outre, les tirs toniques et phasiques stimulent les D3R à haute affinité, qui sont fortement exprimés dans le NAc, où ils se colocalisent avec les D1R, potentialisant leur signalisation (108) et modulant peut-être la récompense et le conditionnement à la drogue (117). Le NAc exprime également des D5R, qui se colocalisent avec les D1R dans les MSN (239), sont également exprimés dans les interneurones et semblent jouer des rôles distincts dans la neuroplasticité par rapport aux D1R (59). Le D4R est également exprimé dans le NAc, et des études génétiques ont impliqué son gène codant (DRD4) dans la vulnérabilité à l’addiction (255), tandis que des études précliniques ont montré qu’il modulait les effets pharmacologiques des drogues. Cependant, il est clair que les différences fonctionnelles entre les récepteurs DA, leur colocalisation et leurs interactions dans le NAc (y compris celle entre D3R et D5R, qui a été peu étudiée) nécessitent des recherches supplémentaires.
Le déclenchement phasique des récepteurs DA et la stimulation du D1R sont nécessaires à la récompense de la drogue et à la création d’associations conditionnées. D’autre part, la stimulation DA de la signalisation D2R est associée à la motivation (306) mais, selon les circonstances, peut interférer avec les effets renforçateurs des drogues, comme c’est le cas avec l’exposition à de multiples renforçateurs alternatifs. Notamment, le renforcement positif et la récompense maximale se produisent lorsque les récepteurs D1R et D2R sont stimulés simultanément dans le NAc, mais des études supplémentaires sont nécessaires pour déterminer comment chaque sous-type de récepteur contribue à l’effet global (311).
3. DOPAMINE ET NEUROPLASTICITÉ
Les drogues, par le biais d’une stimulation dopaminergique excessive et répétée, induisent des adaptations neuroplastiques persistantes dans les neurones DA du mésencéphale et dans leurs projections dans le NAc et également dans le striatum dorsal. On pense que ces adaptations sont à la base du conditionnement, ainsi que de l’augmentation de la saillance incitative aux indices de la drogue et de l’inflexibilité comportementale (128, 262, 293). Lorsque le conditionnement est établi, les neurones DA s’activent lorsqu’ils sont exposés aux indices prédictifs de drogue qui précèdent l’arrivée de la drogue, prédisant ainsi une récompense imminente. Le conditionnement peut être instancié pour de nombreux types d’indices, y compris les lieux et les personnes associés à l’expérience de la drogue, ou les états mentaux qui prédominaient au moment de la consommation de la drogue (dépression, ennui, excitation, stress, etc.), qui peuvent tous éveiller par la suite, par eux-mêmes, la motivation à rechercher la drogue (289, 343). Ces neuroadaptations impliquent principalement des entrées glutamatergiques dans les neurones DA de la VTA et dans les MSN du NAc, préparant ainsi le terrain pour les changements comportementaux respectifs de la réactivité à la récompense et de l’accoutumance qui caractérisent la dépendance, y compris un risque persistant de rechute qui rend le traitement si difficile (176, 290, 359). Certaines des adaptations clés induites par les drogues sont similaires aux changements synaptiques associés à l’apprentissage, notamment les changements dans la morphologie dendritique, les récepteurs ionotropiques du glutamate (principalement les récepteurs AMPA et NMDA) qui entraînent une potentialisation à long terme (LTP) et une dépression à long terme (LTD) (138, 176). La force synaptique est modulée de façon présynaptique par la régulation de la libération de glutamate et de façon postsynaptique par l’insertion ou l’élimination des récepteurs ionotropiques transmembranaires du glutamate (NMDA et AMPA) et par des changements dans la composition de leurs sous-unités, ce qui modifie leur efficacité. La libération de glutamate dans la NAc est diminuée par l’activation des récepteurs métabotropiques du glutamate mGluA2/3 (362), des récepteurs de l’adénosine A1 (37), du D2R (154) ou du cannabinoïde CB1R (272, 316). Au niveau postsynaptique, le trafic des récepteurs AMPA et NMDA est régulé par l’activation des D1R, qui favorisent l’expression de la surface des AMPA. L’insertion de récepteurs AMPA hautement perméables au calcium et dépourvus de la sous-unité GluA2 est nécessaire à l’expression de l’incubation de l’envie de cocaïne (106). Des augmentations des récepteurs NMDA contenant la sous-unité GluN2B ont également été associées à la neuroplasticité après une consommation chronique de cocaïne ou d’héroïne (160, 294, 349). Les mGluR1 postsynaptiques produisent une LTD qui inverse les augmentations des récepteurs AMPA hautement perméables au calcium induites par la cocaïne dans la VTA (220) et dans le NAc où elle réduit l’envie de cocaïne induite par un cue (211).
Les changements morphologiques se produisent parallèlement au renforcement des synapses excitatrices, qui est associé à des synapses plus grandes, tandis que l’affaiblissement se traduit par des synapses plus petites et une densité réduite des épines dendritiques. En outre, des études récentes sur des souris transgéniques indiquent que l’administration chronique de cocaïne est également associée à une plasticité structurelle spécifique des boutons dopaminergiques dans l’enveloppe du NAc (91) (FIGURE 3).
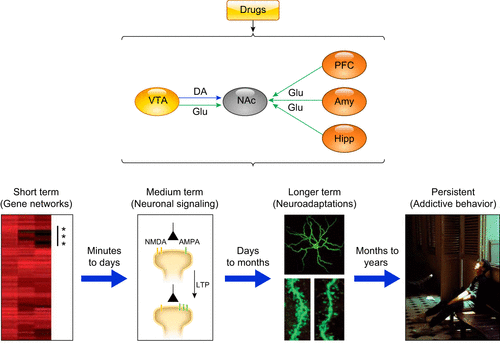
Hypothèse principale sur la façon dont une cascade temporellement coordonnée de modifications de l’activité synaptique induites par la drogue détourne les processus d’apprentissage polyvalents pour engendrer des comportements de dépendance inadaptés et persistants. VTA, aire tegmentale ventrale ; DA, dopamine ; PFC, cortex préfrontal ; Amy, amygdale ; Hipp, hippocampe. Les figures du bas représentent (de gauche à droite) une carte thermique des gènes régulés à la hausse (*) dans le noyau accumbens (NAc) 1 h après l’administration aiguë de cocaïne à des animaux naïfs (275) ; des exemples de ces événements transitoires de transcription et de modulation épigénétique comprennent des gènes de régulation et de signalisation tels que fosB, ΔFosB, NFκB, CdK5 et MEF2. [Les changements induits par les drogues dans l’activité neuronale (par exemple, les changements dans l’équilibre des récepteurs NMDA/AMPA) conduisent à la plasticité synaptique (par exemple, LTP) dans le circuit de la récompense (169). [Les changements morphologiques et fonctionnels, comme l’augmentation de la densité des épines dendritiques, qui, s’ils sont soutenus, peuvent entraîner un remodelage du cytosquelette et du circuit, un phénomène qui est en corrélation avec la force synaptique et la force des souvenirs associés à la drogue in vivo, ce qui, sur une période de plusieurs mois et années, contribue à orchestrer et à cimenter les comportements stéréotypés liés à la dépendance. [D’après Nestler, Dialogues Clin Neurosci 15 : 431-443, 2013].
Cependant, notre compréhension de la neuroplasticité induite par les drogues évolue. Par exemple, en utilisant un protocole de réintégration modifié, il a été démontré que les changements neuroplastiques induits par la cocaïne dans la morphologie des épines dendritiques et les rapports AMPA/NMDA étaient temporairement inversés par l’utilisation de la cocaïne (308). En outre, alors que la plupart des synapses glutamatergiques contiennent à la fois des récepteurs AMPA et NMDA, un petit nombre de synapses dites silencieuses (également appelées “AMPA silencieuses” ou immatures) expriment exclusivement des récepteurs NMDA (203), et ont été associées au stress chronique (315) et aux troubles addictifs et neurodégénératifs (144). Par exemple, des synapses silencieuses sont produites en réponse à la cocaïne (dans le NAc) (89) et à l’alcool (dans le gyrus denté) (23). Cependant, ces synapses ne contribuent pas de manière significative aux courants postsynaptiques excitateurs évoqués par le stimulus (c’est-à-dire la drogue). On a donc émis l’hypothèse que les synapses silencieuses, en récapitulant certains aspects clés du cerveau en développement immature mais plus “enseignable” (89), pourraient fournir un signal de “métaplasticité” et amorcer le circuit pour tout changement plastique ultérieur nécessaire (par exemple, LTP ou LTD) (217).
En outre, l’identification de Maged1, impliqué dans la modulation de la densité des épines dendritiques et de l’apprentissage dans l’hippocampe (363), en tant que gène dont l’expression dans la PFC est essentielle à la fois pour la libération extracellulaire de DA dans le NAc et la sensibilisation comportementale à la cocaïne (82), illustre un autre processus moléculaire impliqué à la fois dans l’apprentissage et dans la neuroplasticité induite par la drogue dans la PFC et le NAc. De même, il a été démontré que les synapses des terminaux glutamatergiques de l’hippocampe dans le NAc subissaient également un LTP, qui était nécessaire à la formation de souvenirs contextuels liés à la récompense, bien que ces changements neuroplastiques ne semblaient pas dépendre de la DA (196).
Il existe également de plus en plus de preuves qu’en plus de la neuroplasticité hébraïque, certaines formes de neuroplasticité induites par les drogues dans le NAc sont homéostatiques et interagissent avec les changements neuroplastiques hébraïques (90, 161, 172, 290). Par exemple, les augmentations de la force synaptique après une exposition répétée à la cocaïne déclenchent des changements homéostatiques de l’excitabilité membranaire dans les MSN du NAc, qui semblent contribuer à l’incubation de l’envie de cocaïne (349).
4. NEUROCIRCUIT DE LA DÉPENDANCE
Le pourcentage d’animaux de laboratoire qui présentent des comportements de type addictif, ou de personnes qui deviennent dépendantes d’une drogue après une exposition répétée, varie en fonction de la drogue, étant plus élevé pour des drogues comme l’héroïne ou la méthamphétamine et plus faible pour des drogues comme l’alcool ou le cannabis. Par exemple, seuls 15 à 20 % des rats exposés de manière chronique à la cocaïne continueront à préférer compulsivement la cocaïne à d’autres options gratifiantes (52), alors que le pourcentage de rats préférant l’héroïne peut atteindre 50 % dans des conditions expérimentales similaires (198). Ces pourcentages varient toutefois d’une souche de rat à l’autre, ce qui souligne le rôle de la génétique dans la modulation des effets des drogues. Les données épidémiologiques sont généralement cohérentes avec ce tableau. Selon les meilleures estimations disponibles, la probabilité, chez les consommateurs de drogues au cours de leur vie, de devenir dépendant de l’alcool, du cannabis, de la cocaïne ou des opioïdes (héroïne) est respectivement d’environ 1,5, 9, 17 et 23 % (7). À l’heure actuelle, on ne sait pas exactement ce qui détermine le passage de l’expérimentation de la drogue à la dépendance, qui apparaît lorsque les individus perdent leur capacité à surmonter la forte envie de prendre la drogue malgré la conscience de ne pas vouloir le faire et la reconnaissance de ses conséquences potentiellement catastrophiques. Cependant, nous savons que cette transition est associée à des perturbations mesurables dans plusieurs circuits cérébraux, notamment ceux impliqués dans le conditionnement, la sensibilité à la récompense, la motivation incitative, l’autocontrôle/la régulation, l’humeur et l’intéroception. Dans cette revue, nous utilisons le terme d’addiction en correspondance avec la définition dimensionnelle des SUD modérés à sévères selon le Manuel diagnostique et statistique des troubles mentaux (DSM-5) (TABLEAU 2).
A. Le conditionnement
La consolidation du conditionnement à la drogue est un processus clé qui amorce la transition vers la dépendance et contribue à la perpétuer. Au fur et à mesure que la dépendance se développe, le nombre de stimuli liés par l’expérience (conditionnés) à la drogue augmente, de même que la probabilité d’être exposé à un indice prédictif de la consommation de drogue. Toute rencontre avec ces indices peut déclencher des poussées de DA dans le NAc (259) et conduire à une consolidation supplémentaire dans le striatum dorsal ; cela dirige l’attention vers l’indice prédictif de la drogue et engendre la motivation de se procurer la drogue. Par conséquent, la motivation à l’égard de la drogue survient maintenant avant la consommation de la drogue et est déclenchée par l’exposition à l’indice prédictif de la drogue. Une fois la drogue consommée, la stimulation DA continue due aux effets pharmacologiques de la drogue favorise la poursuite de l’ingestion tout en renforçant l’apprentissage conditionné, perpétuant ainsi le cycle de la rechute et de la prise de drogue.
L’un des changements supposés contribuer à une réactivité accrue aux indices prédictifs de la drogue dans la dépendance est la rupture de l’équilibre entre les signaux D1R et D2R dans le striatum ventral. Dans l’ensemble, les études sur les rongeurs confirment l’idée que le renforcement des D1R-MSN dans le NAc augmente la récompense de la cocaïne, tandis que le renforcement des D2R-MSN la supprime (49, 208, 323). De même, une étude récente a rapporté que la réintégration induite par un cue était intensifiée soit en activant les D1R-MSN, soit en réduisant l’activité des D2R-MSN (151). Ensemble, ces études suggèrent que la motivation à prendre de la drogue est stimulée par des indices prédictifs et par une stimulation transitoire de la D1R induite par la drogue (activation des D1R-MSN) concomitante à un affaiblissement de la signalisation de la D2R qui est insuffisante pour contrebalancer les D1R-MSN, facilitant ainsi l’ingestion compulsive. En utilisant l’imagerie optique chez des souris transgéniques, nous avons montré que dans le striatum dorsal de souris naïves, la cocaïne aiguë entraînait une augmentation rapide du [Ca2+] dans les D1R-MSN et des diminutions progressives du [Ca2+] dans les D2R-MSN, ce qui est cohérent avec le fait que la DA stimule les D1R-MSN et inhibe les D2R-MSN (213). En revanche, chez les souris chroniquement exposées à la cocaïne, les réponses [Ca2+] à la cocaïne aiguë ont été émoussées, mais dans une mesure significativement plus importante dans les D2R-MSN que dans les D1R-MSN, déséquilibrant la signalisation relative vers une prédominance des D1R-MSN par rapport aux D2R-MSN (251). Cependant, des études sont nécessaires pour évaluer si des changements similaires se produisent dans le NAc et leur association avec la prise compulsive de drogues, d’autant plus qu’il existe des preuves de la coexpression de D1R et D2R dans le NAc et des projections des D1R-MSN et D2R-MSN dans le pallidum ventral.
Le déséquilibre de la signalisation D1R par rapport à la signalisation D2R en cas d’exposition répétée à la drogue favoriserait le déclenchement phasique de la DA et la signalisation D1R induits par les signaux (qui favorisent la recherche de drogue) tout en compromettant le déclenchement tonique de la DA et la signalisation D2R (qui s’opposent aux réponses prépotentes). Plus précisément, la régulation à la hausse du D1R à faible affinité favoriserait la signalisation des réponses DA phasiques, tout en diminuant la sensibilité aux réponses DA toniques en raison d’une régulation à la baisse du D2R à forte affinité. En revanche, une régulation à la hausse du D2R augmenterait la sensibilité à la libération tonique de DA tout en atténuant la libération phasique de DA via l’inhibition des autorécepteurs du D2R, ce qui pourrait expliquer pourquoi la régulation à la hausse du D2R inhibe la prise compulsive de cocaïne (323). Un déséquilibre entre D1R et D2R augmenterait les valeurs de renforcement des drogues et des indices prédictifs de drogues tout en sapant la capacité de contrôle comportemental, facilitant ainsi la consommation impulsive et compulsive de drogues (213). Dans les études cliniques, la sensibilité accrue aux indices conditionnés prédictifs de drogue a été associée à la gravité de la dépendance (343) et à des résultats cliniques plus défavorables (68, 185). Ainsi, une meilleure compréhension de la relation entre les dynamiques D1R et D2R dans le NAc et le striatum dorsal a des implications translationnelles significatives pour le traitement de la dépendance. Par exemple, une étude sur les rongeurs qui a montré que l’activation optogénétique des entrées glutamatergiques sur les D2R-MSNs accumbales réduisait l’auto-administration de cocaïne suggère que le renforcement de la signalisation par les D2R-MSNs pourrait être bénéfique pour le traitement de la toxicomanie (34).
B. Récompense et motivation
Parallèlement à la sensibilité accrue à l’attente des effets gratifiants de la drogue (due au conditionnement), il existe une sensibilité réduite du circuit de récompense DA à la consommation effective de la récompense, qui a été observée chez les toxicomanes et, de manière intéressante, chez certaines personnes obèses qui présentent certains traits phénotypiques compatibles avec une “addiction à la nourriture” (326). Cette sensibilité réduite chez les toxicomanes s’étend aux récompenses non médicamenteuses, avec une diminution concomitante de leur valeur motivationnelle, ce qui contribue au manque d’intérêt pour les activités non associées à la drogue, caractéristique de la toxicomanie. Les études d’imagerie cérébrale sur les toxicomanes ont aidé à caractériser ces adaptations en révélant une diminution de l’expression du D2R et de la libération de DA dans le striatum (régions dorsales et ventrales) (339 ; voir toutefois les études négatives dans les références 95, 175). Très peu d’études ont évalué le D1R dans la dépendance ou dans des modèles animaux de dépendance, et les résultats sont incohérents. Par exemple, il a été rapporté que la cocaïne chronique chez les primates non humains diminue la D1R dans une sous-région spécifique du striatum ventral qui englobe le NAc (234), bien qu’ils semblent se rétablir après 90 jours d’abstinence (25), alors que ni les études électrophysiologiques chez les rats exposés à la cocaïne (227) ni l’imagerie cérébrale des consommateurs de cocaïne n’ont trouvé de changements dans la D1R (224), même si les niveaux étaient prédictifs de la prise de cocaïne chez les consommateurs de cocaïne (224). D’autre part, des études post-mortem chez des consommateurs de méthamphétamine ont fait état d’augmentations significatives de la D1R dans le NAc (360), alors que des études d’imagerie cérébrale n’ont montré aucune différence dans la disponibilité de la D1R (247). Ces incohérences reflètent probablement en partie le manque de données, les différences entre les méthodologies (mesures in vitro et in vivo) et les différences entre les espèces et les modèles animaux utilisés. En outre, la DA est un neuromodulateur dont les effets dépendent de l’état, ce qui peut expliquer en partie pourquoi la stimulation de la DA peut avoir des effets opposés selon le contexte dans lequel elle se produit (291).
Des études d’imagerie ont également révélé une diminution de l’activation des régions cérébrales de récompense à la réception de récompenses non médicamenteuses, telles que la nourriture, les stimuli sexuels ou l’argent, chez les personnes dépendantes aux drogues par rapport aux témoins (6, 33, 53, 99, 253). Une telle sensibilité réduite aux récompenses non liées à la drogue est susceptible de diminuer la capacité d’un individu dépendant à être motivé par des activités et des stimuli naturellement agréables. Curieusement, on observe également une réactivité réduite des régions striatales et préfrontales aux renforçateurs négatifs, ce qui est associé à des résultats plus défavorables (30). Une sensibilité réduite aux renforçateurs négatifs pourrait nuire à la capacité de la personne dépendante à se sentir dissuadée par des résultats négatifs (par exemple, l’incarcération, la perte de la garde des enfants).
C. L’autorégulation
Le développement des envies puissantes conditionnées par les signaux décrits ci-dessus devient encore plus délétère lorsqu’il est associé à des déficits croissants dans la capacité du cerveau à inhiber les comportements inadaptés et les réponses prépotentes. En effet, les déficits de maîtrise de soi peuvent grandement contribuer à l’incapacité d’un individu à éviter les comportements risqués ou autodestructeurs, à résister à la tentation (comme la prise de drogue) ou à retarder les gratifications (comme le bénéfice futur de l’engagement dans un programme de rétablissement à long terme), augmentant ainsi sa vulnérabilité à la dépendance (335).
Des données précliniques et cliniques corroborent l’idée selon laquelle l’affaiblissement des mécanismes de maîtrise de soi est corrélé à une altération des performances des circuits du PFC secondaire à des adaptations induites par la drogue dans les réseaux striataux ou parfois à une atteinte directe du PFC (320, 356). Des études d’imagerie cérébrale chez l’homme ont montré que, dans le striatum, les D2R sont positivement associés à l’activité métabolique de base (marqueur de la fonction cérébrale) dans les régions corticales frontales et inversement associés à la sensibilité aux effets gratifiants des psychostimulants (102, 341, 342), tandis que des études précliniques chez les rongeurs ont montré que la régulation à la hausse des D2R interfère avec la consommation de drogues (323, 324). Les études d’imagerie clinique montrent également que la réduction du D2R striatal observée dans la dépendance humaine est associée à une diminution de l’activité métabolique de base dans les régions préfrontales, notamment le cortex orbitofrontal (OFC), le cortex cingulaire antérieur (ACC) et le cortex préfrontal dorsolatéral (DLPFC) (examiné dans la Réf. 345 ; voir également les Réf. 333, 336, 340, 344). Étant donné que l’OFC, l’ACC et le DLPFC sont impliqués dans l’attribution de saillance, le contrôle inhibiteur/la régulation des émotions et la prise de décision, respectivement, il est raisonnable de supposer qu’une modulation défectueuse de ces régions par le D2R striatal est susceptible de sous-tendre la valeur motivationnelle accrue des drogues, la perte significative de contrôle sur la prise de drogue chez les personnes dépendantes (335) et la prise de drogue compulsive et impulsive observée dans la toxicomanie (129). En outre, les sujets présentant un risque élevé d’alcoolisme (antécédents familiaux positifs) mais ne souffrant pas d’alcoolisme ont montré une régulation à la hausse de la D2R striatale associée à une activité de base normale de l’OFC, de l’ACC et du DLPFC. Ce résultat contraste fortement avec l’hypoactivité observée dans ces mêmes régions frontales chez les personnes touchées par l’alcoolisme et d’autres addictions, ce qui a conduit à l’hypothèse que la régulation striatale de D2R pourrait avoir protégé les personnes non touchées contre l’alcoolisme en régulant les circuits impliqués dans l’autorégulation (340). En effet, les études d’imagerie prospective du développement cérébral révèlent de plus en plus que les anomalies du PFC constituent un risque de vulnérabilité pour le SUD (voir sect. V) (170).
Des études animales corroborent également la présence de neuroadaptations dans les synapses DA mésocorticales dans le PFC ainsi que dans les synapses glutamate corticofuges dans le NAc chez les rongeurs sevrés d’une exposition chronique à la cocaïne (173). La première semble impliquer un découplage partiel entre Giα et D2R (40), et peut contribuer à une réactivité exagérée vis-à-vis des drogues et des indices prédictifs de drogues et à une réponse émoussée vis-à-vis des récompenses naturelles. Cette dernière repose sur des adaptations cellulaires conduisant à des niveaux réduits de glutamate extracellulaire dans le NAc (12) qui pourraient également contribuer à la recherche compulsive de drogues.
La stimulation du D2R, par le biais de tirs toniques de DA (impliqués dans la motivation), sans tirs phasiques concomitants (impliqués dans l’apprentissage associatif) (142), peut s’opposer à la consommation de drogue par sa modulation des régions du PFC impliquées dans l’autorégulation (149). Il est reconnu que la signalisation dopaminergique via D2R dans le PFC module sa fonction, notamment le contrôle inhibiteur et la flexibilité cognitive, où la signalisation D2R semble dépendre non seulement de Gi mais aussi de Gs (augmentant l’excitabilité des neurones pyramidaux corticaux) (274). En effet, la stimulation optogénétique du cortex prélimbique chez des rats exposés à la cocaïne a empêché la recherche compulsive de cocaïne, alors que son inhibition l’a renforcée (64). De même, l’induction d’une activité tonique dans les neurones DA de la VTA, qui se projettent vers les PFC infralimbique et prélimbique, a réduit l’auto-administration d’éthanol (17). En outre, il a été démontré que la fonction du PFC chez les personnes dépendantes permettait de prédire les résultats cliniques, une connectivité perturbée entre le PFC et les régions striatales étant une constatation constante chez les personnes dépendantes de diverses classes de drogues (326). L’importance de la régulation de l’activité striatale par le PFC dans le phénotype de la dépendance chez les rongeurs a été récemment démontrée dans une étude optogénétique qui a montré qu’une connectivité accrue entre le PFC [probablement le PFC infralimbique (192)] et le striatum dorsal prédisait l’autostimulation compulsive des neurones DA de la VTA malgré la réception de chocs électriques nocifs (254). Dans cette étude, l’inhibition optogénétique des terminaux de projection de l’OFC dans le striatum dorsal a inhibé l’auto-administration compulsive. Les projections distinctes des différentes régions du PFC vers le striatum dorsal et ventral expliquent probablement pourquoi, contrairement à ces résultats, la stimulation optogénétique du PFC prélimbique a diminué la consommation compulsive de cocaïne, alors que son inhibition l’a augmentée (64). En tant que tel, le PFC a été la cible d’interventions de stimulation magnétique transcrânienne (TMS) (ENCADRE 3) et de stimulation électrique transcrânienne directe (tDCS) (ENCADRE 4) pour le traitement du SUD, la plupart d’entre elles ayant ciblé le DLPFC. Le PFC est également la cible d’interventions comportementales visant à renforcer les fonctions exécutives et à réduire la saillance incitative des drogues et des indices de drogues, en partie par l’exposition à des renforçateurs alternatifs comme moyen de faciliter et de soutenir le rétablissement.
La TMS comme traitement potentiel de la toxicomanie
La TMS est une technique non invasive susceptible de réduire les changements neurophysiologiques (et comportementaux) à long terme induits par la consommation chronique de drogues. Bien qu’il soit prématuré de juger de son efficacité, les premiers résultats sont encourageants. Par exemple, dans une étude pilote (ouverte), la TMS à haute fréquence (excitatrice) délivrée au DLPFC gauche de patients souffrant de troubles liés à la consommation de cocaïne a conduit à des réductions significatives de la consommation et de l’envie de cocaïne (322). D’autres résultats préliminaires soutiennent également l’idée que la TMS pourrait aider les patients à contrôler leurs envies (263, 267) et leur consommation de cocaïne (35). Les quelques études portant sur l’utilisation de la TMS pour le traitement de la dépendance à la méthamphétamine ont donné des résultats prometteurs mais un peu moins cohérents (201, 206, 313). En outre, un essai récent de sevrage tabagique utilisant la TMS ciblant le DLPFC et l’insula, de manière bilatérale, a entraîné une réduction significative de la consommation de cigarettes et des scores de dépendance à la nicotine qui ont agi en synergie avec une thérapie concomitante d’exposition à des indices (88). Il est clair que des recherches supplémentaires et des études cliniques de plus grande envergure seront nécessaires pour identifier la source de certains résultats contradictoires (98), optimiser les paramètres de la TMS pour différentes indications et déterminer le plein potentiel thérapeutique de la TMS dans la dépendance. Cependant, les propriétés antidépressives évidentes de la TMS à haute fréquence sur le DLPFC gauche (45, 260) et les promesses de la TMS à basse fréquence (sur l’OFC ou l’aire motrice supplémentaire) pour le traitement des troubles obsessionnels compulsifs (22) soulignent son potentiel thérapeutique pour l’addiction, qui partage des caractéristiques nosologiques clés avec ces conditions. Pour ces raisons, la TMS est également apparue comme une technique prometteuse pour traiter les patients souffrant d’une comorbidité de SUD et d’autres maladies mentales (73, 325, 331).
La tDCS comme traitement potentiel de la dépendance
La tDCS est une technique alternative de modulation cérébrale non invasive à potentiel thérapeutique, dans laquelle une partie (difficile à évaluer) du courant pénètre à travers le cuir chevelu et affecte l’excitabilité corticale. Six des sept études sur la tDCS ont constaté des réductions significatives de l’envie ou de la consommation d’alcool après le traitement, tandis que cinq des huit études ont constaté des réductions significatives de l’envie et/ou de la consommation de nicotine (examinées dans la Réf. 70). Seules deux études de preuve de principe ont examiné la tDCS ciblant le PFC pour réduire la cocaïne (18, 80) et bien que les résultats aient été positifs, la taille des échantillons était trop petite (11 et 17 sujets, respectivement) et une réplication est nécessaire. Des réductions de l’envie de fumer ont également été signalées dans une étude portant sur 20 héroïnomanes traités par tDCS ciblant la zone fronto-temporale-pariétale (350). De même, une tDCS bilatérale ciblant le DLPFC de consommateurs de méthamphétamine a significativement réduit le craving tout en modulant la connectivité fonctionnelle des réseaux cérébraux (DMN, contrôle exécutif et saillance) (292).
Des études de neuro-imagerie suggèrent que les effets thérapeutiques de la tDCS (ainsi que de la TMS) pourraient être médiés par sa capacité à moduler la DA (69) dans certaines des zones du cerveau où une dysrégulation de la DA pourrait conduire à une altération des fonctions exécutives et de la récompense (113). Cependant, il reste encore beaucoup à faire pour comprendre les mécanismes d’action des techniques de stimulation transcrânienne et leur potentiel dans le traitement de la dépendance, y compris l’optimisation des protocoles thérapeutiques (fréquence de stimulation, dosage, emplacement) et la possibilité d’interventions personnalisées basées sur le dysfonctionnement spécifique des circuits cérébraux de l’individu dépendant.
D. Humeur négative et réactivité au stress
Une composante importante de l’état de dépendance est le changement de comportement qui est généralement observé, de la recherche de la récompense pour sa valeur de renforcement positif à la recherche de la récompense pour éviter le renforcement négatif (338). Cet état, qui a été décrit comme le “côté obscur” de la dépendance, est le plus évident pendant le sevrage aigu de la drogue et est associé à un risque élevé de rechute comme moyen d’échapper temporairement à l’expérience d’une détresse intense et d’une émotivité négative (184). Cette détresse est associée à une réduction de la signalisation de la DA en réponse aux récompenses (anhédonie), mais aussi à une sensibilité accrue du système de stress du cerveau, y compris l’amygdale étendue, l’habenula et l’hypothalamus (183, 273). Des états émotionnels négatifs ont été caractérisés chez l’homme pendant une abstinence aiguë et prolongée de toutes les principales drogues d’abus (8), un phénomène constamment reproduit dans les études animales (examinées dans la Réf. 183) qui contribue à la nature récidivante de la toxicomanie et probablement aussi à sa forte comorbidité avec la dépression, l’anxiété et la suicidalité (1, 276).
Tout comme les facteurs de stress typiques, tels que la négligence dans l’enfance (122), l’exposition aiguë aux drogues active l’axe hypothalamus-hypophyse-surrénale (HPA) par l’intermédiaire du facteur de libération de la corticotrophine (CRF) (examiné dans la Réf. 273), qui stimule la production d’ACTH dans l’hypophyse antérieure et, en second lieu, de cortisol par le cortex surrénalien. À son tour, l’activation de l’axe HPA influence les circuits cérébraux impliqués dans la récompense de la drogue et l’acquisition d’un comportement de recherche de drogue. Le stress induit une réintégration du comportement de recherche de drogue dans les modèles animaux de consommation de drogue, ce qui illustre le lien entre les systèmes de récompense et de stress (221). Les molécules impliquées dans la régulation de la réintégration induite par le stress comprennent le CRF, la norépinéphrine, la DA, le glutamate, la dynorphine, l’hypocrétine, le neuropeptide Y et d’autres (221). Ces messagers agissent sur différents sites, notamment le noyau du lit de la strie terminale (BNST), l’amygdale centrale, la VTA, la NAc, l’habenula (38, 266), le raphé dorsal, le locus coeruleus et plusieurs régions du PFC (221). L’activation du CRF peut traduire un événement aversif (par exemple, une défaite sociale, un choc au pied) en augmentations robustes de DA dans la NAc, ce qui, bien qu’apparemment paradoxal, reflète le fait que le CRF agit sur un sous-ensemble spécifique de neurones DA de la VTA (158) qui sont accordés à des stimuli aversifs plutôt que gratifiants (159).
E. Conscience intéroceptive
Le passage d’un comportement flexible et orienté vers un but à un comportement réflexe et compulsif est également influencé par les entrées interoceptives et extéroceptives. L’insula, en particulier sa région la plus antérieure, joue un rôle majeur dans l’intéroception en captant et en intégrant des informations sur l’état physiologique interne (dans le contexte d’une activité en cours) et en les transmettant à l’ACC, au striatum ventral et au PFC médian ventral pour déclencher des réponses adaptatives (256). La communication bidirectionnelle entre l’insula et ces régions limbiques suggère un rôle dans l’intégration des informations autonomes et viscérales (y compris les informations transmises par le nerf vagal au nucleus tractus solitarius) avec les informations émotionnelles et motivationnelles qui permettent la prise de conscience des pulsions internes.
L’importance de l’insula dans la dépendance est apparue pour la première fois lors d’une étude fondamentale qui a montré que des fumeurs souffrant de lésions insulaires (dues à un accident vasculaire cérébral) étaient capables d’arrêter de fumer avec une facilité remarquable, sans état de manque ni rechute (243). Depuis, de nombreuses études d’imagerie ont montré une activation différentielle de l’insula antérieure lors de l’envie de nicotine (236), de cocaïne (278) et d’alcool (285) et de l’insula moyenne lors de l’envie de cocaïne et de cigarettes (20, 216). En tant que telle, la réactivité insulaire a été proposée comme biomarqueur potentiel du risque de rechute (164) et comme cible pour la TMS et la tDCS dans le traitement de la dépendance (94, 218) (ENCADRÉS 3 et 4).
L’engagement accru des processus interoceptifs dans l’addiction recrute également le réseau du mode par défaut (DMN), qui est également modulé par la DA (242, 327). Le DMN est impliqué dans la conscience de soi et le vagabondage, et son activation accrue dans l’état addictif pourrait rediriger une attention exagérée vers l’état interne de manque ou d’inconfort. Il n’est pas surprenant que des études d’imagerie aient révélé que la dépendance est associée à des troubles dans les régions qui font partie du DMN ainsi qu’entre le DMN et d’autres réseaux cérébraux fonctionnels (364). Il s’agit notamment d’études montrant une perturbation de l’activité ou de la connectivité de l’ACC (qui fait partie du DMN antérieur) et de l’insula (202, 243). En outre, des études de neuro-imagerie ont également révélé des altérations dans le précuneus (augmentation de l’activation aux indices prédictifs de la drogue et de la connectivité), une région clé du DMN postérieur impliquée dans la conscience interne de la perception des stimuli environnementaux (extéroception) et dans l’auto-surveillance chez les personnes dépendantes (84).
5. FACTEURS DE VULNÉRABILITÉ
L’exposition répétée à une drogue d’abus est une condition préalable au développement de la toxicomanie, mais sa manifestation clinique manifeste dépend fortement de facteurs biologiques, environnementaux et psychosociaux qui interagissent entre eux.
A. Génétique et épigénétique
Les variations génétiques jouent un rôle important dans l’établissement des différences interindividuelles dans le risque de dépendance. Des études axées sur la variabilité entre frères et sœurs identiques et non identiques ont abouti à une estimation approximative d’environ 50 % de la contribution des différences génétiques au risque global d’addiction. Des études génétiques ont fait état d’un chevauchement des variantes génétiques qui influencent le risque vis-à-vis de différentes classes de drogues (332), et la plus grande étude réalisée à ce jour sur 1,2 million d’individus pour évaluer les gènes communs à la consommation d’alcool et de nicotine a identifié des gènes impliqués dans la neurotransmission dopaminergique et glutamatergique, des gènes impliqués dans la transcription et la traduction, ainsi que dans le développement du cerveau (205). Ils ont également révélé qu’un important facteur génétique contribuant aux SUD semble agir par le biais d’un mécanisme sous-jacent général (c’est-à-dire une prédisposition partagée) qui influence la vulnérabilité aux troubles caractérisés par des tendances pathologiques à violer les normes sociales ou à adopter des comportements oppositionnels (regroupés sous le nom de troubles à tendance extériorisante) (178), établissant un lien avec le concept hétérogène désigné sous le nom d’impulsivité (87). Cependant, une vulnérabilité génétique commune a également été signalée pour les SUD et les troubles de l’intériorisation (282), ce qui explique la comorbidité fréquente entre les SUD et l’anxiété et la dépression (207, 268). Outre ces facteurs génétiques communs, des études ont également identifié des variantes génétiques qui sont pour la plupart spécifiques à une drogue donnée. Les variantes génétiques les plus remarquables sont celles qui codent pour les enzymes alcool déshydrogénase (ADH) et aldéhyde déshydrogénase (ALDH), qui entraînent une altération du métabolisme de l’alcool et protègent contre l’alcoolisme (74).
De multiples études d’association à l’échelle du génome (GWAS) ont permis d’identifier des variantes génétiques associées à des toxicomanies spécifiques (28, 143, 279) (voir le tableau supplémentaire 1 ; https://github.com/rubenbaler/PRV-00014-2018R1/blob/master/ST.1.docx). Cependant, comme d’autres troubles biocomportementaux complexes, la toxicomanie est une maladie polygénique qui dépend probablement de plusieurs gènes et réseaux génétiques (205, 229). Les variantes génétiques associées à la dépendance peuvent avoir un impact sur le risque d’abus et de dépendance par le biais d’influences directes ou indirectes sur les systèmes de neurotransmetteurs, les voies métaboliques des drogues, les circuits neuronaux, la physiologie cellulaire, le développement du cerveau, les personnalités et les traits de caractère (par exemple, la recherche de nouveauté, l’impulsivité) qui influencent les réponses comportementales aux stimuli de l’environnement. Bien que la recherche génétique sur la dépendance ne se soit pas encore traduite par de nouvelles thérapies pour les SUD (105, 199, 261), des progrès constants ont été réalisés dans l’identification de biomarqueurs génétiques ayant un potentiel translationnel pour la dépendance à la nicotine (21, 29) et les troubles liés à l’utilisation d’opioïdes (OUD) (32). Étant donné que le contexte génétique peut modifier considérablement l’expressivité phénotypique de différents ensembles de gènes, des études sont nécessaires pour identifier les loci modificateurs dans diverses populations et les modifications épigénétiques qui les régulent (104, 261, 264). En outre, les découvertes génétiques offrent des indices sur les réseaux moléculaires qui pourraient sous-tendre les associations avec la dépendance, élargissant ainsi l’éventail des cibles potentielles pour le développement de thérapies. Ces résultats, associés aux analyses de biologie des systèmes qui examinent les interactions gène × gène, gène × environnement et gène × environnement × développement, constituent des stratégies prometteuses pour la mise au point de traitements et l’identification de biomarqueurs.
Les études génétiques ont permis de mieux comprendre les processus neurobiologiques impliqués dans la dépendance. Par exemple, la découverte qu’un polymorphisme du récepteur nicotinique α5 est associé à un risque accru de dépendance à la nicotine a attiré l’attention sur le rôle de l’habénula, qui présente une concentration substantielle de récepteurs nicotiniques α5 (197) et également de MOR (118). Cela a révélé que l’habénula n’est pas seulement impliquée dans la dépendance à la nicotine, mais qu’elle participe également aux états affectifs négatifs associés à l’utilisation chronique de diverses drogues d’abus, y compris l’alcool (174) et les opioïdes (222).
Notre meilleure compréhension de la manière dont les modifications épigénétiques régulent l’augmentation ou l’inhibition de l’expression des gènes a également conduit à des études qui commencent à caractériser les effets des drogues sur les marques épigénétiques dans diverses régions du cerveau ainsi que leur implication dans le processus de dépendance (261, 347). On peut dire que la plupart des informations proviennent d’études axées sur les effets d’une exposition répétée à la cocaïne sur la méthylation de l’ADN et les modifications post-traductionnelles des protéines histones qui régulent l’accessibilité de l’ADN à la machinerie de transcription via un processus dynamique de remodelage de la chromatine. Par exemple, l’administration systémique de butyrate de sodium, un inhibiteur général de l’histone désacétylase (HDAC), facilite l’extinction d’une préférence de place conditionnée par la cocaïne dans un modèle murin de dépendance (219). Ce résultat est cohérent avec des études antérieures montrant que certains des effets comportementaux de la cocaïne chronique sont associés au recrutement des HDAC pour réduire l’acétylation des histones et l’activité des gènes (270). Certains des effets de la drogue dans la modulation de l’expression des gènes sont plutôt généralisés, tandis que d’autres sont spécifiques à un gène et/ou à un paradigme. Par exemple, dans le striatum, l’hyperacétylation de H4 à des endroits spécifiques de la chromatine le long du promoteur du gène cFos (avec son activation transcriptionnelle concomitante) se produit après une administration aiguë mais non chronique de cocaïne. En revanche, l’hyperacétylation de H3 au niveau des promoteurs des gènes Bdnf et Cdk5 (avec leur activation transcriptionnelle concomitante) est observée après l’administration chronique mais non aiguë de cocaïne. Il est intéressant de noter que les niveaux d’acétylation H4 et H3 ont augmenté dans l’enveloppe du NAc (et non dans le noyau) après une auto-administration chronique mais non aiguë de cocaïne (190). Les changements épigénétiques semblent contribuer à différentes composantes de la trajectoire de la dépendance qui pourraient servir à découvrir de nouveaux candidats pour le développement de médicaments. Cependant, toute manipulation ciblée des marques épigénétiques à des fins thérapeutiques est actuellement une perspective lointaine et difficile.
B. Le développement
Le passage de l’exposition initiale à la drogue à la consommation répétée, puis à la dépendance, dépend dans une large mesure de l’âge et du stade de développement. Si l’exposition à la drogue modifie les fonctions cérébrales, les résultats de cette interaction changent en fonction des processus de développement et de vieillissement en cours (126, 150). Certains âges et certaines périodes du développement (par exemple, le fœtus, l’enfance et l’adolescence) sont caractérisés par des changements plus importants ou plus rapides que d’autres et, par conséquent, l’exposition à des drogues ou à des stimuli environnementaux défavorables au cours de ces périodes critiques peut avoir des conséquences désastreuses sur le développement normal du cerveau et la vulnérabilité à la dépendance. Un facteur essentiel de la vulnérabilité des adolescents aux comportements à risque, y compris la prise de drogues, est lié au fait que les circuits du PFC, nécessaires à l’autorégulation, ne sont pas complètement développés avant le début de l’âge adulte (127). Les fondements neurobiologiques de cette transition critique ne sont pas entièrement compris, mais un aperçu des événements importants et malléables au cours du développement du cerveau commence à émerger.
Par exemple, la période prolongée englobant l’enfance et l’adolescence est caractérisée par une augmentation du volume et de l’organisation de la matière blanche (195), tandis que la matière grise corticale présente une courbe bimodale, augmentant en volume jusqu’au début de l’adolescence, puis commençant à diminuer à nouveau (127). La maturation cérébrale est également associée à une capacité accrue à synchroniser les oscillations neuronales dans plusieurs bandes de fréquence (329), et les trajectoires de ces processus sont prédictives des performances cérébrales et des capacités cognitives (83, 179, 329). Les drogues peuvent perturber ces processus, un effet qui a été le plus largement étudié en association avec la consommation d’alcool (139, 307) et de cannabis (19, 100, 302). Les retards de maturation des réseaux du PFC dus à l’exposition aux drogues, à la génétique ou à la privation sociale semblent augmenter les comportements à risque chez les adolescents (y compris la consommation de drogues). En effet, des études d’imagerie cérébrale chez les adolescents ont commencé à associer des anomalies de la fonction et de la structure du PFC à un risque plus élevé de SUD, ce qui est cohérent avec le rôle du PFC dans l’autorégulation et sa perturbation en tant que facteur contribuant à la vulnérabilité à la consommation de drogues (170, 216).
C. Environnement social
Les études épidémiologiques ont toujours reconnu que les environnements caractérisés par un niveau élevé de facteurs de stress social et un faible soutien social (16, 48, 50, 330), ainsi que par un accès facile aux drogues (115, 124, 125) et l’absence de renforçateurs alternatifs (180), entraînent un risque élevé d’expérimentation des drogues et de dépendance. Les études neuroscientifiques ont commencé à dévoiler comment les environnements sociaux défavorables et le manque d’opportunités affectent le cerveau humain (46) et pourquoi les stades précoces du développement peuvent être les plus sensibles à ces influences néfastes. Il est désormais reconnu que le développement du cerveau est influencé non seulement par des facteurs génétiques, mais aussi par des expositions environnementales (81, 181, 303). Des environnements sociaux défavorables pendant la petite enfance ont été systématiquement associés à un retard de maturation de la connectivité préfrontale-limbique (133). Par exemple, les enfants ayant des antécédents d’adversité précoce présentent un couplage atypique entre l’amygdale et le PFC médian. Ce schéma de connectivité anormal est en partie dû à l’action de l’hormone du stress, le cortisol (121), et contribue probablement à l’augmentation de l’impulsivité (101) et du risque de SUD (233). Le type de stress social persistant qui peut être déclenché par un rang inférieur chez les primates non humains (237) ou par des systèmes de soutien social médiocres chez l’homme (355) a été associé à une réduction de l’expression du D2R striatal et à un risque plus élevé d’impulsivité et de consommation de drogues (223, 237, 355). Et, comme nous l’avons déjà mentionné, l’accès facile aux drogues est un facteur essentiel de l’expérimentation précoce et de la consommation répétée de drogues (115, 124, 125). Les résultats d’études animales (55, 288) et humaines (60, 309) fournissent des preuves irréfutables que lorsque l’exposition aux drogues a lieu pendant l’enfance ou l’adolescence, elle peut interférer avec les trajectoires de développement du cerveau, exacerbant ainsi les conséquences négatives (72).
Afin de mieux cerner les effets de l’exposition précoce aux drogues et de l’environnement social sur les trajectoires de développement du cerveau, le National Institute on Drug Abuse et le National Institute on Alcohol Abuse and Alcoholism, en collaboration avec d’autres instituts des National Institutes of Health, ont récemment lancé l’étude Adolescent Brain Cognitive Development (ABCD), Cette étude suivra plus de 10 000 jeunes aux États-Unis lors de leur passage de l’enfance à l’adolescence puis à l’âge adulte, tout en surveillant leur santé physique et mentale, leur neurocognition, leur environnement social, leur consommation de substances, leurs biomarqueurs génétiques et autres, ainsi que le développement structurel et fonctionnel de leur cerveau (167).
6. Implications cliniques
A. La prévention
Les données probantes suggèrent que la prévention des SUD doit comprendre des composantes universelles (TABLEAU 3), y compris le renforcement des facteurs de protection (p. ex. le soutien parental, l’éducation) et l’inversion ou la réduction des facteurs de risque (p. ex. un comportement déviant, des pairs qui consomment de la drogue, la négligence sociale) (10, 148) et devrait viser toutes les formes de mésusage des drogues, y compris la consommation avant l’âge de drogues légales (p. ex. le tabac ou l’alcool), de drogues d’ordonnance (p. ex. les médicaments stimulants) et de drogues illicites (230). Ces programmes peuvent être mis en œuvre au sein de la famille, de l’école et/ou de la communauté.
[TABLEAU 1]
En outre, les interventions de prévention sur mesure devraient tenir compte des circonstances spécifiques des personnes à haut risque, y compris les personnes souffrant d’autres maladies mentales ou de conditions défavorisées spécifiques. Le renforcement de la maîtrise de soi est un exemple d’intervention personnalisée prometteuse. Lorsqu’elle est évaluée tôt dans la vie, une faible maîtrise de soi est une caractéristique personnelle prédictive d’une plus grande vulnérabilité aux SUD, ainsi que d’une plus mauvaise santé physique, d’une richesse économique plus faible et d’une plus grande implication dans la criminalité (233). Il est important de noter que diverses approches de formation ont été identifiées pour aider à améliorer la maîtrise de soi et d’autres dimensions de la fonction exécutive lorsqu’elles sont mises en œuvre chez les enfants d’âge scolaire ; leur utilité lorsqu’elles sont appliquées aux adultes n’est toutefois pas claire (116). Les approches efficaces comprennent des programmes socio-émotionnels et d’alphabétisation (283), l’éducation musicale (165) et des programmes sportifs spécifiques conçus pour renforcer les compétences individuelles et promouvoir le plaisir (162). Un rapport de synthèse récent dresse un tableau prometteur des avantages de ces interventions pour l’amélioration des circuits de contrôle de soi et leur fonction en tant que stratégie de prévention universelle (241). Une autre intervention de prévention prometteuse est l’utilisation de la formation à la pleine conscience pour améliorer la maîtrise de soi, la régulation émotionnelle et la réactivité au stress, qui pourrait également être exploitée à des fins thérapeutiques (voir Réf. 321 et ci-dessous). Un développement passionnant dans la recherche sur la prévention est le rapport récent selon lequel une parentalité positive (c’est-à-dire un style parental de soutien renforcé) peut surmonter les effets négatifs de la pauvreté de l’enfance sur le développement du cerveau (43). Cette intervention, un essai randomisé du programme “Strong African American Families” auprès de parents et de leurs enfants de 11 ans, a atténué les réductions de volumes cérébraux spécifiques (par exemple, le gyrus denté gauche et les sous-champs hippocampiques CA3 et l’amygdale gauche) précédemment associées à la pauvreté infantile (212). Ce résultat suggère qu’une meilleure prise en charge précoce (comme le soutien parental) pourrait contribuer à atténuer certains des effets néfastes d’environnements sociaux défavorables (43).
Plusieurs études ont également montré qu’il est possible de cibler la réactivité anormale au stress chez les enfants touchés par l’adversité précoce et d’en atténuer l’impact. Par exemple, des études portant sur des enfants présentant un risque de développement (placés dans des familles d’accueil, maltraités ou ayant souffert de la dépression ou du décès de leurs parents) montrent systématiquement que les interventions psychosociales (environnement enrichi, formation des soignants/parents) peuvent abaisser les niveaux de cortisol vers la fourchette observée dans un groupe de comparaison à faible risque (304). De même, par rapport à la prise en charge institutionnelle habituelle, un placement familial de haute qualité a eu un impact positif sur l’intégrité de plusieurs voies de la substance blanche (27), y compris celles de la capsule externe et du corps calleux, dont les anomalies ont été associées à l’émergence de symptômes d’intériorisation liés à la négligence au milieu de l’enfance ou au début de l’adolescence (26).
B. Traitement
Les médicaments approuvés pour le traitement des SUD se limitent aux troubles liés à la consommation d’opiacés, de nicotine et d’alcool (TABLEAU 4). Plusieurs candidats prometteurs pour le traitement des stimulants et de l’OUD font l’objet d’essais cliniques (voir TABLEAU supplémentaire 2 ; https://github.com/rubenbaler/PRV-00014-2018R1/blob/master/ST.2.docx), bien que la plupart des recherches en soient encore au stade préclinique. D’autre part, la caractérisation des différents circuits neuronaux perturbés dans la dépendance les identifie comme des cibles appropriées pour des interventions personnalisées. Par exemple, le renforcement des circuits fronto-corticaux de contrôle de soi pourrait aider à prévenir les rechutes (130, 320). L’amygdale/l’hippocampe (médiateur des émotions, de l’humeur et de la réactivité au stress) et l’insula (responsable de l’intégration et de la traduction des signaux interoceptifs) sont également des cibles pertinentes pour le traitement de l’addiction (246, 339).
[TABLEAU 4]
Ces résultats pourraient être traduits dans la prochaine génération d’interventions non médicamenteuses (par exemple, formation comportementale ciblée, modulation non invasive) conçues pour accroître l’efficacité des réseaux de contrôle en tant que moyen de traiter la dépendance, même chez les personnes qui n’ont pas l’intention d’arrêter de fumer (320). De même, la TMS ou la tDCS pourraient s’avérer utiles pour réduire l’envie de fumer en modulant l’activité insulaire (ENCADRÉS 3 et 4). Enfin, des données expérimentales suggèrent que les techniques basées sur la pleine conscience peuvent avoir un impact positif sur les processus cognitifs (319) et atténuer les comportements addictifs (97, 200, 321, 358). En effet, des données d’imagerie préliminaires montrant que la pleine conscience activait l’amygdale, le striatum, l’ACC, le PFC et l’insula, qui sont des régions qui modulent l’émotion, l’autorégulation et l’intéroception, soulignent son potentiel prometteur dans le traitement des addictions (319).
7. CONCLUSIONS
Des avancées significatives dans le domaine des neurosciences nous ont permis de comprendre les effets des drogues sur le cerveau qui entraînent une dépendance, ce qui a conduit à reconnaître que la dépendance est un trouble cérébral chronique qui devrait être traité comme n’importe quelle autre affection médicale. De même, notre meilleure compréhension des processus neurobiologiques associés à la vulnérabilité à l’expérimentation de drogues et aux SUDs, y compris les effets de l’exposition à des conditions environnementales défavorables, nous aide à redéfinir notre réflexion sur les interventions de prévention adaptées aux personnes à risque. Cependant, il reste encore beaucoup à faire pour saisir la complexité des effets des drogues et des autres récompenses dans notre cerveau, pour comprendre comment ils interagissent et comment ils motivent en fin de compte le comportement.