Frank, G. K., DeGuzman, M. C., & Shott, M. E. (2019). Motivation to eat and not to eat–The psycho-biological conflict in anorexia nervosa. Physiology & behavior, 206, 185-190.
Abstract
L’anorexie mentale est une maladie psychiatrique grave avec un taux de mortalité élevé. La recherche en imagerie cérébrale a indiqué une altération des circuits de récompense dans ce trouble. Nous proposons ici un modèle de maladie pour l’anorexie mentale, étayé par des études récentes, qui intègre des facteurs psychologiques et biologiques. Dans ce modèle, nous proposons qu’il y ait un conflit entre la motivation consciente de restreindre l’alimentation et la motivation motivée par l’homéostasie corporelle d’approcher la nourriture en réponse à la perte de poids. Ces motivations opposées déclenchent de l’anxiété, ce qui entretient le cercle vicieux de la restriction énergétique et de la perte de poids.
1. Introduction
Lors de la réunion annuelle 2018 de la Society for the Study of Ingestive Behaviors à Bonita Springs, nous avons présenté des données récentes de notre groupe sur le traitement cérébral de la récompense dans l’anorexie mentale (AN). Ici, nous fournissons un contexte à ces études et présentons un modèle pour le cercle vicieux de la restriction alimentaire et de la perte de poids qui se produit dans l’AN malgré un poids insuffisant.
2. Présentation clinique de l’anorexie mentale (AN)
L’AN est la troisième maladie chronique la plus fréquente chez les adolescentes. Elle présente le taux de mortalité le plus élevé parmi les troubles psychiatriques, la plupart des décès survenant entre 16 et 29 ans [[1], [2], [3]]. L’AN est associé à une émaciation sévère due à une restriction de l’apport alimentaire et à une perception de surpoids en dépit d’une grave insuffisance pondérale [4]. Ce trouble présente une interaction complexe entre des facteurs neurobiologiques, psychologiques et environnementaux [5], et il s’agit d’un trouble chronique avec des rechutes fréquentes, des coûts de traitement élevés et une lourde charge de morbidité [6,7]. L’efficacité des traitements est limitée [8] et aucun médicament n’a été approuvé pour l’AN [9]. Pourtant, on sait peu de choses sur la physiopathologie ou les biomarqueurs cérébraux qui caractérisent l’AN [10]. Les efforts croissants pour identifier les mécanismes biologiques qui affectent le comportement dans l’AN sont d’une importance capitale pour acquérir une compréhension plus complète du trouble et pour développer des traitements pharmacologiques [11,12].
3. Le conflit central de l’anorexie mentale
Le spectre des individus qui développent un AN est large. Il peut s’agir d’adolescents qui font simplement plus d’exercice pour être plus compétitifs en sport ou qui essaient de manger plus sainement, ou d’individus qui ont été traumatisés et qui ont eu des problèmes d’image corporelle tout au long de leur vie, et pourtant, ils développent tous l’AN avec les mêmes caractéristiques de base. Bien que ces personnes aient suivi des voies différentes pour développer l’AN, elles ont toutes en commun un décalage entre leur motivation consciente pour manger – ou plutôt pour restreindre leur consommation de nourriture – et le besoin du corps de rester à un poids sain et durable. Nous résumerons ici les recherches récentes de notre groupe, qui étudie les processus motivationnels de la prise alimentaire dans l’AN, ainsi que d’autres recherches humaines et fondamentales, afin de développer un modèle psycho-biologique expliquant comment les comportements de base de l’AN se développent et contribuent à un cycle continu de perte de poids. Au cœur de ce modèle se trouve le conflit entre la motivation consciente de restreindre l’alimentation et les messages inconscients des mécanismes de maintien de l’homéostasie corporelle, y compris les circuits de récompense et les systèmes neuroendocriniens, qui incitent à rechercher de la nourriture et à conserver un poids corporel sain. Il s’agit d’un modèle fondé sur des données qui intègre la biologie cérébrale étudiée de manière empirique avec le comportement mesuré et la prise de poids observée dans le cadre du traitement.
4. L’anorexie mentale est associée à une altération du fonctionnement des circuits neuroendocriniens et cérébraux de la récompense.
Au cours de l’AN, une multitude de changements se produisent dans les circuits de régulation de l’appétit. Bien que les résultats ne soient pas tous uniformes, la leptine, marqueur de la graisse corporelle, est faible, la ghréline, hormone stimulant l’appétit, est élevée, tout comme les marqueurs du stress que sont le cortisol et le facteur de libération de la corticotropine, et le niveau d’ocytocine, réduisant l’appétit, est faible en cas d’AN [13]. Si les hormones et les peptides qui participent à la régulation de l’homéostasie corporelle s’adaptent à l’état nutritionnel aigu et se normalisent généralement avec la reprise de poids, ils peuvent jouer un rôle important dans la modulation du circuit cérébral de la récompense [14].
Le système de récompense du cerveau est un circuit bien étudié qui a été supposé prometteur en tant que cible pour de futures interventions thérapeutiques dans les troubles alimentaires, y compris l’AN [14]. La voie gustative est particulièrement importante pour l’alimentation et la récompense alimentaire. Elle projette les signaux des récepteurs gustatifs de la langue vers l’insula, qui contient le cortex gustatif primaire, en passant par le thalamus [15]. Le système de récompense reçoit d’autres informations des régions corticales frontales sur les désirs de consommer des aliments, et il est relié à l’hypothalamus pour intégrer les signaux provenant de la périphérie du corps, tels que les niveaux de sucre dans le sang, afin de réguler la prise alimentaire et de maintenir l’homéostasie énergétique de l’organisme [16]. La perception gustative conduit à des associations apprises entre le goût et les expériences hédoniques subjectives pour créer une représentation cognitive et émotionnelle interne des stimuli alimentaires qui s’active lorsque nous voyons, sentons ou goûtons un aliment [17]. Ces associations fournissent des signaux d’apprentissage médiés par la dopamine aux régions cérébrales d’ordre supérieur afin de comparer l’expérience actuelle (alimentaire) avec l’expérience passée et de stocker de nouvelles informations, ou de mettre à jour des informations précédemment stockées, sur la valeur que nous accordons à un stimulus alimentaire particulier. Cela permet de soutenir le processus de prise de décision concernant le type et la quantité d’aliments que nous aimerions manger à l’avenir [18,19]. Les circuits décrits ci-dessus pour motiver la prise alimentaire sont liés au signal interoceptif de la satiété, et une variété d’hormones intestinales et de neuropeptides, ainsi que des régions cérébrales spécifiques, contribuent à ce signal pour réguler l’alimentation [20,21].
Un nombre croissant d’études d’imagerie cérébrale fonctionnelle ont révélé une activation altérée des régions cérébrales chargées du traitement de la récompense dans l’AN. L’hypothèse a été émise que ces anomalies, associées à des traits anxieux, pourraient contribuer à la physiopathologie cérébrale spécifique de l’AN et conduire à des extrêmes de restriction alimentaire [22]. Les études sur la récompense cérébrale dans l’AN ont appliqué divers paradigmes utilisant par exemple des images de nourriture pour étudier la réponse émotionnelle ou hormonale [23].
Notre laboratoire s’est concentré sur la fonction dopaminergique du cerveau pour étudier les circuits de récompense altérés dans l’AN. Les voies de la dopamine sont un système neuromodulateur qui prend naissance dans les cellules du mésencéphale [24]. Ces neurones du mésencéphale libèrent de la dopamine qui agit sur les récepteurs corticaux et sous-corticaux de la dopamine. La fonction dopaminergique contribue à la modulation de l’activité motrice [25], des comportements alimentaires [26] et de l’apprentissage par renforcement et récompense [27]. Le système dopaminergique est particulièrement intéressant à étudier, car nous en savons relativement plus sur la dynamique neuronale de son activation que sur celle d’autres systèmes de neurotransmetteurs, et des modèles mathématiques ont été mis au point pour prédire la réponse des neurones dopaminergiques lors de la présentation de stimuli gratifiants ou saillants [28,29].
Le système dopaminergique s’adapte en sens inverse aux extrêmes de la prise alimentaire [[30], [31], [32], [33]]. Des modèles animaux ont montré une activation neuronale accrue de la dopamine après une restriction alimentaire [34,35], ce qui a conduit à l’hypothèse selon laquelle les circuits dopaminergiques cérébraux se sensibilisent dans l’AN lors d’une restriction alimentaire et d’une perte de poids et font partie de sa physiopathologie spécifique [14,22]. La restriction alimentaire sensibilise les récepteurs dopaminergiques D1 et D2/D3 dans les études animales, ce qui suggère qu’il s’agit du mécanisme sous-jacent de l’activation accrue des neurones dopaminergiques en réponse à la perte de poids [36,37].
Dans le passé, un faible taux d’acide homovanillique dans le liquide céphalorachidien, le principal métabolite de la dopamine dans l’AN malade [38], et une disponibilité élevée des récepteurs D2/3 de la dopamine après la guérison [39], suggéraient une altération directe de la fonction dopaminergique dans l’AN, bien qu’un groupe actuellement malade de l’AN ait montré une distribution normale des récepteurs D2/3 de la dopamine [40]. Ces études sur les récepteurs n’ont toutefois pas permis d’obtenir des informations sur les fonctions cérébrales en réponse au comportement ou pendant celui-ci.
Les fonctions cérébrales liées à la dopamine peuvent être étudiées chez l’homme de manière indirecte en utilisant l’imagerie par résonance magnétique fonctionnelle (IRMf) dépendante du niveau d’oxygène dans le sang (BOLD) et les tâches liées au modèle d’erreur de prédiction. Le modèle d’erreur de prédiction est un modèle qui explique comment les neurones dopaminergiques réagissent aux stimuli environnementaux et motivent l’approche des récompenses et l’apprentissage à partir de stimuli gratifiants ou saillants [41]. Les neurones dopaminergiques présentent une poussée d’activation phasique en réponse à la présentation d’un stimulus gratifiant inattendu, et une diminution de l’activité tonique des neurones dopaminergiques en réponse à l’omission inattendue d’un stimulus gratifiant attendu [42]. Ce modèle a été validé pour la première fois chez les rongeurs [43], puis adapté à l’imagerie cérébrale humaine [44,45]. Ces circuits sont associés de manière critique à la fourniture de signaux concernant la présence et l’amplitude des récompenses [16,28], et au codage de la valeur des stimuli de récompense, y compris la valeur métabolique de la nourriture [[46], [47], [48], [49]]. Dans des études antérieures, les adultes atteints d’AN ont montré une réponse d’erreur de prédiction élevée (réponse positive plus forte à la réception inattendue et réponse négative plus forte à l’omission inattendue) aux stimuli gustatifs de saccharose par rapport aux témoins [50,51]. Cette élévation dans les deux sens a été interprétée comme une sensibilisation générale de la réponse neuronale dopaminergique dans l’AN. Cela contraste avec les personnes obèses qui ont montré une réponse d’erreur de prédiction plus faible que les témoins, ce qui confirme l’adaptation du système dopaminergique à la quantité de nourriture ingérée et est cohérent avec la science fondamentale [32,51]. Une augmentation plus faible de la réponse à l’erreur de prédiction chez les AN rétablis depuis longtemps suggère une normalisation progressive de la réponse cérébrale avec le rétablissement de la maladie [52]. En résumé, ces études suggèrent que le traitement de la récompense lié à la dopamine est altéré dans l’AN, ce qui nous a amenés à élargir ces études pour intégrer le comportement et la réponse au traitement à l’activation des circuits cérébraux.
5. Un modèle pour les motivations concurrentes à manger et à ne pas manger dans l’anorexie mentale
Nous avons récemment publié une étude portant sur un grand groupe d’adolescents souffrant d’AN (n = 56) et sur un groupe témoin apparié selon l’âge (n = 52) [53]. Dans cette étude, nous avons appliqué une tâche d’erreur de prédiction de goût comme ci-dessus. Nous avons également étudié la connectivité cérébrale dynamique effective, c’est-à-dire la région du cerveau qui commande une autre région pendant la dégustation du sucre. Le signal d’erreur de prédiction dérivé de l’omission ou de la réception inattendue d’une récompense gustative de saccharose a entraîné une réponse accrue dans l’insula, le striatum et le cortex orbitofrontal chez les AN par rapport aux témoins. Cela a confirmé la réponse élevée à l’erreur de prédiction que nous avions trouvée précédemment dans l’AN. Le signal d’erreur de prédiction du cortex orbitofrontal dans le groupe AN était significativement corrélé positivement avec l’évitement du mal, une mesure d’un trait d’anxiété, qui à son tour était positivement corrélé avec la recherche de minceur et l’insatisfaction corporelle (Fig. 1.). En outre, le signal d’erreur de prédiction est corrélé négativement avec l’augmentation de l’indice de masse corporelle (IMC, poids en kg/taille en m2) pendant le traitement. Le cortisol salivaire était élevé dans l’AN, conformément à d’autres études, et a montré une corrélation positive avec la réponse d’erreur de prédiction. On a donc émis l’hypothèse que le stress et l’augmentation du cortisol qui y est associée peuvent contribuer directement à l’augmentation de la réponse cérébrale à l’erreur de prédiction dans l’AN. Enfin, la réponse à l’erreur de prédiction dans l’AN était positivement corrélée à la connectivité dynamique effective entre le striatum ventral et l’hypothalamus, un circuit induit par l’anxiété qui inhibe rapidement la prise alimentaire [54]. Une autre étude de moindre envergure menée chez des adolescents atteints d’AN et utilisant une tâche d’erreur de prédiction de récompense monétaire a également montré une réponse cérébrale élevée à l’erreur de prédiction ainsi qu’une corrélation négative avec l’augmentation de l’IMC au cours du traitement [55]. Cela suggère que l’augmentation de la réponse à l’erreur de prédiction pourrait être un biomarqueur de l’état de la maladie, indépendant du type de stimulus.
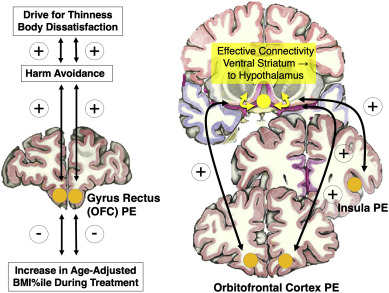
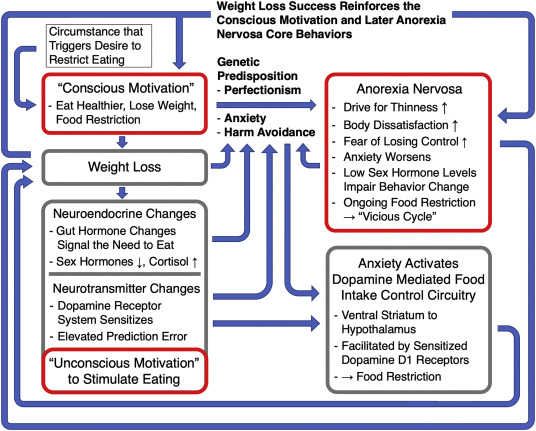
Sur la base de ces données empiriques, nous proposons un modèle pour le cycle continu de restriction énergétique dans l’AN qui intègre des facteurs émotionnels cognitifs tels que la recherche de la minceur, l’insatisfaction corporelle et la peur de prendre du poids, avec les adaptations du corps à la perte de poids qui comprennent des facteurs neuroendocriniens ainsi que les changements dans le système de dopamine du cerveau qui se produisent avec la restriction alimentaire et la perte de poids (Fig. 2.).
5.1 Début du comportement anorexique
L’AN se caractérise par une perte de poids pour diverses raisons. Il peut s’agir d’une perte de poids dans le cadre d’une augmentation de l’exercice physique pour se mettre en forme, d’une alimentation plus “saine” (suppression de certains aliments riches en calories), comme c’est souvent le cas dans les cours de santé au collège, d’individus en surpoids qui souhaitent résolument perdre du poids, d’individus qui ont peut-être été victimes d’abus et qui modifient leur alimentation dans ce contexte, et d’autres raisons encore. Cette “motivation consciente” à changer de comportement alimentaire ou d’exercice physique est ensuite suivie d’une perte de poids. La perte de poids est ensuite associée à l’objectif initial de manger plus sainement, d’être plus en forme ou plus mince, et la prise de poids peut alors être perçue comme une menace pour cet objectif.
5.2 Mécanismes cognitifs et émotionnels sous-jacents
Toutes les personnes qui suivent un régime ou qui font plus d’exercice ne développent pas un AN. Des rapports font état de dynamiques cognitives et émotionnelles sous-jacentes spécifiques, par exemple le sentiment de contrôle, qui motivent la restriction alimentaire dans l’AN, mais on ne sait pas dans quelle mesure ces dynamiques se sont développées dans le cadre de la maladie ou étaient présentes avant la morbidité [56]. Ce que l’on sait, c’est que les personnes qui développent un AN ont tendance à avoir un tempérament anxieux, des traits biologiques tels que l’évitement des dommages et le perfectionnisme, qui peuvent faciliter le développement et le maintien des comportements de base de l’AN [57]. Ces traits qui motivent le désir de faire les choses correctement sont de puissants facteurs de motivation du comportement en général, y compris des comportements liés aux troubles de l’alimentation. La perte de poids, en tant qu’indicateur de réussite, devient alors une récompense conditionnée et un renforçateur cognitif du comportement. L’AN est présent dans les familles et nous postulons une prédisposition génétique pour cette transition de la motivation initiale à changer l’alimentation aux comportements de base de l’AN et à la perte de poids excessive. Nous pensons que des changements cérébraux se produisent et qu’ils sont à l’origine de la préoccupation extrême pour la nourriture, le poids et la forme. Les mécanismes biologiques sous-jacents ne sont pas clairs. Des recherches génétiques récentes ont montré un chevauchement entre les gènes de l’AN et ceux du trouble obsessionnel compulsif, et les deux troubles pourraient partager des mécanismes biologiques qui conduisent à la perpétuation d’un comportement excessif [58]. L’apprentissage d’habitudes a également été supposé faire partie de la physiopathologie de l’AN et il est possible qu’une force d’habitude élevée (le lien entre le stimulus et la réponse comportementale) associée à une connectivité cérébrale frontostriatale accrue contribue à la poursuite des comportements d’AN [[59], [60], [61]].
5.3 Réponse physiologique à la perte de poids
Les modèles animaux ont montré que la réponse normale de l’organisme à la perte de poids est une activation du système d’alimentation, comprenant de nombreuses adaptations des hormones intestinales et des neuropeptides qui signalent à l’hypothalamus les besoins nutritionnels de l’organisme, ainsi qu’une sensibilisation du système dopaminergique pour favoriser l’approche alimentaire [14,16]. La restriction alimentaire est associée à une augmentation du cortisol dans le cerveau, qui affecte la libération de dopamine et la fonction des récepteurs D1 et D2 postsynaptiques de la dopamine [37,54,[62],[63],[64]]. Ces mécanismes de rétroaction corporelle (motivation biologique ou “inconsciente” pour stimuler la prise de poids) contrastent toutefois fortement avec la motivation consciente de restreindre l’apport alimentaire et menacent l’objectif fixé d’une alimentation saine, d’une bonne forme physique, d’une perte de poids, etc. Cela crée un conflit interne et déclenche l’anxiété de perdre le contrôle et de céder à la pulsion alimentaire. L’évitement de la nourriture et la perte de poids réduisent ces craintes, mais seulement brièvement, jusqu’à ce que la peur d’une éventuelle prise de poids domine à nouveau.
5.4 Comportement de l’anorexie mentale chronique
La peur de prendre du poids l’emporte sur les mécanismes corporels qui poussent à la prise de nourriture et la restriction alimentaire se poursuit. Cette boucle de rétroaction positive conduit à une restriction alimentaire continue, à une nouvelle perte de poids, à une nouvelle stimulation de la pulsion alimentaire biologique, suivie d’une anxiété accrue, etc. Pendant l’état d’insuffisance pondérale de l’AN, les mesures des traits anxieux tels que l’évitement des dommages sont élevées et on peut souvent observer que les personnes atteintes d’AN deviennent de plus en plus anxieuses à mesure qu’elles perdent du poids, à l’exception de brefs épisodes de soulagement de l’anxiété lorsqu’elles atteignent un objectif de perte de poids ou lorsqu’elles font de l’exercice [65,66]. Cela confirme l’existence possible d’un mécanisme de renforcement entre les comportements fondamentaux de l’AN et l’anxiété. L’AN est également associé à un faible taux d’hormones gonadiques et la science fondamentale a suggéré que les femmes ayant un faible poids et un faible taux d’hormones sexuelles présentent une altération de l’apprentissage, y compris de l’apprentissage de la récompense [[67], [68], [69], [70]]. Un faible taux d’hormones gonadiques dans l’AN peut donc constituer un facteur neurobiologique qui entrave le changement de comportement et le rétablissement, mais les études spécifiques à l’appui de cette hypothèse chez l’homme restent à faire.
5.5 Données empiriques à l’appui du modèle
Divers facteurs psychosociaux ont été identifiés comme des déclencheurs de l’initiation de l’AN, tandis que des études familiales soutiennent une forte biologie sous-jacente qui prédispose à développer la maladie [71,72]. Les facteurs génétiques qui concernent la fonction des neurotransmetteurs cérébraux dans le contexte d’une insuffisance pondérale ou de troubles comorbides tels que les troubles obsessionnels compulsifs peuvent jouer un rôle important, mais doivent être étudiés plus avant [58,73]. Les comportements de restriction alimentaire se renforcent d’eux-mêmes en cas d’insuffisance pondérale, sont facilités par le stress et l’anxiété et, avec le temps, aggravent le tableau clinique, comme le suggèrent d’autres recherches [[74], [75], [76], [77]]. Des études sur l’homme ont montré que la connectivité frontostriatale, qui a été associée à l’apprentissage des habitudes, était inversement corrélée à la prise alimentaire réelle et pourrait donc être un corrélat biologique de l’apprentissage des habitudes [78]. Les modèles animaux ont confirmé à plusieurs reprises que la perte de poids est associée à des changements physiologiques dans le corps et dans le circuit cérébral de la récompense, y compris la libération de dopamine et la fonction des récepteurs, pour stimuler la prise alimentaire [36,79,80]. Nos études utilisant le modèle d’erreur de prédiction confirment un schéma similaire chez l’homme avec une sensibilité élevée du système de récompense liée à la dopamine associée à une insuffisance pondérale [51,53,55]. La réponse à l’erreur de prédiction était significativement corrélée positivement avec l’anxiété (évitement des dommages) dans notre groupe AN, et cette anxiété était corrélée positivement avec les pensées et comportements fondamentaux des troubles alimentaires, la recherche de la minceur et l’insatisfaction corporelle [53]. En étudiant la connectivité dynamique entre l’hypothalamus et le striatum ventral, nous avons également trouvé des preuves que la réactivité à la dopamine, telle que reflétée par la réponse à l’erreur de prédiction, peut faciliter la restriction alimentaire en cours dans l’AN. L’hypothalamus intègre les informations relatives à l’homéostasie corporelle pour guider l’approche alimentaire, mais un circuit dopaminergique médié par la peur, allant du striatum ventral à l’hypothalamus, a également été identifié comme inhibant la prise alimentaire via les récepteurs D1 de la dopamine [54,81,82]. Nous avons constaté que dans le groupe témoin, l’activité était dirigée de l’hypothalamus vers le striatum ventral, alors que dans le groupe AN, la connectivité dynamique était dirigée du striatum ventral vers l’hypothalamus, et la réponse à l’erreur de prédiction était positivement corrélée à cette connectivité dans l’AN. Nous interprétons ce résultat comme le fait qu’une forte anxiété déclenche un circuit striatum ventral-hypothalamique qui dépend des récepteurs D1 de la dopamine et inhibe la prise alimentaire [54,82]. Les récepteurs dopaminergiques D1 du striatum ventral qui participent à la réponse à l’erreur de prédiction sont déjà sensibilisés par la perte de poids et peuvent être hyperréactifs [37,54,83]. Sur le plan clinique, l’activation de l’erreur de prédiction est inversement corrélée à la prise de poids pendant le traitement. Ceci est en accord avec la corrélation positive entre la réponse à l’erreur de prédiction et la force de connectivité effective du circuit striatal-hypothalamique ventral qui contrôle la prise alimentaire.
5.6 Limites du modèle
Il existe une foule de facteurs endocriniens altérés dans l’AN qui pourraient également interférer avec une alimentation normale et qui ne sont en grande partie pas intégrés dans le modèle en raison du manque de données spécifiques [14]. Dans notre étude, l’anxiété était corrélée à l’insatisfaction corporelle et à la recherche de la minceur, mais nous ne pouvons pas exclure des anomalies intrinsèques de l’intégration corporelle ou de l’intéroception qui peuvent également s’aggraver avec la perte de poids et exacerber la maladie [84]. Les altérations de la structure et de la fonction cérébrales peuvent modifier le traitement de la satiété dans l’AN, ce qui peut faire partie d’un tel modèle et devra être exploré dans de futures études [85,86]. Les renforçateurs cognitifs et émotionnels bien connus qui renforcent l’aspect cognitif du désir de perdre du poids, tels que le feedback de l’environnement, ” tu as perdu du poids, tu as bonne mine “, n’ont pas été évalués dans notre étude. La formation d’habitudes, qui pourrait faire partie de ce modèle pour l’anorexie mentale, n’a pas été mesurée et l’inclusion de ce concept reste conjecturale à ce stade [87]. Le modèle est basé sur des corrélations entre les fonctions cérébrales, les résultats cliniques et le comportement. Pour savoir si les analyses de médiateur ou de modérateur peuvent être appliquées avec succès, il faudra disposer d’un ensemble de données plus important et explorer davantage les différentes variables. La dépression et l’anxiété comorbides peuvent également jouer un rôle essentiel dans la physiopathologie de l’AN et ces effets doivent faire l’objet d’une étude plus approfondie.
6. Implications cliniques
Le modèle présenté ici a plusieurs implications cliniques. Tout d’abord, il fournit un modèle de maladie qui aide les personnes atteintes d’AN ou leurs soignants à mieux comprendre la maladie. Deuxièmement, l’intégration de la biologie cérébrale qui interfère avec le rétablissement accroît l’empathie tant chez les prestataires de traitement que chez les familles ou les soignants, car elle réduit le blâme et l’idée que l’AN est simplement un trouble socioculturel [88]. Troisièmement, le modèle soutient le besoin important de promouvoir l’alimentation et la prise de poids afin de normaliser les motivations inconscientes de la prise de poids, car la normalisation de l’alimentation désensibilise le système d’alimentation. Une étude sur l’AN après un rétablissement à long terme a indiqué un degré élevé de normalisation de la réponse à l’erreur de prédiction, alors que les individus rétablis à court terme présentaient encore des élévations généralisées de ce signal [52,55]. Quatrièmement, le modèle soutient une approche visant à développer d’autres motivations cognitives et émotionnelles. Les stratégies de traitement cognitif remettent généralement en question la volonté de perdre du poids et la motivation pour la perte de poids qui se traduit par une qualité de vie objectivement médiocre et par des admissions en traitement. Développer à nouveau des motivations saines telles que passer du temps avec ses amis, sa famille, etc. et apprendre par l’expérience à profiter de la vie sans la pression constante de la perte de poids est probablement la clé pour que la personne souffrant d’AN puisse commencer à lâcher prise. Cela se fait en remplaçant les comportements motivés par l’AN par des motivations saines et conscientes. Le comportement cognitif ou d’autres formes de psychothérapie ne présentent que des preuves limitées dans le traitement de l’AN, mais de telles stratégies peuvent être utiles lorsque la prise de poids a commencé, et l’engagement d’une motivation consciente intrinsèque est crucial pour un rétablissement durable [89]. Cinquièmement, le modèle soutient une orientation biologique du traitement qui cible le système dopaminergique. La peur de prendre du poids peut être si accablante que l’utilisation de la logique et du raisonnement peut être difficile à mettre en œuvre, et une altération de la fonction dopaminergique du cerveau a été supposée dans l’anxiété et l’altération de la perspicacité dans l’AN [90,91]. L’accent mis sur la gestion des traits de tempérament tels que l’évitement du mal et la sensibilité à la punition peut contribuer à ce processus [92]. La sensibilité élevée du système dopaminergique dans l’AN pourrait suggérer l’utilisation d’un agent bloquant les récepteurs de la dopamine. Cependant, de nombreuses drogues de ce type ont été essayées avec peu de succès, ce qui peut être dû au fait que le cerveau exprime davantage de récepteurs en réponse, ce qui interfère avec l’effet désiré de régulation à la baisse du système [12]. D’un autre côté, les agonistes de la dopamine pourraient être utiles pour soutenir l’apprentissage et le changement de comportement, en particulier chez les femmes en sous-poids et à faible taux d’œstrogènes [93]. Le récepteur D2 de la dopamine a également des effets sur l’homéostasie énergétique, la signalisation de la leptine et la composition corporelle, et des mécanismes métaboliques pourraient également favoriser la prise de poids [[94], [95], [96], [97]]. Nous avons donc commencé à utiliser l’agoniste partiel du récepteur D2 de la dopamine, l’aripiprazole, en partant du principe qu’il pourrait favoriser la psychothérapie et la prise de poids. Des données récentes de notre groupe indiquent que l’aripiprazole peut en fait être bénéfique pour la prise de poids au cours du traitement de l’AN [98,99]. Cependant, l’aripiprazole agit également sur les récepteurs de la sérotonine et d’autres neurotransmetteurs. On ne sait toujours pas si les effets bénéfiques de l’aripiprazole pour le traitement de l’AN sont spécifiquement attribuables à l’agonisme des récepteurs D2 de la dopamine de la drogue, ce qui nécessite des études plus approfondies, et d’autres neurotransmetteurs peuvent également avoir des rôles clés et doivent être identifiés [93].
7. Conclusion
L’AN est une maladie complexe qui est généralement difficile à traiter. Notre compréhension limitée de la neurobiologie sous-jacente de l’AN nous a empêchés de développer des interventions pharmacologiques. Nous avons proposé ici un modèle basé sur le cerveau pour expliquer comment la physiopathologie spécifique de l’AN développe et maintient le désir de perdre du poids en dépit d’une insuffisance pondérale. Après avoir décidé de changer de comportement alimentaire ou de perdre du poids, le perfectionnisme et l’anxiété élevée peuvent jouer un rôle de médiateur, chez les personnes susceptibles de développer un AN, dans la transition vers des préoccupations liées aux comportements fondamentaux de l’AN, tels que la recherche de la minceur et l’insatisfaction corporelle. Les adaptations de l’organisme à la perte de poids, qui comprennent la sensibilisation du système dopaminergique et l’activation des circuits alimentaires hypothalamiques pour stimuler l’alimentation, entrent en conflit avec le désir de perdre du poids. La peur de prendre du poids pousse à la restriction alimentaire et conduit à une boucle d’auto-renforcement ou de rétroaction positive : émaciation, stimulation des circuits d’alimentation, nouvelle peur de perdre le contrôle de l’alimentation, suivie d’une privation de nourriture. La complexité de la maladie et le taux élevé de rechute nécessiteront une combinaison de réhabilitation nutritionnelle avec des interventions biologiques et psychothérapeutiques plus spécifiques afin d’améliorer les résultats du traitement.
