Nowacka, A., & Borczyk, M. (2019). Ketamine applications beyond anesthesia–A literature review. European journal of pharmacology, 860, 172547.
Abstract
L’utilisation clinique de la kétamine a débuté dans les années 1970. Les médecins ont bénéficié de son innocuité et de sa capacité à induire une anesthésie et une analgésie de courte durée. Les effets psychodysleptiques provoqués par le médicament ont remis en question son utilisation clinique ultérieure. Malgré ces effets désagréables, la kétamine est toujours utilisée en médecine vétérinaire, en médecine de terrain et en anesthésie spécialisée. Des recherches intensives récentes ont mis en lumière de nouvelles applications possibles de ce médicament. Elle a commencé à être utilisée dans le traitement de la douleur aiguë, chronique et cancéreuse. Les rapports les plus intéressants proviennent de la recherche sur les propriétés antidépressives et antisuicidaires de la kétamine, ce qui laisse espérer la création d’un traitement efficace des troubles dépressifs majeurs. D’autres rapports soulignent l’utilisation possible de la kétamine dans le traitement de la toxicomanie, de l’asthme et dans la prévention de la croissance du cancer. Outre son utilisation clinique, le médicament est également utilisé dans le modèle animal de la schizophrénie. Il semble qu’aujourd’hui, avec de nombreuses applications possibles, l’utilisation de la kétamine ait retrouvé sa gloire d’antan. Néanmoins, ce médicament doit être utilisé avec prudence, car les mécanismes par lesquels il exerce ses fonctions et les effets à long terme de son utilisation ne sont pas encore totalement connus. Cette revue a pour but de discuter des applications connues et des nouvelles applications prometteuses de la kétamine.
1. Introduction
Après la découverte de l’anesthésie au 19e siècle, la recherche d’anesthésiques sûrs, efficaces et à courte durée d’action a commencé. L’une des réalisations sur cette voie a été une nouvelle réaction chimique organique de Grignard qui a conduit à la synthèse de la phencyclidine (PCP) en 1956. Le PCP était un anesthésique très sûr pour les humains, mais il produisait également un état de délire prolongé et une privation sensorielle. Le PCP a donc commencé à être utilisé comme médicament modèle de la schizophrénie et la recherche d’un dérivé à courte durée d’action s’est poursuivie. Cette quête a abouti à la synthèse du CI-581, plus connu sous le nom de kétamine, qui produit également une anesthésie mais dont les effets sont plus brefs. La kétamine a été utilisée pour la première fois chez l’homme en 1964, lorsqu’elle a été administrée à 20 prisonniers volontaires de la prison d’État du Michigan du Sud à Jackson, aux États-Unis. En fonction de la dose, le médicament a produit à la fois une anesthésie complète et une analgésie profonde, ainsi qu’une augmentation de la pression artérielle sans dépression respiratoire cliniquement significative. Elle n’a aucun effet sur les fonctions hépatiques ou rénales et sur la numération sanguine. En raison de la rapidité d’action de la kétamine et du fait qu’elle ne produit pas de dépression respiratoire, ce qui la rend relativement sûre, elle a été utilisée comme anesthésique de terrain pendant la guerre du Viêt Nam.
L’effet indésirable le plus important de la kétamine est son effet psychologique. L’administration du médicament peut provoquer des hallucinations très réalistes, des expériences oniriques ou des changements d’humeur. En général, ces effets disparaissent en 1 à 2 heures. Depuis la synthèse de la kétamine, les effets provoqués par ces types de drogues ont été qualifiés d'”anesthésie dissociative”. En raison de son action rapide, de sa courte période d’action et de ses propriétés hallucinogènes, la kétamine est devenue une drogue d’abus à usage récréatif. À des doses subanesthésiques, la drogue produit des hallucinations, une distorsion du temps et de l’espace et de légers effets dissociatifs. Les usagers récréatifs décrivent ce phénomène comme une “fusion avec l’environnement” ou une “expérience hors du corps”. À des doses plus élevées, la drogue peut provoquer de graves effets dissociatifs, avec un détachement total de la réalité. Les premiers rapports sur l’usage récréatif de la kétamine sont apparus dans les années 1960 et la drogue a atteint son pic de popularité dans les années 1990, lorsqu’elle était un composant courant des comprimés d’ecstasy en Europe. Aujourd’hui encore, la kétamine reste une drogue de choix parmi les jeunes de Hong-Kong.
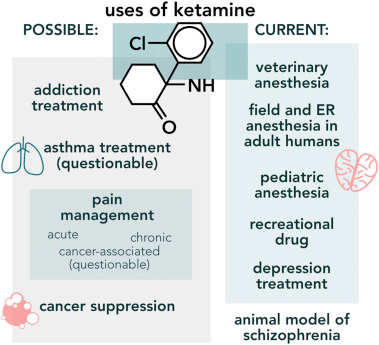
Aujourd’hui, l’application clinique la plus courante de la kétamine est la médecine vétérinaire. En raison de sa facilité d’administration par voie intramusculaire et parce qu’elle ne déprime pas la fonction respiratoire, la kétamine est utilisée comme sédatif et anesthésique chez les primates non humains, de nombreux animaux zoologiques et exotiques, des oiseaux et des reptiles depuis le début des années soixante-dix. Il est souvent utilisé en association avec la xylazine, un agoniste des récepteurs adrénergiques, et peut être utilisé pour faciliter l’anesthésie avec des agents inhalés et pour traiter la douleur postopératoire chez les animaux non humains. Chez l’homme, son utilisation en tant qu’anesthésique général a été réduite en raison de ses effets psychologiques. Cependant, la kétamine reste un anesthésique dans des cas particuliers : chez les patients en situation d’urgence dont l’hémodynamique est compromise, comme les patients en choc septique et chez les brûlés adultes et pédiatriques. La kétamine est également utilisée dans la gestion de la douleur. Ce médicament peut être utilisé comme modèle pour étudier les troubles de la mémoire et les psychoses. Ces dernières années, l’application de la kétamine dans le traitement de la dépression ainsi que de la dépendance à l’héroïne et à l’alcool a fait l’objet d’études approfondies. L’application de la kétamine dans la gestion de la douleur aiguë, chronique et cancéreuse fait également l’objet de recherches intensives. Cet article de synthèse vise à décrire le large éventail d’applications de la kétamine.
2. Propriétés de la kétamine
2.1 Chimie
La kétamine est un dérivé de la phencyclidine. Il s’agit d’une aryl-cyclo-alkylamine soluble dans l’eau dont la masse moléculaire est de 238 g/mol. La kétamine se présente sous la forme de deux énantiomères (S)-(+) et (R)-(-)-2-(2-chlorophényl)-2-(méthylamino) cyclohexanone. Les médicaments à base de kétamine tels que le Ketalar® sont des mélanges racémiques des deux énantiomères. L’énantiomère S(+) est plus puissant et est disponible sous le nom de Ketanesth® en Europe. En 2019, la FDA a approuvé un spray nasal contenant de la S(+)-kétamine, Spravato®, pour le traitement de la dépression résistante au traitement.
2.2 Mécanisme d’action
La plupart des effets anesthésiques, analgésiques et psychodysleptiques sont médiés par son action sur les récepteurs NMDA, dont la kétamine est un antagoniste non compétitif (Fig. 1). La kétamine est un bloqueur de canal ouvert, ce qui signifie qu’elle ne peut se lier au récepteur NMDA qu’à l’état ouvert, empêchant ainsi le flux ionique. La kétamine peut occuper deux sites dans le récepteur NMDA : à l’intérieur du pore du canal Ca2+ (le site de liaison PCP), ce qui diminue le temps d’ouverture des canaux, ou un site situé dans le domaine hydrophobe des récepteurs NMDA, ce qui diminue la fréquence d’ouverture des canaux. L’énantiomère S(+) est environ quatre fois plus puissant pour se lier aux récepteurs NMDA.
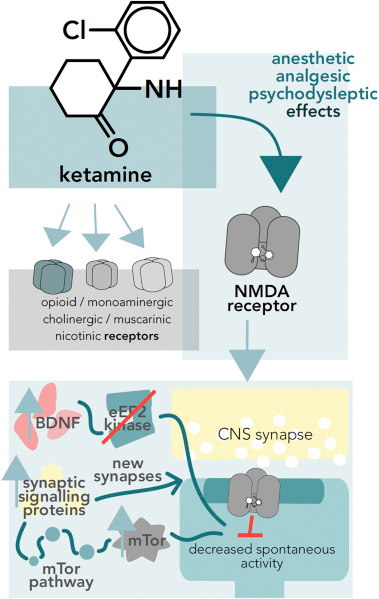
Outre les récepteurs NMDA, la kétamine interagit avec les récepteurs opioïdes (μ, δ et κ) monoaminergiques, cholinergiques, muscariniques et nicotiniques. L’énantiomère S(+) a une affinité 2 à 3 fois plus grande pour les récepteurs opioïdes que la forme racémique de la kétamine. Cette interaction n’est pas responsable des effets analgésiques de la kétamine mais pourrait contribuer aux effets psychosomatiques. La kétamine peut potentialiser les récepteurs de l’acide γ-aminobutyrique de type A (GABAA) en augmentant les propriétés inhibitrices du GABA. Cet effet ne se produit qu’à des concentrations très élevées du médicament et n’est donc pas cliniquement significatif. La kétamine peut inhiber les récepteurs nicotiniques en interagissant avec l’état ouvert et fermé du récepteur et elle affecte les muscles par cette voie. Cependant, avec l’administration de relaxants musculaires supplémentaires, ses effets sur les muscles squelettiques sont cliniquement insignifiants. La kétamine est également un antagoniste des récepteurs muscariniques et elle interagit avec les fonctions du système monoaminergique. Elle peut inhiber le captage de la norépinéphrine, de la dopamine et de la sérotonine, cette dernière étant due à son interaction avec un transporteur de sérotonine. En outre, le médicament inhibe les récepteurs du glutamate non NMDA tels que les récepteurs AMPA ou kaïnate. Cet effet est exécuté par l’inhibition de la NO-synthase induite par la kétamine. Le NO peut jouer un rôle dans la neurotransmission et la perception de la douleur, de sorte que ce rôle de la kétamine peut également contribuer à ses effets analgésiques.
2.3 Pharmacocinétique
La kétamine peut être administrée par voie intraveineuse et atteint les récepteurs NMDA dans la minute qui suit l’injection, traversant rapidement la barrière hémato-encéphalique. L’injection intramusculaire offre également une biodisponibilité élevée et le pic de concentration plasmatique est atteint 5 minutes après l’injection. Environ 10 à 30 % de la kétamine est liée aux protéines plasmatiques. À des fins analgésiques, la kétamine peut être administrée par voie orale, intranasale, transdermique, rectale et sous-cutanée. La biodisponibilité par voie orale est généralement faible, mais la voie d’administration intranasale a fait l’objet de nombreuses recherches et semble puissante. La kétamine est très liposoluble et se distribue donc rapidement dans les tissus périphériques. 80 % de la kétamine est métabolisée dans le foie par un système enzymatique microsomal (N-méthylation) en norkétamine. La norkétamine est un métabolite actif qui possède un tiers à un cinquième du pouvoir anesthésique de la kétamine. Chez les humains et d’autres animaux, comme les chevaux, la kétamine est excrétée par l’organisme dans l’urine et les fèces sous forme de norkétamine et d’autres dérivés hydroxylés. Les chats ne métabolisent pas la kétamine et excrètent le composé inchangé dans l’urine. Chez les rats, on a constaté qu’elle était excrétée par le canal biliaire. La demi-vie d’élimination de la kétamine est de 2 à 3 heures, dépend du débit sanguin dans le foie et peut être 20 % plus rapide chez les femmes que chez les hommes. La kétamine peut également être directement métabolisée en hydroxykétamine (5 %) avec la participation du foie, des reins, de l’intestin et des poumons. La pharmacocinétique de la S(+)-cétamine est meilleure que celle du mélange racémique, elle peut donc être administrée en plus petites doses et a été rapportée comme causant moins d’effets indésirables. L’administration intraveineuse de 50 mg/min de mélange racémique et de S(+)-cétamine produit une narcose en 3 ± 1 min qui dure 6 ± 2 min, mais l’énantiomère S(+) a une phase d’émergence plus courte.
2.4 Pharmacodynamie
La kétamine provoque un état d’anesthésie dissociative qui désigne une anesthésie profonde avec un état de conscience altérée dans lequel les yeux restent ouverts avec un nystagmus et les réflexes de base tels que les réflexes laryngés, cornéens et papillaires sont préservés. L’effet anesthésique dépend de la dose. La kétamine procure également une analgésie profonde. Comme le montre la résonance magnétique fonctionnelle, la kétamine diminue l’activité du cortex insulaire et du thalamus, qui sont généralement activés par une stimulation douloureuse. Chez des volontaires sains soumis à des stimuli thermiques douloureux, il a été démontré que des doses subanesthésiques de kétamine diminuent la perception de la douleur et l’activité cérébrale du cortex somatosensoriel secondaire, de l’insula et du cortex cingulaire antérieur en fonction de la dose. L’administration de kétamine entraîne des déficits de la mémoire épisodique. Des études d’imagerie par résonance magnétique fonctionnelle (IRMf) montrent que l’administration de kétamine altère l’activité frontale et hippocampique normale pendant l’encodage et la récupération de la mémoire. La kétamine provoque une augmentation de la fréquence cardiaque et de la pression artérielle, ainsi qu’une dépression respiratoire non cliniquement significative. En fait, elle détend les voies respiratoires en agissant sur les récepteurs et les voies qui produisent des bronchospasmes. Cette action peut être utilisée chez les patients souffrant d’un état asthmatique, en améliorant la ventilation et les échanges gazeux. La drogue n’affecte pas les fonctions hépatiques ou rénales, la numération sanguine ou les niveaux d’électrolytes (Domino et al., 1965), mais des cas de lésions rénales et de dysfonctionnement de plusieurs organes ont été signalés à la suite d’un abus chronique de kétamine. La kétamine produit des effets psychodysleptiques tels que des hallucinations visuelles et auditives, des rêves conscients, un flottement, une perturbation de l’humeur, de l’image corporelle et de la perception du temps. Ces symptômes produisent un état général d’irréalité et de dépersonnalisation. L’intensité des effets psychodysleptiques dépend de la dose, l’anxiété et les sentiments paranoïaques apparaissant à des doses élevées. La kétamine peut également produire des symptômes psychopathologiques. Dans une étude en double aveugle contrebalancée et contrôlée par placebo, les sujets ont reçu un bolus initial de 8 mg de kétamine par voie intraveineuse, suivi d’une période d’équilibrage de 5 minutes, puis ont reçu une perfusion d’environ 1 heure de 0,01 mg/kg/min de kétamine pendant laquelle ils ont effectué une tâche de génération de mots apparents tout en étant scannés par IRMf pour tester l’activité corticale. Les sujets ayant reçu de la kétamine présentaient des difficultés dans la pensée abstraite, des troubles de la pensée, un manque de spontanéité et de fluidité dans la conversation. Les troubles de la pensée sont corrélés à des mesures d’activation englobant le gyrus temporal supérieur gauche, le gyrus frontal moyen et inférieur droit et le précuneus. L’absence de pensée abstraite est corrélée à des activations prononcées dans les régions préfrontales et cingulaires antérieures, tandis que des hyperactivations dans le gyrus temporal supérieur gauche ont été observées en association avec un manque de spontanéité et de fluidité de la conversation. Ces symptômes psychopathologiques et ces schémas d’activation des régions cérébrales se retrouvent également chez les patients atteints de schizophrénie. Il est intéressant de noter que la kétamine a des propriétés neuroprotectrices. Elle inhibe l’activation des récepteurs NMDA et la signalisation excitotoxique, réduit l’apoptose neuronale, atténue la réponse inflammatoire systémique aux lésions tissulaires et maintient également la pression de perfusion cérébrale à la suite de l’activation du système nerveux sympathique. La kétamine peut également limiter le développement de l’inflammation en interagissant avec le recrutement des cellules inflammatoires, la production de cytokines et la régulation des médiateurs inflammatoires, comme décrit dans la section 4.3.
3. Applications de la kétamine
Les sections suivantes décrivent diverses applications de la kétamine (résumées dans la figure 2). Un résumé des exemples d’essais sur les fonctions non classiques de la kétamine est présenté dans le tableau 1.
[TABLEAU 1]
3.1 Le rôle de la kétamine en anesthésie
Malgré ses effets psychodysleptiques, la kétamine est toujours utilisée comme anesthésique en médecine vétérinaire, en pédiatrie, en anesthésie spécialisée et en médecine de terrain. L’une des premières utilisations cliniques de la kétamine a été l’anesthésie des soldats blessés pendant la guerre du Vietnam. La kétamine est un bon anesthésique de terrain car elle produit des effets rapides et ne provoque pas d’hypotension ou de dépression respiratoire. À ce jour, la kétamine est le médicament de choix pour induire l’anesthésie sur le terrain lorsqu’aucun anesthésiste ni équipement de surveillance n’est disponible. En raison de son innocuité, la kétamine joue un rôle important dans la sédation procédurale au service des urgences, y compris lors des urgences pédiatriques. Son utilisation dans les situations de catastrophe, où les ressources sont limitées, est également bien documentée. Grâce à ses effets excitateurs sur le système cardiovasculaire, la kétamine est le médicament de choix lorsqu’une anesthésie d’urgence rapide est nécessaire chez des patients en état de choc ou hypotendus. La kétamine peut également être administrée comme anesthésique sûr lors de l’intubation endotrachéale de patients gravement malades. Traditionnellement, l’utilisation de la kétamine est contre-indiquée chez les patients souffrant de lésions cérébrales, car elle augmenterait la pression du liquide céphalo-rachidien. Cependant, avec l’accumulation d’études, il semble que ce ne soit pas le cas. Certains rapports montrent même que la kétamine, dans un contexte de ventilation contrôlée, peut être utilisée comme sédatif et anesthésique chez les patients souffrant de lésions cérébrales grâce à ses effets neuroprotecteurs, qui entraînent une réduction de la mort cellulaire et de la dégénérescence neuronale. Le médicament sert d’anesthésique pour les opérations de la fenêtre péricardique chez les patients souffrant de tamponnade péricardique. Elle permet de maintenir une ventilation spontanée, une bronchodilatation et une préservation relative de la courbe de CO2. La kétamine peut être utilisée pour anesthésier les patients, en particulier les enfants, atteints de cardiopathie congénitale en raison de ses effets cardiovasculaires bénéfiques et du fait qu’elle améliore l’oxygénation du sang. Il est également souvent utilisé pour l’anesthésie et l’analgésie chez les grands brûlés qui subissent des changements de pansements répétés ou des procédures de greffe. Il préserve la perméabilité des voies aériennes, les réponses hypoxiques et hypercapniques et diminue la résistance des voies aériennes. Il est donc particulièrement utile dans les cas où aucune manipulation des voies aériennes n’est possible en raison de brûlures graves. En association avec d’autres anesthésiques, la kétamine sert à l’induction et au maintien de l’anesthésie locale et régionale pendant les interventions chirurgicales. La kétamine est l’un des rares médicaments pouvant être administrés pour induire une anesthésie pendant les césariennes. L’inclusion de la kétamine pour induire l’anesthésie chez les patients subissant une chirurgie cardiaque sous circulation extracorporelle atténue le délire postopératoire. La kétamine est également un médicament utile pour l’anesthésie en pédiatrie. Une revue systématique quantitative a montré que la kétamine administrée par voie caudale, accompagnant un anesthésique local, prolonge l’analgésie postopératoire avec peu d’effets indésirables. Chez des enfants subissant des interventions chirurgicales, l’administration de 0,5 mg/kg b.m. de kétamine avec 5 % de sévoflurane et 10 mg/kg b.m. d’alfentanil a amélioré les conditions d’intubation, tout en préservant la respiration spontanée et la stabilité hémodynamique. La kétamine est recommandée pour l’induction de l’anesthésie générale chez les enfants atteints de cardiopathie cyanogène et obligatoire pour les enfants présentant des maladies neuromusculaires associées à une hyperthermie maligne déclenchée par des agents volatils ou des médicaments bloquants neuromusculaires. Il est fréquemment utilisé pour l’anesthésie des enfants à haut risque.
3.2 Utilisation analgésique de la kétamine
Les inquiétudes concernant les effets psychodysleptiques induits par la kétamine ont limité son utilisation. Au début, elle était principalement utilisée à des fins d’anesthésie. Ce n’est qu’en 1970, après l’approbation de la FDA, que la kétamine est devenue disponible et a commencé à être utilisée à des fins analgésiques.
3.2.1 La kétamine dans le traitement de la douleur aiguë
L’approche habituelle de la thérapie de la douleur postopératoire aiguë est l’utilisation d’opioïdes. Cependant, les opioïdes, outre d’autres effets secondaires tels que la dépression respiratoire, les nausées et les vomissements, provoquent une hyperalgésie qui entraîne une augmentation des besoins en analgésiques. Une étude menée sur des rats a montré que l’administration répétée de kétamine peut réduire les effets hyperalgésiques du traitement opioïde. Des études chez l’homme ont montré que l’ajout de kétamine au traitement opioïde de la douleur aiguë prévient la dépression respiratoire induite par les opioïdes et l’hyperalgésie. L’ajout d’une petite dose de kétamine aux opioïdes administrés pendant et après une opération chirurgicale a complètement empêché l’augmentation de la sensibilité à la douleur postopératoire. Les patients qui reçoivent des opioïdes avec de la kétamine pendant l’opération ont moins besoin de morphine après l’opération. Une vaste revue systématique sur l’efficacité et la sécurité de la kétamine intraveineuse périopératoire chez les patients adultes au cours de différentes interventions chirurgicales a conclu que la kétamine intraveineuse périopératoire réduit la consommation d’analgésiques postopératoires et l’intensité de la douleur sans provoquer d’effets indésirables sur le SNC. Une dose bolus préemptive de kétamine a des effets d’épargne opioïde chez les abuseurs d’opioïdes soumis à une sédation modérée. Dans un essai clinique en triple aveugle, randomisé, actif et contrôlé par placebo, Bornemann-Cimenti et al. ont montré que l’utilisation de doses minimales de S-cétamine, plus petites que les faibles doses normales de kétamine racémique, pendant l’anesthésie périopératoire réduisait la consommation d’opioïdes et l’hyperalgésie postopératoires et diminuait la fréquence du délire postopératoire. Dans leur revue, Allen et Ivester concluent que le potentiel de la kétamine à diminuer les besoins en opioïdes postopératoires et à réduire l’hyperalgésie induite par les opioïdes, associé à sa capacité à soutenir la fonction hémodynamique et la pulsion respiratoire, rend son utilisation intéressante en tant qu’agent analgésique. Cependant, l’application de la kétamine seule en prévention de la douleur postopératoire chronique ne semble pas être efficace. La kétamine est de plus en plus utilisée comme analgésique dans les services d’urgence et chez les patients pédiatriques. La kétamine à faible dose associée à un protocole d’hydromorphone à dose réduite a produit un soulagement rapide et profond de la douleur sans effets secondaires significatifs dans une cohorte diversifiée de patients du service des urgences souffrant de douleur aiguë. La kétamine intraveineuse subdissociative administrée à 0,3 mg/kg b.m. offre une efficacité analgésique et une sécurité comparables à celles de la morphine intraveineuse pour le traitement à court terme de la douleur aiguë aux urgences. Dans une étude observationnelle prospective, Andolfatto et al. ont analysé l’efficacité de l’administration intranasale de kétamine comme analgésique aux urgences. La kétamine intranasale a diminué les scores de douleur chez 88 % des patients et les effets indésirables étaient mineurs et transitoires.
3.2.2 La kétamine dans la douleur chronique
Le traitement de la douleur chronique est un défi à bien des égards. Trouver le bon traitement pour chaque individu implique généralement l’utilisation d’antidépresseurs, d’antiépileptiques et d’opioïdes et nécessite de multiples ajustements du régime de traitement (médicaments, dosage, etc.). Quel que soit le traitement, son efficacité est limitée à 30-40 % des patients qui présentent un soulagement de la douleur, le reste des patients répondant mal au traitement. Les anesthésistes utilisent la kétamine pour traiter les douleurs chroniques, en particulier celles qui ont une composante neuropathique. La popularité croissante de la kétamine dans le traitement de la douleur chronique est due à ses effets positifs observés sur les patients souffrants et au fait que des benzodiazépines ou des agonistes α2-adrénergiques sont désormais ajoutés au traitement pour prévenir les effets psychodysleptiques de la kétamine.
La douleur neuropathique est définie comme une douleur résultant directement d’une lésion ou d’une maladie affectant le système somatosensoriel. Plusieurs processus neurochimiques conduisent à la transition d’une douleur causée par une lésion nerveuse/neuronale à une douleur neuropathique chronique qui persiste alors que la cause étiologique initiale a disparu. Ces processus comprennent généralement une plasticité inadaptée du système nerveux : phosphorylation et régulation à la hausse des récepteurs NMDA, perte de l’inhibition descendante, bourgeonnement axonal dans la moelle épinière et activation des cellules immunitaires dans la moelle épinière qui libèrent des cytokines pro-inflammatoires. La kétamine produit une forte analgésie dans les syndromes de douleur neuropathique en raison de son inhibition des récepteurs NMDA. Il existe également des preuves que la kétamine peut influencer les voies descendantes de la douleur. Les voies descendantes modulent la transmission spinale de l’entrée nociceptive et impliquent des neurotransmetteurs inhibiteurs. Chez les patients souffrant de douleurs neuropathiques, ce système de contrôle inhibiteur se déplace de sorte que l’inhibition est suspendue ou transformée en facilitation. Une étude IRMf contrôlée par placebo a montré que la kétamine à faible dose active les régions du cerveau (cortex cingulaire antérieur, cortex frontal orbital, insula et tronc cérébral) impliquées dans l’inhibition descendante de la douleur. Dans une étude randomisée contre placebo menée auprès de patients atteints de neuropathie périphérique, l’administration d’une faible dose de S(+)-cétamine a renforcé ou réactivé l’inhibition descendante.
Malheureusement, l’administration chronique de kétamine peut produire des effets secondaires indésirables. Les effets indésirables les plus fréquents sont la sédation, la somnolence, les vertiges, les illusions sensorielles, les hallucinations, les cauchemars, les sensations dissociatives et la vision floue. Ces effets entraînent des taux élevés de sevrage chez les patients lors des études sur l’utilisation de la kétamine dans le traitement de la douleur chronique. Dans une étude sur 21 patients souffrant de douleurs neuropathiques, 10 se sont retirés de l’étude. La même étude indique que l’administration de kétamine à des patients souffrant de douleurs neuropathiques chroniques n’a augmenté l’analgésie que chez trois patients sur 21, concluant que la kétamine n’a probablement pas d’effet thérapeutique réel. Un taux d’abandon similaire a été observé dans une étude où neuf patients sur 21 ont abandonné en raison des effets indésirables du médicament. Un problème qui a été décrit à de nombreuses reprises est l’effet de l’utilisation prolongée de la kétamine sur les voies urinaires. L’abus de kétamine peut entraîner une cystite ulcéreuse à la kétamine, un syndrome consistant en une vessie de petit volume, cicatrisée et douloureuse, avec pour conséquence de graves symptômes des voies urinaires inférieures, l’incontinence et l’hématurie. La présence d’une maladie des voies urinaires peut entraîner une insuffisance rénale. Cependant, la cystite ulcéreuse associée à la kétamine est fréquente surtout chez les consommateurs récréatifs de kétamine. La kétamine peut entraîner une dépendance. Des rats auxquels on a administré de la kétamine une fois par semaine pendant 5 semaines ont développé une sensibilisation locomotrice. Chez l’homme également, l’administration répétée de kétamine sur une période prolongée peut entraîner une tolérance à la drogue et une dépendance psychologique, mais elle ne provoque aucun symptôme de sevrage physique. Une étude menée auprès de 21 toxicomanes à la kétamine âgés de 0,5 à 12 ans à l’aide de techniques d’IRM a montré que l’abus de kétamine pouvait entraîner des lésions cérébrales dans de nombreuses régions du cerveau.
L’administration de kétamine a permis de réduire la douleur chez des patients souffrant de différents types de syndromes douloureux chroniques, principalement neuropathiques, notamment la névralgie post-zostérienne, le syndrome douloureux régional complexe, la douleur cancéreuse, la fibromyalgie et la douleur du membre fantôme. Les résultats de ces études sont résumés dans le tableau 1 de la section “douleur chronique”. Bien que de nombreux résultats semblent prometteurs, des examens critiques et des méta-analyses d’études cliniques indiquent que les preuves de l’efficacité de la kétamine dans la douleur chronique sont de qualité moyenne à faible et que la variété des protocoles de perfusion et des schémas posologiques des médicaments rend difficile la formulation de conclusions sans équivoque. Certains auteurs affirment que la kétamine en tant qu’analgésique s’est avérée efficace chez les patients souffrant de douleurs sévères qui n’ont pas répondu à la pharmacothérapie de routine, mais son efficacité et ses effets indésirables à long terme ne sont pas suffisamment étudiés pour promouvoir l’utilisation systématique de la kétamine par voie orale dans la gestion de la douleur chronique.
3.2.3 Le rôle de la kétamine dans le traitement de la douleur cancéreuse
La kétamine a récemment été utilisée pour traiter la douleur cancéreuse. Dans le traitement de la douleur cancéreuse, la kétamine est généralement prescrite comme adjuvant aux opioïdes chez les patients qui souffrent de douleurs cancéreuses réfractaires aux opioïdes (lorsqu’ils ne répondent plus aux opioïdes) ou lorsque les symptômes de douleur neuropathique deviennent dominants. Dans ces cas, la kétamine est bénéfique car elle réduit la tolérance aux opioïdes, l’hypersensibilité à la douleur et renforce l’inhibition endogène de la douleur.
La littérature sur l’utilisation de la kétamine dans le traitement de la douleur cancéreuse n’est pas concluante. Dans des études portant sur un plus petit nombre de participants, la kétamine s’est avérée efficace pour réduire la douleur cancéreuse. Dans une étude portant sur 11 enfants et adolescents auxquels on avait administré de fortes doses d’opioïdes et qui souffraient toujours de douleurs intenses, les perfusions de kétamine utilisées comme adjuvant à l’analgésie opioïde ont été associées à des effets d’épargne des opioïdes et à une amélioration apparente du contrôle de la douleur chez 8 des 11 patients. Dans une étude portant sur 10 patients souffrant de douleurs cancéreuses réfractaires aux opioïdes, la kétamine a été administrée comme adjuvant à la morphine. Les patients ayant reçu de la kétamine, mais pas de solution saline, ont vu l’intensité de leur douleur diminuer. Une étude de cas rétrospective portant sur 14 patients pédiatriques en phase terminale et souffrant de douleurs neuropathiques réfractaires aux opioïdes a montré que la kétamine, administrée avec des benzodiazépines limitant les effets psychodysleptiques de la kétamine, soulageait la douleur. Pour plus d’informations sur les études relatives aux effets de la kétamine sur la douleur cancéreuse, le lecteur est invité à consulter des revues approfondies. Cependant, lorsqu’il s’agit d’essais cliniques de grande envergure, prospectifs, entièrement aveugles, contrôlés par un agent actif ou un placebo, les effets de la kétamine sur le soulagement de la douleur cancéreuse ne sont pas aussi définitifs. L’essai clinique randomisé multicentrique en double aveugle le plus récent sur la kétamine orale par rapport au placebo dans le traitement de la douleur cancéreuse chez 214 patients a été mené par Fallon et al. Les sujets représentaient divers types de cancer, mais 74,7 % étaient en rémission et souffraient de douleurs neuropathiques chroniques induites par la chimiothérapie. Les sujets ont reçu de la kétamine comme adjuvant au traitement de la douleur cancéreuse. Les auteurs concluent que les effets de la kétamine sont équivalents à ceux d’un placebo pour les douleurs neuropathiques liées au cancer. Dans une étude portant sur 185 sujets, un traitement sous-cutané de 5 jours à la kétamine comme adjuvant au traitement opioïde n’a pas non plus réduit la douleur de manière significative par rapport au groupe placebo. Jonkman et al. dans leur revue de la littérature sur l’utilisation de la kétamine dans la douleur cancéreuse concluent que les essais contrôlés randomisés retrouvés contiennent des preuves insuffisantes d’un effet bénéfique cliniquement pertinent de la kétamine en tant qu’adjuvant pour le soulagement de la douleur cancéreuse modérée à sévère.
3.3 Le rôle de la kétamine dans le traitement de la dépression
Depuis plus de 10 ans, la kétamine est au centre des recherches sur le traitement du trouble dépressif majeur. Tout a commencé en 2000 avec un essai contrôlé randomisé qui a prouvé qu’une dose unique de kétamine sous anesthésique soulageait les symptômes dépressifs. La plupart des antidépresseurs approuvés agissent sur le système monoaminergique, et le ciblage des récepteurs NMDA est une approche totalement nouvelle. Certains patients ne réagissent pas aux antidépresseurs classiques ; ce groupe est appelé groupe de dépression résistante au traitement. Le deuxième essai contrôlé randomisé a étudié les effets de la kétamine sur ces patients uniquement. Là encore, une seule administration de kétamine a eu des effets antidépresseurs robustes, rapides mais transitoires puisqu’ils ont disparu au bout d’une semaine. Depuis lors, un grand nombre d’essais ont été réalisés pour déterminer les effets de la kétamine sur le trouble dépressif majeur, le trouble bipolaire, la dépression résistante au traitement, etc. Un examen approfondi de ces essais a été présenté dans Aan Het Rot et al, 2012 et Serafini et al, (2014). En outre, il a également été démontré que la kétamine réduisait rapidement les pensées suicidaires chez les patients ayant des idées suicidaires. Ces études, outre le fait qu’elles indiquent un médicament potentiel contre la dépression, ont soulevé de nombreuses questions. Comment la kétamine exerce-t-elle ses propriétés antidépressives ? Comment une seule dose peut-elle réduire les symptômes dépressifs pendant une semaine ? Tous les patients réagissent-ils à la kétamine ?
L’un des mécanismes possibles par lesquels la kétamine exerce ses propriétés antidépressives est lié au facteur neurotrophique dérivé du cerveau (BDNF). Il a été démontré que la kétamine induit rapidement des effets comportementaux de type antidépresseur chez la souris grâce à l’inhibition des courants miniatures spontanés médiés par les récepteurs NMDA, ce qui entraîne une diminution de l’activité de la kinase eEF2 et permet une augmentation de la traduction du BDNF (Fig. 1). Les effets antidépresseurs de la kétamine ont été bloqués chez les souris knock-out BDNF et chez les souris knock-in de l’allèle BDNF Val66Met, qui bloque le traitement et la libération du BDNF en fonction de l’activité. D’autres preuves proviennent d’une étude dans laquelle un anticorps neutralisant le BDNF a été perfusé dans le cortex préfrontal médian, ce qui a bloqué les effets comportementaux de la kétamine chez les rats. Certains patients qui ne répondent pas au traitement à la kétamine sont porteurs d’un polymorphisme mononucléotidique (SNP) associé à une atténuation du fonctionnement du BDNF. Cependant, certaines études remettent en cause le rôle du BDNF dans les effets antidépresseurs de la kétamine. Une étude portant sur 23 patients a montré qu’une perfusion unique de kétamine réduit les symptômes dépressifs mais n’affecte pas les niveaux de BDNF. Dans un test de nage forcée, la kétamine a produit des effets antidépresseurs similaires chez des souris de type sauvage et des souris hétérozygotes bdnf ±, et les niveaux de BDNF n’ont pas été modifiés par l’administration de kétamine.
Un autre mécanisme possible de l’action de la kétamine pourrait être la voie mTOR. La kétamine active rapidement la voie de la cible mammalienne de la rapamycine (mTOR), ce qui entraîne une augmentation de l’expression des protéines de signalisation synaptique ainsi qu’une augmentation du nombre et de la fonction des nouvelles synapses épineuses dans le cortex préfrontal. Le blocage de la signalisation mTOR par la rapamycine a empêché l’induction par la kétamine de la synaptogenèse et des réponses comportementales dans les modèles de dépression (Fig. 1). Il a été démontré que l’administration de kétamine à des rats augmentait les niveaux de mTOR et de BDNF dans l’hippocampe pendant le test de nage forcée, mais la stimulation de mTOR dépendante de la kétamine a également été démontrée dans de nombreuses autres études. Outre le BDNF et la mTOR, l’administration de kétamine est également liée à une augmentation des niveaux de synapsine dans l’hippocampe. Étant donné qu’il s’agit de marqueurs de la neurogenèse et de la synaptogenèse et que la kétamine induit la synaptogenèse et la formation d’épines dans le cortex préfrontal, la kétamine pourrait exercer ses fonctions antidépressives par le biais de mécanismes neurotrophiques. La kétamine pourrait également agir en affectant le système opioïde, car l’administration d’antagonistes des récepteurs opioïdes à 30 sujets humains a atténué les effets antidépresseurs. De manière surprenante, les études sur les actions antidépressives d’autres antagonistes non sélectifs des récepteurs NMDA, tels que la mémantine et la lanicémine, ont été négatives. Pour déployer ses propriétés antidépressives, la kétamine doit être administrée par voie intraveineuse, ce qui constitue un inconvénient, mais l’application nasale du stéréo-isomère S(+)-kétamine semble être efficace et a récemment été mise sur le marché par Janssen. La posologie recommandée est de 56 mg deux fois par semaine pendant 1 à 4 semaines, puis 56 ou 84 mg une fois par semaine pendant les semaines 5 à 8, puis une administration bihebdomadaire ou hebdomadaire de 56 ou 84 mg en fonction de la réponse du patient.
Le grand nombre d’essais cliniques et d’autres études montrent que la kétamine est efficace dans le traitement de la TRD (Serafini et al., 2014) et d’autres troubles dépressifs. Elle constitue également un traitement efficace des idées suicidaires. Cependant, les mécanismes exacts par lesquels la kétamine exerce ses propriétés antidépressives et antisuicidaires semblent encore mal compris et il n’est pas clair si ces propriétés sont déclenchées par les mêmes mécanismes ou par des mécanismes distincts. La formulation du médicament, le dispositif et la technique d’administration, ainsi que les facteurs individuels du patient semblent jouer un rôle dans l’efficacité du traitement à la kétamine, et davantage d’études de sécurité à long terme doivent être réalisées, en particulier avec des doses répétées. Néanmoins, l’utilisation de la kétamine pour le traitement de la dépression se développe et, en mars 2019, le premier spray intranasal contenant de la S-Kétamine a été approuvé par la FDA pour une utilisation chez les adultes souffrant de dépression qui n’ont pas répondu à au moins deux autres thérapies.
3.4 Le rôle de la kétamine dans le traitement des addictions
La découverte des propriétés antidépressives de la kétamine a incité à poursuivre les recherches en psychiatrie. Il semble que la kétamine puisse également aider à traiter diverses toxicomanies. La kétamine réduit la consommation d’éthanol chez les rats préférant l’alcool et cet effet était dépendant de la dose. Ces effets ont été bloqués par la rapamycine, inhibiteur de la voie mTOR. Dans des études sur la préférence de place induite par la morphine, les rats auxquels on avait administré de la kétamine avaient une préférence réduite pour la morphine. En 1997, Krupitsky et Grinenko ont publié une étude résumant 10 ans de recherche sur la thérapie psychédélique à la kétamine (KPT). Dans le cadre de cette thérapie, des alcooliques désintoxiqués ont reçu de la kétamine et ont ressenti ses effets psychédéliques. Pendant la phase psychédélique, le thérapeute guide verbalement le patient pour qu’il trouve un nouveau but à sa vie et lui présente l’odeur de l’éthanol pour créer des émotions négatives liées à l’alcool. La KPT a pour but d’aider les patients à prendre conscience des effets négatifs de leur dépendance. Par rapport à un groupe recevant une thérapie conventionnelle, le nombre de rechutes chez les patients ayant suivi la thérapie KPT est nettement inférieur. La KPT a entraîné un taux d’abstinence plus élevé chez les héroïnomanes. La kétamine a également renforcé la motivation à arrêter la cocaïne et réduit l’état de manque induit par les indices chez les cocaïnomanes. Dans leur revue systématique de l’efficacité de la kétamine dans le traitement des troubles liés à l’utilisation de substances, Jones et al. concluent que la kétamine peut faciliter l’abstinence pour de multiples substances d’abus et qu’elle mérite d’être étudiée plus avant dans le traitement des addictions.
3.5 La kétamine comme modèle d’étude de la schizophrénie et des troubles de la mémoire
La schizophrénie est traditionnellement liée au mauvais fonctionnement du système dopaminergique, qui se manifeste par une augmentation de la libération de dopamine et une hyperactivation des récepteurs D2. Une autre hypothèse a émergé avec l’observation que l’administration de kétamine produit des symptômes semblables à ceux de la schizophrénie, notamment une psychose, des symptômes négatifs et des troubles cognitifs. Ces syndromes peuvent être impossibles à distinguer des symptômes de la schizophrénie aiguë. Il est intéressant de noter que la kétamine provoque des hallucinations chez les enfants moins fréquemment que chez les adultes, ce qui est cohérent avec les symptômes de schizophrénie apparaissant généralement après 16 ans. Il a été démontré que la kétamine augmente les symptômes positifs et négatifs chez les patients schizophrènes. Des doses aiguës de kétamine administrées à des volontaires sains induisent des symptômes positifs et négatifs de type schizophrénique. Les consommateurs chroniques de kétamine présentent une expression accrue des récepteurs D1 similaire à celle des schizophrènes. Des études d’imagerie cérébrale ont montré que les changements dans la morphologie du cerveau après l’administration répétée de kétamine correspondent à ceux qui apparaissent chez les patients atteints de schizophrénie avérée. Ces observations ont donné naissance à l’idée d’utiliser la kétamine comme modèle de laboratoire de la schizophrénie. La kétamine est aujourd’hui utilisée comme modèle de schizophrénie induite par des médicaments, tant chez les rongeurs que chez l’homme. Les recherches utilisant ces modèles visent à expliquer la physiopathologie de la schizophrénie et à trouver un traitement précis.
La kétamine peut également être utilisée comme modèle pharmacologique de troubles de la mémoire. L’administration de kétamine affecte la mémoire épisodique, la mémoire de travail et la mémoire sémantique, l’attention, les fonctions exécutives et l’apprentissage procédural. Ces déficits résultent très probablement du même mécanisme que les symptômes de la schizophrénie et ne sont pas dus à des mécanismes de neurodégénérescence comme dans la maladie d’Alzheimer. La kétamine entraîne des erreurs dans l’apprentissage associatif, ce qui perturbe l’encodage des prédictions. Ainsi, ce n’est peut-être pas la mémoire épisodique elle-même qui est bloquée par la drogue, mais plutôt la kétamine qui peut empêcher l’association d’un souvenir donné avec sa signification, augmentant ainsi la possibilité de délires.
4. Autres applications possibles de la kétamine
4.1 La kétamine dans le traitement de l’asthme
La kétamine agit également comme relaxant des voies respiratoires et comme bronchodilatateur. Grâce à ces propriétés, des tentatives ont été faites pour utiliser la kétamine dans le traitement des exacerbations de l’asthme. Il a été démontré que l’administration IV de kétamine à des enfants et des adultes souffrant d’une crise aiguë d’asthme peut prévenir la nécessité d’une intubation. Les rapports de la littérature sont cependant contradictoires. Dans un essai en double aveugle, randomisé et contrôlé par placebo portant sur 68 enfants, les patients présentant une exacerbation aiguë de l’asthme n’ont pas montré d’amélioration significative après un traitement par kétamine IV par rapport au traitement standard.
4.2 La kétamine dans la lutte contre le cancer
Il semble que la kétamine puisse jouer un rôle important non seulement dans le traitement de la douleur cancéreuse, mais aussi dans le traitement du cancer lui-même. Dans une étude de 2015, Malsy et al. ont montré qu’un traitement à la kétamine ou à la S(+)-kétamine peut réduire le taux de prolifération, l’apoptose et augmenter la nécrose dans les cellules pancréatiques adénocarcinomiques humaines. Cet effet est lié au fait que les cellules cancéreuses du pancréas expriment la sous-unité NR2A du récepteur NMDA. En fait, les sous-unités du récepteur NMDA sont connues pour être exprimées dans divers types de lignées cellulaires cancéreuses et les antagonistes du glutamate peuvent inhiber la prolifération de lignées cellulaires cancéreuses humaines, y compris l’adénocarcinome du côlon, l’astrocytome et le carcinome du sein et du poumon. En outre, il a été démontré qu’un autre bloqueur du canal ouvert NMDA, le MK-801, supprime la croissance du carcinome hépatocellulaire. Une étude récente montre que la kétamine peut induire l’apoptose des cellules d’adénocarcinome pulmonaire en régulant à la hausse l’expression de CD69. CD69 est un marqueur d’activation des leucocytes et des cellules tueuses naturelles (NK) et il est régulé à la baisse chez les patients souffrant d’un adénocarcinome pulmonaire.
4.3 Propriétés anti-inflammatoires et immunomodulatrices de la kétamine
Il a été démontré que la kétamine a un effet positif sur la régulation de l’inflammation sans affecter les processus de guérison. Des études in vitro sur des macrophages en culture ont montré que la kétamine inhibe la production d’IL-6 (interleukine 6), de TNF-α (facteur de croissance tumorale α) et d’oxyde nitrique et inhibe leur fonction oxydative (Yang et al., 2005). Des études in vitro sur des neutrophiles isolés d’animaux ont montré que la kétamine inhibe la production de radicaux libres et de cytokines. Des effets similaires ont été observés sur des neutrophiles humains isolés. Plusieurs études menées chez l’homme ont montré que la kétamine diminuait la production de cytokines pro-inflammatoires. L’administration d’une faible dose de kétamine avant l’induction de l’anesthésie chez des patients humains a entraîné une diminution de la sécrétion d’IL-6 et de TNF-α au cours de la période postopératoire précoce. Dans le même temps, elle a préservé les niveaux préopératoires d’IL-2 (interleukine 2), qui joue un rôle important dans la régulation des réponses inflammatoires cellulaires et humorales. En raison de ses propriétés anti-inflammatoires, l’administration de kétamine a réduit la mortalité dans une étude sur des souris septiques et des rats. Dans une revue systématique évaluant 14 études réalisées sur 684 patients, Dale et al. concluent que l’administration peropératoire de kétamine inhibe la réponse inflammatoire postopératoire précoce. Ces résultats indiquent que l’application de kétamine pourrait être une stratégie efficace pour atténuer les réponses cytokiniques périopératoires et donc améliorer les résultats chirurgicaux.
4.4 La kétamine en tant que drogue récréative
L’histoire de l’utilisation récréative de la kétamine a commencé à peu près en même temps que ses premières applications en anesthésie, c’est-à-dire vers 1965. La kétamine est une drogue récréative puissante en raison de son action rapide, de sa courte durée d’action et de ses propriétés psychédéliques uniques appelées “K-hole”, caractérisées par un état de dissociation extrême accompagné d’hallucinations visuelles et auditives et d’un sentiment d’expérience de mort imminente. En 1978, un médecin, psychanalyste et philosophe américain, John Lilly, dans son livre “The Scientist”, a décrit avec enthousiasme ses expériences avec la kétamine. L’utilisation de cette drogue a augmenté avec la popularité croissante des rave parties dans les années 1990 et est restée un élément de la culture des clubs de danse. La kétamine a également été vendue comme composant des comprimés d’ecstasy. Au cours des 20 dernières années, l’utilisation de la kétamine comme drogue récréative est devenue de plus en plus populaire. Cela s’explique par son prix deux fois moins élevé que celui de la cocaïne et par le fait qu’elle est considérée comme une drogue sûre. Il est intéressant de noter que, par rapport à d’autres villes, la kétamine a été largement utilisée à Hong Kong, où elle est devenue une drogue de choix dans les trois ans qui ont suivi son introduction dans les années 1990 et où elle l’est encore aujourd’hui. Le premier rapport de dix cas établissant un lien entre l’abus de kétamine à des fins récréatives et la survenue d’une cystite ulcéreuse provient de Hong Kong. Récemment, un dérivé de la kétamine, la méthoxétamine, est apparu comme une alternative à la kétamine qui ne provoque pas de toxicité pour la vessie.
5. Conclusions et discussion
La kétamine a un large éventail d’applications. Ses propriétés anesthésiques sont bien établies et continuent d’être utilisées dans certains contextes cliniques. L’utilisation de la kétamine chez les grands brûlés et les patients hémodynamiquement instables reste importante. Ces dernières années, cependant, la substance est revenue sous les feux de la rampe en raison de ses utilisations non classiques. Celles-ci s’inscrivent dans deux voies intéressantes, l’une liée à ses effets psychologiques et l’autre indépendante de ceux-ci.
Dans les domaines liés aux effets psychologiques de la kétamine, la gestion de la douleur et le traitement de la dépression semblent les plus prometteurs. Après un examen approfondi de la littérature, il apparaît que, dans le traitement de la douleur, la kétamine est mieux utilisée en association avec des opioïdes. Dans ce type de traitement, elle peut avoir un effet d’épargne des opioïdes et peut-être limiter le risque de développement d’une dépendance aux opioïdes. Dans la douleur chronique, l’application de la kétamine seule reste controversée et il est nécessaire de mener davantage d’études cliniques dans ce domaine. Parmi les nouvelles applications de la kétamine, ses propriétés antidépressives et antisuicidaires semblent particulièrement prometteuses et permettent d’espérer la mise au point de traitements efficaces. L’approbation récente de la S-cétamine intranasale pour le traitement de la dépression résistante au traitement marque une évolution importante dans ce domaine, car il n’existe pas de nouvelles thérapies pour la dépression résistante au traitement. Les années à venir apporteront sans aucun doute de nouvelles informations sur l’efficacité de la kétamine dans les troubles psychiatriques et confirmeront ou infirmeront les réserves émises quant à l’utilisation de la kétamine en raison de l’abus possible de la substance par les patients.
Une autre application intéressante et totalement nouvelle de la kétamine pourrait émerger des recherches préliminaires montrant les propriétés anticancéreuses et immunomodulatrices de la kétamine. Bien que ces recherches n’en soient qu’à leur début, les patients atteints de cancer pourraient bénéficier des propriétés antidépressives, d’épargne des opioïdes et de suppression du cancer de la substance. Il convient toutefois d’être prudent car les propriétés anticancéreuses de la kétamine n’ont pas encore fait l’objet de recherches approfondies.
Malgré ses nombreuses applications, la façon dont la kétamine exerce ses effets cliniques n’est pas toujours bien comprise. Un problème majeur dans ce domaine est que les régimes de traitement et les dosages varient tellement d’un essai à l’autre qu’il est souvent difficile de tirer des conclusions en comparant les différents rapports. On ne sait toujours pas quelles sont les propriétés de la substance qui se manifestent par des mécanismes indépendants. C’est pourquoi des recherches supplémentaires sur les mécanismes d’action et les effets à long terme de l’utilisation de la kétamine sont encore nécessaires.
