Kim, S. T., & Park, T. (2019). Acute and chronic effects of cocaine on cardiovascular health. International journal of molecular sciences, 20(3), 584.
Abstract.
Les complications cardiaques résultant de la consommation de cocaïne ont fait l’objet d’études approfondies en raison de la complexité des mécanismes physiopathologiques. Cette étude vise à passer en revue les mécanismes cellulaires et moléculaires sous-jacents des effets aigus et chroniques de la cocaïne sur le système cardiovasculaire, en mettant l’accent sur les études humaines. Les études ont constamment rapporté les effets aigus de la cocaïne sur le cœur (par exemple, anomalies électrocardiographiques, hypertension aiguë, arythmie et infarctus aigu du myocarde) par le biais de mécanismes multifactoriels. Cependant, des résultats variables ont été rapportés pour les effets chroniques de la cocaïne. Certaines études n’ont trouvé aucun lien entre la consommation de cocaïne et la maladie coronarienne (CAD), tandis que d’autres ont signalé son association avec l’athérosclérose coronarienne subclinique. Ces résultats contradictoires pourraient être dus à l’hétérogénéité des sujets d’étude en ce qui concerne le risque cardiaque. Après la consommation de cocaïne, les populations présentant un risque élevé de maladie coronarienne ont connu une athérosclérose coronarienne, alors que celles présentant un risque faible n’ont pas connu de maladie coronarienne, ce qui suggère que les effets chroniques de la cocaïne étaient plus susceptibles d’être importants chez les personnes présentant un risque plus élevé de maladie coronarienne. Des études ont également suggéré que les comportements à risque et les risques cardiovasculaires peuvent affecter l’association entre la consommation de cocaïne et la mortalité. Les résultats de notre étude soulignent la nécessité d’une éducation concernant les effets délétères de la cocaïne et d’un accès aux interventions pour les cocaïnomanes.
1. Introduction.
La cocaïne est un composé alcaloïde tropanique qui peut être extrait des feuilles d’un arbuste andin, l’Erythroxylon coca, en Amérique du Sud. La cocaïne était à l’origine utilisée comme anesthésique pour les interventions chirurgicales locales dans les années 1880, mais elle est devenue une drogue récréative dans les années 1970. Dans les années 1980, on a assisté à une épidémie de consommation de cocaïne, le nombre de consommateurs de cocaïne aux États-Unis étant estimé à 5,8 millions en 1985. En 2016, le nombre total de consommateurs de cocaïne était estimé à 18,2 millions dans le monde. Environ 34 % de ces consommateurs de cocaïne résidaient en Amérique du Nord et 20 % en Europe occidentale et centrale. Aux États-Unis, il y avait 1,5 million de consommateurs de cocaïne âgés de 12 ans ou plus, soit 0,6 % de la population. Les jeunes adultes âgés de 18 à 25 ans étaient les plus grands consommateurs de cocaïne (1,4 %).
La cocaïne peut être administrée par voie fumée, par injection intraveineuse, par inhalation nasale ou par voie orale. La pharmacocinétique varie selon la voie d’administration, le temps nécessaire pour atteindre le pic de concentration dans le sang allant de 1 à 5 minutes (fumage ou injection intraveineuse) à 60 à 90 minutes (administration orale). La durée de l’action pharmacologique varie de 5 à 60 minutes après fumage ou administration intraveineuse, et jusqu’à 180 minutes après administration orale. Outre les muqueuses nasales, l’absorption de cocaïne par d’autres muqueuses, telles que les muqueuses intravaginales ou intrarectales, est également possible. L’administration de cocaïne par les muqueuses entraîne un début d’action plus lent, un pic de concentration plus tardif et une durée d’action plus longue que l’administration par voie fumée ou intraveineuse, mais un début d’action plus rapide, un pic de concentration plus précoce et une durée d’action plus courte que l’administration par voie orale. La cocaïne est convertie en deux métabolites principaux par les cholinestérases plasmatiques et hépatiques : la benzoylecgonine et l’ester méthylique de l’ecgonine. Ces métabolites hydrosolubles sont excrétés dans l’urine et sont détectables dans l’urine pendant 24 à 36 heures après la prise.
La cocaïne est classée dans le tableau II de la loi sur les substances contrôlées (Controlled Substances Act). Les drogues ou substances de ce tableau ont un potentiel élevé d’abus, qui peut conduire à une dépendance psychologique ou physique grave. L’abus de cocaïne peut avoir des conséquences néfastes sur la santé. Environ 0,9 million d’adultes américains souffraient d’un trouble lié à l’usage de la cocaïne en 2014. Environ 40 % de l’ensemble des visites aux urgences liées à l’abus et à la consommation de drogues étaient attribuées à la cocaïne.
Des études antérieures ont systématiquement fait état des effets délétères de l’usage/abus de cocaïne sur le système cardiovasculaire. Les complications cardiaques liées à la cocaïne comprennent des affections aiguës telles que l’arythmie et l’infarctus aigu du myocarde (IM), ainsi que des affections chroniques telles que la cardiomyopathie et la maladie coronarienne (CAD). La cardiotoxicité induite par la cocaïne peut entraîner une mort subite. En outre, des études antérieures ont exploré les mécanismes physiopathologiques complexes de la cardiotoxicité de la cocaïne. Ici, nous passons d’abord en revue les mécanismes cellulaires et moléculaires de la cocaïne dans le système cardiovasculaire afin de mieux comprendre ses effets aigus et chroniques sur le cœur et les vaisseaux sanguins. En outre, nous discutons des preuves récentes provenant d’études humaines qui ont examiné les changements associés à la cocaïne dans le système cardiovasculaire. À ce titre, notre examen comprend des études cliniques récentes qui ont été publiées au cours des 10 dernières années (de septembre 2008 à septembre 2018) extraites de la base de données Medline, ainsi que plusieurs autres études cliniques importantes publiées avant septembre 2008.
2. Mécanismes physiopathologiques de la cocaïne sur la santé cardiovasculaire.
La cocaïne stimule le système nerveux sympathique en inhibant la recapture de la noradrénaline, de la dopamine et de la sérotonine en interagissant avec chaque transporteur, ce qui entraîne une activité exagérée et prolongée du système nerveux sympathique. La cocaïne bloque également les canaux sodium/potassium, ce qui induit des profils cardiovasculaires anormaux et déprimés. En particulier, l’abus simultané de cocaïne et d’alcool augmente de manière significative les niveaux de cocaïne dans le sang, ce qui entraîne des risques cardiovasculaires accrus et prolongés. Des études antérieures ont montré que l’usage/abus de cocaïne est associé à un risque accru de complications cardiovasculaires ultérieures telles que l’hypertension, le spasme coronarien, l’arythmie, l’infarctus, la cardiomyopathie, l’athérosclérose et la maladie coronarienne, comme le résume la figure 1. Dans cette section, nous résumons les mécanismes physiopathologiques aigus et chroniques de la cocaïne sur la santé cardiovasculaire.
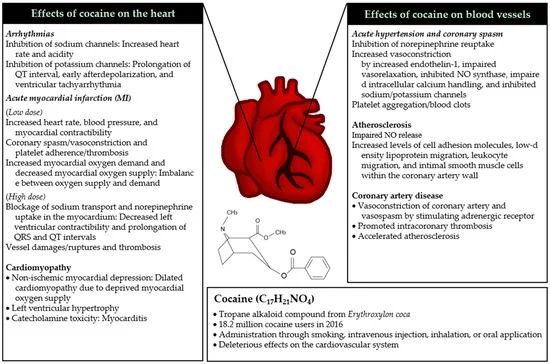
Effets de la cocaïne sur la santé cardiovasculaire. La consommation de cocaïne (en bas) entraîne des changements aigus (en italique) et chroniques (normaux) au niveau du cœur (à gauche) et des vaisseaux sanguins (à droite). (Remarque : la cocaïne induit souvent des troubles cardiaques (par exemple, infarctus du myocarde (IM) aigu et maladie coronarienne) en affectant simultanément le cœur et les vaisseaux).
2.1 Mécanismes de toxicité aiguë
2.1.1 Hypertension aiguë et spasme coronarien.
Les événements coronariens aigus surviennent généralement dans les minutes ou les heures qui suivent l’administration de cocaïne. La cocaïne stimule le système adrénergique en se liant aux transporteurs de la noradrénaline, ce qui augmente les effets de la noradrénaline sur les récepteurs postsynaptiques. Le blocage de la recapture de la norépinéphrine induit une tachycardie et une hypertension, ce qui augmente la demande en oxygène du myocarde et réduit l’apport en oxygène du myocarde par vasoconstriction. Ainsi, la cocaïne induit des effets sympathiques sur le système cardiovasculaire en augmentant les effets inotropes et chronotropes par le biais d’une vasoconstriction accrue. En particulier, la cocaïne induit une hypertension aiguë due à une vasoconstriction accrue induite par une augmentation de l’endothéline-1, une altération de la vasorelaxation induite par l’acétylcholine, une inhibition de l’oxyde nitrique synthase, une altération de la gestion du calcium intracellulaire et une inhibition des canaux sodiques/potassiques, comme cela a été déterminé par des approches analytiques cellulaires et moléculaires. En outre, les lésions aiguës des vaisseaux induisent une agrégation plaquettaire et la formation de caillots sanguins par le biais d’une augmentation du fibrinogène et du facteur de von Willebrand, ce qui entraîne des lésions cardiaques aiguës en raison d’une réduction du flux sanguin. Dans l’ensemble, la cocaïne induit une hypertension aiguë, un spasme coronarien, qui peut conduire à un infarctus du myocarde ultérieur.
2.1.2 Arythmies.
Des études antérieures ont montré que la cocaïne inhibe les canaux ioniques cardiaques tels que les canaux sodiques et potassiques. Il a été démontré que la montée du potentiel d’action était retardée en réponse au blocage des canaux sodiques, qui est modulé par la fréquence cardiaque et l’acidité. L’augmentation de la fréquence cardiaque et de l’acidité renforce l’effet de la cocaïne sur les canaux sodiques. L’inhibition des canaux sodiques s’intensifie en cas d’abus de cocaïne ou de formation de cocaéthylène après l’administration de cocaïne avec de l’alcool. Les effets de la cocaïne sur le blocage des canaux potassiques entraînent un allongement de l’intervalle QT, une post-dépolarisation précoce et une tachyarythmie ventriculaire. Comme pour les effets sur les canaux sodiques, l’abus de cocaïne ou la consommation de cocaïne avec de l’alcool exacerbe l’inhibition des canaux potassiques et l’allongement de l’intervalle QT. En outre, l’administration de cocaïne augmente la température corporelle, ce qui entraîne une hyperthermie. L’overdose de cocaïne peut induire des arythmies cardiaques et entraîner une altération du profil électrocardiographique, ce qui peut être lié à la prévalence accrue de la mortalité associée à la cocaïne par temps chaud et dans des lieux surpeuplés. En plus de ces facteurs, les arythmies cardiaques peuvent être affectées par d’autres facteurs tels que l’excès de catécholamines et le blocage des canaux calciques. L’acidose et les anomalies électrolytiques peuvent également moduler les arythmies cardiaques. Ainsi, les arythmies cardiaques induites par la cocaïne peuvent être générées par de nombreux mécanismes chez les consommateurs de cocaïne.
2.1.3 Infarctus aigu du myocarde.
Les mécanismes de l’infarctus aigu résultant de la consommation de cocaïne sont multifactoriels. La cocaïne et ses métabolites sont des agents sympathomimétiques et induisent des effets anesthésiques locaux. À faibles doses, les effets sympathiques induits par la cocaïne augmentent la fréquence cardiaque, la pression artérielle et la contractilité du myocarde, ce qui entraîne une augmentation de la demande en oxygène du myocarde. La cocaïne augmente également le spasme coronarien/la vasoconstriction et l’adhérence plaquettaire/la thrombose, ce qui réduit l’apport d’oxygène au myocarde. Ainsi, un déséquilibre entre l’apport et la demande en oxygène entraîne un infarctus du myocarde. À fortes doses, l’anesthésie locale induite par la cocaïne entraîne une diminution de la contractibilité du ventricule gauche (VG) et un allongement des intervalles QRS et QT dans les électrocardiogrammes en bloquant le transport du sodium et l’absorption de la norépinéphrine dans le myocarde. Dans les vaisseaux, la cocaïne contribue à l’infarctus du myocarde en augmentant l’endothéline-1 et en réduisant la production d’oxyde nitrique dans les cellules endothéliales. Lorsque les vaisseaux sont soumis à un stress, des dommages/ruptures aigus peuvent se produire, ce qui favorise la thrombose en augmentant l’activité/agrégation plaquettaire et en augmentant les niveaux de fibrinogène et l’activité de l’inhibiteur de l’activateur du plasminogène. Ces cascades cellulaires et moléculaires entraînent une réduction du flux sanguin cardiaque, ce qui provoque un infarctus aigu et, à long terme, une athérosclérose et une thrombose coronarienne. Ainsi, la cocaïne induit un infarctus aigu en affectant directement les tissus myocardiques dans le cœur et en augmentant indirectement la thrombose dans les vaisseaux.
2.2 Mécanismes de toxicité chronique.
2.2.1 Cardiomyopathie.
La cocaïne provoque un dysfonctionnement systolique ou une insuffisance ventriculaire gauche, qui résulte d’une réduction de la fraction d’éjection et d’une hypertrophie de la cavité ventriculaire gauche. L’administration de cocaïne réduit la contractilité myocardique et la fraction d’éjection et augmente la pression de fin de diastole du ventricule gauche et le volume de fin de systole. Elle peut provoquer une dépression myocardique non ischémique, entraînant des cardiomyopathies dilatées telles que la cardiomyopathie de Takotsubo, un type de cardiomyopathie non ischémique. Des études antérieures ont signalé que la cardiomyopathie induite par la cocaïne, en particulier la cardiomyopathie dilatée, résultant d’une privation de l’apport d’oxygène au myocarde malgré une demande accrue d’oxygène, entraîne une réduction du débit sanguin coronarien. La cardiomyopathie dilatée est la conséquence la plus fréquente de l’usage prolongé de cocaïne et peut entraîner plusieurs complications, notamment une insuffisance cardiaque et des anomalies des valves cardiaques. L’abus chronique de cocaïne est associé à une hypertrophie du ventricule gauche. En outre, il a été démontré que la toxicité des catécholamines due à la consommation chronique de cocaïne était associée à une myocardite, liée à une augmentation des réactions immunitaires locales et à une nécrose myocardique.
2.2.2 Athérosclérose.
L’athérosclérose coronarienne apparaît souvent chez les jeunes consommateurs de cocaïne ou chez les consommateurs de cocaïne souffrant d’autres maladies cardiovasculaires (par exemple, infarctus du myocarde). Selon des études antérieures, la cocaïne entrave la libération d’oxyde nitrique par les cellules endothéliales. En outre, la cocaïne augmente les niveaux de molécules d’adhésion cellulaire (par exemple, la molécule d’adhésion intracellulaire 1 (ICAM-1), le cluster de différenciation 54 (CD54), la molécule d’adhésion des cellules vasculaires 1 (VCAM-1), la molécule d’adhésion des leucocytes endothéliaux 1 (ELAM-1)), la migration des lipoprotéines de basse densité et la migration des leucocytes dans les vaisseaux sanguins. En outre, les cellules musculaires lisses intimales de la paroi de l’artère coronaire augmentent, ce qui entraîne probablement une progression de l’athérosclérose et un risque de mort cardiaque subite. D’après des études immunologiques, les mastocytes présents dans les plaques peuvent contribuer à l’athérosclérose, au vasospasme, à la thrombose et à la mort subite. En bref, les substances protéolytiques libérées par les mastocytes accélèrent l’athérosclérose en dégradant et en facilitant l’absorption du cholestérol des lipoprotéines de faible densité par les macrophages. L’histamine libérée par les mastocytes augmente la perméabilité endothéliale, ce qui entraîne la migration des leucocytes. Ainsi, la cocaïne a des effets complexes sur le dysfonctionnement des cellules endothéliales, facilite la migration des lipoprotéines de basse densité et des leucocytes, et augmente les cellules musculaires lisses intimales, ce qui contribue à l’athérosclérose chez les consommateurs à long terme.
2.2.3 Maladies des artères coronaires.
La consommation chronique de cocaïne provoque des dommages répétitifs au cœur et aux vaisseaux en interagissant avec les transporteurs de norépinéphrine. Les récepteurs alpha-2 adrénergiques induisent une vasoconstriction des artères coronaires par la contraction des cellules musculaires lisses vasculaires, ce qui entraîne des effets prothrombotiques dus à l’augmentation du facteur de von Willebrand. La cocaïne induit un vasospasme par la stimulation des récepteurs adrénergiques des artères coronaires. La cocaïne favorise également la thrombose intracoronaire par la libération accrue du facteur de von Willebrand, l’augmentation des niveaux de facteur tissulaire endothélial, un facteur important dans la pathogenèse du syndrome coronarien aigu (SCA), la diminution des niveaux de l’inhibiteur de la voie du facteur tissulaire et l’accélération de l’athérosclérose due au dysfonctionnement des cellules endothéliales. En outre, la consommation prolongée de cocaïne induit des lésions endothéliales, une fibrose vasculaire et un affaiblissement ultérieur de la paroi des vaisseaux, entraînant l’apoptose des cellules musculaires lisses vasculaires et une nécrose kystique médiane. Selon des rapports antérieurs, la cocaïne induit parfois des dissections coronariennes et aortiques carotidiennes. Ainsi, la cocaïne provoque des maladies coronariennes par des mécanismes multifactoriels comprenant la vasoconstriction, la thrombose intracoronaire et l’athérosclérose accélérée.
3. Cardiotoxicité de la cocaïne dans les études humaines.
La cardiotoxicité induite par la cocaïne peut avoir des effets délétères sur le cœur et les vaisseaux par le biais de mécanismes physiopathologiques multifactoriels, comme décrit ci-dessus. Dans cette section, nous nous concentrons sur les études humaines récentes publiées au cours des 10 dernières années, extraites de la base de données Medline. Le tableau 1 présente ces études qui ont examiné l’association entre la consommation de cocaïne et les maladies cardiovasculaires aiguës et chroniques et la mortalité.
[TABLEAU 1]
3.1 Effets aigus de la cocaïne.
Un certain nombre d’études ont fait état d’un lien possible entre la consommation de cocaïne et des affections cardiovasculaires aiguës telles que l’hypertension aiguë, l’arythmie, les anévrismes des artères coronaires (AAC) et l’infarctus aigu. Étant donné que les populations étudiées et les sources de données varient d’une étude à l’autre, les résultats de ces études doivent être interprétés avec précaution dans le contexte de chaque étude individuelle.
Kozor et al en Australie ont comparé la pression artérielle, la rigidité aortique et la masse du ventricule gauche chez les consommateurs de cocaïne avec ceux des non-consommateurs de cocaïne. Les auteurs ont recruté 20 consommateurs réguliers de cocaïne âgés de 37 ± 7 ans (85 % d’hommes) et 20 sujets témoins âgés de 33 ± 7 ans (95 % d’hommes). Cette étude a défini l’usage régulier de cocaïne comme la consommation de cocaïne au moins une fois par mois au cours de l’année précédant la réalisation de l’étude. Les résultats de l’étude ont montré que les consommateurs de cocaïne avaient une pression artérielle systolique plus élevée (134 ± 11 vs. 126 ± 11 mm Hg), une rigidité aortique accrue et une masse ventriculaire gauche plus importante (124 ± 25 vs. 105 ± 16 g) par rapport aux non-consommateurs de cocaïne.
En outre, Sharma et al ont examiné rétrospectivement les enregistrements d’électrocardiogrammes (ECG) de sujets dépendants de la cocaïne pour étudier la cardiotoxicité de la consommation de cocaïne. Les ECG ont été recueillis auprès de 97 sujets cocaïnomanes âgés de 50 ± 4 ans (86 % d’hommes) dans un centre de santé universitaire complet et de 8513 sujets non cocaïnomanes âgés de 52 ± 5 ans (46 % d’hommes) participant à l’étude ARIC (Atherosclerosis Risk in Communities). Les auteurs ont constaté des effets significatifs de la consommation de cocaïne sur la repolarisation précoce (odds ratio (OR) = 4,92, intervalle de confiance (IC) à 95 % : 2,73-8,87), la bradycardie (OR = 3,02, IC à 95 % : 1,95-4,66), la bradycardie sévère (OR = 5,11, IC à 95 % : 2,95-8,84) et la fréquence cardiaque (poids B = -5,84, IC à 95 % : -7,85 à -3,82). Récemment, un cas de bloc auriculo-ventriculaire (AV) de type II de Mobitz associé à la consommation de cocaïne a été rapporté [82]. Ce cas s’est produit chez une femme de 55 ans qui s’est présentée avec des douleurs thoraciques après avoir consommé de la cocaïne.
Satran et al ont étudié la prévalence des AAC chez les cocaïnomanes subissant une coronarographie en utilisant une base de données d’un centre médical aux États-Unis. La population étudiée comprenait 112 patients ayant des antécédents de consommation de cocaïne âgés de 44 ± 8 ans (79 % d’hommes) et 79 patients sans antécédents de consommation de cocaïne âgés de 46 ± 5 ans (61 % d’hommes). En se basant sur le fait que les consommateurs de cocaïne avaient un CAA significativement plus élevé que les non-consommateurs de cocaïne (30,4 % contre 7,6 %, respectivement), les auteurs ont conclu que les consommateurs de cocaïne étaient susceptibles d’être exposés à un risque accru d’infarctus du myocarde aigu.
Plusieurs études ont examiné l’association entre la consommation de cocaïne et l’infarctus du myocarde. Gupta et al [84] ont examiné l’incidence de l’infarctus du myocarde aigu avec sus-décalage du segment ST (STEMI), du choc cardiogénique, de la coronaropathie multivaisseaux et de la mortalité hospitalière dans le groupe cocaïne (n = 924) par rapport au groupe non-cocaïne (n = 102 028) parmi les patients admis dans les 24 heures suivant un infarctus du myocarde aigu. Cette étude a utilisé les données du National Cardiovascular Data Registry Acute Coronary Treatment and Intervention Outcomes Network Registry-Get With The Guidelines (ACTION Registry-GWTG). Comparé au groupe non cocaïné, le groupe cocaïné était plus jeune (âge moyen : 50 (44-56) vs. 64 (54-76)), avait une plus grande proportion d’hommes (80% vs. 65%) et d’Afro-Américains (45% vs. 9%), et moins de facteurs de risque cardiovasculaire traditionnels tels que l’hypertension (65% vs. 71%), la dyslipidémie (42% vs. 59%), un pontage coronarien antérieur (6% vs. 14%), et une revascularisation antérieure (24% vs. 31%). Gupta et al [84] ont trouvé des pourcentages plus élevés de STEMI (46% contre 40%) et de choc cardiogénique (13% contre 4%) chez les consommateurs de cocaïne, bien que leur pourcentage de CAD multivaisseaux soit plus faible (53% contre 65%) par rapport aux non-consommateurs de cocaïne. La mortalité hospitalière était similaire entre les deux groupes (OR = 1,00, 95% CI : 0,69-1,44). Une autre étude menée par Salihu et al [85] a inclus des femmes enceintes âgées de 13 à 49 ans afin d’examiner l’association entre la consommation de cocaïne et l’incidence de l’infarctus aigu ou de l’arrêt cardiaque pendant la grossesse ou l’accouchement. Cette étude rétrospective a utilisé les données de janvier 2002 à décembre 2014 du National Inpatient Sample (NIS), une grande base de données publique sur les patients hospitalisés aux États-Unis. Les résultats de l’étude ont montré que les consommatrices de cocaïne (n = 153 608) couraient un risque plus élevé d’infarctus aigu ou d’arrêt cardiaque que les non-consommatrices (n = 56 882 258), avec un OR ajusté de 1,83 (IC à 95 % : 1,28-2,62). Certaines études ont montré que l’association entre la consommation de cocaïne et l’infarctus du myocarde était influencée par des facteurs de confusion tels que les facteurs de risque cardiaque et les comportements à risque. Par exemple, Aslibekyan et al [86] ont mené une étude rétrospective sur la prévalence de l’infarctus du myocarde chez des adultes américains civils non institutionnalisés. Utilisant les données de la National Health and Nutrition Examination Survey (NHANES), leur étude a porté sur deux groupes d’âge différents : (a) les personnes âgées de 18 à 59 ans (n = 11 993, 46 % d’hommes) et (b) celles âgées de 18 à 45 ans (n = 9337, 39 % d’hommes). Bien qu’Aslibekyan et al [86] n’aient trouvé aucune association entre la consommation de cocaïne et l’infarctus du myocarde dans le groupe d’âge 18-59 ans, la consommation de cocaïne de plus de 10 fois au cours de la vie était significativement associée à l’infarctus du myocarde dans le groupe d’âge 18-45 ans après ajustement pour l’âge (OR ajusté pour l’âge = 4,60, IC à 95 % : 1,12-18,88). Cette association était influencée par les facteurs de risque cardiaque (par exemple, le tabagisme, les antécédents de diabète, d’hyperlipidémie et d’hypertension) dans le modèle ajusté multivarié (OR = 3,84, IC à 95 % : 0,98-15,07). Une autre étude rétrospective de Gunja et al [87] a examiné l’association de la consommation de cocaïne avec l’infarctus du myocarde et la mortalité toutes causes confondues à un an. L’étude a inclus des vétérans atteints de CAD qui ont subi un cathétérisme coronaire entre octobre 2007 et septembre 2014 en utilisant la base de données du Veterans Affairs. Comparé au groupe sans cocaïne (n = 118 953), le groupe cocaïne (n = 3082) était plus jeune (âge médian : 58 vs 65), plus susceptible d’être afro-américain (59% vs 11%) et présentait moins de facteurs de risque cardiaques traditionnels. Après ajustement des facteurs de risque cardiaque, la consommation de cocaïne était significativement associée à l’infarctus du myocarde (rapport de risque (RR) = 1,40, IC à 95 % : 1,07-1,83) ; toutefois, cette association s’est atténuée après prise en compte des comportements à risque dans le modèle séquentiel multivariable (RR = 1,17, IC à 95 % : 0,87-1,56).
En résumé, des études antérieures ont signalé que la consommation de cocaïne était associée à des troubles cardiovasculaires aigus tels qu’une pression artérielle élevée, une bradycardie (sévère), des AAC et un infarctus du myocarde aigu. Ces résultats sont cohérents avec des études antérieures documentant des infarctus liés à la cocaïne. Il convient de noter que les études de cette revue suggèrent que l’association entre la consommation de cocaïne et l’infarctus du myocarde pourrait être faussée par des facteurs de risque cardiaque ou des comportements à risque. Par conséquent, le risque d’infarctus chez les consommateurs de cocaïne doit être compris dans le contexte des facteurs de risque et des comportements à risque.
3.2 Effets chroniques de la cocaïne.
Plusieurs études ont examiné si la consommation de cocaïne était associée à des affections cardiovasculaires chroniques telles que la cardiomyopathie (par exemple, l’hypertrophie ventriculaire gauche), l’athérosclérose subclinique et la maladie coronarienne. Dans cette section, nous présentons les caractéristiques de chaque étude ainsi que ses résultats. Nous avons interprété les résultats en tenant compte des populations étudiées et des sources de données.
Maceira et al ont constaté que les cocaïnomanes présentaient une augmentation du volume ventriculaire gauche en fin de course, de l’indice de masse du ventricule gauche et du volume ventriculaire droit en fin de course, ainsi qu’une diminution de la fraction d’éjection du ventricule gauche et de la fraction d’éjection du ventricule droit. Les participants à l’étude étaient 94 cocaïnomanes âgés de 37 ± 7 ans (86 % d’hommes) qui se rendaient pour la première fois dans une clinique de réadaptation. Ils ont été comparés à un groupe sain apparié selon l’âge et le sexe. Comme mentionné précédemment, Kozor et al ont également montré une plus grande masse ventriculaire gauche chez les consommateurs réguliers de cocaïne par rapport aux non-consommateurs de cocaïne.
En outre, plusieurs études antérieures ont examiné l’association entre la consommation de cocaïne et la CAD. Les effets de la cocaïne sur la CAD subclinique ont été examinés à l’aide de différents marqueurs de substitution de la CAD. Par exemple, Arora et al ont examiné la présence d’une maladie coronarienne subclinique en utilisant l’épaisseur de l’intima de la carotide (CIMT) comme marqueur de substitution. Cette étude transversale a porté sur 33 adultes caucasiens âgés de 37 ± 9 ans qui consommaient de la cocaïne (33 % d’hommes). Leurs conclusions ne suggèrent aucune association entre la consommation chronique de cocaïne et la CAD subclinique mesurée par la CIMT. Une autre étude menée par Bamberg et al. a examiné l’association entre la consommation de cocaïne et la CAD et le SCA à l’aide de la tomodensitométrie coronaire (CT). Les sujets de l’étude étaient des patients qui s’étaient présentés aux urgences pour une douleur thoracique aiguë. Dans cette étude de cohorte imbriquée, il y avait 44 patients dans le groupe cocaïne âgés de 46 ± 7 ans (86 % d’hommes) et 132 patients dans le groupe non-cocaïne apparié selon l’âge et le sexe. Les auteurs n’ont pas trouvé d’association significative entre la consommation de cocaïne et la sténose coronarienne, mais ont trouvé une association significative entre la consommation de cocaïne et le SCA (OR = 5,79, IC à 95 % : 1,24-27,02). Chang et al ont mené une autre étude transversale qui incluait des patients ayant bénéficié d’une angiographie coronaire par tomographie informatisée (CTA) pour l’évaluation de la CAD aux urgences. Les patients présentaient un risque faible à intermédiaire de SCA. Parmi ces patients, les consommateurs de cocaïne étaient âgés de 46 ± 6 ans (n = 157, 58 % d’hommes), tandis que le groupe des non-consommateurs de cocaïne était âgé de 48 ± 9 ans (n = 755, 40 % d’hommes). Chang et al n’ont pas trouvé d’association entre l’usage répété de cocaïne et les calcifications coronaires ou entre l’usage récent de cocaïne et la CAD. Comme indiqué précédemment, Gupta et al ont étudié l’incidence de la CAD multivaisseaux en plus du STEMI et du choc cardiogénique entre le groupe cocaïne (n = 924) et le groupe non-cocaïne (n = 102 028) parmi les patients admis dans les 24 heures suivant un infarctus aigu. Ils ont constaté un pourcentage plus faible de CAD multivaisseaux chez les consommateurs de cocaïne que chez les non-consommateurs (53 % contre 65 %), bien que les pourcentages de STEMI (46 % contre 40 %) et de choc cardiogénique (13 % contre 4 %) aient été plus élevés. Contrairement à ces études, une étude de Lai et al a révélé un risque plus élevé de CAD subclinique chez les consommateurs de cocaïne que chez les non-consommateurs (rapport de prévalence ajusté au score de propension (PR) = 1,27, IC à 95 % : 1,08-1,49). Les sujets de l’étude de Lai et al étaient des Afro-Américains âgés de 45 ans (intervalle interquartile (IQR) : 40-50), dont 60% étaient des hommes. Environ 67 % des sujets étaient séropositifs. Dans cette étude transversale, la CAD subclinique était définie par la présence de calcium dans les artères coronaires (CAC) détecté par tomodensitométrie sans contraste et/ou de plaque coronaire détectée par angiographie par tomodensitométrie avec renforcement du contraste (CCTA). Les consommateurs chroniques de cocaïne présentaient un risque significativement plus élevé de présence de CAC (PR ajusté au score de propension = 1,26, IC à 95 % : 1,05-1,52), de toute sténose coronaire (PR ajusté au score de propension = 1,30, IC à 95 % : 1,08-1,57) et de plaques calcifiées (PR ajusté au score de propension = 1,37, IC à 95 % : 1,10-1,71), en plus de la présence de CAD subclinique. Une autre étude menée par Lucas et al [92] a montré une association significative entre la consommation de cocaïne et la formation de plaques carotidiennes. Plus de 90 % des sujets de cette étude étaient afro-américains. Les non-consommateurs de cocaïne étaient âgés de 46 ans (IQR : 41-53), et 67% étaient des hommes. Les anciens consommateurs de cocaïne étaient âgés de 51 ans (IQR : 46-54) et 66% étaient des hommes. Les consommateurs actuels de cocaïne étaient âgés de 49 ans (IQR : 45-52) et 75% étaient des hommes. Parmi les sujets de l’étude, environ 66% étaient séropositifs. Par rapport aux non-consommateurs de cocaïne, les anciens consommateurs de cocaïne et les consommateurs actuels avaient environ trois fois plus de chances d’avoir des plaques carotidiennes au départ (OR = 3,3, IC à 95 % : 1,5-7,3 et OR = 2,7, IC à 95 % : 1,3-5,5, respectivement).
En résumé, la cocaïne a été associée à un risque élevé de cardiomyopathie caractérisée par une hypertrophie du ventricule gauche et de SCA. En particulier, une étude a trouvé un risque environ six fois plus élevé de SCA chez les consommateurs de cocaïne. Cependant, les études ont rapporté des résultats contradictoires concernant l’association entre la consommation de cocaïne et la CAD subclinique. Certaines études n’ont trouvé aucune association entre la consommation de cocaïne et les calcifications coronaires. Ce résultat est cohérent avec les conclusions de l’étude Coronary Artery Risk Development in Young Adults (CARDIA) qui a examiné l’association entre l’exposition à la cocaïne et la prévalence des calcifications coronariennes en incluant plus de 3 000 participants. L’étude CARDIA n’a signalé aucune relation entre l’exposition à la cocaïne et la calcification coronarienne après ajustement en fonction de l’âge, du sexe, de l’origine ethnique, du statut socio-économique, des antécédents familiaux, du tabagisme et de la consommation d’alcool. Cependant, Lai et al ont rapporté que la consommation de cocaïne était associée à une athérosclérose coronarienne subclinique. Lai et al ont également montré cette association dans leurs études antérieures. De même, Lucas et al. ont constaté une plus grande formation de plaques carotidiennes au départ chez les consommateurs de cocaïne que chez les non-consommateurs. Cette variabilité des résultats entre les études concernant l’association entre la consommation de cocaïne et la maladie coronarienne subclinique pourrait s’expliquer par les différents profils de facteurs de risque de maladie coronarienne des populations étudiées. Les études rapportant des plaques associées à la cocaïne incluaient principalement des participants afro-américains, dont 40 à 100 % étaient séropositifs. En revanche, toutes les autres études ne montrant aucune association entre la consommation de cocaïne et les calcifications coronariennes n’incluaient aucune personne séropositive. Il est largement connu que l’infection par le VIH est un facteur de risque de maladie coronarienne. Par conséquent, les sujets de l’étude séropositifs peuvent avoir été plus exposés au risque de développer une maladie coronarienne, comme l’ont souligné Arora et al.
3.3 Effets de la cocaïne sur la mortalité.
Plusieurs études ont estimé la mortalité cardiovasculaire chez les consommateurs de cocaïne. Ces études ont donné des résultats mitigés en ce qui concerne l’association entre la consommation de cocaïne et la mortalité cardiovasculaire. Certaines études ont rapporté un risque plus élevé de mortalité cardiovasculaire chez les consommateurs de cocaïne que chez les non-consommateurs. Par exemple, DeFilippis et al ont analysé rétrospectivement les dossiers de patients ayant subi un infarctus à un âge ≤50 ans entre 2000 et 2016 afin d’examiner le risque de consommation de cocaïne pour la mortalité cardiovasculaire et la mortalité toutes causes confondues. Les données des patients ont été obtenues auprès de deux grands centres médicaux universitaires aux États-Unis Il y avait 99 individus dans le groupe cocaïne (âge moyen : 44 (40-46), 85% d’hommes) et 1873 individus dans le groupe non-cocaïne (âge moyen : 45 (42-48), 80% d’hommes). Les auteurs ont trouvé des associations significatives entre la consommation de cocaïne et la mortalité cardiovasculaire (HR = 2,32, IC à 95 % : 1,11-4,85) et la mortalité toutes causes confondues (HR = 1,91, IC à 95 % : 1,11-3,29). En Espagne, Morentin et al [94] ont étudié la prévalence de l’usage récent de cocaïne chez les personnes décédées par mort cardiovasculaire subite entre janvier 2003 et décembre 2009 (n = 311). L’âge moyen était de 41 ± 7 ans et 82 % étaient des hommes. Les personnes décédées d’une mort subite non due à une maladie cardiovasculaire (SnoCVD) ont servi de groupe de contrôle (n = 126). L’âge moyen et le pourcentage d’hommes dans le groupe de contrôle étaient de 39 ± 7 ans et de 71 %. Les auteurs ont constaté que la consommation récente de cocaïne était un facteur de risque significatif pour les MCV (OR = 4,10, IC à 95 % : 1,12-15,0). En revanche, Qureshi et al ont constaté que la consommation régulière de cocaïne n’était pas associée à la mortalité cardiovasculaire (risque relatif (RR) = 0,6, IC à 95 % : 0,1-4,7). Les sujets de cette étude rétrospective étaient des adultes civils américains non institutionnalisés, âgés de 18 à 45 ans, figurant dans l’ensemble de données NHANES. L’étude comprenait 7751 non-consommateurs de cocaïne (âge moyen : 31 ± 8 ans, 43% d’hommes) et 178 consommateurs réguliers de cocaïne (consommation de cocaïne au cours de la vie > 100 fois) (âge moyen : 33 ± 7 ans, 70% d’hommes). Bien que les résultats de l’étude aient montré une association significative entre la consommation régulière de cocaïne et la mortalité toutes causes confondues (RR = 1,9, IC à 95 % : 1,2-3,0), la consommation régulière de cocaïne n’a pas été associée à la mortalité cardiovasculaire.
Des études antérieures portant sur l’association entre la consommation de cocaïne et la mortalité toutes causes confondues ont également donné des résultats contradictoires. Dans certaines études, la consommation de cocaïne était significativement associée à la mortalité toutes causes confondues. Comme mentionné précédemment, DeFilippis et al et Qureshi et al ont constaté que la mortalité toutes causes confondues était environ deux fois plus élevée chez les consommateurs de cocaïne que chez les non-consommateurs. De même, Hser et al ont constaté un risque de mortalité élevé associé à la consommation de cocaïne par rapport à la consommation de méthamphétamine (HR = 3,56, IC à 95 % : 1,95-6,48). Les sujets de cette étude étaient des femmes admises dans des programmes de traitement de la toxicomanie aux États-Unis entre 2000 et 2002. Contrairement aux résultats de ces études, certaines études n’ont pas rapporté d’association significative entre la mortalité hospitalière et la consommation de cocaïne. Atoui et al ont réalisé une étude rétrospective des dossiers de patients admis pour des douleurs thoraciques dans un hôpital américain entre juillet 2009 et juin 2010. Parmi la population étudiée sans facteur de risque de CAD, 54 étaient des consommateurs de cocaïne (âge moyen = 44 ± 10 ans, 59 % d’hommes) et 372 étaient des non-consommateurs de cocaïne (âge moyen = 43 ± 12 ans, 49 % d’hommes). Les résultats de l’étude n’ont pas montré de différences significatives dans la durée du séjour et la mortalité à l’hôpital entre les consommateurs et les non-consommateurs de cocaïne. De même, dans l’étude susmentionnée de Gupta et al, la mortalité hospitalière n’était pas significativement différente entre le groupe cocaïne et le groupe non cocaïne (OR = 1,00, IC 95% : 0,69-1,44). Comme mentionné précédemment, dans l’étude de Gunja et al, la consommation de cocaïne s’est avérée initialement significativement associée à la mortalité toutes causes confondues à un an après ajustement des facteurs de risque cardiaque et des comportements à risque chez les anciens combattants atteints de CAD (HR = 1,22, IC à 95 % : 1,04-1,42). Cependant, après avoir contrôlé les conditions de la voie causale, la mortalité n’était plus significativement associée à la consommation de cocaïne (HR : 1,15, IC à 95 % : 0,99-1,33).
En résumé, certaines études antérieures ont rapporté une association entre la consommation de cocaïne et la mortalité cardiovasculaire ou toutes causes confondues. Cependant, cette association n’a pas été observée dans d’autres études. Les variations de résultats entre les études peuvent être dues à l’hétérogénéité des caractéristiques des patients (par exemple, l’âge), les comportements à risque (par exemple, le tabagisme, la consommation d’alcool ou d’autres drogues illicites), et les facteurs de risque traditionnels (par exemple, les morbidités), qui sont tous des prédicteurs de la mortalité. En effet, l’étude de Gunja et al a montré comment l’association entre l’usage de cocaïne et la mortalité était perturbée par ces facteurs. Dans leur étude, la cocaïne a d’abord été associée à une augmentation de la mortalité toutes causes confondues. Cependant, cette association n’a plus été observée après avoir contrôlé les conditions de la voie causale telles que l’insuffisance cardiaque congestive, le choc cardiogénique, la dialyse, la dépression, l’anxiété, le SCA et l’état clinique. Ce résultat suggère que les effets de la cocaïne sur la mortalité dépendent largement des facteurs de risque cliniques individuels. Notamment, le risque de mortalité n’était pas significativement plus élevé chez les consommateurs de cocaïne si ces derniers présentaient moins de facteurs de risque que les non-consommateurs de cocaïne. Par exemple, les sujets des études menées par Atoui et al et Gupta et al étaient respectivement des personnes à faible risque de MCV et de jeunes adultes présentant peu de facteurs de risque CV. Les deux études n’ont trouvé aucune association entre la consommation de cocaïne et la mortalité. En revanche, les sujets des études rapportant une association entre la consommation de cocaïne et la mortalité présentaient un risque plus élevé. La présence de facteurs de risque est susceptible d’augmenter le risque de mortalité suite à la consommation de cocaïne. En outre, la fréquence de la consommation de cocaïne pourrait être un facteur important affectant le risque de mortalité chez les consommateurs de cocaïne. Comme l’a observé l’étude de Qureshi et al. la mortalité toutes causes confondues était environ deux fois plus élevée chez les consommateurs réguliers de cocaïne (consommation de cocaïne au cours de la vie > 100 fois) que chez les non-consommateurs de cocaïne. Cependant, la mortalité toutes causes confondues des consommateurs peu fréquents de cocaïne (consommation de cocaïne au cours de la vie : 1-10 fois) ou des consommateurs fréquents de cocaïne (consommation de cocaïne au cours de la vie > 10 fois) n’était pas significativement différente de celle des non-consommateurs de cocaïne dans cette étude.
4. Cocaïne et nutrition.
La consommation ou l’abus de cocaïne affecte souvent le comportement de prise alimentaire et supprime l’appétit, ce qui peut entraîner une perturbation de la régulation métabolique et neuroendocrinienne. En outre, la malnutrition induite par la cocaïne peut diminuer les niveaux de neurotransmetteurs et altérer l’absorption et l’utilisation des acides aminés. Ainsi, l’exposition chronique à la cocaïne peut entraîner un risque accru de problèmes de santé tels que l’hypertension, les problèmes de poids, le diabète et le syndrome métabolique.
La cocaïne affecte l’appétit et le poids corporel par des mécanismes multifactoriels. Comme mentionné précédemment, la cocaïne inhibe la recapture de la dopamine en interagissant avec le transporteur de la dopamine, ce qui entraîne une augmentation des niveaux de dopamine dans le système nerveux central. Par la suite, les changements dans les niveaux de dopamine affectent le comportement alimentaire et le poids corporel. L’augmentation de la neurotransmission dopaminergique supprime la prise alimentaire globale alors qu’elle augmente la prise d’aliments riches en graisses. En outre, la cocaïne bloque la recapture de la sérotonine en interagissant avec le transporteur de la sérotonine, induisant un effet anorexique dépendant de la leptine. Des études antérieures ont démontré que la cocaïne régulait également les neuromodulateurs tels que le transcrit régulé par la cocaïne et les amphétamines (CART), qui joue un rôle important dans la régulation de la prise alimentaire, le maintien du poids corporel et les fonctions endocriniennes et cardiovasculaires. Il a été rapporté que la surexpression de CART diminuait la prise alimentaire et modifiait le métabolisme lipidique lié au stockage des graisses.
Conformément à ces mécanismes, plusieurs études précliniques ont montré les effets de la cocaïne sur la consommation alimentaire et l’état nutritionnel des animaux. Par exemple, Balopole et al ont signalé une diminution de la prise alimentaire après l’administration de cocaïne à des rats (10, 15 et 25 mg/kg). Ils ont constaté que l’anorexie induite par la cocaïne était transitoire et dépendante de la dose. Après une heure d’effet anorexique, il a été démontré que les animaux surconsommaient des aliments. Par conséquent, la consommation totale d’aliments n’était pas significativement différente entre les rats exposés à la cocaïne et ceux exposés à la solution saline. Une autre étude a examiné les effets de la cocaïne sur la consommation de lait et le poids corporel des rats. Les résultats de cette étude suggèrent que la cocaïne perturbe l’ingestion principalement en interférant avec la phase appétitive du comportement alimentaire (orientation et approche de la nourriture) plutôt qu’avec la phase de consommation (ingestion de la nourriture). Une étude de Church et al a examiné les effets de l’exposition prénatale à la cocaïne sur la toxicité maternelle/fœtale chez les animaux. Les traitements à la cocaïne chez les rats (20, 30, 40 et 50 mg/kg) ont entraîné des réductions significatives de la prise de poids de la mère et de la consommation de nourriture de manière dose-dépendante. La dénutrition a entraîné une réduction significative du poids du fœtus. Cependant, la consommation d’eau par la mère a augmenté de manière significative chez les animaux exposés à la cocaïne, probablement en raison de l’augmentation de l’activité locomotrice et de l’effet diurétique. En outre, la cocaïne a provoqué des diarrhées chez certains animaux ayant reçu des doses élevées, ce qui suggère que la cocaïne, en tant qu’irritant gastro-intestinal, pourrait provoquer une malabsorption et une perte d’électrolytes et de nutriments, ce qui, en fin de compte, peut entraîner une malnutrition.
Des études humaines ont également montré les effets anorexigènes de la cocaïne et la réduction de poids qui en résulte chez les consommateurs de cocaïne. Un faible apport calorique, associé à des fonctions métaboliques et gastro-intestinales anormales, peut conduire à la malnutrition chez les consommateurs de cocaïne. Par exemple, Escobar et al ont constaté que les taux d’hémoglobine et d’hématocrite chez les consommateurs de cocaïne étaient inférieurs à la normale, ce qui indique une malnutrition protéino-énergétique et une anémie. Comme l’ont souligné les auteurs, l’anémie dans cette population pourrait être associée à un régime pauvre en micronutriments (par exemple, le fer), à une consommation inadéquate de protéines et à des problèmes cliniques tels qu’une diminution de la sécrétion du facteur intrinsèque, des perforations intestinales et des maladies bactériennes ou infectieuses. En effet, trois cas ont été rapportés où des patients ont dû être opérés pour leurs perforations intestinales après avoir consommé de la cocaïne. La cocaïne a entraîné une vasoconstriction mésentérique et une ischémie tissulaire focale en bloquant la recapture de la norépinéphrine, ce qui pourrait entraîner des perforations intestinales. Dans l’étude d’Escobar et al., les consommateurs de cocaïne présentaient également des profils lipidiques et glycémiques altérés, avec de faibles taux de cholestérol à lipoprotéines de haute densité (HDL) et des taux élevés de triglycérides, de cholestérol LDL, de cholestérol total et de glucose. Ces résultats suggèrent que les consommateurs de cocaïne pourraient présenter un risque élevé de problèmes métaboliques et cardiovasculaires. Il convient de noter que les consommateurs de cocaïne n’ont pas pris de poids malgré une augmentation compensatoire de la consommation de graisses à la suite de l’anorexie induite par la cocaïne. Cependant, l’arrêt de la consommation de cocaïne a entraîné une prise de poids. Dans une étude menée par Ersche et al, les consommateurs de cocaïne ont consommé beaucoup plus d’aliments gras et d’hydrates de carbone que les non-consommateurs de cocaïne, mais il n’y a pas eu d’augmentation de poids concomitante dans le groupe cocaïne. Les auteurs ont suggéré qu’un déséquilibre entre la consommation et le stockage des graisses pourrait conduire à une prise de poids chez les consommateurs de cocaïne lorsqu’ils arrêtent d’en consommer. Ce déséquilibre pourrait résulter d’altérations métaboliques dues à la consommation répétée de cocaïne. Il est bien connu que la prise de poids augmente le risque de troubles cardio-métaboliques tels que le diabète et les maladies cardiovasculaires. Par conséquent, le contrôle du poids, en tant que moyen de prévenir et de réduire les maladies cardiovasculaires, a des implications profondes pendant l’abstinence de cocaïne.
En résumé, la consommation de cocaïne affecte le comportement alimentaire et supprime l’appétit, ce qui conduit à la malnutrition et à l’anorexie par la perturbation du processus métabolique et de la régulation neuroendocrinienne. En outre, l’absorption de cocaïne dans l’organisme peut entraîner une vasoconstriction mésentérique et une ischémie tissulaire focale, et modifier les profils lipidiques et glycémiques, ce qui entraîne probablement un risque accru de problèmes métaboliques et cardiovasculaires chez les consommateurs de cocaïne. Notamment, l’arrêt de la consommation de cocaïne entraîne une prise de poids soudaine/excessive pendant la période/le processus de récupération, ce qui accroît les risques cardiovasculaires et cardiométaboliques. Ainsi, les changements induits par la cocaïne dans les habitudes alimentaires et le processus métabolique peuvent entraîner des complications cardiovasculaires pendant les périodes de dépendance et d’arrêt de la consommation.
5. Conclusions.
On sait que la consommation/abus de cocaïne modifie l’état nutritionnel et le métabolisme, ce qui peut entraîner un risque accru d’affections à long terme, notamment de troubles de l’alimentation, de syndrome métabolique et d’anomalies psychologiques. Dans cette revue, nous nous concentrons sur les effets délétères aigus et chroniques de la consommation de cocaïne, en particulier sur les résultats cardiovasculaires. Nous avons résumé les mécanismes physiopathologiques de la cocaïne sur la santé cardiovasculaire, qui sont multifactoriels et complexes. Comparés aux effets chroniques, les effets aigus de la cocaïne ont été bien caractérisés dans des études antérieures. La consommation de cocaïne, un puissant stimulant cardiovasculaire, a été associée à des anomalies électrocardiographiques, à une élévation de la pression artérielle, à des arythmies et à des infarctus aigus. Le risque d’infarctus chez les consommateurs de cocaïne était particulièrement influencé par les facteurs de risque cardiaque et les comportements à risque des individus. La consommation de cocaïne peut entraîner des affections aiguës de manière multifactorielle, par exemple en bloquant les canaux sodiques/potassiques dans le cœur et en augmentant le spasme/la vasoconstriction des artères coronaires dans les vaisseaux. En revanche, les effets chroniques de la cocaïne sont difficiles à déterminer, comme le montrent les résultats contradictoires des études antérieures. Certaines études ont signalé une association entre la consommation chronique de cocaïne et l’athérosclérose coronarienne en utilisant la calcification coronarienne comme marqueur. À l’inverse, d’autres études n’ont démontré aucune association entre la consommation chronique de cocaïne et la calcification coronarienne. Il convient de noter que les sujets inclus dans les études montrant cette association présentaient un risque plus élevé de maladie coronarienne que ceux des études ne montrant pas d’association. Par conséquent, les effets chroniques de la cocaïne peuvent avoir été plus importants chez les personnes présentant des profils de facteurs de risque de maladie coronarienne plus élevés. Les contributions de la cocaïne aux maladies chroniques étaient également multiples. L’exposition à long terme à la cocaïne peut exercer des effets chroniques, par exemple sur le cœur par le biais d’une dépression myocardique non ischémique et sur les vaisseaux en induisant des lésions des cellules endothéliales et une thrombose intracoronaire. En outre, des études antérieures ont suggéré que les comportements à risque, les facteurs de risque de maladies cardiovasculaires et la fréquence de la consommation de cocaïne peuvent contribuer à l’association entre la consommation de cocaïne et la mortalité. Pour évaluer plus précisément les effets de la consommation de cocaïne à long terme sur l’athérosclérose et la mortalité, il est nécessaire de réaliser de grandes études longitudinales bien conçues avec des sujets issus de populations à faible risque et à risque élevé. Un traitement par β-bloquants a souvent été suggéré pour les consommateurs de cocaïne, en particulier pour ceux qui souffrent d’insuffisance cardiaque associée à la cocaïne. Des études ont montré que les β-bloquants abaissaient la pression artérielle, amélioraient la fraction d’éjection du ventricule gauche et réduisaient l’incidence de l’infarctus et de la mortalité chez les consommateurs de cocaïne. La compréhension des mécanismes physiopathologiques multifactoriels de la cocaïne pourrait aider les cliniciens à reconnaître les différents symptômes après l’usage/abus de cocaïne et à améliorer le traitement des patients présentant des symptômes aigus ou chroniques. Les divers effets CV délétères résultant de la consommation de cocaïne soulignent la nécessité d’informer sur les effets cardiaques néfastes de la consommation de cocaïne et d’offrir aux cocaïnomanes un accès à des interventions efficaces. Parallèlement, il est également important de modifier le mode de vie et les comportements (par exemple, l’abus d’alcool ou le tabagisme) pour réduire les effets cardiaques néfastes auxquels ces facteurs comportementaux contribuent chez les consommateurs de cocaïne.