Moningka, H., Lichenstein, S., & Yip, S. W. (2019). Current understanding of the neurobiology of opioid use disorder: An overview. Current behavioral neuroscience reports, 6, 1-11.
Abstract.
Objectif de la revue :
Cette revue donne une vue d’ensemble des mécanismes neurobiologiques qui sous-tendent le trouble de l’usage des opiacés (OUD) en s’appuyant sur des recherches en génétique, en imagerie par résonance magnétique (IRM) fonctionnelle et structurelle.
Résultats récents :
Des preuves préliminaires suggèrent une association entre l’OUD et des variantes spécifiques des gènes DRD2, du récepteur δ-opioïde 1 (OPRD1) et du récepteur μ-opioïde 1 (OPRM1). En outre, la recherche par IRM indique des altérations fonctionnelles et structurelles dans les régions cérébrales striatales et corticolimbiques et les voies sous-jacentes aux processus de récompense, d’émotion/stress et de contrôle cognitif chez les personnes atteintes d’OUD.
Résumé :
Les différences individuelles dans les caractéristiques génétiques, fonctionnelles et structurelles du cerveau sont corrélées aux différences de gravité de l’OUD et aux résultats du traitement, et peuvent donc potentiellement être utilisées un jour pour informer la sélection du traitement de l’OUD. Cependant, étant donné l’hétérogénéité des résultats rapportés, d’autres recherches longitudinales à différents stades de la dépendance aux opiacés sont nécessaires pour obtenir une caractérisation convergente de l’OUD et améliorer le traitement et la prévention.
Introduction.
La consommation non médicale d’opioïdes constitue un grave problème de santé publique à l’échelle mondiale et est associée à des conséquences physiques et psychosociales néfastes pour l’individu. La consommation régulière et prolongée d’opioïdes peut entraîner un trouble de l’usage des opioïdes (OUD), un trouble chronique récidivant caractérisé par une diminution du contrôle de la consommation de drogues et une altération du fonctionnement comportemental et psychosocial. Selon des estimations récentes, près de trois millions d’individus aux États-Unis ont été diagnostiqués avec un OUD en 2015, faisant ainsi peser une énorme charge économique sur le système de santé. En outre, un tiers des personnes atteintes d’OUD en cours de traitement déclarent avoir consommé des opioïdes avant l’âge de 18 ans, et les taux de mortalité attribués aux surdoses d’opioïdes ont quadruplé depuis 1999. Il est donc urgent d’améliorer les stratégies de prévention et de traitement.
Les interventions pharmacologiques et comportementales sont toutes deux prometteuses dans le traitement de l’OUD. Les traitements assistés par médicaments (TAM) avec des agents opioïdes tels que la méthadone (agoniste), la buprénorphine (agoniste partiel) et la naltrexone (antagoniste) sont largement utilisés comme traitement de première ligne de l’OUD. En outre, les preuves empiriques de l’efficacité de la thérapie cognitivo-comportementale en tant qu’adjuvant à la MAT pour l’OUD se sont multipliées (6-8). Cependant, ces interventions fondées sur des données probantes donnent encore des résultats variables selon les individus et l’évolution clinique de l’OUD est souvent entachée de multiples tentatives de traitement infructueuses. Il est donc nécessaire de poursuivre les recherches afin d’identifier les facteurs de différence individuels qui confèrent le risque et la résilience pour l’acquisition de l’OUD et la rechute afin d’améliorer les interventions existantes et d’en développer de nouvelles.
Les facteurs qui sous-tendent l’apparition, le maintien et la rechute de l’OUD sont multiples. La recherche sur les addictions commence à mieux comprendre comment les processus psychologiques, y compris les émotions, les cognitions et les comportements, sont cartographiés au niveau neuronal et, en retour, comment les facteurs génétiques et socio-environnementaux influencent le développement et le fonctionnement des neurones. La recherche en génétique est prometteuse pour l’identification des variantes génétiques qui confèrent le risque et la résilience à l’OUD et les différences interindividuelles dans la réponse au traitement. En outre, des études de neuro-imagerie ont mis en évidence des altérations fonctionnelles et structurelles des neurones chez les personnes souffrant d’OUD, qui pourraient jouer un rôle dans les résultats du traitement.
Les données existantes suggèrent que la capacité à résister à l’envie de drogue et à rester abstinent dépend des interactions dynamiques entre les systèmes de contrôle cognitif et inhibiteur, notamment le cortex préfrontal (CPF) et les systèmes limbiques sous-corticaux qui sous-tendent la récompense, la régulation des émotions et du stress et les processus motivationnels liés à la recherche et à la consommation de drogue. Ces connaissances ont fait progresser les théories neurobiologiques de l’OUD et des troubles liés à la consommation de substances (SUD) en général et peuvent faciliter la recherche de biomarqueurs neuronaux fiables qui sous-tendent la physiopathologie de l’OUD, suivent la gravité du trouble et prédisent la réponse au traitement.
La présente étude vise à mettre en évidence les découvertes récentes et notables dans le domaine de la neuroscience des addictions qui permettent de mieux comprendre la physiopathologie des OUD, et à discuter des implications cliniques de ces découvertes pour améliorer les efforts de prévention et de traitement. Nous nous concentrons spécifiquement sur les contributions génétiques à l’OUD et sur les études utilisant l’IRM fonctionnelle et structurelle pour examiner les activations neuronales basées sur la tâche, la connectivité fonctionnelle à l’état de repos (RSFC), la morphométrie cérébrale ou les caractéristiques microstructurelles de la substance blanche.
Le système opioïde endogène.
Le système opioïde endogène est composé d’un groupe de récepteurs et de peptides qui sont largement distribués dans les systèmes nerveux périphériques et centraux (16). Il existe trois classes principales de récepteurs opioïdes couplés aux protéines G (mu(μ), MOR ; delta(δ), DOR ; et kappa(κ), KOR) qui sont stimulés par trois familles de peptides opioïdes endogènes (β-endorphines, enképhalines et dynorphines). Bien qu’un gène code pour chaque récepteur (OPRM1, OPRD1 et OPRK1), il y a plus de 60% de chevauchement dans leur composition en acides aminés. Ces récepteurs sont fortement exprimés dans les zones du cerveau responsables des processus de récompense, de stress et d’analgésie (par exemple, l’aire tegmentale ventrale, VTA ; le noyau accumbens, NAcc ; le cortex préfrontal, PFC ; le thalamus ; l’hypothalamus et l’amygdale étendue) et sont impliqués dans la modulation de ces circuits. Les récepteurs opioïdes peuvent également être activés par des opiacés alcaloïdes exogènes tels que la morphine, l’héroïne et d’autres opioïdes synthétiques (par exemple, le fentanyl).
Les MOR ont été les plus étudiés en raison de leur rôle dans la médiation des actions des agents analgésiques cliniquement pertinents et des drogues d’abus. L’activation des MOR stimule la libération dopaminergique de la VTA dans le striatum ventral et le MPFC en inhibant les interneurones locaux de l’acide γ-aminobutyrique (GABA. En outre, les MOR sont présents dans les voies descendantes modulant la douleur (par exemple, la zone grise périaqueducale et la médulla locus coeruleus) et, lorsqu’ils sont activés, les MOR de ces sites inhibent directement les neurones qui bloquent la transmission de la douleur de la moelle épinière. Par conséquent, les MOR dans deux voies distinctes sous-tendent les effets euphoriques et analgésiques des opioïdes, ce qui souligne à la fois leur valeur thérapeutique dans le soulagement de la douleur chronique et leur risque d’abus.
Les MOR sont impliqués de manière critique dans le codage des effets gratifiants et renforçants des drogues, comme le démontre l’absence d’effets physiologiques et gratifiants de la morphine chez les souris knockout MOR. En revanche, l’auto-administration de morphine est intacte chez les souris knockout DOR, ce qui indique que les DOR ne sont pas essentiels à la récompense par la morphine. De plus, alors que l’agonisme de DOR chez l’homme produit des effets anxiolytiques, l’agonisme de KOR produit de la dysphorie Ainsi, les modèles neurobiologiques actuels des addictions mettent l’accent sur le rôle de MORs pendant la phase de consommation de l’addiction (par exemple, binge/intoxication), mais sur le rôle de KORs et DORs pendant le sevrage et les états affectifs négatifs (16). Pour une revue récente, voir.
Pharmacothérapie pour le trouble de l’usage aux opioïdes.
La méthadone, la buprénorphine et la naltrexone sont des médicaments opioïdes approuvés par la FDA pour le traitement à long terme de l’OUD, mais il existe des différences pharmacologiques entre ces médicaments. La méthadone est un agoniste MOR complet synthétique à longue durée d’action et à longue demi-vie, ce qui lui permet d’agir comme un substitut opioïde tout en réduisant l’euphorie et le sevrage associés aux opioïdes d’abus. La buprénorphine, quant à elle, est un agoniste MOR partiel et un antagoniste KOR, ce qui diminue l’euphorie en présence d’autres agonistes MOR. La buprénorphine peut également être associée à la naloxone, un antagoniste des opioïdes, afin de prévenir les abus (c’est le cas du Suboxone). Enfin, la naltrexone est un antagoniste compétitif complet des récepteurs opioïdes qui bloque les effets gratifiants des opioïdes et précipite un sevrage marqué si elle est administrée à des utilisateurs actifs d’opioïdes. Les formes courantes de naltrexone pour l’OUD sont la naltrexone orale (quotidienne) et la naltrexone injectable (mensuelle) à libération prolongée (XR-NTX).
Parmi les trois MATs, la méthadone est celle qui a été le plus étudiée. Une méta-analyse Cochrane a démontré que la méthadone permettait une meilleure rétention du traitement et une réduction de la consommation d’héroïne que l’absence de MAT pour les personnes dépendantes de l’héroïne. Une autre méta-analyse Cochrane a montré que la buprénorphine devait être administrée à des doses plus élevées (>16 mg) pour donner des résultats significativement meilleurs que le placebo et atteindre une efficacité comparable à celle de la méthadone. Alors que le traitement à la méthadone nécessite des visites quotidiennes dans une clinique de méthadone, des résultats récents suggèrent que la buprénorphine peut être prescrite efficacement en ambulatoire, et pourrait représenter une approche prometteuse pour encourager l’engagement dans le traitement et réduire la consommation d’opiacés chez les personnes souffrant d’OUD qui se présentent aux urgences. Les recherches sur l’efficacité de la naltrexone sont mitigées. Bien qu’une méta-analyse Cochrane n’ait pas démontré son efficacité dans la rétention du traitement ou la réduction de la consommation d’opioïdes par rapport au placebo (34), la naltrexone à libération prolongée (XRNTX) s’est révélée prometteuse dans le maintien de l’abstinence (35), un récent essai clinique randomisé ayant constaté que le XRNTX était aussi efficace que la buprénorphine pour la rétention du traitement et l’abstinence à court terme des opioïdes. Cependant, il existe des obstacles importants à l’induction réussie du XRNTX et de nombreux patients interrompent le traitement prématurément, ce qui suggère que des recherches supplémentaires sont nécessaires pour améliorer l’utilité clinique du XRNTX dans le monde réel. À ce jour, aucune étude n’a comparé directement les trois MAT. Bien que les données probantes actuelles suggèrent une prise en charge réussie de l’OUD avec la méthadone et la buprénorphine, une méta-analyse des résultats du traitement par MAT suggère qu’un pourcentage important de personnes maintenues sous opioïdes ne parviennent pas à maintenir l’abstinence aux opioïdes. Des recherches supplémentaires sont nécessaires pour identifier et traiter les obstacles à la réussite du traitement MAT. De plus, il n’existe actuellement aucun biomarqueur permettant de prédire quelle pharmacothérapie ou quelle dose peut être la plus efficace au niveau individuel. Pour un examen complet des pharmacothérapies de l’OUD, voir.
La recherche pharmacothérapeutique intégrant des évaluations génétiques et de neuro-imagerie peut fournir des informations clés sur la neurobiologie de l’OUD en identifiant les facteurs de différence individuels contribuant à la variabilité des réponses au traitement. Dans les sections suivantes, nous examinons les résultats récents d’études translationnelles utilisant ces approches.
Recherche génétique.
La variabilité génétique peut influencer le phénotype complexe de la vulnérabilité à l’OUD et la réponse au traitement. Par exemple, un polymorphisme nucléotidique simple (SNP) à rs1076560 dans le gène DRD2, qui est impliqué dans la voie de signalisation dopaminergique, a été associé à l’OUD dans un échantillon de plus de 1 300 Américains européens et africains. En outre, des variantes spécifiques dans les gènes du système opioïde endogène, en particulier dans le gène OPRM1 (par exemple, rs1799971, A118G), ont été associées à l’OUD. En revanche, les méta-analyses n’ont pas trouvé d’associations significatives entre le marqueur génétique OPRM1 rs1799971 et le risque initial d’OUD. Récemment, Woodcock et ses collègues ont proposé que, si les facteurs génétiques peuvent contribuer à la vulnérabilité à l’OUD, ils sont également susceptibles d’être impliqués dans différents stades de la dépendance aux opiacés. En accord avec cela, ils ont démontré que les porteurs de l’allèle 118G ont rapporté des conséquences significativement plus importantes de la consommation d’héroïne et de multiples tentatives d’abandon par rapport aux homozygotes 118A/A dans un échantillon d’hommes caucasiens consommateurs chroniques d’héroïne.
Plusieurs études ont également identifié des variantes génétiques associées à de meilleurs résultats en matière de MAT, qui peuvent représenter des marqueurs candidats de la réponse au traitement. Par exemple, un SNP intronique de l’OPRD1, rs678849, a prédit de manière différentielle les résultats des traitements à la méthadone et à la buprénorphine chez des participants afro-américains, mais pas européens-américains, de telle sorte que les individus maintenus à la méthadone avec le génotype CC (par rapport à CT ou TT) avaient une probabilité accrue de dépistages d’opioïdes dans l’urine, alors que les individus maintenus à la buprénorphine présentaient le schéma inverse. Dans une autre étude, des analyses sexospécifiques ont révélé que deux SNP introniques de l’OPRD1 permettaient de prédire l’issue du traitement chez les personnes maintenues sous buprénorphine, de sorte que les femmes présentant un génotype CC (vs A/A) au rs529520 et un génotype G/G (vs A/A ou A/G) au rs581111 présentaient des tests urinaires positifs aux opiacés significativement plus faibles. D’autres recherches récentes ont démontré que les Européens-Américains maintenus sous méthadone et présentant le génotype A/A (vs. A/G et G/G) au niveau du rs10485058 du gène OPRM1 étaient moins susceptibles d’avoir des tests d’urine positifs aux opiacés et que l’allèle A était également associé à des taux de rechute autodéclarés plus faibles dans un échantillon indépendant. En outre, une étude d’association à l’échelle du génome a révélé une association significative entre la dose de méthadone et un SNP, situé légèrement en amont du gène OPRM1.
Collectivement, les données ci-dessus indiquent que les différences individuelles dans les gènes codant pour des aspects du fonctionnement dopaminergique et opioïde contribuent à la vulnérabilité à l’OUD. Elles soulèvent également la possibilité que les différences génotypiques interindividuelles et sexospécifiques puissent un jour être utilisées pour informer la sélection des MAT et les exigences de dosage, améliorant ainsi les efforts de traitement individualisé de l’OUD. Cependant, des réplications prospectives de ces résultats ainsi que des tests supplémentaires dans des échantillons indépendants sont justifiés.
Théories neurobiologiques actuelles de la dépendance et pertinence pour le trouble de l’usage d’opioïdes.
Selon les théories neurobiologiques dominantes, la dépendance est un trouble cérébral chronique et récurrent dans lequel la consommation initiale et volontaire de drogues évolue vers la recherche et la prise compulsives et incontrôlées de drogues. Ce processus a été conceptualisé comme un cycle en trois étapes : le binging/intoxication, l’émotivité négative et le besoin pendant le sevrage, et il est associé à des neuroadaptations durables en cas de consommation prolongée de drogues. Pendant l’intoxication, la prise de drogue active le système opioïde endogène et provoque des augmentations importantes et rapides de la dopamine dans les régions mésocorticolimbiques, y compris le mésencéphale (p. ex. VTA), le striatum (p. ex. NAcc, striatum dorsal) et le PFC (p. ex, cortex cingulaire antérieur et orbitofrontal ; ACC et OFC), ce qui renforce positivement la poursuite de la consommation de drogue et les associations conditionnées entre les stimuli liés à la drogue et l’attente de la récompense. On pense que la consommation prolongée de drogues entraîne des neuroadaptations durables telles qu’une surévaluation des stimuli liés à la drogue et une diminution de la sensibilité aux récompenses naturelles et non liées à la drogue.
Dans ce cadre, lors d’un état de privation d’opioïdes, l’émergence d’une émotivité négative ou d’une dysphorie peut perpétuer la recherche de drogues par des mécanismes de renforcement négatif. De même, pendant le sevrage, les systèmes de stress du cerveau (par exemple, le facteur de libération de la corticotrophine, la norépinéphrine) et les circuits neuronaux (par exemple, l’amygdale étendue) sont impliqués, produisant des états aversifs ou semblables au stress. De plus, une sensibilité accrue aux indices liés à la drogue et aux états émotionnels négatifs caractérise une augmentation de l’envie de drogue qui peut motiver un nouveau comportement de recherche de drogue et augmenter la probabilité de rechute. La poursuite de la consommation de drogues est probablement liée à des dysfonctionnements des régions corticales préfrontales, qui sous-tendent les processus de fonctionnement exécutif, notamment le contrôle cognitif et inhibiteur. La consommation prolongée de drogue contribue probablement à des déficiences dans la prise de décision et l’inhibition comportementale qui diminuent la capacité à résister au besoin de drogue et à maintenir l’abstinence.
Les critères de diagnostic actuels des MUS et les théories neurobiologiques dominantes de la dépendance mettent l’accent sur les marqueurs neurobiologiques et les processus psychologiques communs aux différents MUS. Cependant, des mécanismes neurobiologiques distincts ont également été mis en évidence dans les différents SUD. Des études précliniques indiquent que des lésions spécifiques des terminaux dopaminergiques du NAcc inhibent l’auto-administration de cocaïne, mais pas d’héroïne. Cela suggère que des systèmes neuronaux indépendants peuvent médier les effets renforçants de la cocaïne et de l’héroïne. En outre, la propension à la rechute semble être spécifique à la substance et dépend du contexte environnemental. Des études précliniques et cliniques indiquent que l’héroïne est préférentiellement consommée à la maison, alors que c’est le contraire pour la cocaïne. Une telle contextualisation de l’affect spécifique à une substance a été liée à une double dissociation de l’activité neuronale dans le PFC gauche, le caudate dorsal gauche et le cervelet bilatéral. Des augmentations plus importantes des activations fronto-striatales-cérébelleuses ont été constatées lorsque les individus imaginaient consommer de l’héroïne à l’extérieur de la maison et de la cocaïne à la maison (moins préférée) par rapport à l’héroïne à la maison et à la cocaïne à l’extérieur de la maison (préférée).
Des études ont également identifié les différences de motivation qui sous-tendent les différents comportements de consommation de substances. Les personnes souffrant d’OUD considèrent la douleur et l’inconfort physique comme les principales motivations de la consommation de drogues, tandis que les consommateurs de cocaïne décrivent leurs motivations comme provenant de pulsions tentantes. Dans le même ordre d’idées, les données d’évaluation écologique momentanée indiquent que les décisions de consommer de la cocaïne sont précédées d’une exposition à la drogue et d’états affectifs positifs, mais que l’envie de consommer des opiacés est précédée d’états affectifs négatifs). Une étude récente d’apprentissage automatique a identifié des marqueurs comportementaux spécifiques à la substance pour l’OUD et le trouble de l’usage de la cocaïne, dans laquelle le trait de personnalité de l’impulsivité était un prédicteur du trouble de l’usage de la cocaïne, mais pas de l’OUD. Il est important de tenir compte de ces facteurs neuronaux, comportementaux, environnementaux et motivationnels qui peuvent distinguer l’OUD des autres SUD, car ils pourraient apporter un éclairage supplémentaire sur la physiopathologie de l’OUD et guider le développement de traitements adaptés et spécifiques à la substance.
Recherche en neuro-imagerie : IRMf basée sur la tâche
Traitement des récompenses et apprentissage.
Des études d’IRMf basées sur des tâches ont mis en évidence des réponses neuronales corticolimbiques accrues aux stimuli liés aux opiacés chez les personnes souffrant d’OUD, qui peuvent diminuer après des MAT et une abstinence prolongée (figure 1). Comparativement aux témoins, les personnes maintenues sous méthadone présentent des réponses neuronales plus importantes dans les zones de récompense (p. ex. NAcc) lorsqu’elles voient des signaux liés à l’héroïne (par rapport à des signaux neutres), réponses qui se sont maintenues chez les rechuteurs ultérieurs par rapport aux non-rechuteurs après trois mois de suivi (62). En outre, deux études transversales ont démontré que, par rapport aux abstinents à long terme de l’OUD, les abstinents à court terme présentaient des activations neurales accrues dans l’ACC, le MPFC et le caudate et dans l’hippocampe, l’insula, le thalamus et le striatum dorsal lorsqu’on leur présentait des stimuli liés à l’héroïne (par rapport à des stimuli neutres).
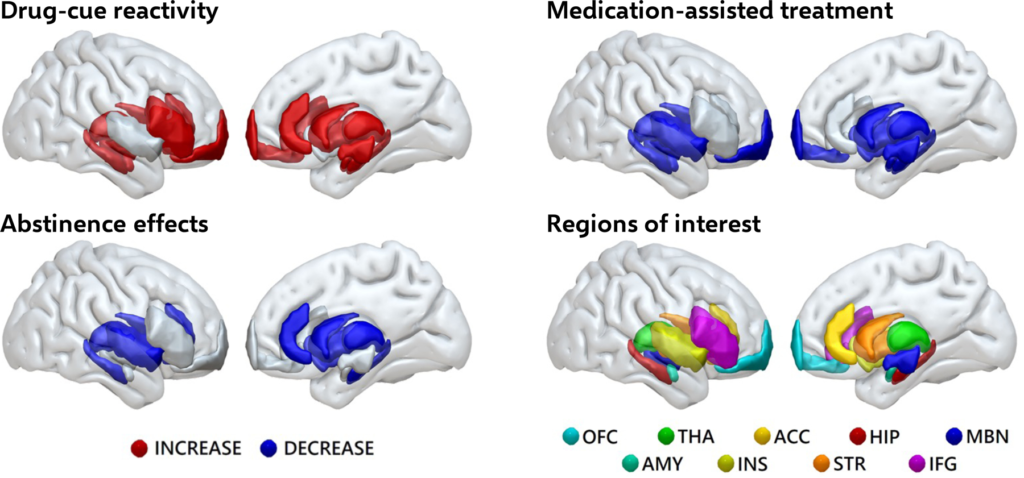
Résumé des résultats de l’IRMf des études sur la réactivité aux signaux de drogues dans les troubles liés aux opioïdes
Les personnes souffrant de troubles liés à l’utilisation d’opioïdes présentent des réponses cérébrales accrues aux signaux de drogue. Ces réponses sont réduites par les traitements médicamenteux et après une abstinence prolongée.
Abréviations : OFC, cortex orbitofrontal ; THA, thalamus ; ACC, cortex cingulaire antérieur ; HIP, hippocampe ; MBN, mésencéphale ; AMY, amygdale ; INS, insula ; STR, striatum ; IFG, gyrus frontal inférieur.
Selon Volkow et ses collègues, la dépendance implique la désensibilisation des systèmes de récompense, ce qui diminue le plaisir tiré des récompenses naturelles, non liées à la drogue. Deux études d’IRMf évaluant les réponses neuronales à des stimuli affectivement positifs par rapport à des stimuli liés aux opioïdes chez des personnes récemment désintoxiquées et abstinentes de l’OUD ont trouvé des activations atténuées dans les régions amygdaliennes et corticales postérieures ainsi que dans les régions corticales antérieures. Cependant, aucune étude d’IRMf n’a directement comparé les réponses neuronales pendant l’exposition à des indices liés aux opiacés et à des renforçateurs naturellement appétissants (par exemple, la nourriture, le sexe et les interactions sociales). Des études portant sur des processus d’apprentissage non liés à la drogue et fondés sur la récompense (par exemple, l’anticipation et le résultat des récompenses par rapport à la perte) ont également révélé des réponses neuronales diminuées dans l’insula et le gyrus frontal inférieur chez les personnes maintenues sous méthadone par rapport aux témoins.
Deux études pharmacothérapeutiques récentes suggèrent que le traitement au XRNTX peut moduler les réponses neuronales aux stimuli liés ou non à la drogue chez les personnes atteintes d’OUD. Pendant le traitement au XRNTX, les personnes souffrant d’OUD ont présenté une réduction de la NAcc et de la réactivité aux stimuli liés aux opiacés (par rapport aux témoins), ce qui a été corrélé à la réduction de la gravité du sevrage. Cependant, cette étude n’était pas contrôlée par placebo. La deuxième étude a montré qu’après deux semaines de XRNTX, les activations striatales ventrales des schémas liés au bébé ont augmenté, ce qui a été corrélé avec une réduction de l’envie de consommer des opioïdes. Cela peut suggérer un retour des récompenses non liées à la drogue associées à la prise en charge, qui peuvent être atténuées en cas de dépendance aux opioïdes. Par conséquent, ces résultats fondés sur des tâches suggèrent que les personnes souffrant d’OUD peuvent présenter des réponses neuronales accrues aux stimuli liés aux opioïdes (par rapport aux stimuli non liés aux drogues), qui peuvent se normaliser après une abstinence prolongée ou une pharmacothérapie.
Traitement/régulation des émotions.
Les personnes souffrant d’OUD présentent une activation amygdalienne et insulaire réduite par rapport aux témoins lors de la visualisation d’images négatives. De même, lorsqu’elles sont exposées à des images distracteurs neutres au cours d’une tâche de recherche d’émotions, les personnes souffrant à la fois d’une personnalité borderline et d’un OUD présentent une activation amygdalienne moindre par rapport aux personnes ne souffrant d’aucun de ces deux troubles. Cependant, à l’inverse, des études plus récentes sur des personnes souffrant de TOC et suivant un traitement d’entretien à l’héroïne ont signalé des réponses amygdaliennes plus élevées aux visages émotionnels négatifs par rapport aux témoins, réponses qui ont été atténuées après l’administration d’héroïne. Ces résultats convergent avec les théories neurobiologiques prédominantes de la dépendance qui proposent la dysrégulation émotionnelle comme un élément clé du cycle de la dépendance. Cependant, la nature précise des difficultés de régulation des émotions et leurs fondements neuronaux dans l’OUD restent à élucider.
Contrôle cognitif et inhibiteur.
Des études d’IRMf basées sur des tâches indiquent que les personnes souffrant d’OUD présentent des activations plus importantes aux indices liés à l’héroïne dans les régions neuronales qui sous-tendent le fonctionnement exécutif, ce qui est en corrélation avec les rapports subjectifs de manque. De plus, des activations altérées du PFC ont été signalées chez les personnes souffrant d’OUD au cours de tâches de contrôle inhibiteur (p. ex., Go/No-Go, Stroop), ce qui pourrait être lié aux difficultés à exercer un contrôle sur les envies de drogue. Néanmoins, la direction de ces résultats est incohérente : deux études ont rapporté une diminution du recrutement latéral du PFC après l’administration d’héroïne, tandis qu’une autre a rapporté le schéma inverse. Ces incohérences pourraient être dues à des différences méthodologiques ou aux caractéristiques des participants, notamment la variabilité de la durée de l’abstinence. D’autres études longitudinales sont nécessaires pour obtenir une caractérisation neuronale fiable du contrôle cognitif dans l’OUD après une abstinence prolongée.
Il convient de noter qu’une grande partie des études d’IRMf basées sur des tâches mentionnées ci-dessus ont été menées il y a environ dix ans. À la lumière de ce qui précède, il est justifié de poursuivre les recherches sur les réponses neurales liées à la tâche qui sous-tendent les processus de récompense, d’émotion et de contrôle cognitif, ainsi que sur leur relation avec les résultats du traitement. Pour un examen systématique des études IRMf sur l’OUD, voir.
Recherche en neuro-imagerie : Connectivité fonctionnelle à l’état de repos (RSFC)
Comme décrit ci-dessus, les études évaluant l’activité neuronale pendant l’exécution d’une tâche ont facilité l’identification des régions du cerveau et des processus complexes liés à l’OUD. Des informations complémentaires peuvent être obtenues en étudiant la dynamique des circuits neuronaux au niveau du système lorsque le cerveau est “au repos”, comme dans les analyses RSFC. Le RSFC reflète le degré de corrélation temporelle des fluctuations intrinsèques des signaux hémodynamiques dans différentes régions neuronales en l’absence de tâche explicite, ce qui permet de mesurer l’organisation fonctionnelle intrinsèque du cerveau (79). À l’instar des études d’IRMf basées sur des tâches, les recherches sur le RSFC ont permis d’identifier des altérations dans les circuits de récompense (par exemple, le système MCL), les circuits d’émotion et de stress (par exemple, l’amygdale étendue) et les circuits de contrôle cognitif chez les personnes atteintes d’OUD. En outre, des altérations des interactions à grande échelle entre les CII, en particulier entre le DMN, le SN et le FPN, ont été signalées dans les SUD et sont également impliquées dans les OUD.
Des études de RSFC ont signalé une connectivité accrue au sein des circuits du MCL et entre le MCL et d’autres zones sous-corticales et corticales chez les personnes atteintes d’OUD. Par exemple, Ma et al. (2010) ont signalé une augmentation de la RSFC dans le système MCL entre le NAcc et le PFC ventromédial dans un échantillon de personnes abstinentes, maintenues sous méthadone. En revanche, une diminution du RSFC entre le système MCL et d’autres zones sous-corticales et corticales a également été rapportée. Par exemple, les personnes dépendantes aux opioïdes sur ordonnance présentaient des réductions du RSFC entre le NAcc et l’insula antérieure droite et le PFC ventromédial, qui étaient associées à de plus longues périodes de dépendance aux opioïdes. De même, une autre étude a signalé des réductions étendues du RSFC entre l’insula et les zones inférieures de l’OFC, du putamen et du caudate. Étant donné les différences entre les études au niveau des populations cliniques et des méthodes d’analyse, d’autres travaux comparant directement les sous-groupes d’OUD (par exemple, les personnes sous traitement à la méthadone par rapport aux utilisateurs d’opioïdes sur ordonnance) sont nécessaires.
Certaines recherches suggèrent que les personnes souffrant de dépendances présentent également des altérations du RSFC au sein de CII ” canoniques ” à grande échelle. Il s’agit du 1) DMN, qui comprend le cortex cingulaire postérieur, le MPFC et le précuneus ; 2) SN, qui comprend le CAC dorsal et l’insula et 3) le réseau frontopariétal (FPN), qui comprend les zones corticales préfrontales latérales et pariétales postérieures. Le DMN est impliqué dans le traitement indépendant de la tâche, y compris la pensée autoréférentielle, tandis que le FPN soutient une série de fonctions cognitives (par exemple, la mémoire de travail et l’attention). Des données indiquent que le DMN et le FPN sont “anticorrélés”, de sorte que le DMN tend à se désactiver lorsque le FPN est activé, par exemple, pendant des tâches cognitives. Le SN est impliqué dans la détection et le traitement de la saillance et est supposé médier les interactions entre le DMN et le FPN.
Sutherland et al. ont proposé un modèle de SUD à triple réseau dans lequel le SN induit une saillance aberrante à l’égard des effets gratifiants de la drogue et des symptômes de sevrage internes pendant l’abstinence, orientant ainsi le traitement vers le DMN au lieu de l’ECN. Ce modèle est donc cohérent avec les étapes d’intoxication excessive et d’émotivité négative du modèle en trois étapes de Koob et Volkow (2010). Ce changement dans la dynamique du réseau est illustré par les résultats d’une augmentation du RSFC du DMN-SN et d’une diminution du RSFC du FPN-SN chez les fumeurs en phase d’abstinence aiguë, ce qui était corrélé avec les rapports subjectifs d’envie de fumer et la performance des tâches de mémoire de travail.
Néanmoins, peu d’études ont porté sur le fonctionnement de ces réseaux à grande échelle chez les personnes souffrant d’OUD. Parmi les études menées sur le RSFC, des altérations du DMN ont été systématiquement signalées à différents stades de la dépendance aux opiacés. Par exemple, une réduction du RSFC du DMN antérieur a été démontrée chez les personnes récemment désintoxiquées de l’OUD par rapport aux témoins (91), chez les rechuteurs de l’OUD par rapport aux abstinents, et chez les consommateurs actifs d’héroïne par rapport aux témoins. De plus, une réduction du RSFC du DMN a été associée à une consommation d’héroïne plus longue dans la vie (94). Les résultats concernant d’autres réseaux d’état de repos ont été plus mitigés. Une diminution du RSFC dans le SN (insula) et le FPN (PFC dorsolatéral et zones pariétales) a été rapportée chez les consommateurs d’héroïne sous méthadone par rapport aux témoins, le premier résultat étant associé à un risque plus faible de test d’urine positif aux opiacés. Néanmoins, d’autres études ont également rapporté le résultat inverse d’une augmentation du RSFC de l’insula et de l’ACC. Enfin, une étude prospective récente a examiné les interactions inter-réseaux entre ces trois CII à grande échelle, spécifiquement chez des individus maintenus sous méthadone (80). Les résultats suggèrent que, par rapport aux témoins, les individus maintenus sous méthadone ont montré une augmentation du RSFC DMN-SN, ce qui a été associé à une plus grande probabilité de rechute.
Pris dans leur ensemble, ces résultats soutiennent l’hypothèse du modèle à triple réseau d’altérations du réseau entre le DMN, le SN et le FPN, bien que la directionalité des résultats soit incohérente. En outre, les résultats existants soulèvent la possibilité que les interactions de réseau altérées puissent conférer un risque de rechute future dans l’OUD. Par conséquent, ces études suggèrent que l’OUD se caractérise par des altérations au niveau des systèmes, allant au-delà d’une seule région ou d’un seul réseau cérébral. Cependant, d’autres études doivent être menées afin de déterminer plus précisément ces prédicteurs systémiques des résultats du traitement de l’OUD et si ces réseaux peuvent servir de cibles potentielles pour le traitement.
Recherche en neuro-imagerie : IRM structurelle
Des études utilisant la morphométrie à base de voxels indiquent que, par rapport aux témoins sains, les personnes atteintes d’OUD présentent des réductions significatives de la matière grise dans le PFC, l’ACC, les régions insulaires et temporales. Ces réductions ont en outre été associées à la durée de la consommation d’héroïne et à l’impulsivité. Une réduction des volumes de matière grise dans d’autres régions impliquées dans le traitement de la récompense et des émotions (par exemple, la NAcc et l’amygdale) a également été observée. En outre, une méta-analyse récente a conclu que l’OUD implique des altérations structurelles dans deux circuits distincts, mais qui se chevauchent largement : (i) un système fronto-cérébelleux qui sous-tend l’impulsivité, la compulsivité et le traitement des émotions et (ii) un système fronto-insulaire impliqué dans les processus cognitifs et décisionnels.
Les données préliminaires soulèvent la possibilité d’une certaine récupération structurelle avec une abstinence soutenue. Wang et al. ont constaté une réduction significative des densités de matière grise dans les régions corticales frontales, cingulaires et occipitales chez les personnes dépendantes de l’héroïne après trois jours d’abstinence par rapport aux témoins. Cependant, les différences dans certaines régions (c’est-à-dire le gyrus frontal supérieur) n’ont plus atteint le seuil de signification après 30 jours d’abstinence. En outre, une autre étude a révélé que les personnes actuellement sous méthadone présentent des diminutions plus étendues de la matière grise corticostriatale par rapport à un groupe abstinent, qui ne présentait que des réductions de la matière grise du mésencéphale-thalamique. Des études longitudinales sont toutefois nécessaires pour déterminer si une abstinence prolongée réduit les anomalies ou si moins d’anomalies structurelles précèdent une abstinence réussie.
L’IRM pondérée par diffusion (IRMd) a également été utilisée pour évaluer les microstructures de la substance blanche chez les personnes souffrant d’OUD. Un certain nombre d’études d’IRMd ont révélé une altération de l'” intégrité ” de la substance blanche dans les régions frontale, temporale et pariétale chez les personnes souffrant d’OUD par rapport aux témoins. On a également signalé des perturbations dans des trajets spécifiques reliant les régions fronto-pariétales, occipitales et temporales (par exemple, le faisceau longitudinal supérieur) et les connexions de l’amygdale avec les zones sous-corticales et limbiques (par exemple, la stria terminalis, l’amygdalofugal ventral, le faisceau uncinate). Conformément aux théories neurobiologiques des SUD, ces résultats révèlent des altérations microstructurales de la substance blanche dans les régions impliquées dans le contrôle cognitif et le traitement des émotions. Cependant, les différences entre les groupes n’ont pas été rapportées de manière cohérente dans les études. L’hétérogénéité des résultats de l’IRMd pourrait être attribuée à des méthodologies différentes (par exemple, analyses statistiques spatiales basées sur les voxels du cerveau entier, sur les régions d’intérêt ou sur les voies) ou à des différences dans les caractéristiques cliniques (par exemple, durée de l’abstinence) entre les études. L’IRMd étant particulièrement sensible au mouvement, des résultats apparemment contrastés peuvent également être liés à des effets de mouvement non contrôlés dans et entre les études.
Notamment, les altérations de la substance blanche ont également été liées à la durée de l’utilisation des opioïdes et il a été démontré qu’elles diminuent après une abstinence prolongée. En outre, une étude récente a démontré une association entre la réduction de la substance blanche et les taux de tests urinaires positifs aux opiacés lors du suivi. Ces données soulèvent la possibilité que les perturbations de la substance blanche puissent être associées à la rechute de l’OUD. Comme les altérations de la substance blanche et du RSFC peuvent être liées, des travaux futurs combinant ces modalités pourraient permettre de mieux comprendre la vulnérabilité à l’OUD, la progression de la maladie et les changements liés au traitement.
Conclusion
Les preuves présentées ci-dessus suggèrent que des caractéristiques génétiques ainsi que des caractéristiques neuronales fonctionnelles et structurelles sont impliquées dans l’OUD. Ces altérations neurobiologiques, ainsi que d’autres facteurs psychologiques et socio-environnementaux, peuvent contribuer au phénotype multiforme de la dépendance aux opiacés. Des études antérieures ont montré que les systèmes dopaminergiques et opioidergiques endogènes sont impliqués dans les puissants effets euphoriques et analgésiques des opioïdes. La recherche génétique a identifié plusieurs gènes candidats (par exemple, DRD2 et OPRM1) comme étant impliqués dans la vulnérabilité à l’OUD et la réponse au traitement. Des données d’IRMF provenant d’études basées sur des tâches (c’est-à-dire la réactivité aux signaux de drogue, le traitement des émotions, les tâches Stroop et Go/No-Go) et sur l’état de repos suggèrent des altérations dans les régions et les réseaux du cerveau (par exemple, les circuits MCL, DMN, SN et FPN) qui sous-tendent les processus de récompense, d’émotion/stress et de contrôle cognitif. Ces résultats appuient les théories neurobiologiques de la dépendance (p. ex., les modèles à trois étapes et à triple réseau), selon lesquelles la consommation prolongée de substances psychoactives entraîne des neuroadaptations, notamment une augmentation de la saillance des signaux de drogue, des difficultés de régulation des émotions et du stress et des déficiences du contrôle cognitif. Enfin, des altérations structurelles étendues de la matière grise et blanche dans les régions préfrontale, pariétale, temporale, occipitale, insulaire et amygdalienne ont été signalées dans l’OUD. Ces altérations neurobiologiques ont également été associées à des indices neurocognitifs et comportementaux ainsi qu’à des mesures du résultat du traitement.
Il convient toutefois de noter que les études présentées ci-dessus font état de résultats hétérogènes et présentent un certain nombre de limites. Par exemple, les études génétiques susmentionnées ont fait état d’associations incohérentes ou faibles, voire inexistantes, entre des SNP spécifiques dans des gènes candidats (par exemple, OPRM1) et l’OUD, ce qui souligne la nécessité de mener d’autres études de grande envergure sur des échantillons indépendants. De même, les études de neuroimagerie fonctionnelle et structurelle font état d’incohérences en ce qui concerne la spécificité anatomique et la directionnalité des résultats. Cette hétérogénéité pourrait être attribuée à des différences, notamment (mais pas uniquement) au stade de l’OUD (p. ex., récemment désintoxiqué ou abstinent), à la médication (p. ex., méthadone ou buprénorphine) et à la durée de l’abstinence. En outre, il y a un manque d’études de neuroimagerie incluant des femmes et celles qui effectuent des analyses spécifiques au sexe, ce qui devrait être abordé dans les études futures. La plupart des études génétiques et de neuro-imagerie portent également sur des personnes dépendantes de l’héroïne. Compte tenu de l’évolution de l’épidémie d’opioïdes, dans laquelle l’abus d’opioïdes sur ordonnance a considérablement augmenté, d’autres études devraient examiner cette population et déterminer si des mécanismes neurobiologiques communs ou spécifiques sous-tendent les différents sous-groupes d’OUD.
On ne sait toujours pas si les altérations neurobiologiques identifiées confèrent un risque d’OUD ou se manifestent à la suite d’une utilisation chronique d’opioïdes. L’étude prospective de ces marqueurs neurobiologiques putatifs chez les consommateurs naïfs et occasionnels d’opiacés par rapport à ceux qui passent à la dépendance peut fournir des indications précieuses sur la raison pour laquelle certaines personnes sont dotées d’une résilience. De même, l’étude des personnes souffrant d’OUD au fur et à mesure qu’elles passent d’une rémission précoce à une abstinence à long terme pourrait permettre de mieux comprendre les mécanismes neurobiologiques qui sous-tendent les différentes étapes de la guérison.
Enfin, il est important de garder à l’esprit que la génétique et la neuro-imagerie ne représentent qu’une petite partie d’un effort plus vaste pour comprendre l’étiologie et le traitement de la dépendance aux opiacés. L’addiction est une construction complexe à multiples facettes qui justifie une investigation à partir de différentes perspectives et de multiples niveaux d’analyse. L’intégration des facteurs socio-environnementaux dans la recherche neuroscientifique sur les dépendances et l’utilisation d’une approche multimodale et longitudinale pourraient permettre de mieux caractériser l’OUD à différents stades de la dépendance et du rétablissement. En outre, des recherches plus poussées identifiant des marqueurs neurobiologiques fiables qui sous-tendent les résultats positifs de la MAT pourraient un jour fournir une base pour adapter les traitements au niveau individuel (c’est-à-dire la médecine de précision). Récemment, on a constaté un intérêt croissant pour l’utilisation d’approches basées sur les données (par exemple, l’apprentissage automatique) afin de sonder la base neuronale du comportement de dépendance et la réponse au traitement en utilisant un large éventail de mesures, y compris des données de connectivité fonctionnelle du cerveau entier, des données génétiques, psychosociales et comportementales. De telles études sont prometteuses pour cartographier de manière exhaustive la trajectoire de développement de l’OUD, identifier des marqueurs cliniquement pertinents pour améliorer les efforts de prévention et de traitement et pour informer le développement d’interventions individualisées et optimisées.
