Wang, S. C., Chen, Y. C., Lee, C. H., & Cheng, C. M. (2019). Opioid Addiction, Genetic Susceptibility, and Medical Treatments: A Review. International Journal of Molecular Sciences, 20(17).
Abstract.
La dépendance aux opioïdes est une maladie chronique et complexe caractérisée par des rechutes et des rémissions. Au cours de la dernière décennie, l’épidémie d’opioïdes ou la crise des opioïdes aux États-Unis a sensibilisé le public. La méthadone, la buprénorphine et la naloxone ont prouvé leur efficacité dans le traitement des personnes dépendantes, et chacune d’entre elles a des effets différents sur les différents récepteurs opioïdes. La recherche en génétique classique et moléculaire a fourni des informations précieuses et révélé le mécanisme possible des différences individuelles de vulnérabilité à l’addiction aux opiacés. Le score de risque polygénique basé sur les résultats d’une étude d’association pangénomique (GWAS) peut être un outil prometteur pour évaluer l’association entre les phénotypes et les marqueurs génétiques sur l’ensemble du génome. Une nouvelle approche d’édition de gènes, les répétitions palindromiques courtes groupées et régulièrement espacées (CRISPR), a été largement utilisée dans la recherche fondamentale et potentiellement appliquée à la thérapeutique humaine comme les maladies mentales ; de nombreuses applications contre la dépendance basées sur CRISPR sont actuellement en cours de recherche, et certaines sont réussies dans les études animales. Dans cet article, nous avons résumé les mécanismes biologiques de la dépendance aux opiacés et les traitements médicaux, et nous avons passé en revue les articles sur la génétique de la dépendance aux opiacés, l’approche prometteuse pour prédire le risque de dépendance aux opiacés, et une nouvelle approche d’édition de gènes. Des recherches supplémentaires sur les traitements médicaux basés sur la vulnérabilité individuelle sont nécessaires.
1. Introduction.
La dépendance aux opioïdes est une maladie mentale chronique qui entraîne chez les personnes dépendantes de nombreuses rechutes et rémissions tout au long de leur vie, ainsi que de nombreux symptômes désagréables, notamment le développement de la tolérance et le sevrage. Comparée à la consommation de tabac et d’alcool, la dépendance aux opioïdes est moins fréquente ; cependant, elle a imposé une lourde charge aux systèmes de santé et au système de justice pénale. La crise des opioïdes coûte chaque année des milliards de dollars aux États-Unis, notamment en raison de la récente épidémie d’opioïdes sur ordonnance. Le traitement de la dépendance aux opioïdes par des médicaments peut jouer un rôle important dans la prévention des rechutes et permettre aux personnes dépendantes d’être suffisamment stables pour travailler ; elles peuvent ainsi bénéficier de périodes d’abstinence plus longues.
Au cours des deux dernières décennies, l’épidémie d’opioïdes ou la crise des opioïdes aux États-Unis a sensibilisé le public, et des interventions efficaces sont nécessaires de toute urgence. Les médicaments contre la dépendance aux opioïdes, comme la méthadone et la buprénorphine, sont utilisés pour traiter les personnes dépendantes en réduisant l’intensité des symptômes de sevrage et de manque, et la naloxone est utilisée pour traiter les surdoses d’opioïdes ou les intoxications aux opioïdes. Bien qu’il existe des médicaments efficaces contre la dépendance aux opioïdes, les rechutes et les rémissions sont encore fréquentes chez les personnes dépendantes. Le risque de rechute est accru en raison de la sensation de manque accompagnée de terribles symptômes de sevrage, ainsi que des modifications neurobiologiques du cerveau causées par l’abus répété d’opioïdes.
Plusieurs études ont suggéré que l’hétérogénéité de la population peut être associée au développement de la dépendance et à ses résultats longitudinaux, tels que la rechute ou la rémission. Les alcooliques ont des fréquences plus faibles des allèles de l’alcool déshydrogénase et de l’aldéhyde déshydrogénase que les non-alcooliques, ce qui suggère que ces variations génétiques influencent le risque de développer un alcoolisme. Hill et al. ont suggéré que les schémas de consommation d’alcool peuvent être classés en quatre groupes de trajectoires : “Early highs”, “increasers”, “late onsetters” et “non-bingers”. Jackson et al. ont trouvé quatre classes de trajectoires, en utilisant un modèle de mélange de croissance avec cinq indices de consommation d’alcool. Genberg et al, en utilisant la modélisation de la courbe de croissance latente et la cohorte longitudinale AIDS Linked to the IntraVenous Experience, ont trouvé que les utilisateurs de drogues par voie intraveineuse peuvent être classés en cinq groupes différents avec des trajectoires uniques : Injection persistante, rechute fréquente, arrêt précoce, arrêt différé et arrêt tardif.
Dans cet article, nous résumons les mécanismes biologiques de la dépendance aux opioïdes et les récepteurs opioïdes. Nous passons également en revue les articles précédents sur les traitements médicaux de la dépendance aux opioïdes et les variantes génétiques de la susceptibilité à la dépendance, en essayant d’établir un lien entre la nouvelle thérapie d’édition de gènes et la dépendance aux opioïdes.
2. La dépendance aux opioïdes, mécanisme biologique et médicaments
La plupart des personnes commencent à consommer des opioïdes pour éprouver des sensations euphoriques ou soulager la douleur ; ensuite, une tolérance se développe en raison de la désensibilisation des récepteurs opioïdes, ce qui entraîne une consommation incontrôlée. Les symptômes de tolérance et de sevrage aux opioïdes, ainsi que la consommation incontrôlée et l’état de manque, sont les principaux symptômes de la dépendance aux opioïdes. Les symptômes de sevrage comprennent de fortes douleurs musculaires, des douleurs osseuses, des larmoiements, des écoulements nasaux, des bâillements, des diarrhées, des crampes abdominales, de l’agitation, de l’anxiété et des sueurs. De nombreuses personnes dépendantes ont repris des opioïdes pour soulager ces sentiments intolérables. Volkow et al. ont examiné les articles relatifs à la dépendance aux opioïdes et ont constaté que les mécanismes moléculaires de la tolérance et de la dépendance physique induites par les opioïdes jouent un rôle important dans la dépendance aux opioïdes. Après l’administration répétée d’opioïdes, la régulation des récepteurs opioïdes, telle que la désensibilisation et l’internalisation, a commencé, tout comme la tolérance aux récepteurs opioïdes, impliquant plusieurs processus cellulaires tels que la régulation à la hausse de l’AMP cyclique/la protéine kinase A et la signalisation de l’élément de réponse de l’AMPc. En outre, l’envie de consommer des drogues, la diminution de la maîtrise de soi et les réponses fortes aux stimuli associés à la drogue sont associées aux changements cellulaires et moléculaires de la projection glutamatergique dans le cortex préfrontal et la région des ganglions de la base, tels que des altérations de la signalisation de la protéine G dans le cortex préfrontal et une libération accrue de glutamate présynaptique dans l’accumbens.
Les personnes souffrant de troubles liés à l’abus de substances connaissent des changements de comportement qui ont un impact sur leur capacité à fonctionner, et ces changements peuvent se poursuivre même après qu’une personne a cessé de consommer. Pire encore, la dépendance à long terme altère les fonctions intellectuelles. Les alcooliques, par exemple, présentent un risque élevé de syndrome de Wernicke-Korsakoff. Une déficience fonctionnelle intellectuelle – plus précisément une déficience cognitive et un manque de jugement – peut être observée chez les toxicomanes qui consomment régulièrement des opioïdes et des amphétamines. Cette déficience fonctionnelle se traduit souvent par l’incapacité de ces personnes à conserver un emploi stable ou à entretenir des relations saines ; il est donc nécessaire de mettre en place des interventions efficaces contre la dépendance pour arrêter et/ou prévenir la détérioration cognitive.
Il existe actuellement trois groupes de médicaments pour traiter la dépendance aux opioïdes, à savoir les agonistes complets, les agonistes partiels et les antagonistes des récepteurs opioïdes. La méthadone est un agoniste complet des récepteurs opioïdes ; les patients qui ont reçu un traitement d’entretien à la méthadone (TEM) présentent des symptômes de sevrage moins intenses, tels que des douleurs musculaires et osseuses ; ils sont donc moins susceptibles de reprendre des opioïdes pour éviter cette sensation terrible. La buprénorphine, un agoniste partiel des récepteurs opioïdes, a été développée comme alternative à la méthadone ; elle ne stimule pas le récepteur opioïde μ (MOR) au même degré que la méthadone, de sorte que les personnes dépendantes sous traitement par buprénorphine sont moins susceptibles de présenter une dépression respiratoire et une euphorie. La naloxone et la naltrexone sont des antagonistes, ciblant tous les sous-types de récepteurs opioïdes, se liant aux récepteurs opioïdes et bloquant l’agoniste ; elles ne provoquent donc pas d’effets similaires à ceux des agonistes, tels que la dépression respiratoire et l’euphorie. L’affinité de la naloxone est la plus élevée pour le MOR et elle est utilisée pour traiter la dépression respiratoire chez les personnes dépendantes ayant subi une grave surdose d’opioïdes. La naltrexone se lie à la fois au MOR et au récepteur opioïde κ (KOR), et une forme de naltrexone injectable à action prolongée a un effet continu pour diminuer la fréquence et le dosage de l’usage d’héroïne.
Récepteurs opioïdes
Les récepteurs opioïdes sont des récepteurs couplés aux protéines G répartis dans le cerveau, la moelle épinière, la peau et le tractus gastro-intestinal. Les récepteurs μ, κ et δ sont des sous-types de récepteurs opioïdes, partageant un effet analgésique commun dans le cerveau, et chacun d’entre eux a ses effets uniques tels que l’euphorie et la dépression respiratoire pour le MOR, la dysphorie pour le KOR et l’anxiolyse pour le récepteur opioïde δ (DOR).
Le MOR a été le premier récepteur opioïde découvert et peut déclencher l’euphorie ; il est donc essentiel pour les circuits de récompense du cerveau qui sont très dynamiques, et il joue également un rôle important dans les comportements dirigés vers un but, comme la recherche de drogues pour le plaisir. Lorsque la dépendance aux opiacés devient sévère, les troubles cognitifs amènent les personnes dépendantes à prendre de mauvaises décisions, transformant les comportements dirigés vers un but en comportements habituels tels que la recherche répétitive de drogues et/ou le besoin impérieux de drogues. Un polymorphisme commun (A118G) dans le gène MOR (OPRM1) est associé au rejet social et à l’hédonisme social dans l’étude de la sensibilité neurale humaine [40], et des études récentes sur des souris suggèrent que le MOR est également associé à l’attachement social et à l’anhédonie. Lorsque la tolérance aux opiacés se développe, la recherche compulsive de plus d’opiacés et une consommation incontrôlée apparaissent ; en conséquence, l’homéostasie des circuits de récompense du cerveau et la capacité à maintenir un fonctionnement social équitable sont compromises. Des études récentes ont démontré que l’effet du MOR varie avec l’âge ; les rongeurs adolescents ont un renforcement plus positif du MOR et moins de symptômes de sevrage des opiacés, par rapport aux rongeurs adultes, et cette constatation est cohérente avec la notion que les comportements de dépendance sont initiés plus chez les adolescents.
Le KOR déclenche des effets anti-récompense et produit une dysphorie. L’exposition prolongée à des drogues peut modifier les circuits cérébraux de récompense et renforcer la fonction KOR par l’intermédiaire de l’axe hypothalamo-hypophyso-surrénalien, ce qui favorise la rechute de la dépendance aux opiacés ; en outre, le stress dû à une exposition prolongée aux drogues peut également produire un sentiment dysphorique. En bref, l’intensification du stress due à une exposition prolongée aux opioïdes peut renforcer la fonction du KOR, produisant une humeur dysphorique et conduisant à la rechute. Le DOR se lie aux enképhalines, et il peut alors réduire les niveaux d’anxiété et atténuer les symptômes dépressifs.
3. Médicaments pour la dépendance aux opioïdes
Chez les personnes dépendantes, l’une des raisons de l’utilisation continue d’opioïdes est la lutte contre les symptômes de sevrage tels que les douleurs musculaires et osseuses pendant quelques heures après la consommation, car l’héroïne et la morphine ont une demi-vie courte. Le traitement par agonistes opioïdes permet d’éviter les symptômes de sevrage, ce qui permet aux personnes dépendantes sous traitement de travailler et d’avoir une vie stable.
3.1 Méthadone, buprénorphine et naloxone
La méthadone est un agoniste MOR complet, elle a certains effets agonistes sur le KOR et est également un agoniste DOR possible. La méthadone provoque moins de symptômes de sevrage et est moins renforçante en raison de sa demi-vie plus longue ; par conséquent, les toxicomanes soumis au TEM ne sont plus préoccupés par la recherche compulsive de drogues et le besoin impérieux d’en consommer, et ils sont plus disposés à rester en traitement, améliorant leur fonction psychosociale avec l’aide des prestataires de soins de santé. Les toxicomanes qui suivent un traitement de substitution et consomment de l’alcool et/ou des sédatifs en même temps courent un risque élevé de dépression respiratoire.
La buprénorphine est un agoniste partiel ayant une forte affinité pour le MOR, un agoniste partiel du KOR ou un antagoniste fonctionnel, et un faible antagoniste du DOR. Par rapport à l’agoniste MOR complet, la buprénorphine a un effet plafond sur le MOR, procurant des sensations moins euphoriques et présentant moins de risque de dépression respiratoire ; elle est donc plus sûre que la méthadone et adéquate pour soulager les symptômes de sevrage des opioïdes. La buprénorphine, en association avec la naloxone, est couramment utilisée pour traiter la dépendance aux opiacés aux États-Unis, et les personnes dépendantes sont moins susceptibles de se l’injecter en raison d’un sevrage opioïde sévère.
La naloxone et la naltrexone sont toutes deux des antagonistes des opioïdes. La naloxone est un antagoniste non sélectif et compétitif des récepteurs opioïdes, et elle est utilisée pour les intoxications aiguës aux opioïdes, en annulant les effets secondaires les plus dangereux comme la dépression respiratoire. La naltrexone injectable à longue durée d’action peut bloquer les récepteurs opioïdes, atténuer l’état de manque et diminuer le risque de surdose d’opioïdes.
3.2 Pharmacogénomique pour la dépendance aux opioïdes
Comme nous l’avons mentionné plus haut, l’efficacité de la méthadone, de la buprénorphine et de la naloxone a été démontrée dans le traitement de la dépendance aux opioïdes, mais les rechutes et les récidives sont encore très fréquentes. La médecine personnalisée et la pharmacogénomique pourraient être des traitements efficaces et prometteurs de la dépendance aux opiacés. La pharmacogénétique des analgésiques opioïdes et le traitement de la douleur ont attiré l’attention des chercheurs ces dernières années ; cependant, ces articles se sont concentrés sur les mécanismes des récepteurs opioïdes et les effets analgésiques plutôt que sur la dépendance aux opioïdes. Dans le paragraphe suivant, nous passons en revue les articles relatifs à la susceptibilité génétique à la dépendance et résumons les gènes liés à la dépendance aux opiacés, en indiquant les objectifs possibles de la pharmacogénomique pour la dépendance aux opiacés.
4. Susceptibilité génétique à la dépendance
Les fondements génétiques des troubles liés à la consommation de substances sont fréquemment étudiés. Les approches génétiques classiques, telles que les études sur les jumeaux, les familles et l’adoption, montrent qu’il existe des influences génétiques significatives sur la toxicomanie. L’héritabilité est la proportion des différences observées sur un trait phénotypique entre les individus d’une population qui sont dues à des différences génétiques, et l’héritabilité de la dépendance a été estimée à 0,4-0,6. Ces dernières années, les énormes progrès de la technologie informatique ont rendu possibles les approches de génétique moléculaire. Les études de liaison, les études d’association génétique et les études d’association à l’échelle du génome peuvent identifier et localiser les gènes associés. Un certain nombre d’études sur les comportements de dépendance ont été réalisées à l’aide d’approches moléculaires. Les approches génétiques classiques ont montré que la dépendance est héréditaire ; les approches génétiques moléculaires suggèrent que des comportements spécifiques liés à la dépendance sont associés à des gènes spécifiques.
4.1 Recherche génétique classique et recherche en génétique moléculaire sur l’addiction
L’épidémiologie génétique est un domaine de recherche en pleine expansion. La recherche en génétique classique et la recherche en génétique moléculaire fournissent toutes deux des informations précieuses sur les troubles liés à la consommation de substances. Cette section présente un examen des dernières recherches génétiques sur les troubles liés au tabac, à l’alcool et aux opiacés. La section suivante traite des liens génétiques possibles entre la dépendance aux opiacés et des modèles de comportement spécifiques.
L’examen de la recherche sur les gènes et la dépendance effectué par Kreek et al. propose un modèle à trois domaines comprenant la génétique, divers facteurs environnementaux et les effets induits par les drogues. En 1960, Kaij et al. ont mené la première étude sur l’alcoolisme chez des jumeaux, et en 1966, Partanen et al. ont mené une étude similaire sur des jumeaux qui a exploré plus avant les associations entre l’intelligence, la personnalité et la consommation d’alcool. Il s’agit des premières études proposant que des dépendances spécifiques soient héréditaires ou influencées par les gènes. Une étude sur l’adoption menée par Cloninger et al. a conclu que les gènes influencent l’abus d’alcool, puisque les probands adoptés ressemblaient davantage à leurs parents biologiques qu’à leurs familles adoptives. De plus, l’étude d’adoption de Cloninger et al. a fourni une approche classique pour démêler l’influence de la génétique de celle des facteurs environnementaux. En 1988, Merikangas et al. ont signalé une multiplication par huit de la probabilité de troubles liés à la drogue chez les parents de probands présentant des troubles liés à la drogue, le rapport de cotes le plus élevé étant observé pour la dépendance à la même substance. L’étude de Tsuang sur les jumeaux postule que l’environnement et les gènes influencent la susceptibilité d’une personne à l’abus de drogues ; Tsuang a également constaté que toutes les drogues couramment consommées – opiacés, marijuana, sédatifs, psychédéliques et stimulants – avaient une variance génétique globale de 0,3-0,5. L’héroïne avait la plus grande variance génétique globale, 0,54, et une variance génétique partagée, 0,2, avec les autres drogues. Cependant, la plupart de ces drogues n’avaient qu’une faible variance pour les facteurs génétiques spécifiques, et seule l’héroïne avait la plus grande variance génétique spécifique, soit 0,4, ce qui indique que des facteurs génétiques uniques pourraient affecter l’abus d’opioïdes. Dans leur étude de jumeaux sur les troubles liés à la consommation de substances, Kendler et ses collègues ont constaté que la consommation de cannabis, de cocaïne, d’hallucinogènes, de sédatifs, de stimulants et d’opiacés au cours de la vie présentait une variance génétique additive, ou héritabilité, de 0,3 à 0,5. Des études de jumeaux aux études d’adoption, de l’alcool aux autres substances, ces études génétiques classiques fournissent des preuves solides que la génétique joue un rôle important dans les troubles liés à la consommation de substances. Par la suite, les études de génétique moléculaire ont exploré l’héritabilité à un niveau plus profond. Au cours des vingt dernières années, grâce aux énormes progrès de l’informatique et de la technologie des réseaux génomiques, les approches de génétique moléculaire ont permis d’identifier ou de localiser des gènes associés spécifiques.
4.2 L’héritabilité la plus élevée : La dépendance aux opiacés
L’étude de jumeaux de Tsuang et al. a révélé que l’héroïne présentait la plus grande variance génétique globale, 0,54, et une variance génétique partagée, 0,2, avec toutes les drogues. L’étude de Wilen et de ses collègues sur les familles dont les parents étaient dépendants des opiacés ou de l’alcool a révélé que les enfants de toxicomanes présentaient des taux plus élevés de psychopathologie, notamment de troubles de l’humeur, d’anxiété et de toxicomanie. Une étude sur l’adoption menée par Cadoret et al. a révélé une corrélation entre les facteurs biologiques et environnementaux héréditaires et la consommation de substances. Ces résultats étaient cohérents avec les études de jumeaux.
Les scientifiques ont commencé à utiliser des approches moléculaires en épidémiologie génétique pour identifier l’emplacement des gènes associés à la dépendance. Les études de liaison sont des études familiales qui établissent un lien avec des régions spécifiques du génome plutôt qu’avec un gène particulier ; elles ciblent des phénotypes tels que des traits physiques ou des maladies spécifiques. Il y a encore vingt ans, les études de liaison ne pouvaient détecter qu’un nombre limité de gènes candidats car la technologie n’était pas suffisamment avancée ; aujourd’hui, grâce à des ordinateurs beaucoup plus puissants, des études de liaison à l’échelle du génome sont possibles. Gelernter et al. ont réalisé une étude de liaison à l’échelle du génome pour la dépendance aux opiacés et ont découvert que les chromosomes 2 et 17 sont associés à la dépendance aux opiacés. Lachman et ses collègues ont mené une autre étude de liaison à l’échelle du génome sur la dépendance aux opiacés et ont constaté qu’une région spécifique du chromosome 14q est associée à la dépendance aux opiacés. Les études d’association à l’échelle du génome ont permis de découvrir, dans une approche sans hypothèse, que des polymorphismes mononucléotidiques (SNP) répartis sur l’ensemble du génome sont associés à un phénotype spécifique en comparant les individus affectés à des individus non affectés. Wetherill et al. ont mené une étude d’association à l’échelle du génome pour examiner l’association entre des gènes candidats et la toxicomanie et ont découvert qu’un SNP, rs2952621 dans le gène non caractérisé LOC151121 sur le chromosome 2, et un autre SNP, rs2567261 dans ARHGAP28 (Rho GTPase-activating protein 28), sont associés à la toxicomanie. Dans une autre étude d’associations pangénomiques, Gelernter et ses collègues ont découvert que les SNP de plusieurs loci-KCNG2*rs62103177 qui impliquent les voies de signalisation du potassium étaient associés à la dépendance aux opiacés.
4.3 Susceptibilité génétique et traits psychologiques
Certains comportements tels que l’impulsivité, la prise de risque et la réaction au stress, qui sont dus à des traits de personnalité et à des caractéristiques physiologiques spécifiques, peuvent rendre certaines personnes plus sujettes aux troubles de la dépendance. Ces modèles peuvent être partiellement influencés par la variation génétique. En outre, les différences de personnalité et de traits physiologiques peuvent affecter les différents stades de la dépendance. Ces stades de la dépendance sont définis chronologiquement comme l’initiation à la consommation de drogues, la consommation régulière de drogues, l’abus/la dépendance et la rechute. Il est clair que de nombreux gènes ont été associés à la dépendance. Le présent travail se concentre sur les gènes associés à la dépendance à l’héroïne. Ces gènes peuvent être classés en deux systèmes génétiques : Le système dopaminergique et le système MOR. Plusieurs polymorphismes mononucléotidiques dans le système dopaminergique sont associés à la dépendance à l’héroïne. Il s’agit des rs4680, rs1800497, rs1800955, rs1611115, rs1079597, rs747302, rs1800498 et rs936462. On a également constaté que le gène du récepteur D4 de la dopamine était associé à la recherche de la nouveauté, qui est elle-même associée à la prise de risque. Les gènes candidats OPRM1, rs1799971, rs7997012 et rs540825 du système MOR sont associés à la dépendance aux opiacés. Nous avons résumé les résultats ci-dessus et énuméré les caractéristiques des gènes liés à la dépendance à l’héroïne/aux opiacés, notamment le produit protéique, le système, l’emplacement sur le chromosome et les SNP associés dans le tableau 1.
[TABLEAU 1]
Dans l’ensemble, étant donné les preuves de l’héritabilité la plus élevée dans la dépendance aux opiacés et les succès isolés dans l’alcool et le tabac pour les variations génétiques chez les consommateurs, de nombreux chercheurs ont essayé de trouver des variations génétiques chez les personnes souffrant de dépendance aux opiacés. Comme nous l’avons décrit précédemment, de nombreux gènes ont été liés à la dépendance aux opiacés ; par conséquent, la dépendance aux opiacés est plus probablement une maladie complexe qu’un trouble monogénique. L’analyse du score de risque polygénique peut être un outil prometteur pour évaluer l’association entre les phénotypes comportementaux et les marqueurs génétiques sur l’ensemble du génome et pour prédire le risque de dépendance aux opioïdes.
4.4 Score de risque polygénique pour la dépendance aux opioïdes
L’analyse du score de risque polygénique crée un score à partir des principaux SNP d’une étude d’association pangénomique (GWAS) sur un phénotype cible, et elle est couramment utilisée pour examiner les hypothèses de maladies communes et de variantes communes.
L’analyse du score de risque polygénique est une approche statistique qui est utilisée pour résumer les effets génétiques parmi un groupe de SNP qui n’ont pas d’associations significatives avec des maladies/traits. Cette approche repose sur l’hypothèse selon laquelle, bien que de nombreux SNP n’atteignent pas le seuil de signification après correction pour les tests à l’échelle du génome, la queue de la distribution des valeurs de p inférieures à un certain seuil cible sera enrichie d’un véritable signal. Une étude d’association pangénomique est d’abord menée sur un échantillon d’entraînement, et les valeurs p des SNP sont obtenues. Un score de risque polygénique est ensuite construit dans un échantillon indépendant comme une somme pondérée de scores d’allèles associés à un trait pour chaque sujet, pour différents sous-ensembles de marqueurs de premier rang. La première analyse réussie du score polygénique dans le cadre d’une GWAS a été appliquée à la schizophrénie et aux troubles bipolaires. Cette approche a deux applications possibles. Premièrement, les scores polygéniques peuvent être utilisés pour déterminer l’association entre une maladie/un trait et des SNP sélectionnés. Deuxièmement, les scores polygéniques peuvent être utilisés pour prédire les valeurs individuelles des maladies/traits. Cette approche a suscité beaucoup d’intérêt et a été utilisée pour plusieurs maladies courantes et complexes, notamment la sclérose en plaques, le risque cardiovasculaire et la polyarthrite rhumatoïde].
5. Modification génétique CRISPR pour l’addiction aux opiacés
Récemment, la technologie CRISPR (clustered, regularly-interspaced short palindromic repeats) a été largement utilisée en recherche fondamentale et potentiellement appliquée au traitement de maladies humaines telles que les infections virales latentes, les maladies génétiques, les troubles neurodégénératifs, les cancers et les maladies mentales. Les CRISPR sont des loci qui contiennent des répétitions multiples, courtes et directes de séquences d’ADN dans les bactéries. Chaque répétition est constituée d’une série de séquences d’ADN suivies de segments d’ADN de 25 à 30 paires de bases appelés “espaceurs”. Les espaceurs sont dérivés d’un bactériophage ou d’un plasmide et servent de “mémoire” des expositions passées. Lorsque l’hôte rencontre à nouveau la même séquence d’ADN spécifique, il peut reconnaître l’ADN étranger par appariement complémentaire de bases avec le court espaceur mémorisé dans l’ARN CRISPR (crRNA). Un hybride ARNrc/ARNrc transactivant (ARNrc tra) agit comme un ARN guide pour la protéine associée à CRISPR (Cas), qui est une endonucléase chargée de couper l’ADN envahissant. Dans le système CRISPR/Cas9, CRISPR est utilisé pour construire des gènes guidés par des ARN qui ciblent une séquence d’ADN spécifique. Grâce à un ARN guide unique (ARNg) spécifiquement conçu et à la protéine Cas, le génome de l’organisme peut être coupé à la plupart des endroits, à la seule condition que la séquence NGG (protospacer adjacent motif (PAM)) soit disponible dans le site de ciblage (figure 1).
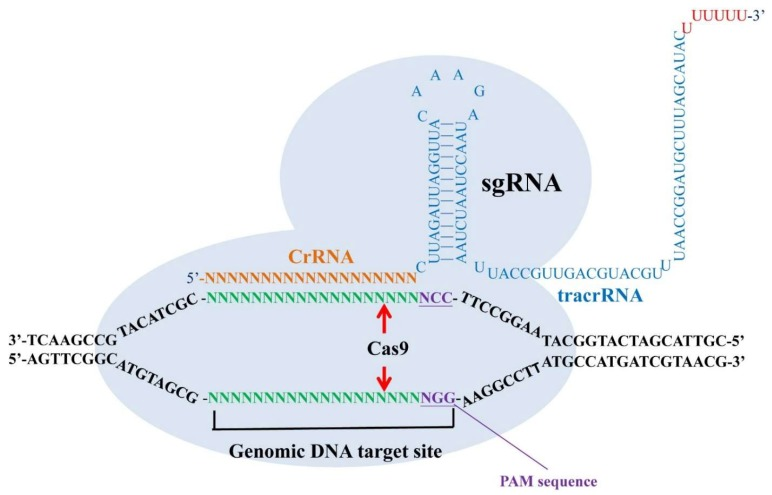
Un seul ARN guide (sgRNA), composé d’un ARN (crRNA) CRISPR (clustered, regularly-interspaced short palindromic repeats) et d’un crRNA transactivateur (tracrRNA), peut reconnaître sa séquence d’ADN cible et permettre à la protéine Cas9 de cliver 3 pb en amont de la séquence NGG (protospacer adjacent motif (PAM)) dans le brin sens et le brin antisens. La liaison spécifique des sgRNA et le clivage de l’endonucléase Cas9 créent une rupture double brin (DSB) avec des extrémités émoussées dans leurs sites cibles génomiques.
5.1 CRISPR/Cas9 comme outil d’étude des maladies mentales
Le système CRISPR/Cas9 a été appliqué avec succès à la recherche fondamentale sur les maladies mentales, y compris la dépendance aux opioïdes, en modifiant, activant ou supprimant des gènes spécifiques d’intérêt, principalement dans la génération de rats transgéniques. Les rats ont toujours été considérés comme un modèle animal solide pour les études de comportement ; cependant, par rapport aux souris transgéniques, leur application est limitée en raison du retard pris dans le développement de l’édition du génome du rat. À l’heure actuelle, les techniques CRISPR ont révolutionné l’édition du génome des rats, et le ciblage génétique n’est donc plus limité aux souris. Back et al. ont utilisé le système combiné de virus adéno-associé (AAV)-CRISPR pour introduire une mutation dans le gène du neurone dopaminergique, testant ainsi la fonction des gènes dans un modèle de toxicomanie ou de maladie de Parkinson. Il s’agit du premier modèle de rat knockin produit en ciblant les gènes de la lignée germinale dans les cellules souches spermatogoniales.
Les récepteurs D2 de la dopamine (Drd2), qui constituent une cible primaire pour les médicaments, sont impliqués dans des troubles du cerveau tels que la toxicomanie, la schizophrénie et la maladie de Parkinson. Yu et al. ont utilisé des techniques CRISPR pour générer deux lignées de rats knockin (Drd2::Cre et Rosa26::loxp-stop-loxp-tdTomato). En croisant ces deux lignées de rats, ils ont produit des rats rapporteurs de Drd2 qui expriment la protéine fluorescente tdTomato sous le contrôle du promoteur endogène de Drd2. Les rats Drd2::Cre générés pourraient constituer un excellent modèle animal pour étudier la fonction des populations neuronales exprimant Drd2.
La ghréline, une hormone dérivée de l’estomac, agit en se liant au récepteur sécrétagogue de l’hormone de croissance (GHSR) et influence divers comportements animaux, notamment la toxicomanie, la récompense, le stress et l’alimentation. Zallar et al. ont établi, vérifié et caractérisé un modèle de rat Wistar knockout (KO) du GHSR en utilisant des techniques CRISPR. Ce modèle de rat Wistar KO GHSR peut représenter un outil nouveau et privilégié pour étudier le rôle du système de la ghréline dans les troubles neuropsychiatriques et l’obésité.
5.2 Traitement potentiel de la dépendance aux opioïdes basé sur CRISPR
De nombreuses applications contre la dépendance aux opiacés basées sur CRISPR sont en cours de recherche, et certaines d’entre elles ont été couronnées de succès dans les études sur les animaux. Les résultats de l’édition du génome à l’aide de CRISPR/Cas9 peuvent accélérer les études sur les troubles du cerveau et offrent potentiellement une stratégie thérapeutique pour la toxicomanie en transplantant des cellules souches ou en modifiant directement les gènes correspondants.
La dépendance à la cocaïne, une maladie du cerveau associée à la recherche compulsive de drogue, est facile à rechuter une fois exposée à la drogue, même après de longues périodes d’abstinence. Li et al. ont signalé que des cellules souches épidermiques de la peau peuvent être modifiées à l’aide de CRISPR, puis transplantées dans des souris donneuses. La transplantation de cellules cutanées s’est avérée exprimer une butyrylcholinestérase active pour hydrolyser la cocaïne et maintenir cette libération d’enzyme sur une longue période afin de protéger les souris des comportements de recherche et d’overdose de cocaïne. Le résultat a révélé que la thérapie génique cutanée par transplantation de peau qui facilite l’élimination de la drogue peut constituer un choix thérapeutique alternatif pour la toxicomanie.
Les récepteurs de l’acide gamma aminobutyrique (GABA) de type A (GABA-A) englobant la sous-unité α2 (Gabra2) qui s’expriment dans la plupart des régions du cerveau jouent un rôle important dans la modulation de la fonction synaptique inhibitrice. La variation du locus génétique Gabra2 peut provoquer des troubles psychiatriques, l’épilepsie, l’alcoolisme et la toxicomanie. Mulligan et al. ont réparé la délétion du gène Gabra2 chez des souris C57BL/6J (B6J) à l’aide de CRISPR et ont complètement restauré les niveaux d’ARNm et de protéines Gabra2 dans le cerveau des souris. Ce résultat a eu des implications cruciales pour les chercheurs qui utilisent les souris B6J comme souche de base pour étudier la génétique moléculaire de la neurobiologie et du comportement, et a laissé entrevoir la possibilité de traiter l’abus de drogues par la thérapie génique Gabra2.
Bien que le traitement médical de la dépendance aux opiacés basé sur CRISPR soit prometteur pour les applications cliniques, il existe des défis associés concernant les limites de la technique, les problèmes de sécurité et les questions éthiques qui doivent être délibérément évalués (tableau 2). Heureusement, de nombreuses stratégies ont été développées pour améliorer les conséquences et surmonter la plupart des défis.
[TABLEAU 2]
Conclusion.
Aux États-Unis, des milliards de dollars ont été perdus en raison de la dépendance aux opioïdes, et des milliers de décès ont été causés par cette dépendance chaque année. En particulier, la forte prévalence de la dépendance aux opioïdes chez les individus à la fin de l’adolescence et au début de l’âge adulte a imposé une lourde charge aux structures sociétales, telles que celles des soins de santé et de la justice pénale.
Des études sur les animaux ont soutenu l’idée que les rongeurs adolescents sont plus susceptibles de développer une dépendance aux opioïdes parce qu’ils ont plus de rétroaction positive de la MOR et moins de symptômes de sevrage aux opioïdes. À mesure que les adolescents développent une dépendance aux opioïdes, l’envie et la recherche de drogues peuvent ruiner les possibilités d’éducation et d’emploi des individus et peuvent même conduire à une activité criminelle entraînant une incarcération ; par conséquent, l’altération irréversible des fonctions cérébrales entraîne un cercle vicieux dans lequel les toxicomanes veulent d’abord se débarrasser des drogues mais recommencent ensuite à en consommer parce qu’ils sont incapables de faire face aux sentiments de frustration, de réparer les relations avec leur entourage et de trouver un emploi.
Les médicaments agonistes et antagonistes des opioïdes se sont avérés être des traitements efficaces de la dépendance aux opioïdes. Les traitements agonistes opioïdes tels que la méthadone et la buprénorphine peuvent réduire l’intensité de l’euphorie et du sevrage, et les traitements antagonistes opioïdes peuvent prévenir le mésusage des médicaments de substitution aux opioïdes. Comme mentionné plus haut, les récepteurs opioïdes sont associés au système de récompense du cerveau, et les médicaments ayant un effet plus important sur le MOR, qui est associé aux stimuli de récompense, sont plus susceptibles de maintenir les personnes dépendantes en traitement. L’objectif du traitement de la dépendance aux opiacés est de stabiliser les problèmes médicaux, psychiatriques, juridiques, familiaux, de logement et d’emploi des patients. Cependant, les récidives et les rechutes sont fréquentes sous les traitements médicaux et psychologiques actuels. Ainsi, la recherche génétique peut fournir une approche pour révéler les mécanismes de la dépendance aux opioïdes et pour comprendre les différences individuelles de vulnérabilité à la dépendance aux opioïdes.
La recherche génétique classique et la recherche en génétique moléculaire ont toutes deux fourni des preuves que la dépendance aux opiacés n’est pas seulement environnementale mais aussi au moins en partie héréditaire ; les résultats des précédentes études de génétique moléculaire telles que les GWAS soutiennent l’idée que la dépendance aux opiacés est associée à des gènes spécifiques qui sont impliqués dans les récepteurs opioïdes, le système dopaminergique et le système sérotoninergique. Comme indiqué précédemment, la dépendance aux opioïdes est associée à des comportements spécifiques tels que la tolérance, l’état de manque et les symptômes de sevrage, et elle est également associée aux circuits de récompense du cerveau par le biais du système des récepteurs opioïdes. Les résultats ci-dessus suggèrent que la dépendance aux opioïdes est une maladie complexe. L’analyse des scores de risque polygénique a été appliquée à des troubles psychiatriques tels que la schizophrénie et le trouble bipolaire, et les résultats ont confirmé l’idée que la schizophrénie et le trouble bipolaire sont des maladies complexes. Des recherches supplémentaires sur l’application d’une analyse du score de risque polygénique à la dépendance aux opiacés et à d’autres troubles liés à la consommation de substances sont nécessaires.
La nouvelle méthode d’édition de gènes, CRISPR, pourrait être un outil efficace pour générer des rats transgéniques qui présentent des avantages expérimentaux par rapport aux souris pour étudier la dépendance aux opiacés. En ce qui concerne le traitement médical, de nombreuses stratégies thérapeutiques, dont la thérapie cellulaire et la thérapie génique, sont en cours de développement pour la dépendance aux opiacés. Si la dépendance aux opiacés est une maladie héréditaire avec des défauts génétiques dans Drd2, GHSR et Gabra2, il est raisonnable d’appliquer les technologies d’édition de gènes (par exemple, CRISPR) pour prévenir médicalement et éthiquement la dépendance aux opiacés. Si les patients souffrent déjà d’une dépendance aux opioïdes, le résultat thérapeutique de l’utilisation de l’édition de gènes CRISPR est limité, sauf si les patients ont des gènes défectueux associés à la dépendance aux opioïdes. Les nouvelles modifications génétiques CRISPR/Cas9 ont suscité un intérêt accru pour le traitement des maladies neurodégénératives telles que la maladie d’Alzheimer et la maladie de Huntington. Ainsi, les thérapies géniques pourraient être efficaces dans le traitement de la dépendance aux opiacés, bien que la plupart d’entre elles fassent actuellement l’objet de recherches et que d’autres essais/examens soient nécessaires en raison de problèmes de sécurité et d’éthique. Dans ces cas, la thérapie cellulaire basée sur CRISPR est recommandée et potentiellement utile pour le traitement des patients souffrant déjà d’une dépendance aux opiacés. Le développement et les implications de la technologie d’édition de gènes CRISPR devraient être étudiés dans un contexte aussi large que possible. En outre, l’orientation future de la recherche et l’application de ces nouvelles découvertes devraient également être soulignées.
