Kwako, L. E., & Koob, G. F. (2017). Neuroclinical framework for the role of stress in addiction. Chronic Stress, 1, 2470547017698140.
Abstract
La dépendance a été conceptualisée comme un cycle en trois étapes – consommation/intoxication, sevrage/affect négatif et préoccupation/anticipation – qui s’aggrave avec le temps et implique des changements allostatiques dans la fonction hédonique par le biais de changements dans les systèmes de récompense et de stress du cerveau. En utilisant le stade du sevrage/affect négatif et le renforcement négatif comme source importante de motivation pour la recherche compulsive de drogues, nous décrivons la neurobiologie de la composante stress du stade du sevrage/affect négatif et la relions à un dérivé du concept de recherche Research Domain Criteria pour l’étude des maladies psychiatriques, connu sous le nom d’Addictions Neuroclinical Assessment (évaluation neuroclinique des dépendances). À l’aide de l’évaluation neuroclinique des dépendances, nous définissons cinq sous-domaines d’états émotionnels négatifs qui peuvent être mesurés de manière opérationnelle dans des laboratoires humains et mis en parallèle avec des modèles animaux. Nous émettons l’hypothèse que l’accent mis sur l’émotivité négative et le stress est étroitement lié aux altérations neurobiologiques aiguës que l’on observe dans la toxicomanie et qu’il peut servir de passerelle vers une reformulation de la nosologie de la toxicomanie afin de mieux saisir les différences individuelles chez les patients pour lesquels l’étape du sevrage/de l’affect négatif entraîne une prise de drogue compulsive.
Cadre conceptuel
Qu’est-ce que le stress ?
Selye a défini le stress comme une réponse à des exigences (généralement nocives) imposées à l’organisme qui, historiquement, ont été définies par divers changements physiologiques incluant l’activation de l’axe hypothalamo-hypophyso-surrénalien (HPA). Cependant, une définition du stress plus compatible avec ses nombreuses manifestations dans l’organisme est “tout ce qui provoque une altération des processus homéostatiques psychologiques.” En fait, dans un article précurseur, Mason a souligné l’importance du stress psychologique pour déclencher une réponse au stress, même parmi les facteurs de stress physique, et a affirmé que de nombreux défis physiques sans stress psychologique ne sont pas stressants.
La réponse physiologique la plus associée à un état de stress est une élévation des glucocorticoïdes provenant du cortex surrénalien. Cette réponse est contrôlée par l’axe HPA. Vale et al. ont d’abord démontré que le facteur de libération de la corticotropine (CRF) initie la réponse neuroendocrine au stress de l’axe HPA (hormone adrénocorticotrope et finalement glucocorticoïdes) en liant les récepteurs CRF1 dans l’antéhypophyse après leur libération dans le sang portal. Le CRF provenant du noyau paraventriculaire de l’hypothalamus a alors été identifié comme le principal régulateur de l’axe HPA. Les glucocorticoïdes ont pour fonction d’augmenter et de maintenir la glycémie en augmentant la gluconéogenèse, et ils diminuent la fonction immunitaire en bloquant les protéines pro-inflammatoires. Ces réponses facilitent la mobilisation de l’organisme en réponse à des facteurs de stress aigus. Cependant, nous savons maintenant que les neurocircuits du cerveau médient les réponses comportementales aux facteurs de stress et jouent un rôle majeur dans “l’homéostasie psychologique”.
La comorbidité entre les troubles liés à la dépendance et ceux liés au stress est élevée, ce qui est important pour la présente étude. Lors de la troisième vague de l’enquête épidémiologique nationale sur l’alcool et les maladies apparentées (NESARC), le rapport de cotes à 12 mois pour le syndrome de stress post-traumatique (PTSD, c’est-à-dire la maladie psychiatrique la plus directement liée à l’exposition au stress) et tout trouble lié à l’utilisation d’une substance était de 1,3 ; le rapport de cotes au cours de la vie était de 1,5. En outre, dans la National Comorbidity Survey-Replication, un diagnostic de PTSD au temps 1 était associé à des rapports de cotes de 3,2 et 5,4 pour la dépendance à l’alcool et aux drogues illicites, respectivement, au temps 2, 10 ans plus tard, parmi les personnes qui n’étaient pas dépendantes d’une substance au temps 1.
Qu’est-ce que l’addiction ?
L’addiction peut être définie de différentes manières, mais une définition généralement adoptée dans le domaine est que l’addiction est un trouble chronique et récidivant qui se caractérise par une compulsion à rechercher et à prendre des drogues et par la perte de contrôle de la prise de drogue. D’autres ont mis l’accent sur une autre caractéristique, notamment “l’émergence d’un état émotionnel négatif (par exemple, dysphorie, anxiété et irritabilité) qui définit un syndrome de sevrage motivationnel lorsque l’accès à la drogue est empêché”. En effet, certains théoriciens ont affirmé qu’un tel état émotionnel négatif est la caractéristique déterminante de la dépendance à une drogue :
La notion de dépendance à une drogue, à un objet, à un rôle, à une activité ou à tout autre stimulus-source requiert la caractéristique cruciale de l’affect négatif ressenti en son absence. Le degré de dépendance peut être assimilé à l’intensité de cet affect négatif, qui peut aller d’un léger inconfort à une détresse extrême, ou à la difficulté ou à l’effort nécessaire pour se passer de la drogue, de l’objet, etc.
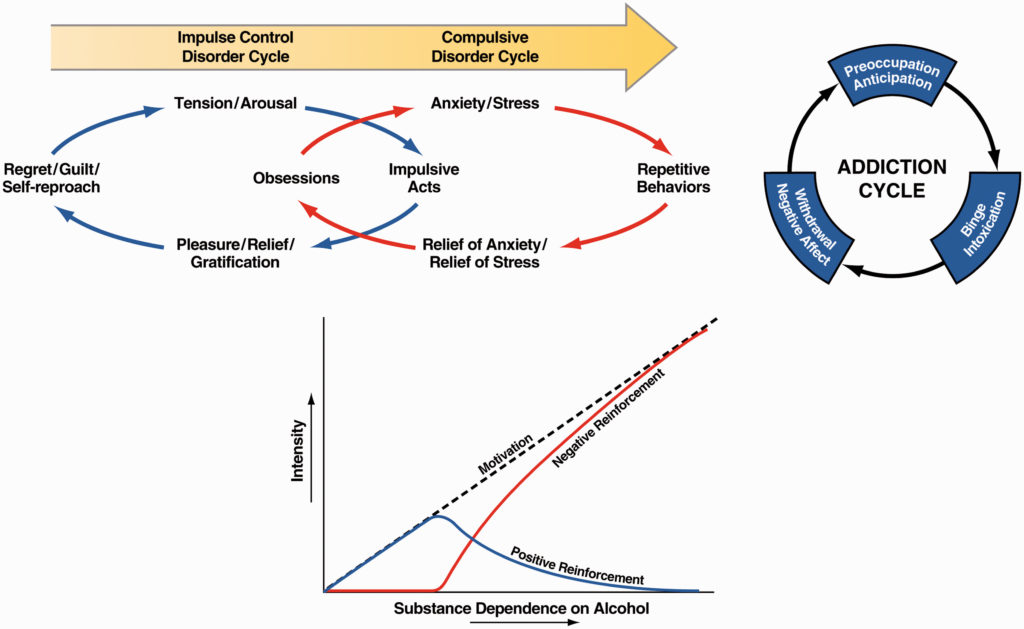
En utilisant ce cadre, l’addiction a été conceptualisée comme un cycle en trois étapes – cuite/intoxication, sevrage/affect négatif et préoccupation/anticipation – qui s’aggrave avec le temps et implique des changements allostatiques dans la fonction hédonique par le biais de changements dans les systèmes de récompense et de stress du cerveau. L’allostasie est définie comme la stabilité par le biais d’un mécanisme de rétroaction qui réajuste les paramètres à un nouveau point de consigne hédonique, mais en dehors de la plage homéostatique. Deux sources principales de renforcement – le renforcement positif et le renforcement négatif – ont été supposées jouer un rôle dans ce processus allostatique. Le renforcement positif est défini comme le processus par lequel la présentation d’un stimulus augmente la probabilité d’une réponse. Le renforcement négatif est défini comme le processus par lequel la suppression d’un stimulus aversif (ou d’un état aversif, dans le cas de l’addiction) augmente la probabilité d’une réponse.
Un autre cadre permettant de conceptualiser l’addiction à la drogue est le continuum impulsivité-compulsivité, dans lequel l’impulsivité peut être définie sur le plan comportemental comme “des actions mal conçues, exprimées prématurément, indûment risquées ou inadaptées à la situation et qui entraînent souvent des conséquences indésirables”. L’impulsivité est un déficit fondamental dans les troubles liés à l’abus de substances. Elle peut être mesurée de multiples façons, mais deux domaines dominent : le choix d’une récompense plus petite et immédiate plutôt qu’une récompense plus grande et différée, ou l’incapacité d’inhiber un comportement en changeant le cours de l’action ou d’arrêter une réponse une fois qu’elle est initiée. D’un point de vue opérationnel, les tâches de gratification différée (par exemple, les tâches d’actualisation différée, le choix impulsif) et la tâche Stop-Signal ou Go/No-Go (impulsivité comportementale) ont toutes deux été utilisées pour mesurer les différents domaines de l’impulsivité.
En revanche, “la compulsivité peut être caractérisée par des actions persévérantes et répétitives qui sont excessives et inadaptées à la situation”. Les personnes qui souffrent de compulsions reconnaissent souvent que les comportements sont nuisibles, mais elles se sentent néanmoins émotionnellement obligées de les exécuter. L’exécution de ces comportements réduit la tension, le stress ou l’anxiété. D’un point de vue opérationnel, dans les modèles animaux, le fait de répondre à une drogue ou à un alcool face à des conséquences négatives ou de répondre à une drogue ou à un alcool selon un calendrier de renforcement à rapport progressif a été considéré comme reflétant la compulsivité. Ainsi, en plus du renforcement positif associé à une forte impulsivité liée aux premiers stades du processus d’addiction, une source supplémentaire de motivation est recrutée, à savoir le renforcement négatif.
Ce continuum impulsivité-compulsivité a une histoire nosologique. Les sujets présentant des troubles atypiques classiques du contrôle des impulsions, comme la kleptomanie, éprouvent un sentiment croissant de tension ou d’excitation avant de commettre un acte impulsif ; du plaisir, de la gratification ou du soulagement au moment de commettre l’acte ; et du regret, de l’auto-reproche ou de la culpabilité à la suite de l’acte. En revanche, les sujets souffrant de troubles compulsifs classiques, tels que les troubles obsessionnels compulsifs, ressentent de l’anxiété et du stress avant d’adopter un comportement répétitif compulsif et sont soulagés de ce stress en adoptant le comportement compulsif. Nous avons soutenu que l’addiction à la drogue évolue d’une source de renforcement positif qui peut effectivement impliquer davantage d’éléments d’impulsivité à une source de renforcement négatif qui peut impliquer davantage d’éléments de compulsivité (figure 1). Le cycle de l’addiction en trois étapes, avec les sources conceptuelles intégrées de motivation de renforcement positif et négatif qui correspondent à l’impulsivité et à la compulsivité (figure 1), n’est pas propre à la toxicomanie et se généralise aux addictions non médicamenteuses ou aux addictions “de processus”. Dans une étude récente, les auteurs ont identifié trois grands domaines d’altération neurofonctionnelle liés au trouble du jeu, à savoir la perte de contrôle, l’état de manque/le retrait et la négligence d’autres domaines de la vie. Ces domaines correspondent étroitement aux domaines décrits dans les trois étapes du cycle de l’addiction et dans le cadre de l’évaluation neuroclinique des addictions (ANA) (voir ci-dessous).
Neurobiologie du stress
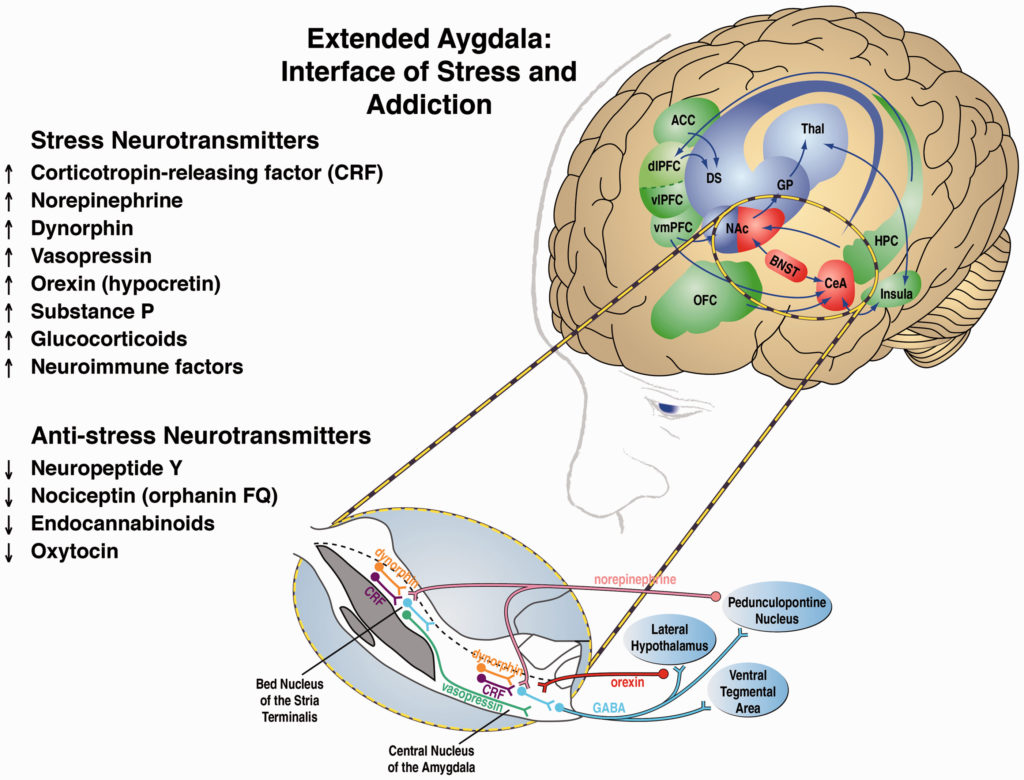
Les principales réponses hautement conservées aux facteurs de stress dans l’environnement comprennent la lutte ou la fuite. Une superstructure du cerveau antérieur basal, l’amygdale étendue, traite la peur, les menaces et l’anxiété chez l’homme (c’est-à-dire les réponses de lutte ou de fuite) et engage le neurocircuit des états émotionnels négatifs. L’amygdale étendue présente des similitudes en termes de morphologie, de neurochimie et de connectivité et se compose du noyau central de l’amygdale (CeA), du noyau du lit de la strie terminale (BNST) et d’une zone de transition dans la partie médiane postérieure (coquille) du noyau accumbens (NAcSh). L’amygdale étendue reçoit des informations de diverses régions du cerveau impliquées dans les émotions, mais surtout du cortex préfrontal. L’amygdale étendue se projette fortement vers l’hypothalamus et d’autres structures du mésencéphale qui sont impliquées dans l’expression des réponses émotionnelles. Lorsque les animaux sont exposés à un facteur de stress, ils présentent une réaction de congélation accrue à un stimulus de peur conditionnée, une réaction de sursaut accrue à un stimulus de sursaut, l’évitement des zones ouvertes, des bras ouverts et des hauteurs, ainsi que des réponses typiques de l’espèce accrues à un stimulus aversif. Toutes ces réponses sont au moins partiellement médiées par l’amygdale étendue. En psychopathologie, on a émis l’hypothèse que le dérèglement de l’amygdale étendue jouait un rôle clé dans les troubles liés au stress et aux états émotionnels négatifs, tels que le PTSD, le trouble anxieux général, les phobies, les troubles affectifs et l’addiction.
Deux systèmes neurochimiques, le CRF et la dynorphine, jouent un rôle clé dans l’amygdale étendue pour effectuer de tels changements comportementaux. Deux systèmes neurochimiques, le CRF et la dynorphine, jouent un rôle clé dans l’amygdale étendue pour effectuer ces changements comportementaux. Tous deux sont également impliqués dans la psychopathologie associée à l’amygdale étendue, et tous deux sont au centre des différences individuelles dans la pathologie du stress. La réponse glucocorticoïde mobilise l’organisme pour des réponses physiologiques aux facteurs de stress ; le CRF joue un autre rôle en mobilisant la réponse comportementale de l’organisme aux facteurs de stress par l’intermédiaire de circuits cérébraux extérieurs à l’hypothalamus. Dans une première étude, le CRF a été injecté par voie intracérébroventriculaire dans le cerveau de rats naïfs, ce qui a entraîné une hyperactivité et une hyperexcitation dans un environnement familier, mais une réponse très prononcée de type “freezing” dans un nouvel environnement stressant. Des travaux ultérieurs ont montré que l’amygdale étendue était un système important qui médiait de telles réponses au CRF et à la peur et à l’anxiété en général. L’administration d’antagonistes compétitifs des récepteurs du CRF s’est avérée avoir des effets anti-stress opposés. Cette observation était essentielle car elle confirmait le rôle du CRF endogène dans les réponses comportementales aux facteurs de stress (pour une revue, voir Koob et Zorrilla).
Le système opioïde dynorphine-κ joue également un rôle clé dans les réponses comportementales aux facteurs de stress. Les dynorphines contiennent la séquence leucine (leu)-enképhaline dans la partie N-terminale de la molécule et sont des ligands endogènes pour le récepteur opioïde κ. Les dynorphines sont largement répandues dans le système nerveux central et jouent un rôle dans la régulation neuroendocrinienne, la régulation de la douleur, l’activité motrice, la fonction cardiovasculaire, la respiration, la régulation de la température, le comportement alimentaire et la réactivité au stress. Les dynorphines produisent des effets aversifs de type dysphorique chez l’animal et chez l’homme et ont été considérées comme des médiateurs des réponses comportementales aux facteurs de stress et aux états émotionnels négatifs (pour une revue, voir Van’t Veer et Carlezon).
D’autres systèmes de neurotransmetteurs clés, qui interagissent tous avec l’amygdale élargie, médiatisent les réponses comportementales aux facteurs de stress, notamment la noradrénaline, la vasopressine, l’hypocrétine (orexine), la substance P, les cytokines pro-inflammatoires et les systèmes de neurotransmetteurs clés qui agissent en opposition aux systèmes de stress cérébraux, tels que le neuropeptide Y (NPY), la nociceptine et les endocannabinoïdes. Dans l’ensemble, ces systèmes neurochimiques donnent le ton et modulent l’expression émotionnelle, en particulier les états émotionnels négatifs, par l’intermédiaire de l’amygdale élargie (figure 2). Ces systèmes de stress et leur pertinence pour l’addiction font l’objet d’une revue complète dans Koob.
Neurobiologie de l’addiction
La base neurobiologique de la phase de frénésie et d’intoxication du cycle de l’addiction implique l’activation des circuits de récompense et la facilitation des circuits de saillance incitative. Les drogues sont gratifiantes, mais elles confèrent également des propriétés motivantes à des stimuli auparavant neutres, un processus connu sous le nom de saillance incitative. La récompense et la saillance incitative induite par la drogue sont largement médiées par les neurocircuits des ganglions de la base. Pour la plupart des grandes drogues, des études animales ont montré que leurs actions renforçantes sont médiées par la libération de dopamine et de peptides opioïdes dans le striatum ventral (NAc). Des études d’imagerie chez l’homme ont montré que des doses intoxicantes de la plupart des drogues et de l’alcool libèrent de la dopamine et des peptides opioïdes dans le striatum ventral. L’activation du striatum ventral entraîne le recrutement de boucles ganglions de la base-globus pallidus-thalamiques-corticales qui engagent le striatum dorsal dans la formation et le renforcement d’habitudes, ce qui est supposé être le début d’une réponse compulsive aux drogues.
Au stade du sevrage et de l’affect négatif, on suppose que deux processus, agissant peut-être en parallèle, constituent la base neurobiologique de la perte de fonction des systèmes de récompense (neuroadaptation interne) dans le striatum ventral et du recrutement des systèmes de stress cérébral (neuroadaptation intersystème) dans l’amygdale élargie. Une neuroadaptation intra-système a été définie comme le processus par lequel le principal élément de réponse cellulaire à la drogue (circuit A, circuit de récompense) s’adapte pour neutraliser les effets de la drogue et avoir des effets opposés à ceux de la drogue. Des exemples de changements à l’intérieur du système ont été supposés être des changements cellulaires moléculaires à l’intérieur des circuits de récompense qui sont suractivés dans la phase de consommation excessive/intoxication et comprennent les perturbations des voies de transduction des signaux intracellulaires, y compris les changements dans le fonctionnement des protéines G et l’activité de la protéine kinase A (PKA) et des facteurs de transcription tels que la protéine de liaison de l’élément de réponse à l’adénosine monophosphate cyclique (CREB), et en aval ΔFosB, le facteur nucléaire κB, et CDK5 qui peuvent modifier l’expression des gènes. À mesure que la dépendance (définie comme la manifestation de symptômes de sevrage motivationnels ; c’est-à-dire des éléments d’états émotionnels négatifs) se développe, les systèmes de stress du cerveau, tels que le CRF, la noradrénaline, la dynorphine, l’hypocrétine et la substance P, sont recrutés, produisant des états aversifs ou de type stress. Une neuroadaptation intersystème a été définie comme un changement dans un circuit qui n’est pas le circuit A, dans lequel le circuit B (circuit du stress) peut être déclenché par l’activité du circuit A (c’est-à-dire le circuit de la récompense). Les neuroadaptations intra-système peuvent interagir dynamiquement avec les neuroadaptations inter-systèmes, dans lesquelles le circuit B (c’est-à-dire le circuit du stress) est activé soit en parallèle pour affecter un état émotionnel négatif, soit en série pour supprimer l’activité du circuit A afin d’affecter un état émotionnel négatif. Les systèmes CRF décrits ci-dessus sont recrutés lors de crises de boulimie et de sevrage répétées, avec activation de l’axe HPA qui, à son tour, libère des glucocorticoïdes qui, à leur tour, sensibilisent les systèmes CRF dans l’amygdale élargie qui activent les circuits pour conduire des états émotionnels négatifs (tableau 1). On a longtemps supposé que le système dynorphine-κ jouait un rôle de médiateur dans les états émotionnels négatifs liés au sevrage de la drogue en supprimant l’activité du système dopaminergique mésocorticolimbique. Les données disponibles à ce jour suggèrent que ces actions peuvent être médiées par l’activité de la dynorphine dans le NAcSh. Le système dynorphine-κ peut également interagir avec le CeA et être impliqué dans la promotion de réponses de type anxieux. Parallèlement, comme indiqué ci-dessus, il existe des systèmes tampons anti-stress dans l’amygdale étendue qui ont des effets opposés à ceux des systèmes modulateurs favorisant le stress. Il s’agit notamment du NPY, de la nociceptine et des endocannabinoïdes (tableau 1). Par exemple, l’activation du NPY dans la CeA a des effets opposés à ceux du CRF. Le NPY bloque l’administration compulsive d’alcool, bloque la transition vers une consommation excessive avec le développement d’une dépendance, et bloque l’augmentation de la libération d’acide γ-aminobutyrique (GABA) dans le CeA qui est produite par l’alcool. La combinaison de la diminution de la fonction des neurotransmetteurs de récompense et du recrutement des systèmes de stress cérébraux constitue une motivation puissante pour reprendre la consommation et la recherche de drogues.
[tableau 1]
Ainsi, de multiples circuits impliquant de multiples systèmes de neurotransmetteurs modulateurs convergent vers l’amygdale étendue pour médier les états émotionnels négatifs associés au stade du sevrage/de l’affect négatif. Chacun de ces circuits transmet théoriquement des dimensions qualitatives différentielles à la construction d’un état émotionnel négatif qui constitue une base pour les dimensions d’une évaluation neuroclinique de la phase de sevrage/affect négatif du cycle de l’addiction (tableau 1).
La phase de préoccupation/anticipation (“craving”) est le médiateur de l’altération du contrôle exécutif dans l’addiction par l’intermédiaire des circuits du cortex préfrontal. La fonction exécutive peut être définie comme un circuit de contrôle global qui limite les réponses impulsives et compulsives, retarde le renforcement et fait des choix et des réponses appropriés, entre autres. Deux systèmes ont été conceptualisés : un système Go et un système Stop, qui n’agissent pas nécessairement en opposition. Le système Go se compose de parties du cortex cingulaire antérieur, du cortex préfrontal dorsal et du cortex orbitofrontal et engage les habitudes par l’intermédiaire des ganglions de la base. Le système Stop se compose du cortex préfrontal ventral, du cortex orbitofrontal et d’autres régions préfrontales qui se chevauchent avec le système Go. Les projections du système Stop inhibent le système de saillance incitative des ganglions de la base et le système de stress de l’amygdale étendue. Chez les personnes souffrant de troubles liés à l’utilisation de substances, on observe des perturbations de la prise de décision, des déficiences dans la gestion des informations spatiales et des déficiences dans l’inhibition comportementale, qui peuvent toutes entraîner un état de manque et la recherche de drogues. L’état de manque, défini comme le désir d’une drogue ou d’un alcool en l’absence de drogue, a été divisé en deux domaines : l’état de manque de récompense (recherche de drogue induite par des drogues ou des stimuli liés aux drogues) et l’état de manque de soulagement (recherche de drogue induite par un facteur de stress aigu ou un état de stress). Les circuits cérébraux qui interviennent dans ces deux domaines peuvent être parallèles aux dysrégulations sous-corticales supposées associées aux stades de la frénésie/intoxication et du sevrage (effets négatifs) et peuvent contribuer à la rechute lors d’une abstinence prolongée au stade de la préoccupation/anticipation (“craving”).
Évaluation neuroclinique : De la récompense au stress et inversement
Le cadre de recherche nosologique appelé Research Domain Criteria (RDoC) fait partie du plan stratégique 2008 du National Institute of Mental Health (NIMH), dont l’objectif est de créer un cadre de recherche pour l’étude des troubles psychiatriques. Le cadre du NIMH était conceptuellement fondé sur la recherche en neurosciences et couvrait cinq domaines : Systèmes de valence négative, Systèmes de valence positive, Systèmes cognitifs, Systèmes pour les processus sociaux, et Systèmes d’éveil et de régulation. Les domaines de la RDoC sont organisés par unités d’analyse, allant des gènes aux paradigmes (pour un aperçu de la matrice RDoC, voir http://www.nimh.nih.gov/research-priorities/rdoc/research-domain-criteria-matrix.shtml ; consulté le 20 janvier 2017), et cette approche a suscité de nombreuses discussions conceptuelles et méthodologiques. Nous avons proposé une approche de recherche plus paroissiale, au sein d’un même trouble, le cadre de l’évaluation neuroclinique des addictions (ANA)66 , qui saisit des informations dans trois des cinq domaines RDoC d’origine.
Les domaines de l’ANA ont été dérivés du cadre conceptuel décrit ci-dessus, dans lequel l’addiction à la drogue découle d’un cycle en trois étapes dont les racines conceptuelles sont l’impulsivité et la compulsivité, le recrutement de renforcements positifs et négatifs et les interactions entre les substrats neurobiologiques de la récompense et du stress. Trois domaines fonctionnels – la fonction exécutive, la saillance de l’incitation et l’émotion négative – ont été proposés comme décrit ci-dessus. La phase de retrait/affect négatif de ce cycle, qui comprend le stress et les états émotionnels négatifs mais ne se limite pas au retrait et représente le domaine de l’émotionnalité négative, est au centre de la discussion qui suit.
Émotions négatives
Bien que cela ne soit pas souvent souligné, les rapports des personnes souffrant d’addiction à la drogue sont remplis de descriptions de la dysphorie générale qu’elles déclarent elles-mêmes et de diverses manifestations d’états émotionnels négatifs. Ces descriptions incluent la dépression, l’anxiété, l’anhédonie, la dysphorie, le malaise, l’alexithymie, l’hyperkativité, la douleur émotionnelle, la douleur physique, l’irritabilité et les troubles du sommeil. L’hypothèse de l’automédication a longtemps infiltré les théories de l’addiction, mais elle a été écartée, généralement au motif que les humains et les animaux s’auto-administrent des drogues sans subir de sevrage physique. Cependant, un malentendu assez courant sur la tolérance et le sevrage dans l’addiction est qu’ils représentent des phénomènes purement “physiques”, plutôt que des constructions motivationnelles. En effet, la tolérance (définie comme une recherche accrue de récompense et la prise d’une plus grande quantité de drogue pour produire le même effet) et le sevrage (défini comme un syndrome de sevrage motivationnel caractérisé par la dysphorie, l’anxiété et l’irritabilité lorsque la récompense recherchée n’est pas disponible) sont tous deux présents dans toutes les addictions médicamenteuses et comportementales. Par exemple, une évaluation complète des mécanismes de récompense doit inclure des mesures de l’hypohédonie. L’hypohédonie est largement documentée comme une caractéristique clinique de l’addiction et est fortement associée à l’augmentation de l’envie de drogues et à la rechute.
Le processus d’opposition comme principe directeur
L’interaction entre la récompense et le stress est dynamique, tant sur le plan phénotypique que neurobiologique. De faibles niveaux de stress aigu ont longtemps été considérés comme gratifiants. Les glucocorticoïdes ont des propriétés gratifiantes et peuvent même être auto-administrés par les animaux. Cependant, le stress chronique entraîne généralement un malaise, une irritabilité et une dysphorie, qui déclenchent des mécanismes de renforcement négatif. D’un point de vue neurobiologique, des preuves de plus en plus nombreuses établissent un lien entre l’activation excessive du système de récompense et l’activation des systèmes de stress du cerveau (voir ci-dessous). Dans le domaine de la motivation dans l’addiction, l’interaction entre la récompense et le stress a été inextricablement liée aux états hédoniques, affectifs ou émotionnels dans le contexte de la dynamique temporelle par la théorie du processus d’opposition de la motivation. Ici, les états hédoniques, affectifs ou émotionnels, une fois initiés, sont automatiquement modulés par des mécanismes qui réduisent l’intensité des sentiments hédoniques, probablement par l’intermédiaire du système nerveux central. Solomon et Corbit ont soutenu qu’il existe des systèmes d’habituation (ou de tolérance) affective ou hédonique et des systèmes de retrait (abstinence) affective ou hédonique. Ils ont défini deux processus : le processus a et le processus b. Le processus a consiste en des réponses hédoniques positives ou négatives. Dans le cas de l’addiction, on peut supposer que le processus a est une réponse hédonique positive à l’administration d’une drogue très gratifiante. Le processus a se produit peu de temps après la présentation d’un stimulus, est en étroite corrélation avec l’intensité du stimulus, la qualité et la durée du renforçateur, et fait preuve de tolérance. En revanche, le processus b apparaît après la fin du processus a, est lent à se mettre en place, est lent à atteindre une asymptote, est lent à décroître et s’amplifie en cas d’exposition répétée (figure 3). Le processus b serait le début du développement de l’état émotionnel négatif associé au stade du retrait/affect négatif.
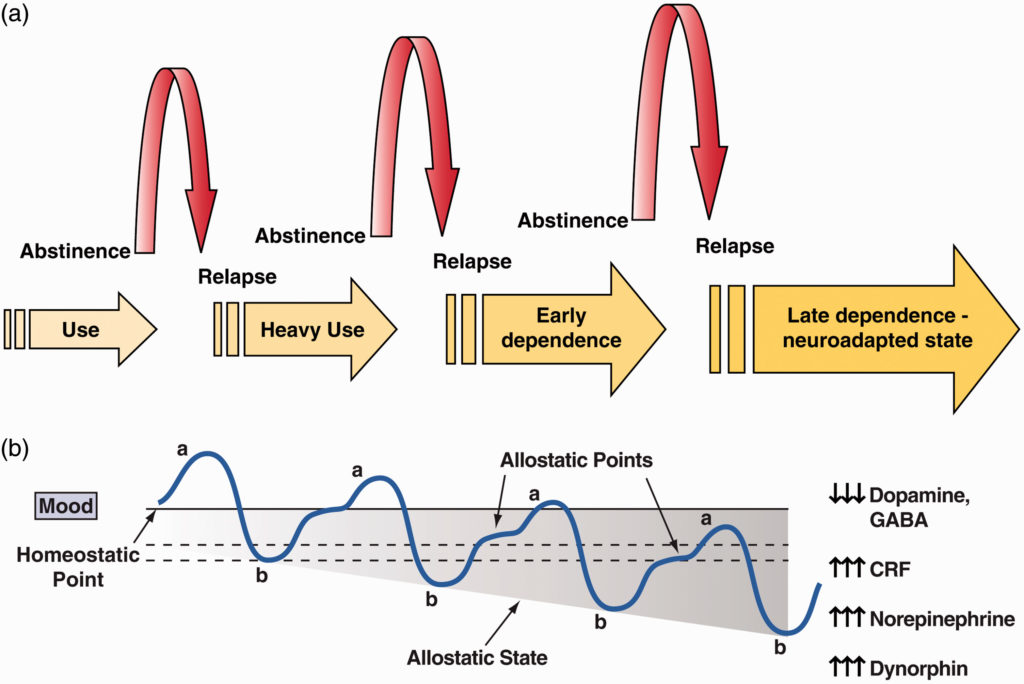
Un tel processus d’opposition a été démontré chez l’animal. Dans une première étude, l’auto-administration chronique de cocaïne sous forme de binge-like a entraîné un effet opposé sur les seuils de récompense de la stimulation cérébrale (c’est-à-dire une mesure de l’activité hédonique dans le cerveau), à savoir une élévation des seuils de récompense de la stimulation cérébrale. Des études ultérieures ont montré que l’élévation des seuils de récompense cérébraux associée au sevrage d’une administration chronique de drogues d’abus est un élément commun à toutes les drogues d’abus, y compris la cocaïne, l’amphétamine, les opioïdes, les cannabinoïdes, la nicotine et l’alcool. Une série d’études a révélé des élévations des seuils de récompense du cerveau pendant le sevrage dans des modèles animaux. Des preuves neuropharmacologiques essentielles ont été produites qui montrent que l’inversion de la neurotransmission déficitaire de la récompense et de la neurotransmission excédentaire du stress peut bloquer l’élévation des seuils de récompense produite par le sevrage de la drogue.
Un élément clé des états émotionnels négatifs en général et de l’hypohédonie en particulier, associé à la phase de sevrage/affect négatif du cycle de l’addiction, est l’engagement des systèmes de stress du cerveau, y compris les systèmes HPA et extrahypothalamiques. Comme indiqué plus haut, les systèmes de stress cérébraux comprennent des systèmes de neurotransmetteurs tels que le CRF, la dynorphine, la norépinéphrine, l’hypocrétine (orexine), la substance P et la vasopressine. Les preuves du dérèglement des systèmes cérébraux anti-stress, tels que le NPY, la nociceptine, les endocannabinoïdes et l’ocytocine, sont tout aussi convaincantes. On suppose que l’augmentation de l’activité des systèmes cérébraux de stress et la diminution de l’activité des systèmes cérébraux anti-stress contribuent de manière significative à l’émotivité négative.
Évaluation neuroclinique : Anhédonie, hypohédonie et dysphorie
La neurocircuiterie de l’anhédonie, de l’hypohédonie et de la dysphorie a, dans une large mesure, été supposée refléter des changements ” internes au système ” dans le système dopaminergique mésocorticolimbique ou les systèmes de peptides opioïdes qui convergent vers le NAc. Les changements “entre systèmes” qui médient l’anhédonie, l’hypohédonie et la dysphorie comprennent l’activation de neurocircuits impliqués dans le stress (CRF dans la VTA et la BNST) ou de neurocircuits qui suppriment l’activité dopaminergique (CRF et/ou dynorphine ou acétylcholine dans la VTA, la NAc et l’habenula ; tableau 1). Les modèles animaux avec une validité de construction pour l’anhédonie, l’hypohédonie et la réponse de type dysphorique qui ont aidé à élucider les circuits neurologiques respectifs comprennent des mesures de seuils de récompense par stimulation cérébrale (autostimulation intracrânienne), la préférence pour le saccharose, la réponse par rapport progressif et la tâche de récompense probabiliste chez l’animal (tableau 2). Les évaluations humaines en laboratoire de l’anhédonie, de l’hypohédonie et de la dysphorie vont des mesures standard d’auto-évaluation, telles que l’inventaire de dépression de Beck et l’échelle d’évaluation de l’anxiété de Hamilton, aux mesures qui se concentrent sélectivement sur les constructions de récompense négative, telles que l’échelle de plaisir de Fawcett-Clark (tableau 3). Des mesures plus opérationnelles de l’anhédonie, de l’hypohédonie et de la dysphorie comprennent, entre autres, la tâche de récompense probabiliste et la tâche d’effort pour la dépense de récompenses.
[tableaux 2 & 3]
Évaluation neuroclinique : Anxiété, réactivité au stress et irritabilité
La neurocircuiterie de l’anxiété, du stress et de l’irritabilité est supposée impliquer des changements “entre les systèmes” qui comprennent l’activation des neurocircuits impliqués dans le stress (CRF, noradrénaline, vasopressine et hypocrétine dans le CeA et le BNST ; tableau 1). Les modèles animaux avec une validité de construction pour les comportements de type anxiété, réactivité au stress et comportement de type irritabilité qui ont aidé à élucider les circuits neurologiques associés à l’anxiété, au stress et à l’irritabilité comprennent le labyrinthe plus surélevé, le test de retrait défensif, le test d’enfouissement défensif, le test d’enfouissement de marbre et le test d’interaction sociale (tableau 2). Les évaluations en laboratoire de l’anxiété, de la réactivité au stress et de l’irritabilité chez l’homme vont des mesures standard d’auto-évaluation, telles que l’inventaire d’anxiété de Beck et l’échelle d’évaluation de la dépression de Hamilton, à celles qui se concentrent sélectivement sur les traumatismes, telles que le questionnaire sur les traumatismes de l’enfance (tableau 3). Des mesures plus opérationnelles de l’anxiété, de la réactivité au stress et de l’irritabilité comprennent le test Cyberball, le test de stress social de Trier et l’inventaire d’hostilité de Buss-Durkee (tableau 3).
Évaluation neuroclinique : Douleur et hyperkativité
On suppose que la neurocircuiterie de la douleur et de l’analgésie implique des changements “entre les systèmes” qui comprennent l’activation des circuits de la douleur ainsi que des neurocircuits impliqués dans le stress (CRF, noradrénaline, vasopressine et substance P dans le CeA et le BNST ; tableau 1). Les modèles animaux avec une validité de construction pour la douleur et l’hyperalgésie qui ont aidé à élucider les circuits neurologiques associés à la douleur et l’interaction entre la douleur et le stress comprennent le test de la plaque chaude, le test de la queue et le test de von Frey (tableau 2).
L’hyperalgésie et l’hyperkatiféie ont été observées chez l’homme lors du sevrage des opioïdes et de l’alcool. L’hyperalgésie peut être définie comme une sensibilité accrue à la douleur. L’hyperkatifeia (dérivé du mot grec katifeia qui signifie abattement, tristesse ou état émotionnel négatif) est définie comme l’intensité accrue des symptômes et signes émotionnels/motivationnels négatifs. Les évaluations en laboratoire de l’hyperalgésie chez l’homme vont des batteries de tests standard des seuils de douleur à la douleur thermique, à la stimulation électrique ou à la pression. Les tests plus généraux de responsabilité émotionnelle comprennent l’échelle d’Alexithymie de Toronto (Tableau 3). Les mesures plus opérationnelles de la douleur comprennent des tests qui se concentrent sélectivement sur l’hyperalgésie (par exemple, le test de la pression froide) et l’hyperkativité (par exemple, la tâche d’appariement des émotions faciales ; tableau 3).
Évaluation neuroclinique : Malaise, troubles du sommeil et excitation
La neurocircuiterie du malaise, des troubles du sommeil et de l’éveil est supposée impliquer à la fois des changements “intra-système” dans le système dopaminergique mésocorticolimbique pour l’éveil et le malaise, mais aussi des changements “inter-systèmes” dans les neurocircuits qui sont impliqués dans le malaise (CRF, noradrénaline, vasopressine et hypocrétine dans le CeA et le BNST) et le sommeil/éveil (hypocrétine dans l’hypothalamus ; tableau 1). En effet, il a été démontré que l’hypocrétine (orexine) joue un rôle essentiel non seulement dans l’addiction, comme décrit ci-dessus, mais aussi dans la régulation de l’éveil et la coordination de la vigilance nécessaire à la poursuite de comportements orientés vers un but. Les modèles animaux avec une validité de construction pour le malaise, les troubles du sommeil et l’éveil qui ont aidé à élucider le neurocircuit associé à ces constructions chez l’homme comprennent des mesures d’activité, l’électroencéphalographie et des observations de l’éveil physiologique périphérique. Les patients souffrant d’addiction à divers agents se plaignent eux-mêmes de malaises, de troubles du sommeil et de perturbations de l’éveil. Le malaise peut être défini comme un sentiment indéfini de maladie ou de malaise sans cause spécifique. Dans le cadre des troubles liés à l’addiction, les troubles du sommeil prennent souvent la forme d’insomnies et de modifications de l’architecture du sommeil. La dysrégulation de l’éveil peut se manifester par une hyperexcitation en réponse à des stimuli stressants ou à des signaux de drogue, par rapport à des personnes qui ne souffrent pas d’addiction. De même, l’hyperexcitation est un critère diagnostique clé du PTSD, qui présente une forte comorbidité avec l’addiction à diverses substances. Les évaluations de ces concepts en laboratoire humain comprennent la polysomnographie pour l’évaluation du sommeil et l’électroencéphalographie et les signaux périphériques (par exemple, la réponse galvanique de la peau, la respiration et la fréquence cardiaque) pour l’évaluation de l’excitation, en plus des mesures d’auto-évaluation, telles que l’inventaire des malaises, l’indice de qualité du sommeil de Pittsburgh et l’échelle du système d’activation comportementale (tableau 3).
Implications pour la nosologie des addictions
Au fil du temps, la nosologie des addictions est restée relativement statique. La dernière version du Manuel diagnostique et statistique des troubles mentaux (DSM-5)135 regroupe les anciennes catégories d’abus et de dépendance en une seule, appelée trouble lié à l’utilisation d’une substance. Ce changement permet également d’évaluer la gravité de la maladie sur la base du nombre de symptômes. Quoi qu’il en soit, la nosologie actuelle pose plusieurs problèmes, qui peuvent être résolus grâce à l’ANA et à l’accent mis sur l’émotivité négative et le stress. Tout d’abord, la plupart des critères diagnostiques spécifiques s’appuient sur le même facteur, bien qu’en pratique, il existe une hétérogénéité considérable au sein du diagnostic, ce qui constitue un facteur limitant les résultats du traitement. Deuxièmement, ces critères ne reposent pas sur la neurobiologie de l’addiction, mais plutôt sur les symptômes rapportés par les patients. Si les plaintes des patients constituent un élément essentiel du diagnostic et de la formulation du plan de traitement, elles sont également insuffisantes pour ces tâches. Par exemple, un patient souffrant d’une forme particulière de cancer peut se plaindre de douleurs et de fatigue ; ces symptômes, bien qu’importants, ne constituent pas la base du diagnostic. Au lieu de cela, un diagnostic de cancer est établi en tenant compte des altérations des systèmes biologiques des patients, telles que la présence d’une tumeur ou une augmentation des cellules cancéreuses dans la circulation sanguine, qui sont diagnostiquées par l’imagerie et/ou des tests sanguins. Actuellement, la présentation chez les sujets des critères diagnostiques actuels de tolérance hédonique et de retrait motivationnel (définis ci-dessus) sont les plus étroitement liés aux altérations neurobiologiques réelles qui se produisent dans les addictions et peuvent servir de passerelle vers une reformulation de la nosologie de l’addiction.
Même en l’absence d’un marqueur neurobiologique spécifique et définitif, l’accent mis sur le stress et les états affectifs négatifs dans les troubles liés à l’addiction, comme nous l’avons vu, pourrait conduire à leur inclusion dans les futures itérations des diagnostics d’addiction. Par exemple, le fait de préciser si un individu éprouve une dysphorie significative ou un besoin de soulagement pendant le sevrage, tout en restant basé sur les symptômes, constituerait un pas de plus vers un diagnostic de l’addiction fondé sur des données neurobiologiques. Cela permettrait également aux cliniciens d’identifier les traitements qui correspondent le mieux à un sous-type spécifique d’addiction. Dans l’ensemble, le fait de mettre l’accent sur les états affectifs négatifs associés à l’addiction pourrait favoriser l’intégration de la neurobiologie dans la nosologie de l’addiction et améliorer les résultats des traitements. Étant donné l’importance des coûts de santé publique associés aux addictions, ces améliorations mériteraient que l’on consacre du temps et des efforts à l’étude du rôle du stress et des affects négatifs dans les addictions.
