Nardou, R., Sawyer, E., Song, Y. J., Wilkinson, M., Padovan-Hernandez, Y., de Deus, J. L., … & Dölen, G. (2023). Psychedelics reopen the social reward learning critical period. Nature, 1-9.
Abstract
Les psychédéliques sont une vaste classe de drogues définies par leur capacité à induire un état de conscience altéré1,2. Ces drogues sont utilisées depuis des millénaires dans des contextes spirituels et médicinaux, et un certain nombre de succès cliniques récents ont suscité un regain d’intérêt pour le développement de thérapies psychédéliques3,4,5,6,7,8,9. Néanmoins, un mécanisme unificateur pouvant expliquer ces propriétés phénoménologiques et thérapeutiques communes reste inconnu. Ici, nous démontrons chez la souris que la capacité à rouvrir la période critique de l’apprentissage de la récompense sociale est une propriété commune à toutes les drogues psychédéliques. Notamment, l’évolution temporelle de la réouverture de la période critique est proportionnelle à la durée des effets subjectifs aigus rapportés chez l’homme. En outre, la capacité à rétablir l’apprentissage de la récompense sociale à l’âge adulte est parallèle à la restauration métaplastique de la dépression à long terme médiée par l’ocytocine dans le noyau accumbens. Enfin, l’identification des gènes différentiellement exprimés dans l' » état ouvert » par rapport à l' » état fermé » fournit la preuve que la réorganisation de la matrice extracellulaire est un mécanisme commun en aval qui sous-tend la réouverture de la période critique médiée par les drogues psychédéliques. L’ensemble de ces résultats a des implications importantes pour la mise en œuvre des psychédéliques dans la pratique clinique, ainsi que pour la conception de nouveaux composés pour le traitement des maladies neuropsychiatriques.
Le principal
Classiquement, les psychédéliques ont été définis comme des drogues telles que le diéthylamide de l’acide lysergique (LSD), la mescaline, la phénylcyclohexylpipéridine (PCP), l’ibogaïne, la 3,4-méthylènedioxyméthamphétamine (MDMA), la psylocibine et la kétamine, parce que chacun de ces composés produit des altérations de la perception des sens, de soi, du temps et de l’espace qui sont « si étrangères à l’expérience quotidienne qu’elles jettent une lumière nouvelle sur le fonctionnement de ces fonctions mentales de tous les jours »1. Bien que des tentatives plus récentes aient été faites pour sous-catégoriser les psychédéliques10 sur la base du caractère subjectif de l’état altéré qu’ils induisent (par exemple, hallucinogène, empathogène, oneirogène ou dissociatif), de leur structure chimique (par exemple, tryptamines, phénéthylamines ou arylcyclohexamines), ou de leur principale cible de liaison (par exemple, le récepteur 2A de la sérotonine), les psychédéliques ne sont pas considérés comme des drogues, récepteur 2A de la sérotonine (5-HT2AR), transporteur de monoamine, récepteur κ-opioïde (KOR) ou récepteur N-méthyl-d-aspartate (NMDAR)), l’importance de ces catégories pour les applications thérapeutiques reste incertaine, étant donné que les psychédéliques qui couvrent la diversité des systèmes de classification se sont révélés remarquablement prometteurs pour le traitement de la dépendance4,5, du trouble de stress post-traumatique6,7 (PTSD) et de la dépression3,8,9. Ainsi, l’identification d’un mécanisme neurobiologique commun pouvant expliquer les effets thérapeutiques partagés des psychédéliques est une priorité évidente pour les neurosciences translationnelles.
Au cours de périodes spécifiques du développement du cerveau, le système nerveux présente une sensibilité accrue aux stimuli éthologiques, ainsi qu’une plus grande malléabilité pour les modifications synaptiques, des circuits et du comportement. Ces fenêtres de temps limitées sur le plan mécanique sont appelées périodes critiques et les neuroscientifiques cherchent depuis longtemps des méthodes pour les rouvrir à des fins thérapeutiques. Récemment, nous avons découvert une nouvelle période critique pour l’apprentissage de la récompense sociale et montré que le psychédélique empathique MDMA est capable de rouvrir cette période critique11. Ce mécanisme partage un certain nombre de caractéristiques avec les effets thérapeutiques de la psychothérapie assistée par la MDMA pour le traitement du PTSD, notamment la rapidité d’apparition, la durabilité et la dépendance au contexte6,7. Parallèlement, la cocaïne ne rouvre pas la période critique de l’apprentissage de la récompense sociale11, et comme la cocaïne ne partage pas le profil thérapeutique des psychédéliques12, ces résultats renforcent l’idée que le rétablissement de l’apprentissage de la récompense sociale à l’âge adulte est à la base de l’efficacité thérapeutique de la MDMA.
La question de savoir si la capacité de la MDMA à rouvrir la période critique de l’apprentissage de la récompense sociale se généralise à l’ensemble des psychédéliques reste ouverte. La MDMA est classée comme « empathogène » parce que ses effets subjectifs aigus sont nettement prosociaux13. Le fait que cette qualité ne soit pas partagée par les psychédéliques hallucinogènes tels que la psilocybine et le LSD14, les psychédéliques dissociatifs tels que la kétamine15, ou les psychédéliques oneirogéniques tels que l’ibogaïne16 remet en question l’idée que ces drogues pourraient rouvrir la période critique de l’apprentissage de la récompense sociale. Cependant, les effets psychotropes de la MDMA incluent un état de conscience altéré partagé par tous les psychédéliques1,2, et si c’est cette caractéristique plutôt que ses propriétés prosociales qui incarne l’expérience subjective de la réouverture des périodes critiques, alors la capacité à réintégrer l’apprentissage de la récompense sociale à l’âge adulte pourrait se généraliser à tous les psychédéliques.
La réouverture de la période critique est une propriété partagée
Pour vérifier si la capacité de la MDMA à rouvrir la période critique de l’apprentissage de la récompense sociale se généralise à tous les psychédéliques, nous avons commencé par examiner l’effet du prétraitement à la psilocybine sur l’ampleur de l’apprentissage de la récompense sociale à l’âge adulte en utilisant l’essai de préférence de place conditionnée à la récompense sociale (sCPP) (Extended Data Fig. 1). Nous avons administré une dose intrapéritonéale (i.p.) unique de psilocybine17 (0,3 mg kg-1) à des souris mâles adultes (au jour postnatal 96 (P96)) et 48 heures plus tard (à P98), nous avons évalué l’ampleur de la sCPP (Fig. 1a). Les souris prétraitées à la psilocybine, mais pas à la solution saline, ont présenté une sCPP significative à P98 (Fig. 1b-d). Pour désigner formellement les états « ouvert » et « fermé » de cette période critique, nous avons ensuite généré un modèle de régression par spline naturelle sur les données précédemment publiées11 avec des nœuds à P35 et P98 (P = 1,003 × 10-6 ; erreur quadratique moyenne (r.m.s.e.) = 0,19 ; R2 = 0,11), comme indiqué dans les données étendues de la Fig. 2. Comparée à cette courbe dérivée, l’amplitude de la sCPP chez les souris traitées au sérum physiologique ne s’est pas écartée de manière significative de l’état fermé (P = 0,72), alors que l’ajustement dérivé des souris traitées à la psilocybine a montré un décalage moyen significatif (P = 1,12 × 10-6) dans la plage de l’état ouvert (Fig. 1e). De même, le prétraitement au LSD17 (i.p. 1 µg kg-1), mais pas la solution saline, a également rouvert la période critique pour l’apprentissage de la récompense sociale (solution saline P = 0,90, LSD P = 1,76 × 10-9) (Fig. 1f-i). Nous avons ensuite examiné les effets de la kétamine18 (i.p. 3 mg kg-1) et de l’ibogaïne19 (i.p. 40 mg kg-1). Les souris prétraitées avec l’une ou l’autre de ces drogues ont également présenté une sCPP à l’âge adulte (P = 8,78 × 10-4 et P = 3,17 × 10-5, respectivement) (Fig. 1k-m). Comme pour la MDMA11, ces effets étaient dépendants de la dose (Extended Data Fig. 3). Chez les juvéniles, le prétraitement à la MDMA11 (i.p. 10 mg kg-1) n’a pas entraîné d’augmentation supplémentaire de l’ampleur de l’apprentissage de la récompense sociale (Extended Data Fig. 3). Contrairement à ses effets sur le comportement d’apprentissage de la récompense sociale, le prétraitement avec des psychédéliques n’a pas eu d’effet sur l’ampleur de deux comportements similaires à la dépendance : l’apprentissage de la récompense de la cocaïne et la sensibilisation locomotrice induite par l’amphétamine (Données complémentaires, Fig. 4). L’ensemble de ces études démontre que, comme pour les psychédéliques empathogènes11, les psychédéliques hallucinogènes, oneirogènes et dissociatifs sont capables de rouvrir la période critique de l’apprentissage de la récompense sociale.
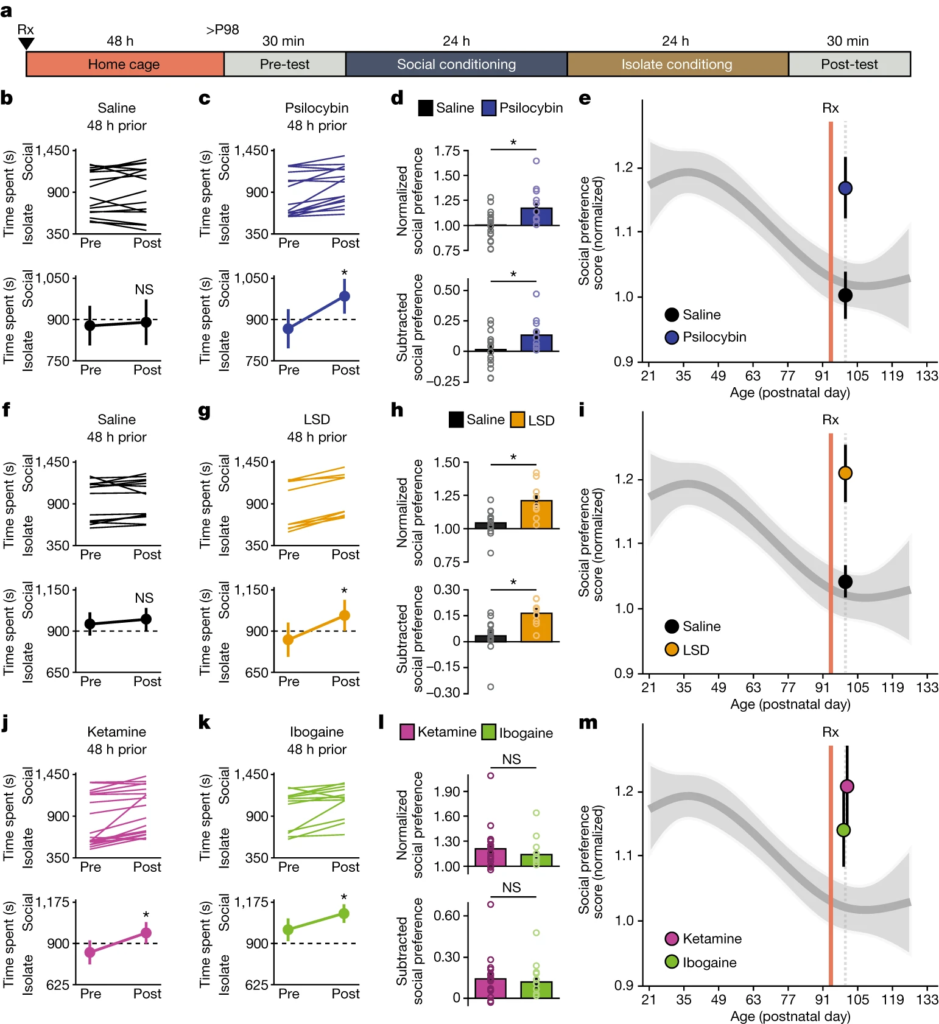
a, évolution temporelle expérimentale du prétraitement i.p. (Rx) dans le sCPP.
b,c,f,g,j,k, les réponses individuelles (en haut) et moyennes (en bas) des souris P98 indiquent que les souris prétraitées à la psilocybine (0,3 mg kg-1) (c ; n = 15, t(14) = -3,741, P = 0,002), au LSD (1 µg kg-1) (g ; n = 9, t(8) = -7,095, P < 0. 001), la kétamine (3 mg kg-1) (j ; n = 18, t(17) = -3,826, P < 0,002) et l’ibogaïne (40 mg kg-1) (k ; n = 12, t(11) = -2,690, P = 0. 02) mais pas la solution saline (b ; n = 17 souris, t(16) = -0,441, P = 0,665. f ; n = 14 souris, t(13) = -1,215, P = 0,25) développent une préférence pour l’indice de la litière sociale. Test t pair bilatéral.
d,h,l, Les comparaisons révèlent une augmentation significative de la préférence sociale normalisée (en haut) et soustraite (en bas) pour le prétraitement à la psilocybine par rapport à la solution saline (d ; normalisé, t(30) = -2,800, P = 0,009 ; soustrait, t(30) = -2,401, P = 0. 023), et avec le LSD par rapport à la solution saline (h ; normalisé, t(21) = -3,558, P = 0,002 ; soustrait, t(21) = -3,344, P = 0,003), mais aucune différence entre le prétraitement par la kétamine et l’ibogaïne (l ; normalisé, t(28) = 0,749, P = 0,460 ; soustrait, t(28) = 0,409, P = 0,686). Test t bilatéral non apparié, avec correction de Welch pour tenir compte de l’inégalité de la variance de l soustraite. *P < 0,05 ; NS, non significatif (P > 0,05).
e,i,m, préférence sociale normalisée chez les souris prétraitées à la psilocybine par rapport à la solution saline (e), au LSD par rapport à la solution saline (i) et à l’ibogaïne par rapport à la kétamine (m), représentée par rapport à un modèle de régression en spline naturelle de l’évolution temporelle des scores de préférence sociale normalisée. La comparaison avec le modèle de spline naturelle a révélé que l’ampleur de la sCPP chez les souris traitées à la solution saline ne s’écartait pas significativement de l’état fermé (b ; P = 0,72) (f ; P = 0,90), alors que les souris prétraitées à la psilocybine (P = 1,12 × 10-6), au LSD (P = 1,76 × 10-9), à la kétamine (P = 8,78 × 10-4) ou à l’ibogaïne (P = 3,17 × 10-5) présentaient un décalage moyen significatif par rapport à l’état ouvert. Les comparaisons avec le modèle de la spline naturelle ont été considérées comme non significatives (P > 0,1). Rx indique le traitement par la drogue. Les données sont exprimées en moyenne ± s.e.m. n correspond au nombre de souris biologiquement indépendantes.
Durée de l’état d’ouverture psychédélique
La durée des effets subjectifs aigus et la durabilité de la réponse thérapeutique varient considérablement d’un psychédélique à l’autre. Par exemple, chez l’homme, les effets subjectifs aigus de la kétamine15 durent de 30 à 120 minutes, tandis que ses effets antidépresseurs9 durent une semaine. En revanche, les effets subjectifs de la psilocybine et de la MDMA20,21 durent de 3 à 6 heures, tandis que les effets aigus du LSD et de l’ibogaïne persistent pendant 8 à 10 heures et 36 à 72 heures, respectivement16,22 ; ces effets subjectifs de longue durée correspondent à des effets thérapeutiques très durables qui durent des mois, voire des années4,5,7. Précédemment, nous avons montré que la réouverture de la période critique induite par la MDMA dure deux semaines, mais revient à l’état fermé au bout de quatre semaines11. Ici, pour approfondir l’étude de l’évolution temporelle de l’état d’ouverture de la période critique induite par les psychédéliques, nous avons examiné la durée de la réouverture de la période critique après un traitement à la kétamine, à la psilocybine, au LSD et à l’ibogaïne (Fig. 2a). Une semaine après le traitement psychédélique, les souris traitées à la psilocybine, mais pas celles traitées à la kétamine, ont présenté un apprentissage social significatif de la récompense (Fig. 2b-e). Deux semaines après le traitement psychédélique, la période critique de l’apprentissage de la récompense sociale est restée ouverte pour les souris traitées à la psilocybine et au LSD (Fig. 2f-i). Après trois semaines, les souris traitées au LSD, mais pas celles traitées à la psilocybine, ont présenté un apprentissage significatif de la récompense sociale (Fig. 2j-m), tandis qu’après quatre semaines, la période critique d’apprentissage de la récompense sociale est restée ouverte pour les souris traitées à l’ibogaïne, mais pas pour celles traitées au LSD (Fig. 2n-q). Pour chaque psychédélique, nous avons examiné au moins trois points temporels ; l’augmentation de la dose de LSD à 50 µg kg-1 n’a pas prolongé la durée de l’état ouvert (Extended Data Fig. 5). Comme le montre la figure 3, les états ouverts progressivement plus longs induits par la kétamine (figures 1f-i et 2b-e et figure 5 des données complémentaires), puis par la psilocybine (figure 2b-i), la MDMA11 (figure 5 des données complémentaires), le LSD (figure 2j-q) et l’ibogaïne (figure 2n-q et figure 5 des données complémentaires) sont proportionnels à la durée des effets subjectifs aigus de ces drogues chez l’homme15,16,20,21,22. Ces résultats fournissent une explication mécaniste de l’importance de la période d’intégration post-traitement pour la mise en œuvre clinique des psychédéliques, et informent la conception de nouveaux composés pour des applications cliniques.
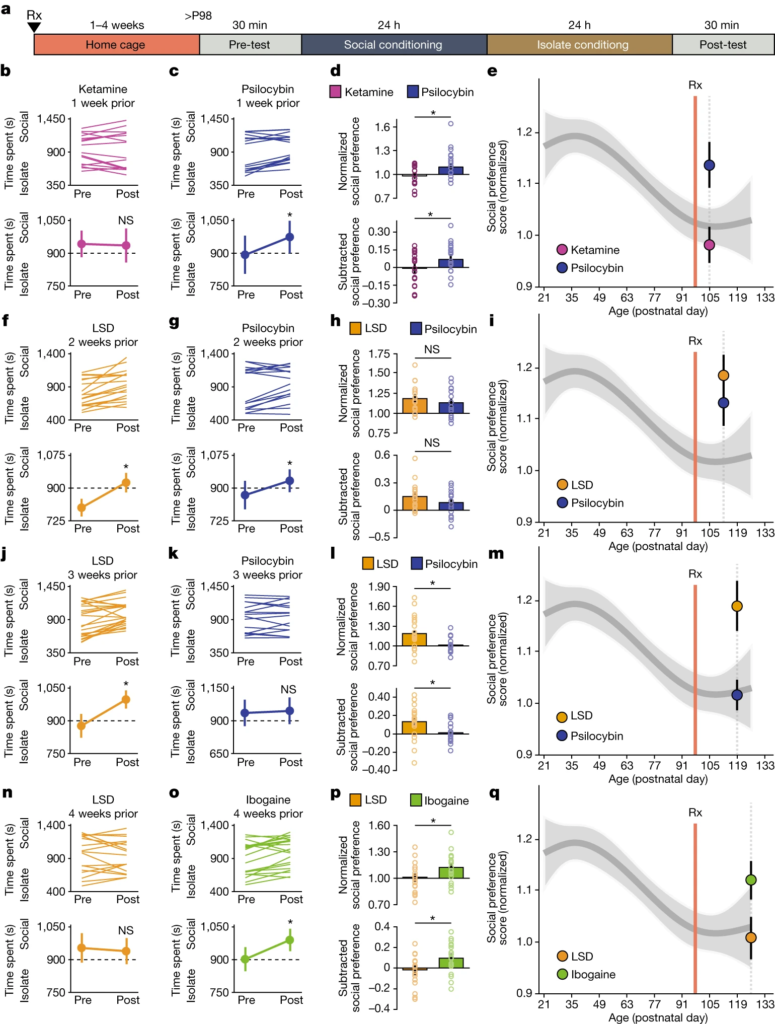
a, chronologie expérimentale du prétraitement i.p. dans l’essai sCPP. b-q, sCPP chez des souris adultes 1 semaine après prétraitement i.p. à la kétamine (3 mg kg-1) ou à la psilocybine (0. 3 mg kg-1) (b-e), 2 semaines après un prétraitement au LSD (1 µg kg-1) ou à la psilocybine (0,3 mg kg-1) (f-i), 3 semaines après un prétraitement au LSD (1 µg kg-1) ou à la psilocybine (0. 3 mg kg-1) (j-m) ou 4 semaines après un prétraitement au LSD (1 µg kg-1) ou à l’ibogaïne (40 mg kg-1) (n-q).
b,c,f,g,j,k,n,o, les réponses individuelles (en haut) et moyennes (en bas) indiquent que la réintégration du sCPP est absente une semaine après le traitement à la kétamine (b, n = 16 souris, t(15) = 0. 204, P = 0,841), dure deux semaines pour la psilocybine (c, 1 semaine : n = 17 souris, t(16) = -2,959, P = 0,009 ; g, 2 semaines : n = 22 souris, t(21) = -3. 542, P = 0,002 ; k, 3 semaines : n = 16 souris, t(15) = -0,405, P = 0,691), dure 3 semaines pour le LSD (f, 2 semaines : n = 18 souris, t(17) = -4. 360, P < 0,001 ; j, 3 semaines : n = 23 souris, t(22) = -3,671, P = 0,001 ; n, 4 semaines : n = 17 souris, t(16) = 0,441, P = 0,665), et dure au moins 4 semaines pour l’ibogaïne (o, n = 20 souris, t(19) = -3,004, P = 0,007). Test t bilatéral par paires.
d,h,l,p, Les comparaisons révèlent une différence significative de sCPP entre les groupes kétamine et psilocybine 1 semaine après le prétraitement (d, normalisé : t(31) = -2,700, P = 0,011 ; soustrait : t(31) = -2,113, P = 0,043), entre LSD et psilocybine à 3 semaines (l, normalisé : t(34) = 3. 050, P = 0,004 ; soustraction : t(37) = 2,471, P = 0,018) mais pas à 2 semaines (h, normalisé : t(38) = 0,390, P = 0,699 ; soustraction : t(38) = 1,077, P = 0. 288), et LSD et ibogaïne 4 semaines après le prétraitement (p, normalisé : t(35) = -2,045, P = 0,048 ; soustrait : t(35) = -2,283, P = 0,029). Test t bilatéral non apparié, avec correction de Welch pour tenir compte de la variance inégale dans l soustraction.
*e,i,m,q, préférence sociale normalisée une semaine après la kétamine ou la psilocybine (e), deux (i) et trois (m) semaines après le LSD et la psilocybine, et quatre semaines après le LSD et l’ibogaïne (q) tracée par rapport à un modèle de spline naturelle de l’évolution temporelle des scores de préférence sociale normalisés. L’ampleur de la sCPP ne s’est pas écartée de manière significative de l’état fermé une semaine après la kétamine (e, P = 0,949), trois semaines après la psilocybine (i, P = 0,633) et quatre semaines après le LSD (m, P = 0. 705), tandis que l’amplitude a montré un changement moyen significatif dans la plage de l’état ouvert à la fois pour une (e, P = 0,054) et deux semaines (i, P = 0,0211) après la psilocybine, deux (i, P = 0,0121) et trois semaines (m, P = 0,00745) après le LSD et quatre semaines après l’ibogaïne (q, P = 0,0758). Les comparaisons avec le modèle de spline naturelle ont été considérées comme non significatives (P > 0,1). Les données sont des moyennes ± s.e.m. n se réfère au nombre de souris biologiquement indépendantes.
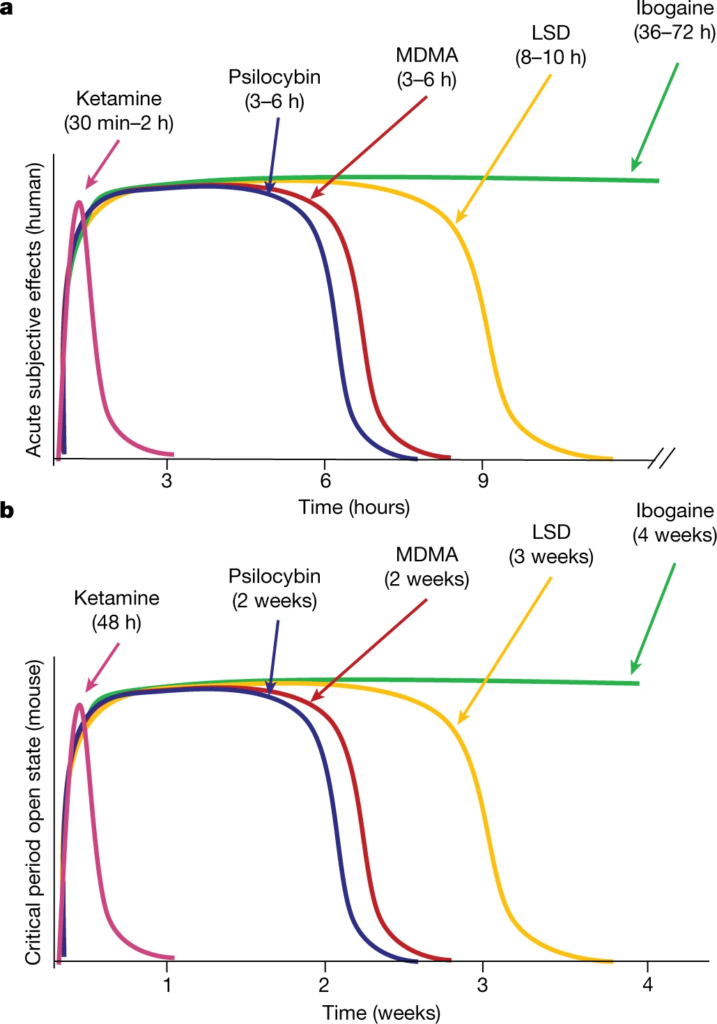
a, durées des effets subjectifs aigus des psychédéliques chez l’homme (données des réf. 15,16,20,21,22).
b, durées de la période critique de l’état ouvert induit par les psychédéliques chez la souris. Basé sur la réf. 11 et Figs. 1 et 2 et Extended Data Fig. 5.
La métaplasticité, pas l’hyperplasticité
La régulation dynamique de la mesure dans laquelle la plasticité synaptique peut être induite est appelée « métaplasticité « 23 et est considérée comme l’un des mécanismes sous-jacents à l’établissement des périodes critiques24. Précédemment, nous avons montré que l’ocytocine induit une nouvelle forme de dépression à long terme exprimée au niveau présynaptique, et impliqué cette plasticité dans l’encodage de l’apprentissage de la récompense sociale25,26. Ici, pour déterminer si la capacité à induire une régulation métaplastique de la plasticité de l’ocytocine se généralise à travers les psychédéliques, nous avons prétraité des souris adultes avec une solution saline, de la cocaïne ou des psychédéliques. Quarante-huit heures ou deux semaines plus tard, nous avons préparé des tranches aiguës ex vivo contenant le noyau accumbens (NAc) et effectué des enregistrements de voltage-clamp à cellules entières à partir de neurones épineux moyens (MSN) (Fig. 4a-c). Une application d’ocytocine dans le bain pendant 10 minutes a induit une diminution significative de la fréquence (Fig. 4d-k) mais pas de l’amplitude (Fig. 4l-s) des courants post-synaptiques excitateurs miniatures (mEPSC) après un prétraitement au MDMA, au LSD, à la psilocybine, à la kétamine et à l’ibogaïne, mais pas à la solution saline ou à la cocaïne, à 48 heures ; cette métaplasticité a persisté pendant 2 semaines dans le groupe prétraité au LSD, mais pas dans les groupes prétraités à la kétamine. Nous n’avons pas observé de changements significatifs dans l’amplitude ou la fréquence de base des mEPSC après un prétraitement aux psychédéliques dans le NAc ou dans la couche 5 du cortex préfrontal médian (mPFC) (Extended Data Fig. 6). L’ensemble de ces résultats prouve que les psychédéliques induisent une métaplasticité plutôt qu’une hyperplasticité, une distinction particulièrement importante pour la conception de biomarqueurs permettant de tester les profils thérapeutiques et les risques d’abus des nouveaux composés.
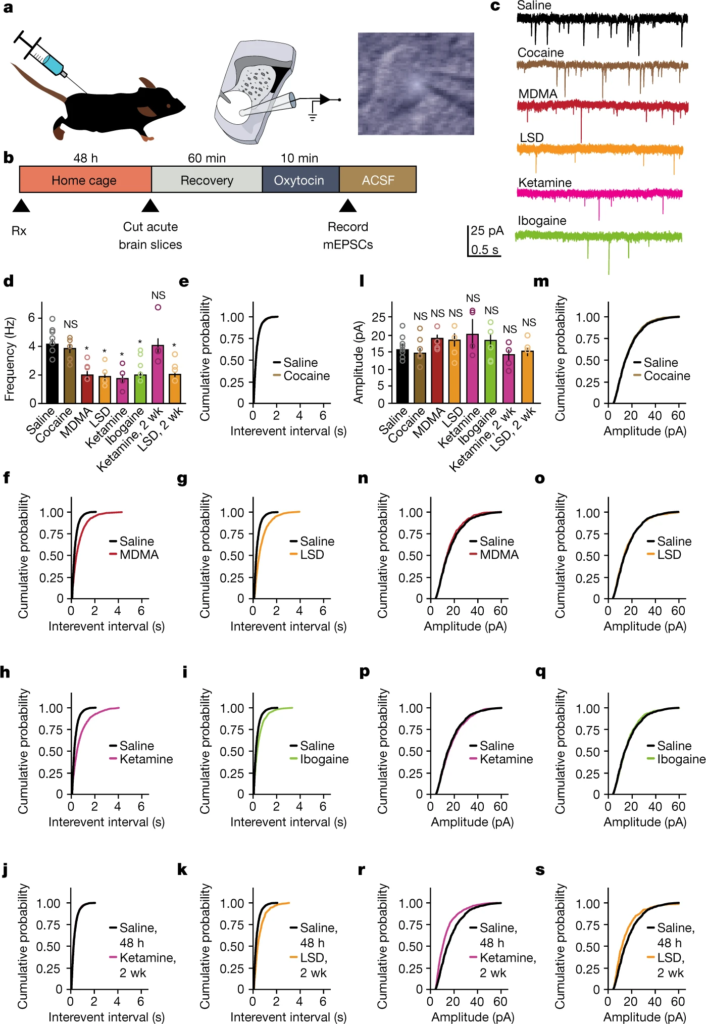
a,b, Illustration (a) et évolution temporelle (b) du traitement et du protocole électrophysiologique. Illustration en a adaptée de la réf. 25.
c, Traces représentatives de mEPSC enregistrées à partir de MSN dans le NAc de tranches de cerveau traitées à l’ocytocine et prélevées sur des souris prétraitées avec du sérum physiologique (n = 8), 20 mg kg-1 de cocaïne (n = 6), 10 mg kg-1 de MDMA (n = 4), 1 µg kg-1 de LSD (n = 4), 3 mg kg-1 de kétamine (n = 4) ou 40 mg kg-1 d’ibogaïne (n = 5). d-k,
Fréquence moyenne des mEPSC (d) et probabilités cumulées des intervalles inter-événements pour la cocaïne (e), la MDMA (f), le LSD (g), la kétamine (h) et l’ibogaïne (i) enregistrés à partir des MSN après deux jours, et après deux semaines (wk) pour la kétamine (j) et le LSD (k). l-s, moyenne (l) et distributions de probabilité cumulées des amplitudes enregistrées dans les MSN pour la cocaïne (m), la MDMA (n), le LSD (o), la kétamine (p) et l’ibogaïne (q) après deux jours, et après deux semaines pour la kétamine (r) et le LSD (s).
L’analyse de variance à un facteur a révélé un effet significatif du traitement sur la fréquence (d, F(7,31) = 5,99, P = 0,0002) mais pas sur l’amplitude (l, F(7,31) = 1,09, P = 0,39), et l’analyse des comparaisons multiples a révélé une diminution de la fréquence des mEPSC médiée par l’ocytocine après un prétraitement aux psychédéliques (f, MDMA : P = 0,011 ; g, LSD : P = 0,0013 ; h, kétamine : P = 0,001 ; i, ibogaïne : P = 0,013), mais pas la cocaïne (P = 0,83), et que cette diminution restait significative au bout de deux semaines avec le LSD (k, n = 4, P = 0,01) mais pas avec la kétamine (j, n = 4, P = 0,99). Toutes les cellules ont été enregistrées dans des tranches de souris adultes à P98. Les données sont des moyennes ± s.e.m. *P < 0,05 ; NS, non significatif (P > 0,05). n se réfère au nombre de cellules biologiquement indépendantes.
Le 5-HT2AR n’est pas le mécanisme universel
Le récepteur de la sérotonine 5-HT2AR, identifié pour la première fois par sa liaison au LSD27, est le médiateur des altérations de la perception et de la cognition induites par les « psychédéliques sérotoninergiques « 10 tels que le LSD28 et la psilocybine29. En outre, la MDMA déclencherait l’efflux synaptique de sérotonine par sa liaison au transporteur de sérotonine SERT30, et certains des effets de la kétamine seraient médiés par le 5-HT2AR31. Nous avons donc cherché à déterminer le rôle du 5-HT2AR dans la réouverture de la période critique de l’apprentissage de la récompense sociale avec le LSD, la psilocybine, la MDMA et la kétamine. Nous avons administré des psychédéliques par voie intrapéritonéale à des souris adultes P96, soit seuls, soit en combinaison avec de la kétansérine (HTR-A, 0,1 mg kg-1) – l’antagoniste 5-HT2AR utilisé dans les études humaines – que nous avons injectée 30 minutes avant le psychédélique (Extended Data Fig. 7). Le prétraitement au LSD ou à la psilocybine a induit une réintégration de la sCPP mesurée 48 heures plus tard, et cet effet a été bloqué par l’administration concomitante de kétansérine (Extended Data Fig. 7). Cependant, la réintégration de la sCPP induite par la MDMA a persisté en présence de kétansérine (Extended Data Fig. 7). De même, la co-administration de kétansérine n’a pas bloqué la réintégration de l’apprentissage de la récompense sociale induite par la kétamine à l’âge adulte (Extended Data Fig. 7). Ces résultats démontrent que si les 5-HT2AR sont nécessaires à la réouverture de la période critique de l’apprentissage de la récompense sociale induite par le LSD et la psilocybine (avec des contributions potentielles des récepteurs 2B et 2C de la sérotonine, puisque la kétansérine a également une affinité pour ces sous-types de récepteurs 2 de la sérotonine), la MDMA et la kétamine rétablissent l’apprentissage de la récompense sociale d’une manière indépendante des 5-HT2AR. Bien que certains aient soutenu10,32 que les psychédéliques qui lient les 5-HT2AR (comme le LSD et la psilocybine) devraient être classés séparément de ceux qui ne le font pas (comme la MDMA et la kétamine), ces résultats identifient une nouvelle propriété (réouverture de la période critique) qui est cohérente avec la catégorie des psychédéliques mais qui ne respecte pas la limite de la liaison aux 5-HT2AR. Ainsi, combinés aux données présentées dans les figures 1 et 2, ces résultats soutiennent l’utilisation continue de la convention de dénomination établie pour les psychédéliques1,2, plutôt qu’une sous-classification ou un changement de nom basé sur la liaison aux récepteurs ou les propriétés subjectives.
La β-arrestine-2 n’est pas le mécanisme universel
Des études récentes indiquent que la liaison prolongée du LSD au récepteur 5-HT2AR déclenche une signalisation basée sur la β-arrestin-2 (β-arr2) plutôt que sur la signalisation canonique de la protéine G33. En outre, les effets de la MDMA11 et de l’ibogaïne34 seraient également médiés par des récepteurs métabotropiques couplés aux protéines G (RCPG). Bien que les effets thérapeutiques de la kétamine soient considérés comme étant médiés par les récepteurs ionotropiques NMDA35, le récepteur métabotropique du glutamate 5 a également été impliqué36. Pour tester l’hypothèse selon laquelle la signalisation β-arr2-biaisée médierait la capacité des psychédéliques à rouvrir la période critique de l’apprentissage de la récompense sociale, nous avons examiné leurs effets sur des souris β-arr2-knockout (KO) disponibles dans le commerce. Nous avons commencé par déterminer le sCPP de base chez les souris β-arr2-KO juvéniles et adultes et avons constaté que ces souris présentaient le profil normal de maturation de l’apprentissage de la récompense sociale (Extended Data Fig. 8). Ensuite, nous avons comparé l’ampleur de la sCPP chez des souris β-arr2 adultes (P98) de type sauvage et β-arr2-KO 48 h après l’administration de drogues psychédéliques (Extended Data Fig. 9). Le LSD et le MDMA ont rouvert la période critique de l’apprentissage de la récompense sociale chez les souris de type sauvage, mais pas chez les souris β-arr2-KO (Extended Data Fig. 9). À l’inverse, la kétamine et l’ibogaïne ont permis de rétablir l’apprentissage de la récompense sociale chez les souris de type sauvage et les souris β-arr2-KO (Extended Data Fig. 9). L’ensemble de ces résultats démontre que si la signalisation β-arr2 est nécessaire à la réouverture de la période critique de l’apprentissage de la récompense sociale induite par le LSD ou la MDMA, la kétamine ou l’ibogaïne rétablissent l’apprentissage de la récompense sociale de manière indépendante de la β-arr2.
Les psychédéliques induisent un remodelage de l’ECM (matrice extracellulaire)
Puisque les psychédéliques, en tant que catégorie, rouvrent tous la période critique de l’apprentissage de la récompense sociale (Fig. 1), même si ces drogues agissent sur un ensemble diversifié de cibles de liaison principales (Extended Data Fig. 7) et de voies de signalisation biochimiques (Extended Data Fig. 9), nous avons pensé que le mécanisme commun qui permet la réouverture de la période critique pourrait se situer en aval de ces processus cellulaires. De plus, étant donné la durabilité de la réponse (Fig. 2), nous avons émis l’hypothèse que les psychédéliques pourraient moduler l’expression de gènes ou de voies spécifiques. Pour tester cette hypothèse, nous avons procédé au séquençage de l’ARN du NAc microdisséqué 48 heures et 2 semaines après un prétraitement par une solution saline, de la cocaïne, de la kétamine, du LSD ou de la MDMA. Nous avons recueilli l’ARNm total de chaque échantillon et créé des bibliothèques de brins spécifiques pour chacun des trois réplicats de chaque condition. Les abondances au niveau des transcrits ont été regroupées en estimations d’expression au niveau des gènes pour l’ajustement du modèle.
Pour comparer directement les changements transcriptionnels liés au traitement et spécifiques à la capacité commune des psychédéliques à rouvrir la période critique de l’apprentissage de la récompense sociale, nous avons analysé l’ensemble des données d’expression génique entre les conditions dans lesquelles la période critique est ouverte (48 h et 2 semaines après le traitement au LSD, 48 h après le traitement à la kétamine et 48 h après le traitement à la MDMA) et les conditions dans lesquelles la période critique reste ou revient à l’état fermé (48 h et 2 semaines après le traitement à la solution saline, 48 h et 2 semaines après le traitement à la cocaïne et 2 semaines après le traitement à la kétamine). Cette approche nous a permis d’identifier 65 gènes significativement exprimés de manière différentielle (test du rapport de vraisemblance ; q corrigé de Benjamini-Hochberg ≤ 0,1) (Fig. 5). L’analyse de l’enrichissement des ensembles de gènes de cette liste a permis d’identifier un enrichissement significatif des ontologies associées au développement endothélial, à la régulation de l’angiogenèse, au développement vasculaire et à la morphogenèse des tissus. Il convient de noter que de nombreux gènes ayant obtenu les meilleurs scores sont des composants de la matrice extracellulaire (ECM) ou ont été impliqués dans son remodelage, notamment : Fn1(réf. 37), Mmp16(réf. 38), Trpv4(réf. 39), Tinagl1(réf. 40), Nostrin41, Cxcr4(réf. 42), Adgre5(réf. 43), Robo4(réf. 44) et Sema3g45. En outre, l’ensemble des gènes différentiellement exprimés comprend les gènes précoces immédiats (IEG) Fos, Junb, Arc et Dusp. Lorsque nous n’avons pas contrôlé la réponse psychoactive spécifique aux psychédéliques (solution saline contre toutes les drogues, y compris la cocaïne), nous avons identifié 39 gènes différentiellement exprimés (q ≤ 0,15 corrigé par Benjamini-Hochberg) (Extended Data Fig. 10) ; cependant, l’analyse d’enrichissement n’a identifié aucune ontologie significative associée à cet ensemble de gènes, et seuls 6 gènes (Hspa12b, Sema3g, Eng, Flt4, Cavin1 et Ube4b) se chevauchent avec les gènes différentiellement exprimés dans l’ensemble de données de l’état ouvert par rapport à l’état fermé illustré dans la Fig. 5. Ces résultats prouvent que la capacité commune des psychédéliques à rouvrir la période critique de l’apprentissage de la récompense sociale converge vers la régulation transcriptionnelle de l’ECM. Sur la base de ces résultats, notre modèle de travail (Fig. 6) postule que les psychédéliques agissent sur un ensemble diversifié de cibles de liaison (telles que SERT, 5-HT2AR, NMDA et KOR), pour déclencher une réponse de signalisation en aval qui conduit à la dégradation de l’ECM en fonction de l’activité (peut-être via la détection de coïncidence médiée par l’IEG), qui à son tour est l’événement permissif qui permet la métaplasticité. Dans ce modèle, la régulation transcriptionnelle à la hausse des composants de la MEC (par exemple, FN1) et la régulation à la baisse des enzymes protéolytiques de la MEC (par exemple, MMP-16) reflètent la réponse homéostatique à ces changements cellulaires de longue durée. L’ensemble de ces résultats démontre de nouveaux effets biologiques (comportementaux, temporels, électrophysiologiques et moléculaires) qui, à l’instar des effets thérapeutiques, sont communs à tous les psychédéliques.
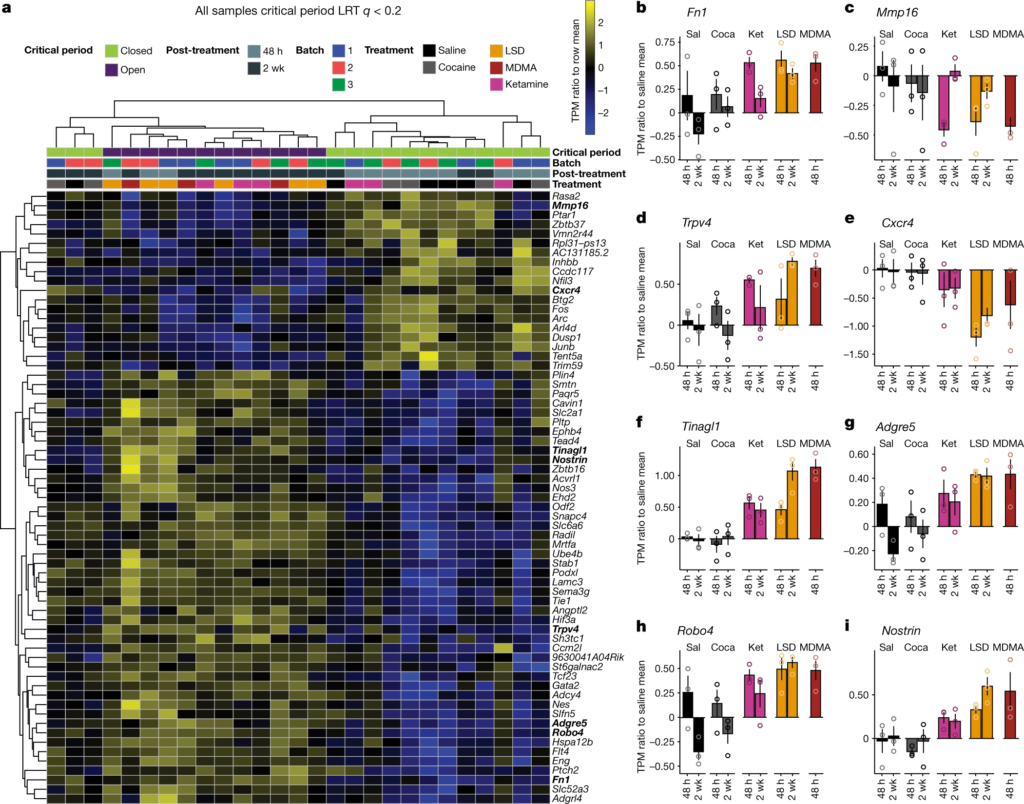
a. Carte thermique des valeurs d’expression normalisées de l’ARN provenant du NAc microdisséqué pour les gènes qui sont significativement exprimés de manière différentielle dans des conditions où la période critique reste à l’état ouvert par rapport à des conditions où la période critique reste ou revient à l’état fermé. LRT, test du rapport de vraisemblance ; TPM, transcriptions par million.
b-i, rapport des valeurs d’expression par rapport à la ligne de base saline moyenne pour les gènes les mieux notés liés au remodelage de la matrice extracellulaire : Fn1 (b), Mmp16 (c), Trpv4 (d), Cxcr4 (e), Tinagl1 (f), Adgre5 (g), Robo4 (h) et Nostrin (i). Coca, cocaïne ; ket, kétamine ; sal, solution saline.
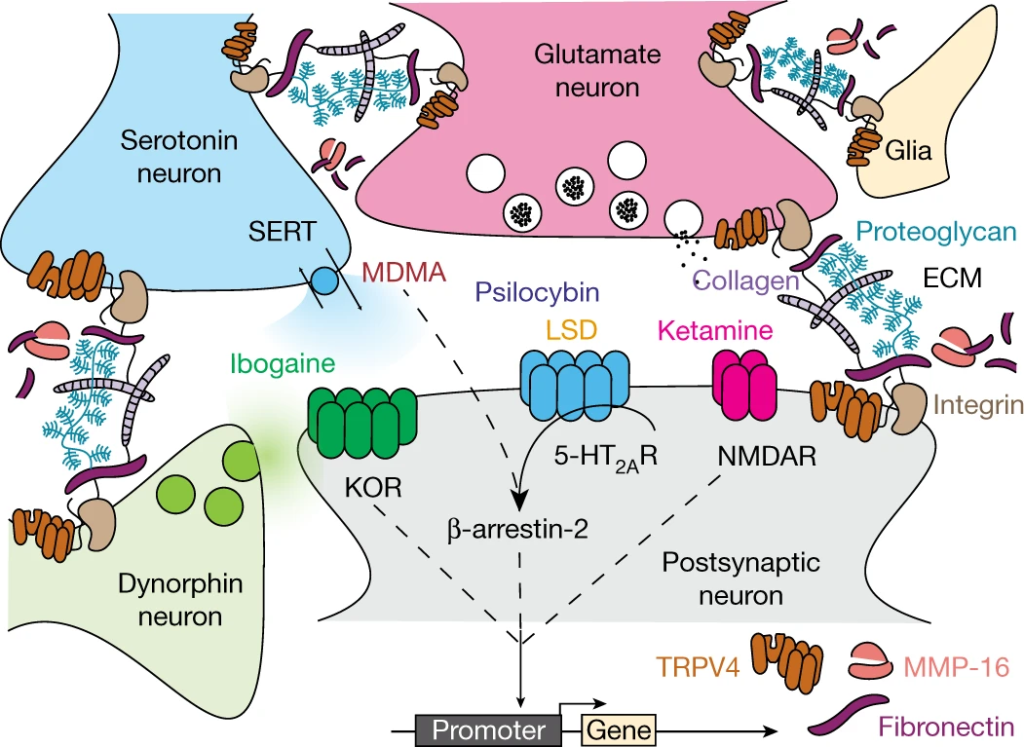
Les psychédéliques agissent sur un ensemble diversifié de cibles de liaison principales et de mécanismes de signalisation en aval qui ne se limitent pas au récepteur de la sérotonine 2A (Extended Data Fig. 7) ou au β-arr2 (Extended Data Fig. 9). La convergence des mécanismes se produit plutôt au niveau de la transcription de l’ADN (Fig. 5). Les transcrits régulés dynamiquement comprennent des composants de la matrice extracellulaire (MEC) tels que la fibronectine, ainsi que des récepteurs (tels que TRPV4) et des protéases (telles que MMP-16) impliqués dans la régulation de la MEC. Adapté de la réf. 25.
Conclusions
Ces études fournissent un nouveau cadre conceptuel pour comprendre les effets thérapeutiques des psychédéliques, qui se sont révélés très prometteurs pour le traitement d’un large éventail de maladies neuropsychiatriques, notamment la dépression, le PTSD et la toxicomanie. Bien que d’autres études aient montré que les psychédéliques peuvent atténuer les comportements de type dépressif35,46,47,48 et peuvent également avoir des propriétés anxiolytiques49, anti-inflammatoires50 et antinociceptives51, la façon dont ces propriétés sont directement liées aux effets thérapeutiques durables et dépendants du contexte des psychédéliques n’est pas claire4,6,7,8. En outre, bien que des études in vitro antérieures aient suggéré que les effets psychédéliques pourraient être médiés par leur capacité à induire l’hyperplasticité52, ce compte ne distingue pas les psychédéliques des drogues addictives (telles que la cocaïne, l’amphétamine, les opioïdes, la nicotine et l’alcool) dont la capacité à induire une hyperplasticité morphologique et physiologique robuste et bidirectionnelle est considérée comme étant à la base de leurs propriétés addictives12. De plus, nos résultats ex vivo (Fig. 4 et Extended Data Fig. 6) sont cohérents avec les études in vivo, qui démontrent que la formation d’épines dendritiques suite à l’administration de psychédéliques est à la fois rare et dépendante du contexte47,53,54, suggérant un mécanisme métaplastique plutôt qu’hyperplastique. En effet, des études antérieures ont également impliqué directement la métaplasticité dans le mécanisme d’action de la kétamine55,56,57. En même temps, puisque nos résultats montrent que les psychédéliques ne modifient pas directement les comportements de type toxicomanie (Extended Data Fig. 4 et réf. 11), ils fournissent un indice mécaniste selon lequel la réouverture de la période critique pourrait être le substrat neuronal sous-jacent à la capacité des psychédéliques à induire une flexibilité psychologique et une réévaluation cognitive, propriétés qui ont été liées à leur efficacité thérapeutique dans le traitement de la toxicomanie, de l’anxiété et de la dépression58,59,60.
Bien que les études actuelles se soient concentrées sur la période critique de l’apprentissage de la récompense sociale, des périodes critiques ont également été décrites pour une grande variété d’autres comportements, y compris l’empreinte chez l’oie des neiges, l’apprentissage du chant chez les pinsons, l’apprentissage du langage chez les humains, ainsi que les réarrangements des circuits cérébraux à la suite de perturbations sensorielles ou motrices, comme la plasticité de la dominance oculaire et l’apprentissage moteur après un accident vasculaire cérébral61,62,63,64,65. Puisque la capacité des psychédéliques à rouvrir la période critique de l’apprentissage de la récompense sociale est indépendante du caractère prosocial de leurs effets subjectifs aigus (Fig. 1), il est tentant de spéculer que l’état de conscience altéré partagé par tous les psychédéliques reflète l’expérience subjective de la réouverture des périodes critiques. En accord avec ce point de vue, l’évolution temporelle des effets subjectifs aigus des psychédéliques est parallèle à la durée de l’état ouvert induit par les composés (Fig. 2 et 3). De plus, puisque nos résultats indiquent un mécanisme moléculaire commun (métaplasticité et régulation de l’ECM) (Fig. 4-6) qui a également été impliqué dans la régulation d’autres périodes critiques55,56,57,64,66, ces résultats suggèrent que les psychédéliques pourraient servir de « clé principale » pour déverrouiller un large éventail de périodes critiques. En effet, des preuves récentes suggèrent que l’application répétée de kétamine est capable de rouvrir la période critique pour la plasticité de la dominance oculaire en ciblant l’ECM67,68. Ce cadre élargit le champ des troubles (y compris l’autisme, les accidents vasculaires cérébraux, la surdité et la cécité) qui pourraient bénéficier d’un traitement avec des psychédéliques ; l’examen de cette possibilité est une priorité évidente pour les études futures.
