Costa, G., & Gołembiowska, K. (2022). Neurotoxicity of MDMA: Main effects and mechanisms. Experimental Neurology, 347, 113894.
Abstract.
Des études précliniques et cliniques indiquent que la 3,4-méthylènedioxyméthamphétamine (MDMA ; “ecstasy”), outre son potentiel d’abus, peut provoquer des anomalies aiguës et persistantes de gravité variable au niveau central. Il est important de noter que les effets neurotoxiques de la MDMA ont été démontrés chez les animaux de laboratoire. En conséquence, la toxicité centrale induite par la MDMA peut constituer un grave danger pour la santé, étant donné que la MDMA fait partie des substances utilisées à des fins récréatives par les jeunes et les adultes. Cette revue donne un aperçu concis des résultats récents d’études précliniques et cliniques qui ont évalué les effets centraux de la MDMA et les mécanismes impliqués dans la neurotoxicité induite par cette drogue apparentée aux amphétamines.
1. Introduction.
Le psychostimulant 3,4-méthylènedioxyméthamphétamine (MDMA ; “ecstasy”) est une drogue apparentée aux amphétamines qui présente un risque d’abus et est utilisée à des fins récréatives, en particulier chez les jeunes adultes. Le rapport européen sur les drogues 2017, publié par l’Observatoire européen des drogues et des toxicomanies (OEDT) en 2017, indique que l’abus de MDMA est en augmentation et qu’il ne se limite plus aujourd’hui aux personnes fréquentant les clubs de danse et les soirées, comme c’était le cas depuis le début des années 1980, mais qu’il s’étend à un large éventail de lieux de vie nocturne ordinaires, y compris les bars et les soirées privées. Ces données confirment les conclusions des enquêtes pionnières de Siegel (1986), qui a indiqué que la majorité des personnes prenant de la MDMA étaient des utilisateurs expérimentaux, qui ont consommé la drogue au maximum dix fois et dans des situations sociales, et ont déclaré que leur consommation de MDMA était motivée par leur curiosité à l’égard de la drogue et par l’attente d’effets positifs aigus de la drogue sur l’état émotionnel.
Les effets positifs et indésirables de la MDMA varient en fonction de la dose, de la fréquence et de la durée de la consommation. En général, de faibles doses de MDMA prises en une seule fois induisent des effets positifs aigus sur l’état émotionnel, notamment l’euphorie, l’excitation, la relaxation, une sociabilité accrue et une plus grande proximité avec les autres. Néanmoins, la MDMA peut également induire des effets indésirables dont la manifestation et la gravité peuvent être influencées par une multitude de facteurs environnementaux et pharmacocinétiques. Bien que les effets indésirables aigus de la MDMA soient bien caractérisés tant chez l’homme que chez l’animal de laboratoire (tableau 1), plusieurs controverses existent quant aux effets nocifs à long terme provoqués par l’exposition répétée à la MDMA chez les gros consommateurs, en particulier en ce qui concerne les effets impliquant la manifestation d’une neurotoxicité dans le système nerveux central (CNS) (tableau 2). En fait, différents mécanismes et facteurs semblent intervenir dans les effets nocifs à long terme de la MDMA, comme l’indiquent les résultats obtenus chez les animaux de laboratoire, qui montrent que l’apparition de ces effets, en particulier la neurotoxicité, est influencée non seulement par des facteurs liés à la drogue, tels que la dose, les voies et les schémas d’administration de la MDMA, mais aussi par des facteurs tels que l’espèce et le sexe des animaux, ainsi que la température corporelle et l’environnement dans lequel la MDMA est administrée.
Tableau 1. Résumé des effets indésirables centraux aigus provoqués par la 3,4-méthylènedioxyméthamphétamine (MDMA) chez l’homme et les animaux de laboratoire. Pour une liste plus complète des effets centraux et périphériques de la MDMA.
2. Effets pharmacologiques de la MDMA.
2.1 Effets aigus de la MDMA sur la libération de sérotonine (5-HT) et de dopamine (DA).
Des études menées sur des animaux de laboratoire ont montré que les voies sérotoninergiques et dopaminergiques (DA) sont la principale cible de la MDMA. La MDMA peut interagir, directement ou indirectement, avec le transporteur de la 5-hydroxytryptamine (5-HT) (SERT) et le transporteur de la dopamine (DA) (DAT), afin de stimuler l’efflux de 5-HT et de DA des vésicules présynaptiques dans le caudé-putamen (CPu) et le cortex préfrontal (PFC) ; notamment, cet effet est également affiché par la 3,4-méthylènedioxyamphétamine (MDA), le principal métabolite de la MDMA. De plus, la MDMA et la MDA peuvent diminuer l’activité de la tryptophane hydroxylase (TPH), une enzyme impliquée dans la synthèse de la 5-HT. La possibilité que la MDMA affecte les niveaux de SERT et les densités des récepteurs 5-HT chez l’homme est contestée, car les études réalisées jusqu’à présent se caractérisent pour la plupart par une hétérogénéité méthodologique marquée (c’est-à-dire en ce qui concerne les doses de MDMA utilisées et la prise de drogues autres que la MDMA) et par des échantillons de petite taille. Néanmoins, il existe des preuves suggérant que l’interaction de la MDMA avec le SERT et la libération subséquente de 5-HT pourraient être responsables de la plupart des effets physiques et psychologiques de la MDMA chez l’homme. Cette hypothèse peut être étayée par des données obtenues chez des animaux de laboratoire, selon lesquelles le blocage pharmacologique du SERT par la fluoxétine réduit la capacité de la MDMA à libérer la 5-HT des terminaux. Des résultats similaires ont été obtenus chez des animaux de laboratoire après le blocage de la DAT par la cocaïne ou ses analogues, ce qui a entraîné une réduction de la libération de DA. Néanmoins, la MDMA semble agir principalement sur le système sérotonergique dans le cerveau humain ; par conséquent, on ne sait toujours pas si la consommation aiguë de MDMA peut affecter le DAT chez l’homme.
2.2 Effets persistants de la MDMA sur la 5-HT et la DA après une exposition répétée ou la prise de doses élevées.
Comme mentionné ci-dessus, il existe des controverses quant à la caractérisation des effets indésirables centraux à long terme provoqués par l’exposition répétée à la MDMA, à la fois chez les gros consommateurs humains et chez les animaux de laboratoire. Malgré le grand nombre d’études suggérant l’apparition de lésions cérébrales neurotoxiques chez les animaux de laboratoire traités de manière répétée à la MDMA, certains auteurs ont émis l’hypothèse que la MDMA pouvait être capable de réguler à la baisse les récepteurs 5-HT et SERT sans provoquer de lésions neuronales manifestes, remettant ainsi en question l’existence d’effets neurotoxiques de la MDMA. À cet égard, il convient de tenir compte du fait que de nombreuses études menées sur des animaux de laboratoire utilisent généralement un régime d’administration de type “binge” et ne procèdent souvent pas à une évaluation des modifications sérotoninergiques et/ou dopaminergiques persistantes/retardées induites par la MDMA, qui peuvent se manifester pleinement longtemps après l’arrêt de la prise de drogue.
En ce qui concerne les effets de la MDMA sur le système sérotoninergique, des études menées sur des rats et des primates non humains ont montré qu’une seule administration de MDMA peut réduire les niveaux de 5-HT striatale, limbique et corticale, un effet qui se rétablit généralement dans les 24 heures suivant l’administration de la drogue, et peut diminuer l’activité de la TPH, un effet qui se rétablit généralement après une période plus longue. Néanmoins, une exposition prolongée et/ou répétée à la MDMA peut provoquer des anomalies à long terme dans le système sérotonergique des rongeurs et des primates non humains, telles qu’une diminution des taux de 5-HT hypothalamique, striatal, limbique et cortical et de son principal métabolite, l’acide 5-hydroxyindoleacétique (5-HIAA), une réduction de la densité des SERT et une baisse de l’activité de la TPH. Il est important de noter que ces changements se sont avérés persistants, puisqu’ils ont pu être observés des mois, voire des années après l’arrêt du médicament, tant chez les rats que chez les primates non humains. À cet égard, les primates non humains se sont révélés très sensibles aux effets nocifs de la MDMA sur le cerveau. En effet, il a été démontré que les primates non humains traités de manière répétée avec de la MDMA présentent des déplétions de 5-HT et de 5-HIAA dans différentes régions du cerveau, telles que le cortex somatosensoriel, le noyau caudé, le putamen, l’hippocampe, l’hypothalamus et le thalamus, ainsi que dans le liquide céphalo-rachidien (LCR). En outre, on a constaté que des primates non humains traités de manière répétée à la MDMA présentaient une densité réduite de SERT lorsqu’ils étaient évalués un an après l’arrêt de la drogue au moyen de la tomographie par émission de positons (TEP) pour le [11C]McN-5652, un radioligand qui se lie sélectivement au SERT.
Plusieurs études ont également testé la possibilité que la MDMA puisse provoquer des anomalies sérotoninergiques dans le cerveau humain. Une revue récente a résumé les résultats des études d’imagerie réalisées au cours des 20 dernières années, concluant qu’une forte consommation de MDMA peut être associée à une réduction de la densité des SERT dans plusieurs régions du cerveau (lobe pariétal, temporal et occipital, cortex cingulaire antérieur et postérieur, thalamus et hippocampe) ; néanmoins, il n’est pas exclu que la réduction de la densité des SERT soit réversible, comme l’ont supposé d’autres auteurs.
En ce qui concerne les effets de la MDMA sur le système dopaminergique, il convient de noter que la plupart des études disponibles à cet égard ont été réalisées sur des souris. Ainsi, la MDMA provoque chez cette espèce un profil particulier de neurotoxicité qui affecte à peine les systèmes sérotoninergiques, mais fortement les systèmes DAergiques nigrostriataux et mésolimbiques. On a constaté que l’administration orale aiguë de MDMA diminuait la teneur en DA du striatum lorsqu’elle était administrée à 25 °C, mais pas à 4 °C. L’administration répétée de MDMA à des souris a diminué les taux de DA et de DAT dans le CPu, ainsi que l’immunoréactivité de la tyrosine hydroxylase (TH), l’enzyme limitant la vitesse de synthèse de la DA, dans le CPu et la substantia nigra pars compacta (SNc). L’induction de lésions DAergiques par la MDMA a longtemps été considérée comme un effet propre aux souris ; cependant, des données récentes suggèrent que l’administration répétée de MDMA peut être toxique pour le système DAergique des rats et des primates non humains (Millot et al., 2020) également. Dans l’étude de Cadoni et al., l’exposition de rats à de multiples injections de MDMA à l’adolescence a induit des dommages DAergiques qui étaient évidents à l’âge adulte et qui consistaient en un nombre réduit de neurones positifs pour la TH à la fois dans le SNc et l’aire tegmentale ventrale (VTA), et en une diminution de l’immunoréactivité pour la TH et la DAT dans le CPu et le noyau accumbens. Millot et al. ont d’abord traité à plusieurs reprises des primates non humains avec de la MDMA, puis, après une période d’élimination de cinq mois, ils ont administré à ces mêmes animaux la neurotoxine DAergique 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP), qui est capable d’induire chez les animaux de laboratoire (c’est-à-dire les souris et les primates non humains) une dégénérescence DAergique nigrostriatale et des déficits moteurs semblables à ceux qui caractérisent la maladie de Parkinson (MP). De manière intéressante, cette étude a révélé que l’administration répétée de MDMA réduisait la disponibilité de la DAT dans le noyau caudé et dans le putamen, évaluée au moyen de techniques d’imagerie par résonance magnétique utilisant le ligand [11C]PE2I (11C-N-(3-iodoprop-2E-enyl)-2bêta-carbométhoxy-3bêta-(4-méthylphényl)nortropane. De plus, et c’est important, la même étude a montré qu’une exposition préalable à la MDMA aggravait le parkinsonisme induit par le MPTP chez les primates non humains. Ces données obtenues chez des primates non humains sont particulièrement pertinentes, compte tenu de leur potentiel de transposition au milieu humain. Il est intéressant de noter qu’une interaction néfaste similaire entre la MDMA et la neurotoxine DAergique MPTP a été précédemment démontrée par notre groupe chez des souris C57BL/6J, où l’exposition répétée à la MDMA pendant l’adolescence a exacerbé les dommages DAergiques nigrostriataux, corticaux et limbiques, ainsi que l’activation de la glie et les déficits de la mémoire de reconnaissance induits par le MPTP administré à l’âge adulte.
La consommation de psychostimulants illicites a été associée à la présence d’une morphologie anormale du SNc et à un risque accru de MP. En effet, un lien possible entre l’utilisation de MDMA et la manifestation de la MP a été supposé il y a plusieurs années, sur la base de rapports de cas de parkinsonisme juvénile chez des utilisateurs de MDMA. En outre, McCann et al. ont identifié une réduction de l’acide homovanillique, un métabolite de la DA, dans le LCR de femmes, mais pas d’hommes, consommateurs de MDMA, ce qui suggère des anomalies possibles dans les systèmes DAergiques. En outre, l’analyse métabolomique d’échantillons de plasma prélevés sur des personnes ayant pris une dose unique de MDMA a révélé une diminution du calcitriol après la prise de MDMA. Le calcitriol est le métabolite actif de la vitamine D3 et est capable de réguler à la hausse les facteurs trophiques, y compris le facteur neurotrophique dérivé de la lignée des cellules gliales, provoquant ainsi des effets protecteurs sur les neurones DAergiques. Par conséquent, la capacité de la MDMA à réduire les niveaux de calcitriol pourrait étayer l’hypothèse selon laquelle cette drogue apparentée aux amphétamines pourrait induire des lésions DAergiques chez l’homme. Néanmoins, il n’existe à ce jour aucune preuve convaincante démontrant sans équivoque que la consommation de MDMA peut endommager les neurones et/ou les terminaisons DA chez l’homme.
D’autres effets néfastes à long terme de la consommation de MDMA chez l’homme sont fréquemment décrits, notamment des déficits cognitifs, des troubles psychiatriques et le développement d’une tolérance aux effets agréables de la drogue sur l’état émotionnel (tableau 2). Des analyses récentes de la littérature existante ont suggéré que les gros consommateurs de MDMA présentent des déficiences dans plusieurs domaines cognitifs, par rapport aux personnes n’ayant jamais consommé de MDMA. Ces déficits semblent particulièrement évidents pour l’apprentissage verbal, l’attention et la mémoire de travail, alors que les données disponibles ne démontrent pas systématiquement l’existence d’effets néfastes de la MDMA sur d’autres domaines cognitifs. En outre, les gros consommateurs de MDMA se plaignent fréquemment de la présence de troubles psychiatriques, tels qu’une humeur dépressive, un effet qui a été signalé comme étant présent jusqu’à trois semaines après la prise de drogue, et l’anxiété. Enfin, les consommateurs réguliers de MDMA signalent souvent une diminution de la réactivité aux effets agréables de la drogue et un besoin conséquent d’augmenter les doses, ce qui implique le développement d’une tolérance.
En résumé, la plupart des preuves expérimentales suggérant l’existence d’une neurotoxicité, de dysfonctionnements cognitifs et psychiatriques et d’une tolérance induits par la MDMA proviennent d’études réalisées chez de gros consommateurs récréatifs. S’il semble plausible qu’une forte consommation de MDMA puisse entraîner certains effets toxiques sur le plan neuronal et comportemental, il est important de noter qu’il n’existe pas encore suffisamment de preuves pour conclure qu’une consommation faible à modérée de MDMA est préjudiciable à la structure/fonction cérébrale de l’homme.
3. Mécanismes de la neurotoxicité induite par la MDMA.
Des études indépendantes ont proposé différents mécanismes pouvant être responsables des effets neurotoxiques de la MDMA. À ce jour, l’importance relative des différents mécanismes susceptibles de sous-tendre la neurotoxicité induite par la MDMA est toujours contestée ; en outre, on peut supposer que seule l’apparition d’interactions synergiques entre les différents mécanismes de toxicité peut expliquer entièrement les effets nocifs provoqués par la MDMA dans le CNS. Les données disponibles suggèrent que, parmi les mécanismes les plus susceptibles d’être impliqués dans la neurotoxicité induite par la MDMA, il y a la génération de métabolites toxiques de la MDMA, l’augmentation du stress oxydatif et des quinones à base de DA, l’apparition d’un dysfonctionnement mitochondrial, l’activation des cellules gliales et l’apparition d’événements excitotoxiques, l’induction d’une hyperthermie. Les données disponibles étayant le rôle de ces mécanismes dans la toxicité induite par la MDMA sont résumées dans la suite de cette étude.
3.1 Rôle des métabolites toxiques de la MDMA.
Les injections locales de MDMA dans diverses régions du CNS des rongeurs ne parvenant pas à reproduire la neurotoxicité observée après l’administration systémique de MDMA, plusieurs études ont exploré la possibilité que la neurotoxicité induite par la MDMA provienne de la production de métabolites toxiques. Le métabolisme de la MDMA peut impliquer une réaction de O-déméthylation avec formation de MDA, qui est ensuite converti en 3,4-dihydroxyamphétamine (également connue sous le nom d’α-méthyldopamine, α-MeDA) ; la MDMA peut également subir une réaction de N-déméthylation avec formation de 3,4-dihydroxyméthamphétamine (HHMA) (Fig. 1). L’α-MeDA et la HHMA peuvent être métabolisés par la catéchol-O-méthyltransférase (COMT) en 3-méthoxy-4-hydroxyamphétamine (HMA) ou en 3-méthoxy-4-hydroxyméthamphétamine (HMMA), respectivement (revue par Green et al., 2003) (Fig. 1). L’α-MeDA est un composé catécholique qui peut être oxydé en ortho-quinone correspondante, une molécule hautement redox-active, qui peut être oxydée à son tour et conduire à la synthèse d’espèces réactives de l’oxygène (ROS) et d’espèces réactives de l’azote (RNS), et qui pourrait donc être impliquée dans la manifestation de la neurotoxicité de la MDMA. Cette hypothèse est étayée par la preuve que l’injection intracérébroventriculaire d’α-MeDA dans le cerveau du rat produit des altérations à court terme dans les systèmes DAergique, sérotonergique et noradrénergique. Cependant, et c’est intéressant, d’autres études ont montré que les injections locales de métabolites dérivés de la HHMA dans le cerveau du rat ne parvenaient pas à reproduire les effets neurotoxiques observés après l’administration périphérique de MDMA.
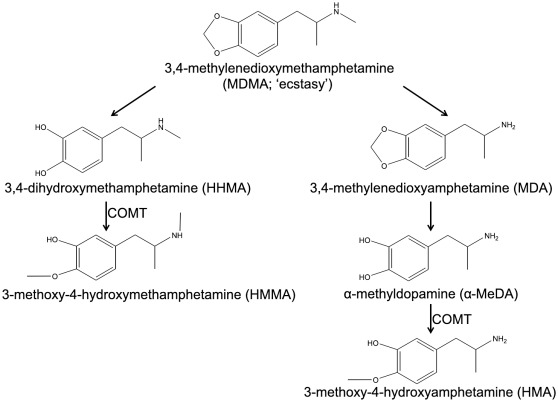
Comme décrit en détail dans le paragraphe suivant, la 5-HT peut former des métabolites capables de causer des dommages sélectifs aux neurones 5-HT. Collectivement, ces données soutiennent l’hypothèse selon laquelle la formation de produits toxiques peut être un mécanisme qui participe aux effets neurotoxiques de la MDMA, mais elles suggèrent également qu’un tel mécanisme implique principalement les métabolites qui peuvent être convertis en quinones.
3.2 Rôle du stress oxydatif et des quinones à base de dopamine (DA).
Le stress oxydatif est défini comme un déséquilibre entre la production de ROS et l’activité des systèmes de défense antioxydants. ROS est un terme collectif qui inclut non seulement les radicaux oxygénés (c’est-à-dire le superoxyde et le radical hydroxyle), mais aussi certaines espèces non radicalaires qui possèdent des propriétés oxydantes (c’est-à-dire le peroxyde d’hydrogène et le peroxynitrite). Il est important de noter que la production de ROS peut avoir lieu non seulement dans le réticulum endoplasmique et les mitochondries, mais qu’elle peut également provenir de l’autoxydation cytoplasmique d’espèces non radicalaires qui possèdent un cycle catécholique, comme l’AD.
L’AD est une molécule chimiquement stable uniquement lorsqu’elle se trouve à l’intérieur de la vésicule synaptique. Plusieurs études ont corroboré l’idée que les effets de la MDMA sur la libération de 5-HT et de DA interagissent pour engendrer une neurotoxicité. Ainsi, la DA libérée par la MDMA peut pénétrer dans les terminaisons 5-HT par l’intermédiaire du SERT, puis être oxydée par l’enzyme monoamine oxydase (MAO) de type B, ce qui entraîne la production de ROS. En outre, la MDMA favorise l’exocytose de la DA et cet effet peut être exacerbé par l’hyperthermie, qui est également provoquée par la MDMA (voir ci-dessous), ainsi que par l’administration concomitante d’agents dopaminomimétiques tels que la 3,4-dihydroxy-l-phénylalanine (L-DOPA). L’implication possible de la libération de DA dans les effets neurotoxiques de la MDMA peut s’expliquer par le fait que la DA cytosolique peut être oxydée en quinones réactives, soit spontanément, soit par voie enzymatique. Ainsi, la DA peut s’auto-oxyder en présence d’ions métalliques, tels que Cu2+, Mn2+, Fe3+, ou de chélates de cuivre et de fer ; alternativement, la DA peut être oxydée dans des conditions physiologiques par l’action d’enzymes oxydatives, telles que la xanthine oxydase, les peroxydases, les lipoxygénases et les catéchol oxydases contenant du cuivre. Nous avons récemment démontré que la MDMA peut activer les enzymes antioxydantes et qu’il existe des différences entre les sexes dans les systèmes antioxydants qui sont déclenchés dans la voie nigrostriatale en réponse aux dommages neurotoxiques induits par la MDMA. En effet, nous avons constaté que les neurones dopaminergiques nigrostriataux des souris mâles sont plus sensibles aux effets toxiques médiés par l’isoforme mitochondriale 2 de la superoxyde dismutase (SOD2) qu’aux effets toxiques médiés par la SOD1 cytoplasmique. Ces résultats sont en accord avec des découvertes antérieures montrant que l’administration de MDMA augmente l’activité de la SOD chez les souris, et que la surexpression génétique de l’isoforme SOD1 protège les souris des dommages neurotoxiques induits par la MDMA.
En ce qui concerne les mécanismes responsables de la mort neuronale provoquée par la MDMA, étant donné que les intermédiaires O-quinone sont des accepteurs de Michael, il est possible que la toxicité se produise par l’alkylation de protéines cellulaires cruciales et/ou de l’ADN. Il a également été postulé que des dysfonctionnements au niveau du système NO peuvent entraîner des processus de mort neuronale, et des dysfonctionnements du système NO ont été observés chez des rongeurs traités à la MDMA. Ainsi, l’administration de MDMA augmente significativement la formation de NO, ainsi que de protéines nitrées portant la modification nitrotyrosine, dans le striatum du rat. La nitration de la tyrosine semble particulièrement importante pour la neurotoxicité médiée par la MDMA, car cet acide aminé est essentiel au fonctionnement des terminaux 5-HT ou DA.
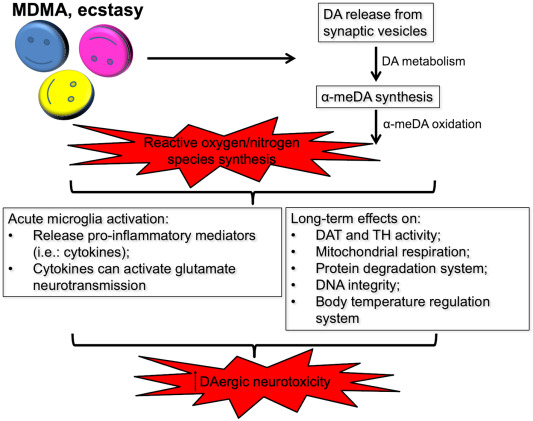
Dans l’ensemble, les processus métaboliques qui conduisent à la formation de quinones, de ROS, de RNS et/ou de produits d’oxydation toxiques peuvent représenter un facteur clé responsable de la neurotoxicité DAergique exercée par la MDMA. Par exemple, les quinones DA peuvent activer la microglie et interagir avec la DAT et la TH, les complexes mitochondriaux I et IV et le protéasome, ce qui peut avoir des effets délétères sur l’homéostasie neuronale (Fig. 2). Ainsi, la microglie activée libère des médiateurs pro-inflammatoires, comme détaillé ci-dessous. En outre, les quinones DA se lient de manière covalente à la TH et à la dopamine, inhibant ainsi la fonction de ces protéines, et elles peuvent également perturber la respiration mitochondriale dans le cerveau. En outre, l’inhibition du protéasome peut conduire à l’accumulation de protéines mal repliées et à leur agrégation, entraînant la mort des cellules DAergiques.
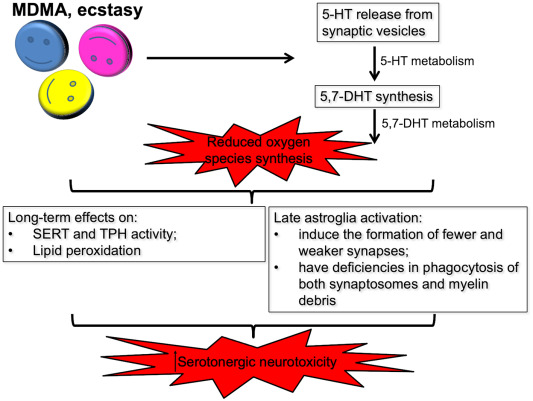
Outre l’autoxydation de la DA, l’augmentation du stress oxydatif provoquée par la MDMA peut également provenir de l’oxydation de la 5-HT (Fig. 3). Ainsi, comme mentionné ci-dessus, la MDMA libère de la 5-HT qui peut être oxydée en peroxyde d’hydrogène, ce qui entraîne la formation de radicaux hydroxyles. En outre, la 5-HT peut être oxydée pour former des métabolites dont on pense qu’ils causent des dommages sélectifs aux neurones 5-HT, comme la 5,7-dihydroxytryptamine (5,7-DHT). En effet, on a constaté que l’administration intracérébroventriculaire de 5,7-DHT dans la PFC des rats épuisait la 5-HT et le SERT et augmentait de manière persistante les niveaux des marqueurs de l’activation astrocytaire, tels que la protéine de choc thermique 32 et la protéine acide fibrillaire gliale (GFAP). Il est intéressant de noter qu’il a été démontré que les astrocytes réactifs, qui sont activés à la suite de la libération de médiateurs pro-inflammatoires par la microglie activée, perdent la capacité de promouvoir la survie, la croissance, la synaptogenèse et la phagocytose des neurones, et sont au contraire capables de favoriser la mort des neurones et des oligodendrocytes.
Il est maintenant bien accepté qu’une augmentation des niveaux de ROS contribue à un certain nombre de processus pathologiques dans le CNS comme, par exemple, le vieillissement, l’apoptose et les lésions cellulaires au cours de l’ischémie et de la reperfusion. Depuis les années 1990, plusieurs séries de preuves précliniques se sont accumulées pour soutenir la possibilité que la formation de ROS fasse partie des mécanismes qui soutiennent la neurotoxicité DAergique et sérotonergique induite par la MDMA. Ainsi, des données obtenues chez le rat ont montré que l’administration répétée de MDMA augmente la formation de radicaux hydroxyles. Il est intéressant de noter que Shankaran et al. ont démontré que la capacité de l’administration répétée de MDMA à augmenter la production de radicaux hydroxyles dans le CPu des rats était parallèle à l’augmentation de la concentration extracellulaire de DA striatale, qui peut subir une oxydation, comme nous l’avons expliqué précédemment. Il est intéressant de noter que le même groupe a évalué, après des prises répétées de MDMA, la concentration extracellulaire d’acide 2,3-dihydroxybenzoïque striatal, en tant qu’indice de génération de radicaux hydroxyles. Les résultats obtenus ont montré que la MDMA augmentait les niveaux d’acide 2,3-dihydroxybenzoïque, qui étaient réduits par un traitement à la fluoxétine, qui atténuait également la déplétion striatale en 5-HT. Enfin, il a été largement démontré que certaines substances psychoactives, lorsqu’elles sont administrées en même temps que la MDMA, peuvent renforcer les effets pro-oxydants de cette drogue apparentée à l’amphétamine et entraîner une exacerbation de la neurotoxicité. Ainsi, on a constaté que l’administration conjointe de caféine potentialise la libération de DA induite par la MDMA dans le CPu de la souris ; étant donné les propriétés auto-oxydantes de la DA, cet effet pourrait expliquer l’augmentation des lésions DAergiques observées dans le système nigrostriatal de la souris après l’administration combinée de caféine et de MDMA, par rapport à la MDMA seule. À l’inverse, l’administration combinée de molécules antioxydantes, ainsi que de piégeurs de radicaux libres, a permis de freiner les effets neurotoxiques de la MDMA sur le système sérotoninergique des rats.
Des études précliniques ont démontré que les effets pro-oxydants de la MDMA peuvent également entraîner une augmentation de la peroxydation lipidique dans les terminaisons nerveuses sérotonergiques, ce qui a été mis en évidence dans le PFC, l’hippocampe et le CPu de rongeurs expérimentaux traités de manière répétée à la MDMA. En outre, il a été constaté que le traitement répété à la MDMA affectait également l’intégrité de l’ADN dans l’hippocampe et le système nigrostriatal des souris. Les effets néfastes de la MDMA sur l’intégrité de l’ADN se sont manifestés sous la forme de ruptures simple et double brin et, fait intéressant, on a constaté qu’ils persistaient même après la disparition de l’épuisement du stress oxydatif, comme l’ont montré Frenzilli et al. dans l’hippocampe de la souris et également notre groupe dans le PFC de la souris ainsi que dans le PFC et l’hippocampe du rat (Fig. 4).
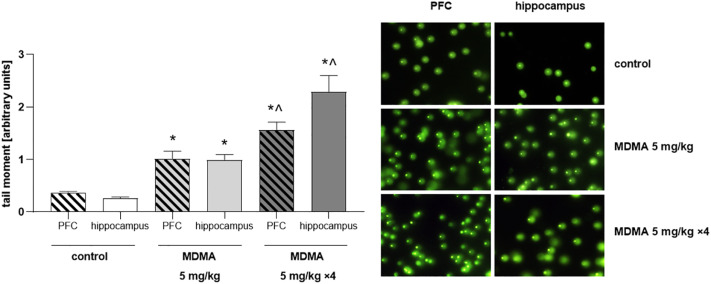
Dans l’ensemble, les données précliniques disponibles appuient fortement la possibilité qu’une augmentation du stress oxydatif participe aux effets neurotoxiques de la MDMA. Néanmoins, à notre connaissance, la capacité de la MDMA à induire des événements oxydatifs chez l’homme n’a été démontrée que dans des échantillons de plasma, ce qui plaide en faveur d’investigations supplémentaires visant à clarifier si la MDMA peut augmenter les niveaux de stress oxydatif dans le CNS de l’homme et si un tel effet peut éventuellement conduire à des lésions neuronales.
3.3 Rôle du dysfonctionnement mitochondrial.
Il a été démontré que l’administration répétée de MDMA inhibe le complexe I de la chaîne de transport d’électrons, entravant ainsi la respiration mitochondriale et conduisant finalement à une production accrue de ROS. Sur la base de ces données, plusieurs études ont examiné des stratégies neuroprotectrices susceptibles de prévenir les dommages mitochondriaux induits par la MDMA. À cet égard, il a été démontré que l’inhibition du métabolisme de la DA par la pargyline, un inhibiteur de la MAO, offrait une protection significative contre l’inhibition du complexe I induite par la MDMA et la neurotoxicité associée. En outre, une autre étude a montré que l’exercice physique atténuait l’augmentation de la production de ROS induite par une administration unique de MDMA dans des mitochondries isolées du cerveau de rat, ainsi que le gonflement des mitochondries, les lésions de la membrane externe des mitochondries et la quantité de cytochrome c libéré par les mitochondries. Bien que les études précliniques suggèrent que le dysfonctionnement mitochondrial pourrait jouer un rôle important dans les effets neurotoxiques de la MDMA, l’importance de ce mécanisme dans les effets toxiques de la MDMA chez l’homme est mal définie et d’autres études à cet égard sont justifiées.
3.4 Rôle des cellules gliales et événements excitotoxiques.
Dans le CNS, les cellules gliales, et en particulier les cellules microgliales et les astrocytes, jouent un rôle essentiel de protection et de soutien des neurones.
Dans des conditions physiologiques, les cellules microgliales sont au repos, mais en réponse à une agression, elles augmentent immédiatement de taille, migrent vers le site de la lésion et libèrent des médiateurs pro-inflammatoires, tels que des cytokines. À long terme, l’activation de la microglie est un événement neuroprotecteur, car elle entraîne la phagocytose des cellules mourantes et mortes. Une activation rapide de la microglie associée à une augmentation des concentrations d’IL-1β a été démontrée dans le cortex et l’hypothalamus de rats après une administration unique de MDMA. En outre, des études ultérieures ont confirmé la capacité de la MDMA à activer rapidement la microglie, en démontrant que des rongeurs expérimentaux traités à plusieurs reprises avec de la MDMA présentaient une activation accrue de la microglie dans les zones corticales et limbiques du cerveau. Un point crucial pour comprendre l’interaction entre l’activation de la microglie et la neurotoxicité provoquée par la MDMA est le fait que les cytokines produites lors de l’activation de la microglie peuvent activer la neurotransmission du glutamate et, à leur tour, favoriser l’excitotoxicité. À cet égard, il convient de noter qu’une étude antérieure menée sur des rats a démontré que l’activation de la microglie observée dans l’hippocampe après une exposition répétée à la MDMA était en corrélation avec l’augmentation du glutamate extracellulaire dans la même région.
Les astrocytes sont d’autres cellules gliales importantes qui participent au recaptage du glutamate libéré au niveau synaptique, optimisant ainsi la fonction neuronale et prévenant l’excitotoxicité du glutamate. Les astrocytes constituent une deuxième ligne de défense du CNS et, à l’instar de la microglie, ils subissent des changements morphologiques et fonctionnels en réponse aux insultes. Les astrocytes réactifs sont caractérisés par une hypertrophie de leurs processus cellulaires et une altération de l’expression de nombreux gènes, y compris la régulation à la hausse de la GFAP. Il est intéressant de noter que Thomas et al. ont constaté que non seulement la MDMA était capable d’augmenter l’activation de la microglie dans le cerveau de la souris, mais aussi que la MDMA augmentait la coloration de la GFAP. Comme expliqué plus haut, les astroglies réactives peuvent contribuer à la mort neuronale, ce qui corrobore l’idée d’un lien entre l’activation des cellules gliales et la neurotoxicité. L’étude de Thomas et al. a également montré que les médicaments apparentés aux amphétamines dépourvus d’effets neurotoxiques, tels que la l-méthamphétamine, la fenfluramine et la 2,5-diméthoxy-4-iodoamphétamine, n’augmentaient pas la coloration de la GFAP et n’induisaient pas d’activation microgliale chez les souris. Ces résultats indiquent donc que la microglie et l’astroglie sont toutes deux impliquées de manière critique dans les effets neurotoxiques de la MDMA.
Nous avons démontré, avec d’autres, que chez la souris, l’administration répétée de MDMA induit une activation des cellules gliales dans le système DAergique nigrostriatal qui peut être associée à la neurotoxicité. Les facteurs cruciaux de l’activation de la glie induite par la MDMA et de la neurotoxicité associée semblent être l’âge et le sexe des animaux, ainsi que le cadre environnemental (c’est-à-dire la promiscuité et la température) dans lequel la MDMA est administrée. En outre, d’autres études ont montré que l’activation de la glie et la neurotoxicité induite par la MDMA dans le système nigrostriatal DAergique peuvent être influencées par des médicaments administrés en même temps que la MDMA. Par exemple, il a été démontré que les rongeurs expérimentaux traités avec de la MDMA en association avec de la caféine ou du Δ9-tétrahydrocannabinol présentaient une exacerbation des effets pro-inflammatoires et neurotoxiques dans le tractus nigrostriatal DAergique, par rapport à la MDMA seule.
Il est difficile de comprendre le rôle de la glie dans les effets nocifs centraux de la MDMA chez l’homme, car il n’existe que peu d’études portant sur les modifications de la réponse immunitaire à l’administration de MDMA chez l’homme.
3.5 Rôle de l’hyperthermie.
Comme le montre le tableau 1, l’induction d’une hyperthermie est un effet indésirable aigu fréquent de l’administration de MDMA chez les animaux de laboratoire et chez l’homme. L’un des principaux facteurs influençant la manifestation de l’hyperthermie est la dose de MDMA : les doses faibles/modérées ont peu d’effet, tandis que les doses élevées ou répétées provoquent une augmentation marquée de la température corporelle pouvant dégénérer en hyperpyrexie, qui peut être mortelle. Parmi les autres facteurs à prendre en compte lors de l’examen des effets hyperthermiques de la MDMA figure le cadre environnemental dans lequel la drogue est expérimentée. En effet, il a été suggéré que la promiscuité sociale, telle qu’elle se produit dans les clubs de danse, les soirées privées et les bars, ainsi que la musique forte, peuvent être des facteurs qui favorisent la manifestation de l’hyperthermie, bien que l’impact de ces facteurs sur la température corporelle soit plus difficile à étudier chez les utilisateurs humains que chez les animaux de laboratoire. Néanmoins, des études précliniques indépendantes sur des rongeurs expérimentaux ont démontré que les effets neurotoxiques et/ou neuroinflammatoires de la MDMA peuvent être exacerbés par l’hyperthermie, ainsi que par l’expérience de la drogue dans un contexte impliquant des températures environnementales élevées et/ou la promiscuité des cages. Les résultats d’autres études précliniques portant sur l’administration de MDMA à des températures ambiantes basses ou sur l’administration conjointe de MDMA et de composés capables d’abaisser la température corporelle vont dans le même sens et ont révélé une neurotoxicité réduite de la MDMA dans ces conditions expérimentales, par rapport aux conditions expérimentales standard. Une revue récemment publiée par Vercoulen et Hondebrink a analysé la littérature issue d’études in vitro, animales et humaines portant sur la co-administration de MDMA et d’alcool, révélant que l’alcool semble diminuer la température corporelle, bien que l’influence de cet effet sur la pharmacocinétique de la MDMA ne soit pas claire. Il est intéressant de noter que certaines données suggèrent que les enzymes COMT pourraient jouer un rôle important dans la régulation de la réponse hyperthermique à la MDMA et, par conséquent, des effets neurotoxiques de cette drogue apparentée à l’amphétamine. En effet, il a été constaté que l’inhibition pharmacologique de la COMT chez le rat potentialise les déficits sérotoninergiques induits par la MDMA et exacerbe la réponse hyperthermique à la MDMA.
4. Conclusions.
Les études précliniques indiquent que la MDMA peut endommager les corps et les terminaux neuronaux. Dans cette revue, nous avons présenté des preuves que la génération de métabolites toxiques de la MDMA, l’augmentation du stress oxydatif et des quinones à base de DA, l’apparition d’un dysfonctionnement mitochondrial, l’activation des cellules gliales et l’apparition d’événements excitotoxiques, l’induction d’une hyperthermie sont impliqués dans les effets neurodégénératifs de la MDMA chez les animaux de laboratoire. Bien que l’on s’accorde de plus en plus à penser que la MDMA peut également avoir des effets neurotoxiques chez l’homme, aucune preuve concluante de lésions neurotoxiques sérotoninergiques et/ou DAergiques durables n’a été obtenue jusqu’à présent chez les consommateurs de MDMA. Néanmoins, l’utilisation de la MDMA pose un sérieux problème de santé, car elle peut induire des altérations des fonctions cérébrales qui peuvent persister même après l’arrêt de la consommation. Il est donc essentiel d’étudier les conséquences comportementales des lésions neurotoxiques causées par la MDMA chez les animaux de laboratoire afin de mieux comprendre les conséquences de l’abus de cette drogue apparentée aux amphétamines chez l’homme.