Bravo, R. R., Faria, A. C., Brito-da-Costa, A. M., Carmo, H., Mladěnka, P., da Silva, D. D., & Remião, F. (2022). Cocaine: an updated overview on chemistry, detection, biokinetics, and pharmacotoxicological aspects including abuse pattern. Toxins, 14(4).
Abstract.
La cocaïne est l’un des stimulants les plus consommés dans le monde, selon les sources officielles. Il s’agit d’un alcaloïde tropique sympathomimétique naturel dérivé des feuilles de l’Erythroxylon coca, qui est utilisé par les populations locales d’Amérique du Sud depuis des millénaires. La cocaïne se présente généralement sous deux formes : le chlorhydrate de cocaïne, une poudre blanche, et le “crack”, une base libre. Alors que la première est généralement administrée par insufflation (“sniffer”) ou par voie intraveineuse, la seconde est adaptée à l’inhalation (fumer). La cocaïne peut exercer une action anesthésique locale en inhibant les canaux sodiques dépendant du voltage, interrompant ainsi la propagation des impulsions électriques ; la cocaïne a également un impact sur la neurotransmission en empêchant la recapture des monoamines, en particulier la dopamine, à partir de la fente synaptique. L’excès de dopamine disponible pour l’activation postsynaptique est à l’origine des effets agréables signalés par les consommateurs et contribue au potentiel de dépendance et aux effets toxiques de la drogue. La cocaïne est métabolisée (principalement par voie hépatique) en deux métabolites principaux, l’ester méthylique d’ecgonine et la benzoylecgonine. D’autres métabolites comprennent, par exemple, la norcocaïne et le cocaéthylène, qui présentent tous deux une action pharmacologique, et le dernier constitue un biomarqueur de la co-consommation de cocaïne et d’alcool. Cette revue donne un bref aperçu de la prévalence et des modes d’utilisation de la cocaïne, de ses propriétés physico-chimiques et des méthodes d’analyse, de sa pharmacocinétique, de sa pharmacodynamique et de sa toxicité à plusieurs niveaux.
Introduction.
La cocaïne est un alcaloïde sympathomimétique naturel provenant de la plante Erythroxylon coca qui est utilisée comme stimulant, en mâchant les feuilles ou en faisant des infusions, en Amérique du Sud depuis plus de 5000 ans. La cocaïne a été isolée pour la première fois des feuilles au milieu des années 1800 et était à l’époque considérée comme sûre et utilisée dans les gouttes contre les maux de dents, les pilules contre la nausée, les toniques énergétiques et la première boisson “Coca-Cola”. Actuellement, on la trouve sous l’une des deux formes d'(ab)utilisation : Le chlorhydrate de cocaïne (également appelé ” coke “, ” blow ” ou ” snow “), une fine poudre cristalline blanche, soluble dans l’eau et consommée principalement par voie intranasale (” sniffer ” / ” snort “), orale ou intraveineuse ; ou sous forme de base libre (résultant de la réaction du chlorhydrate de cocaïne avec de l’ammonium ou du bicarbonate de soude), communément appelée “crack” ou simplement “crack”, et généralement consommée par inhalation (la masse solide est brisée en “cailloux” qui sont fumés à l’aide de pipes en verre ou de fortune).
L’abus de cocaïne reste un problème de santé publique important, avec de graves conséquences socio-économiques dans le monde entier. Selon le dernier Rapport mondial sur les drogues, 0,4 % de la population mondiale âgée de 15 à 64 ans a déclaré avoir consommé de la cocaïne en 2019 – ce qui correspond à environ 20 millions de personnes. La dernière édition du rapport sur les drogues de l’Observatoire européen des drogues et des toxicomanies (OEDT) indique qu’elle reste la deuxième substance la plus consommée dans l’Union européenne, juste derrière le cannabis. En outre, malgré la pandémie mondiale de COVID-19, les autorités européennes ont intercepté dans les ports maritimes des quantités croissantes de cocaïne en 2020. Pendant ce temps, les rapports de cas détaillant les conséquences néfastes de la consommation de cocaïne abondent.
La présente revue vise à fournir un aperçu informatif des données disponibles sur les propriétés physicochimiques de la cocaïne et les méthodes de détection, la pharmacodynamique, la pharmacocinétique, les effets et la toxicité, les modes d’abus ainsi que sa prévalence.
Résultats et discussion.
Occurrence naturelle et caractérisation chimique d’Erythroxylum coca
L’arbuste de coca, dont est extraite la cocaïne, est une plante du genre Erythroxylum qui pousse en Amérique centrale et en Amérique du Sud, et qui compte plus de 250 espèces identifiées, dont les deux plus importantes sont E. coca et Erythroxylum novogranatense ; cependant, c’est de E. coca Lam. var. coca (également appelée coca ‘bolivienne’ ou ‘Huanuco’) que la majorité de la cocaïne est extraite. La plante de coca présente de grandes feuilles épaisses, vert foncé, de forme elliptique et à l’apex un peu pointu, ainsi que de petits fruits rouges. On trouve environ 18 alcaloïdes différents dans les feuilles de la plante de coca, comme la cinnamoylcocaïne, la tropacocaïne, la méthylecgonine, la benzoylecgonine (BE) et la pseudotropine, qui sont tous nettement moins euphorisants et moins toxiques que la cocaïne (Figure 1).
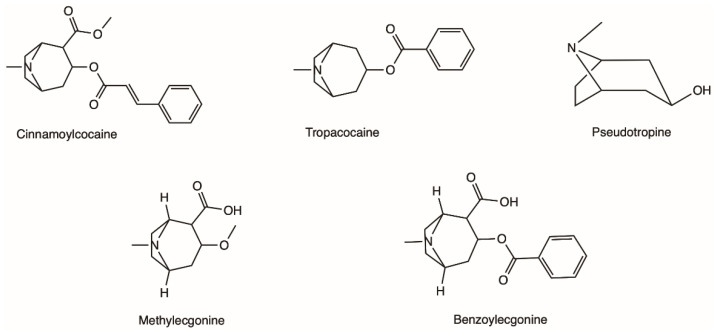
Exemples de différents alcaloïdes que l’on peut trouver dans les feuilles de la plante de coca.
Les feuilles de coca ont été traditionnellement utilisées par les populations indigènes des Andes et étaient/sont consommées principalement par mastication ; les feuilles de coca faisaient partie des occasions religieuses et autres célébrations des Incas, et étaient également utilisées à des fins médicinales. C’est à partir des feuilles de coca qu’Albert Niemann a isolé pour la première fois la cocaïne en 1859-1860. Une étude réalisée cent ans plus tard a montré que les feuilles sèches de E. coca var. coca contiennent environ 6,3 mg de cocaïne par gramme de matériel végétal.
Propriétés physico-chimiques de la cocaïne et méthodes analytiques d’identification
La cocaïne est un alcaloïde tropanique aux propriétés basiques faibles. Sous forme de base libre, la cocaïne est unie et insoluble en milieu aqueux, affichant un point d’ébullition de 187 °C ; tandis que son sel chlorhydrate ionisé se dissout facilement dans l’eau et présente une grande stabilité à des températures très élevées, de sorte qu’elle ne se volatilise pas dans la fumée. Le tableau 1 résume quelques-unes des propriétés physiques et chimiques de la cocaïne.
L’une des méthodes de détection de la cocaïne les plus utilisées est le test immunologique, une méthode rapide qui permet une évaluation qualitative présomptive de la drogue dans la matrice biologique testée (par exemple, le sang, l’urine). Cependant, comme ce type de test est sujet à un certain degré de faux positifs et de faux négatifs, une méthode quantitative de confirmation doit être employée par la suite. La cocaïne peut être détectée dans des matrices biologiques et non biologiques par des méthodes chromatographiques. Un certain nombre de rapports dans la littérature décrivent la détection de la cocaïne et de ses métabolites dans des échantillons d’urine humaine mais aussi dans le sang/plasma ou les cheveux. Une comparaison des méthodologies entre la chromatographie en phase gazeuse couplée à la spectrométrie de masse (GC-MS) et la chromatographie liquide à haute performance (HPLC) pour l’analyse de l’urine humaine a donné des résultats similaires. Cela a permis aux laboratoires de recourir à la CLHP pour l’examen des échantillons sans un prétraitement aussi exigeant. Kintz et al. ont décrit pour la première fois une méthode de GC-MS adaptée à l’identification simultanée du métabolite spécifique du “crack”, l’ester méthylique d’anhydroecgonine (AEME), ainsi que de la drogue mère, la cocaïne, et d’autres métabolites (BE, ester méthylique d’ecgonine (EME) et cocaéthylène (CE)) dans des échantillons de plasma, de salive, d’urine, de sueur et de cheveux. Cette méthode a été appliquée avec succès à des échantillons de 1 ml d’urine, de salive et de plasma, à 50 mg de cheveux et à de la sueur extraite d’un timbre transpirant, ce qui a permis d’obtenir des limites de détection pour l’AEME de 1 ng/ml pour les trois premières matrices (avec une plage de linéarité de 5 à 1500 ng/ml), de 0,1 ng/mg pour les cheveux (avec une plage de linéarité de 0,2 à 25 ng/mg) et de 0,5 ng/patch (avec une plage de linéarité de 2 à 100 ng/patch). Récemment, des recherches publiées par Fernandez et al. ont décrit une méthode validée pour la détection de la cocaïne et de plusieurs de ses métabolites dans 0,5 ml d’échantillons d’urine, en recourant à une simple étape de dérivatisation après une extraction en phase solide (SPE) – la méthode a atteint de faibles limites de quantification de 2,5 à 10 ng/mL en utilisant la GC-MS avec ionisation électronique. La chromatographie liquide couplée à la spectrométrie de masse en tandem (LC-MS/MS) a également été utilisée avec succès pour détecter la cocaïne et le BE dans l’urine et le liquide oral [41], tout comme la chromatographie liquide ultra-performante couplée à la spectrométrie de masse en tandem (UPLC-MS/MS) dans les échantillons de sang séché. Il convient de noter que la cocaïne dans les échantillons de sang/plasma peut subir une hydrolyse spontanée et enzymatique en son métabolite BE, si les échantillons ne sont pas traités avec un inhibiteur de la pseudocholinestérase (PChE), tel que le fluorure de sodium. Ainsi, les échantillons suspectés de contenir de la cocaïne doivent être ajustés à un pH de 5 avec de l’acide acétique et réfrigérés à 4 °C ou congelés pour augmenter la stabilité du médicament, bien qu’une certaine dégradation se produise au fil du temps, même à -20 °C.
Statut légal.
Depuis 1961, la Convention internationale unique sur les stupéfiants considère l’usage récréatif de la cocaïne comme un crime. Aux États-Unis, en 1970, le Comprehensive Drug Abuse Prevention and Control Act a établi la cocaïne comme une drogue de l’annexe II (une substance qui a un fort potentiel d’abus mais qui a un usage médical dans des cas spécifiques), une définition que la Drug Enforcement Administration (DEA) a conservée jusqu’à ce jour. L’État de l’Oregon est le seul État où, actuellement, la possession de cocaïne (et d’autres drogues) pour un usage personnel est dépénalisée pour des quantités inférieures à 2 g. Au Royaume-Uni, le Misuse of Drugs Act, promulgué en 1971, a rendu illégale la possession d’une drogue de classe A, telle que la cocaïne [46]. En Europe, la possession, la vente et le transport de cocaïne sont généralement illégaux, tout comme la culture de la plante de coca. Toutefois, la consommation de cocaïne fait l’objet de quelques exceptions légales, comme au Portugal, qui a dépénalisé la consommation des principales drogues illégales telles que le cannabis, la cocaïne et l’héroïne, dans la limite de la quantité seuil respective (également 2 g pour la cocaïne). Les Pays-Bas ont également mis en œuvre un modèle de décriminalisation en 1976, où aucune sanction juridique ou administrative ne s’applique en cas de possession d’une quelconque drogue (dans les limites du seuil de 0,5 g). En ce qui concerne les pays d’Amérique du Sud, la Bolivie a mis en place un régime de décriminalisation pour la possession et la culture de la feuille de coca, tandis que le Chili, la Colombie, le Pérou, l’Uruguay, le Paraguay et l’Argentine ont décriminalisé la possession de cocaïne lorsqu’il est prouvé qu’elle est destinée à un usage personnel et qu’elle atteint un certain seuil.
Prévalence, modes d’utilisation (ab) et problèmes de santé publique
Les données les plus récentes concernant la prévalence de la consommation de cocaïne montrent que, dans l’Union européenne, 1,2 % des adultes âgés de 15 à 64 ans ont consommé de la cocaïne au cours de l’année écoulée. En Amérique du Sud, le pourcentage d’usagers en 2019 était presque identique (1%) à celui observé en Europe pour la même tranche d’âge, tandis qu’en Amérique du Nord, la prévalence a augmenté à 2,1%. La cocaïne est produite principalement en Bolivie, en Colombie et au Pérou, et de là, elle fait l’objet d’un trafic vers des destinations intermédiaires ou finales. L’édition 2021 du Rapport mondial sur les drogues de l’Office des Nations unies contre la drogue et le crime (ONUDC) détaille que 1436 tonnes de cocaïne ont été saisies dans le monde en 2019, ce qui représente une augmentation de 9,6 % par rapport à l’année précédente, et que 83 % des saisies ont eu lieu dans les Amériques (Nord, Centre et Sud). De même, le rapport européen sur les drogues de 2021 informe d’un record de 213 tonnes saisies dans l’Union européenne en 2019, accompagné d’une augmentation de la pureté des produits et du nombre d’individus recherchant un traitement spécialisé pour abus de cocaïne.
En Europe, la majorité des usagers de cocaïne en quête de traitement sont des hommes d’un âge moyen de 35 ans, dont l’âge de la première consommation est en moyenne de 23 ans ; ils ont une fréquence de consommation de 2 à 6 jours par semaine ; et choisissent le sniff comme forme de prise. Les différences dans le niveau d’intégration sociale des consommateurs de cocaïne en poudre et de “crack” sont également détaillées dans le rapport mondial sur les drogues de l’ONUDC de 2021, bien que ces disparités se soient estompées ces dernières années. Les usagers ayant des conditions de vie et de travail stables ont des habitudes de consommation plus sporadiques, consommant la cocaïne dans des contextes de loisirs/de vie nocturne, ayant tendance à préférer la cocaïne en poudre et choisissant plus souvent la voie intranasale que les autres moyens. En revanche, les usagers dont les conditions de vie et d’emploi sont instables ont tendance à choisir le “crack”, à le consommer par inhalation et à avoir un mode de consommation plus fréquent que le premier groupe d’usagers. En fait, la consommation de “crack” est plus susceptible d’entraîner une consommation chronique et importante, car elle est souvent associée à des groupes sociaux spécifiques (par exemple, les sans-abri, les travailleurs du sexe) et à la violence systémique. La polytoxicomanie est une pratique fréquente dans les deux sous-groupes de consommateurs de cocaïne ; toutefois, elle est plus courante dans le second groupe que dans le premier, en particulier avec l’alcool et l’héroïne (voir section “Polytoxicomanie”), mais aussi avec la nicotine et les cannabinoïdes.
Aux États-Unis, selon les données recueillies depuis l’année 2011, rapportées par la Substance Abuse and Mental Health Services Administration, la cocaïne était la drogue la plus courante ayant donné lieu à un traitement hospitalier, avec 505 224 visites dans les services d’urgence (40,3 % de toutes les visites liées à la drogue rapportées), ce qui se traduit par un taux de 162 visites pour 100 000 individus. Un rapport spécialisé 2021 de l’OEDT concernant les décès liés à la drogue en Europe indique qu’il y a eu une augmentation de la consommation de chlorhydrate de cocaïne par voie intraveineuse, ainsi que de la consommation de “crack” par voie intraveineuse, ce qui se traduit par une augmentation des visites aux services d’urgence et des décès liés à la cocaïne, le nombre de décès augmentant d’année en année.
Pharmacocinétique.
Absorption
Comme mentionné précédemment, la forme de cocaïne choisie par l’usager (sel de cocaïne ou base libre), la voie d’administration et les habitudes de consommation varient. En raison de son hydrophilie, le chlorhydrate de cocaïne est généralement consommé par “sniffage”. Le crack est généralement la seule forme de cocaïne qui est fumée – ceci est dû au fait que le chlorhydrate de cocaïne a un point d’ébullition élevé et ne se vaporise pas aux températures de combustion. Ces voies qui impliquent le système respiratoire ont tendance à être privilégiées pour les deux formes de cocaïne, car elles permettent au stimulant d’atteindre la circulation cérébrale en 6 à 8 s environ ; la voie d’inhalation présente des pics de concentration plasmatique plus élevés qui sont atteints plus rapidement par rapport à l’administration intranasale. Il faut noter que, pour la voie intranasale, les propriétés vasoconstrictrices de la cocaïne ralentissent la propre absorption du médicament, entraînant un retard de 60 minutes du pic des concentrations plasmatiques. En termes de biodisponibilité, la voie d’inhalation présente la plus grande biodisponibilité, qui dépasse 90 %, tandis que la voie intranasale présente environ 80 %. En ce qui concerne le temps nécessaire pour atteindre le pic d’effet et la durée d’action, l’inhalation produit une stimulation maximale dans les 1 à 3 minutes suivant l’administration, le stimulus durant entre 5 et 15 minutes. La voie intranasale détermine un effet plus long, compris entre 15 et 30 minutes.
L’administration intraveineuse de chlorhydrate de cocaïne, par dissolution de la poudre dans un milieu aqueux, est également utilisée par les consommateurs. Par rapport aux voies inhalée et intranasale, lorsque la cocaïne est administrée par voie intraveineuse, elle met deux fois plus de temps à atteindre la circulation cérébrale et les concentrations plasmatiques maximales sont plus élevées et atteintes plus rapidement. La biodisponibilité est plus proche de celle de la voie inhalée [24]. En 1995, Edward Cone a publié une étude comparant directement la pharmacocinétique de la cocaïne par inhalation, intranasale et intraveineuse (à 42 mg de cocaïne “crack”, 32 mg de chlorhydrate de cocaïne et 25 mg de chlorhydrate de cocaïne, respectivement) en utilisant les mêmes sujets pour les différentes voies (plan croisé), et a conclu que les concentrations plasmatiques maximales étaient atteintes en 5 minutes par injection intraveineuse et inhalation, alors que la voie intranasale prenait environ 50 minutes.
Le chlorhydrate de cocaïne peut également être administré par voie orale ou appliqué sur les muqueuses de la bouche, du vagin ou du rectum. L’administration orale est associée à la plus faible biodisponibilité, présentant une absorption plus lente et plus erratique. Le faible degré de biodisponibilité s’explique dans ce cas par la dégradation gastrique et le métabolisme intestinal. Cette voie d’administration est souvent associée à une apparition tardive des effets, présentant la durée d’effet la plus longue (entre 1 et 2 h).
La mastication de coca, en tant que méthode alternative pour consommer la cocaïne, favorise grandement l’absorption sublinguale. Cependant, cela se traduit par des doses plus faibles de la drogue par rapport à l’utilisation de poudre de cocaïne ; alors que la dose totale maximale de cocaïne sur 24 heures atteinte en mâchant des feuilles de coca se situe autour de 200-300 mg (et étant donné que l’absorption de la cocaïne ne sera pas de 100%, la valeur réelle sera certainement beaucoup plus faible), la “ligne” moyenne de chlorhydrate de cocaïne contient entre 20 et 50 mg de la drogue, et les utilisateurs “sniffent” fréquemment plusieurs “lignes” en une seule séance. Ainsi, la dose de cocaïne administrée par les usagers au cours d’une séance récréative peut être considérablement plus importante et la concentration de drogue dans le sang total près de 50 fois plus élevée [21]. Holmstedt et al. ont rapporté que la mastication de feuilles de coca en poudre (7-20 g) contenant 17-48 mg de cocaïne, a donné lieu à des concentrations plasmatiques maximales de 11-139 ng/mL de cocaïne en 0,4-2 h. De plus, dans deux cas rapportés d’utilisation sublinguale de cocaïne HCl (après neutralisation avec du bicarbonate pour augmenter son absorption et réduire l’acidité), un début d’action plus lent, un pic d’effet plus tardif et une durée d’action plus longue ont été décrits par rapport à la voie intraveineuse. Une autre façon de consommer les feuilles de coca est de préparer des thés. Jenkins et al. ont rapporté que les sachets de thé contenant en moyenne 4,86 mg (feuilles de Bolivie) et 5,11 mg (feuilles du Pérou) de cocaïne par sachet, une fois infusés, produisaient des thés contenant 4,29 mg et 4,14 mg de cocaïne, respectivement.
Distribution
La cocaïne a une élimination rapide vers les tissus, avec un volume de distribution compris entre 1 et 3 L/Kg. La cocaïne se lie à l’albumine et à l’α1-glycoprotéine acide à un taux d’environ 90 % et peut être trouvée aux concentrations les plus élevées dans le cerveau, la rate, les reins et les poumons, suivis par le sang, le cœur et les tissus musculaires. La demi-vie moyenne de la cocaïne est comprise entre 40 et 90 min, pouvant varier en fonction de la voie d’administration (plus courte pour la voie intraveineuse, plus longue pour l’insufflation).
Métabolisme
La cocaïne produit deux métabolites principaux : EME et BE, qui peuvent tous deux subir une hydrolyse supplémentaire en ecgonine (EC). L’EME est un métabolite pharmacologiquement inactif formé dans le plasma et dans le foie par l’action de la PChE et de la carboxylestérase de type 2 (hCE2), respectivement. L’autre principal métabolite inactif de la cocaïne pour toutes les voies d’administration, le BE, peut être formé spontanément à un pH physiologique ou dans le foie par la hCE1. La cocaïne peut également subir une N-déméthylation par l’enzyme CYP3A4 du cytochrome P450 (CYP), générant la norcocaïne (NCOC), un métabolite hautement hépatotoxique capable de traverser la barrière hémato-encéphalique (BHE). La NCOC représente environ 5 % de la cocaïne absorbée et a été décrite comme un anesthésique local plus puissant et plus efficace pour inhiber le captage de la noradrénaline par les synaptosomes du cerveau que la drogue mère. La BE et l’EME peuvent subir une N-déméthylation supplémentaire par le CYP, produisant respectivement de la norbenzoylecgonine (NBE) et de l’ester méthylique de norécgonine (NEME). D’autres métabolites mineurs sont la méta-hydroxybenzoylecgonine (m-OH-BE), la para-hydroxybenzoylecgonine (p-OH-BE), la méta-hydroxycocaïne (m-OH-COC), l’ecgonidine (ED) et l’ester méthylique de la norécgonidine (NEDME). La figure 2 résume les voies métaboliques de la cocaïne.
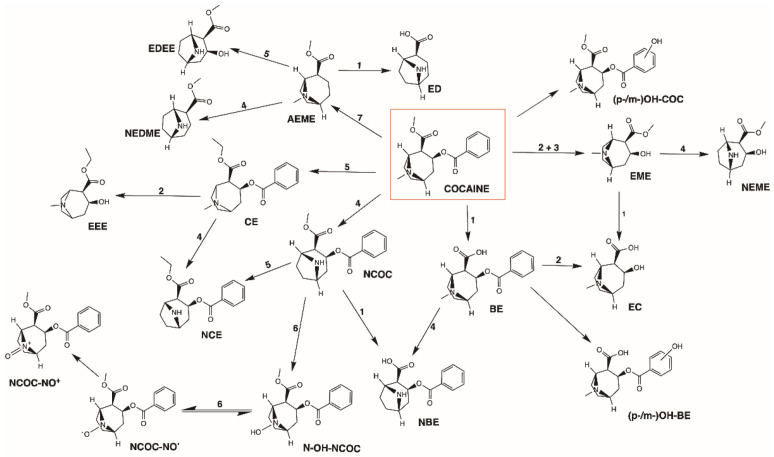
Voies métaboliques de la cocaïne. La cocaïne est principalement métabolisée par hydrolyse en benzoylecgonine (BE) et en ester méthylique d’ecgonine (EME), qui peuvent tous deux être hydrolysés en ecgonine (EC). La cocaïne peut également subir une hydroxylation pour donner de la para-/méta-hydroxycocaïne (p-/m-OH-COC). Une autre réaction métabolique mineure est la N-déméthylation de la cocaïne en norcocaïne (NCOC). En présence d’éthanol (EtOH), la cocaïne subit une transestérification et forme du cocaéthylène (CE). AEME, ester méthylique d’anhydroecgonine ; CYP450, cytochrome P450 ; ED, ecgonidine ; EDEE, ester éthylique d’ecgonidine ; EEE, ester éthylique d’ecgonine ; FADM, monooxygénase contenant de la flavine adénine dinucléotide ; hCE1, carboxylestérase humaine de type 1 ; hCE2, carboxylestérase humaine de type 2 ; NBE, norbenzoylecgonine ; NCE, norcocaéthylène ; NCOC-NO-, nitroxyde de norcocaïne ; NCOC-NO+, nitrosonium de norcocaïne ; NEDME, ester méthylique de norécgonidine ; NEME, ester méthylique de norécgonine ; N-OH-NCOC, N-hydroxy-norcocaïne ; (p-/m-)OH-BE, (para-/méta-)hydroxybenzoylecgonine ; PChE, pseudocholinestérase.
Il est particulièrement important de noter que la co-consommation de cocaïne et d’alcool entraîne la formation de CE, un produit de transestérification des deux drogues. Il est intéressant de noter qu’il n’est produit in vivo que par la catalyse de la hCE1. Harris et al. ont réalisé une étude dans laquelle 10 sujets humains ont reçu des administrations intraveineuses de cocaïne (à 0,3, 0,6 et 1,2 mg/Kg) et une dose orale unique d’éthanol (à 1 g/Kg), 1 heure avant la prise de cocaïne. Ils ont démontré que 17% de la dose de cocaïne intraveineuse était convertie en CE et que l’ingestion d’éthanol diminuait les niveaux urinaires de CE. Une autre étude, portant sur 10 cocaïnomanes expérimentés, a démontré que le pourcentage d’EC provenant de l’administration orale de cocaïne était plus important que celui produit par l’administration intraveineuse et l’inhalation (34 ± 20 % contre 24 ± 11 % et 18 ± 11 %, respectivement). Le CE est un métabolite actif qui présente une activité pharmacologique, avec une demi-vie moyenne plus longue (148 ± 15 min) que la cocaïne. Certaines études rapportent qu’il peut être plus mortel et induire des réactions toxiques aiguës plus graves, produisant également une plus grande augmentation de la fréquence cardiaque, comparé à la cocaïne. Le CE est utilisé comme biomarqueur de la consommation concomitante d’alcool et de cocaïne, qui peut être détecté soit dans l’urine pour déterminer une consommation récente, soit dans les cheveux pour une exposition chronique.
Fumer du “crack” conduit à la formation d’un autre biomarqueur d’exposition, l’AEME, qui est le principal produit de la dégradation thermique de la cocaïne. Des études in vitro et in vivo montrent que l’AEME semble avoir des effets sur le système cardiovasculaire, en agissant comme un agoniste muscarinique. En outre, des effets neurotoxiques ont également été signalés pour ce métabolite. L’AEME peut être hydrolysé par la hCE1 en ED, ou en ester éthylique d’ecgonidine (EDEE) en présence d’alcool. La détermination de l’AEME et de l’ED dans différents fluides biologiques a été proposée comme biomarqueur pour la consommation de “crack”. L’application de la méthode analytique de Kintz et al. à des échantillons d’authentiques consommateurs de “crack” a permis d’identifier l’AEME dans l’urine (90 échantillons ; gamme de concentration 5-1477 ng/mL), la sueur (1 cas de surdose ; 53 ng/patch), la salive (1 cas de surdose ; 5-18 ng/mL), les cheveux (32 échantillons, y compris des cheveux de fœtus ; gamme de concentration 0,20-21,56 ng/mg), mais pas dans le sang. L’EDEE a également été suggérée comme un marqueur médico-légal supplémentaire possible pour la situation particulière de la co-consommation de crack et d’éthanol.
Excrétion
Après le métabolisme, la cocaïne et ses principaux métabolites sont excrétés dans l’urine. L’EME et le BE constituent les principaux produits d’excrétion, quelle que soit la voie d’administration (intraveineuse, inhalation et intranasale). De plus, environ 1 à 3 % des produits métaboliques de la cocaïne excrétés dans les urines sont ceux résultant de la N-déméthylation en une base de norécgonine, comme le NBE, en plus du CE. Un sujet ayant bu une tasse de thé péruvien (4,14 mg de cocaïne) ou bolivien (4,29 mg de cocaïne) avait, dans ses urines, une concentration de BE de 3940 ng/mL et 4979 ng/mL, respectivement 10 et 3,5 h après l’ingestion.
Huestis et al. ont réalisé une étude sur 6 sujets humains, dans laquelle ils ont examiné le profil d’excrétion urinaire de la cocaïne et de certains métabolites (BE, EME, m-OH-BE, p-OH-BE, NBE et EC), après avoir fumé. Cette étude a démontré une augmentation dose-dépendante de la concentration maximale (Cmax) de tous les analytes, tandis que le paramètre Time-to-Maximum (Tmax) n’a pas montré de proportionnalité directe. Parmi les métabolites, l’EME a présenté le temps de détection le plus long (jusqu’à 164 h après une dose de 40 mg). Un autre travail du même groupe a évalué l’excrétion urinaire de l’ecgonine et de cinq autres métabolites (BE, EME, m-OH-BE, p-OH-BE, NBE) après des administrations contrôlées de cocaïne par inhalation, par voie orale, par voie intraveineuse et par voie intranasale, démontrant que la voie d’administration n’a pas d’impact significatif sur la Cmax ou le Tmax. Au contraire, Cone et al. ont réalisé une étude chez 6 volontaires sains de sexe masculin à qui l’on a administré des doses presque équivalentes de cocaïne par voie intraveineuse, par fumage et par voie intranasale, et ont démontré que les demi-vies d’élimination de la cocaïne et de ses métabolites (BE, EME, NCOC, NBE, m-OH-BE, p-OH-BE, m-OH-COC et para-hydroxycocaïne) étaient généralement plus rapides en cas d’inhalation, intermédiaires en cas d’administration intraveineuse et les plus longues après une administration intranasale.
Pharmacodynamique
La cocaïne possède différentes propriétés pharmacodynamiques qui rendent possible son utilisation comme anesthésique local et comme stimulant sympathomimétique au niveau du système nerveux central (SNC).
L’action anesthésique de la cocaïne est liée à sa capacité à bloquer les canaux sodiques voltage-gated en stabilisant ces canaux dans un état inactif (Figure 3). La liaison de la cocaïne au pore du canal empêche le sodium de circuler dans les cellules, bloquant ainsi le processus de dépolarisation et la propagation des impulsions électriques. L’utilisation médicale actuelle est très limitée car la plupart des pays la considèrent comme obsolète. Il peut encore être utilisé comme anesthésique topique, ce qui pourrait être particulièrement utile pour la chirurgie endoscopique des sinus, étant donné ses effets vasoconstricteurs. Il existe cependant des controverses liées à l’apparition de morbidités légères, telles que l’hypertension et la tachycardie.
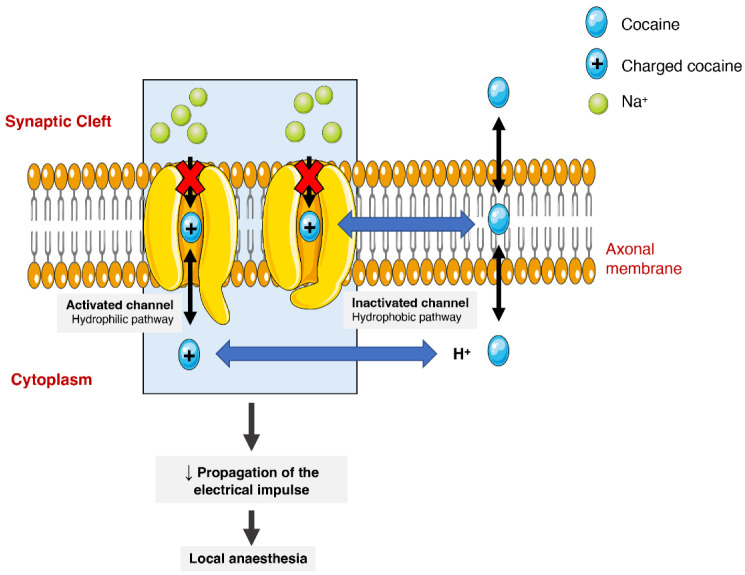
Représentation schématique de l’interaction de la cocaïne avec les canaux sodiques voltage-dépendants. La cocaïne pénètre dans les canaux et s’y lie par deux voies (hydrophile et hydrophobe). Dans la voie hydrophobe, la cocaïne interagit avec le canal sodique au niveau de la membrane, alternativement dans la voie hydrophile, la cocaïne est ionisée dans le cytoplasme avant l’interaction. Dans les deux cas, le flux de sodium est bloqué, ce qui diminue la propagation des impulsions électriques et provoque un effet anesthésique local.
D’autre part, les effets psychoactifs et sympathomimétiques de la cocaïne proviennent du blocage des transporteurs présynaptiques responsables de la recapture de la sérotonine, de la noradrénaline et de la dopamine. Dans le cas de cette dernière, le blocage du transporteur présynaptique de la dopamine (DAT) dans la fente synaptique provoque une augmentation extracellulaire de la dopamine avec une surstimulation des récepteurs postsynaptiques dopaminergiques, induisant le “rush” euphorique. D’autres mécanismes de tolérance à ce niveau sont responsables de la chute ultérieure des niveaux de dopamine, vécue comme un “crash” dysphorique. Une récente méta-analyse a montré que les consommateurs chroniques de cocaïne présentent une réduction significative des récepteurs de dopamine D2 et D3 dans le striatum, les régions cérébrales caudate et putamen, ainsi qu’une disponibilité significativement accrue de la DAT dans tout le striatum.
La consommation de cocaïne entraîne une activité dopaminergique exacerbée le long des voies mésocorticolimbiques. Les neurones de ces voies sont situés dans l’aire tegmentale ventrale et se projettent vers d’autres endroits du cerveau, notamment le noyau accumbens. Cela pourrait expliquer pourquoi la drogue a un tel potentiel addictif, car il est bien connu que le noyau accumbens peut jouer un rôle important dans les propriétés de récompense et de dépendance de la cocaïne et d’autres drogues. Cependant, il faut mentionner que la capacité de la cocaïne à augmenter l’activité sérotoninergique (qui peut provoquer des crises) pourrait également contribuer au potentiel addictif de la drogue. La figure 4 représente schématiquement l’action pharmacodynamique de la cocaïne sur le système monoaminergique.
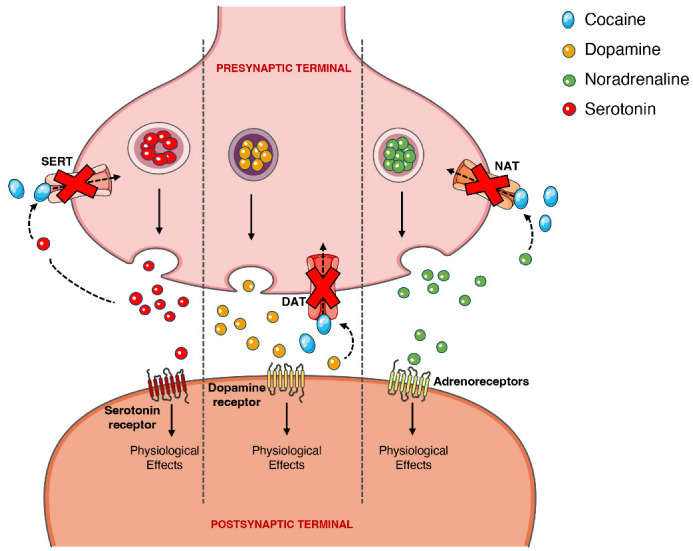
Représentation schématique de la pharmacodynamique de la cocaïne au niveau de la synapse noradrénergique, sérotonergique ou dopaminergique. La cocaïne agit en bloquant les transporteurs présynaptiques de la dopamine, de la sérotonine et de la noradrénaline, empêchant ainsi la recapture des neurotransmetteurs dans le terminal présynaptique, ce qui provoquera une stimulation intense et prolongée des récepteurs postsynaptiques. DAT, transporteur de dopamine ; NAT, transporteur de noradrénaline ; SERT, transporteur de sérotonine.
Les propriétés sympathomimétiques de la cocaïne sont liées à l’inhibition susmentionnée de la recapture de la noradrénaline par le transporteur de noradrénaline (NAT). Étant donné que la cocaïne empêche la recapture de la noradrénaline et augmente ainsi sa disponibilité, il y aura une augmentation de la stimulation des récepteurs α- et β-adrénergiques et une réponse adrénergique accrue, ce qui est lié aux propriétés vasoconstrictives marquées de la drogue (responsable de quelques-uns des effets cardiotoxiques).
De plus, la cocaïne a également la capacité de cibler directement les récepteurs adrénergiques, les récepteurs N-méthyl-D-aspartate (NMDA) et les récepteurs opioïdes sigma et kappa. La cocaïne agit sur les récepteurs NMDA, puisque l’exposition à la drogue module (plus ou moins) l’expression des sous-unités des récepteurs, modifie la distribution des récepteurs dans la synapse et influence la diaphonie du récepteur NMDA avec le récepteur dopaminergique D1, dans différentes zones du cerveau, par exemple, le noyau accumbens, l’aire tegmentale ventrale et le cortex préfrontal [84]. Enfin, la cocaïne agit directement sur les récepteurs opioïdes sigma, en se liant avec une plus grande affinité au récepteur σ1 qu’au récepteur σ2 ; l’agonisme du σ1 par la cocaïne est partiellement responsable de l’hyperlocomotion et des crises, et ces récepteurs sont primordiaux dans l’établissement de la préférence de place conditionnée induite par la cocaïne chez les souris.
Récemment, il a été suggéré que l’action pharmacologique de la cocaïne sur le DAT pourrait ne pas être aussi simple que la seule inhibition de la fonction de recaptage du transporteur, car son comportement est distinct de celui d’autres inhibiteurs du DAT de puissance égale ou supérieure (avec une capacité équivalente à traverser la BHE) et ressemble à celui du méthylphénidate (un inhibiteur du recaptage de la noradrénaline et de la dopamine qui induit également la libération de dopamine synaptique). Il a donc été supposé que, comme les amphétamines, la cocaïne fonctionne comme un modulateur allostérique négatif de la DAT (c’est-à-dire un “agoniste inverse” de la DAT), modifiant la fonction du transporteur et inversant la direction du transport. Cependant, des recherches supplémentaires sont nécessaires dans ce domaine pour clarifier davantage la pharmacodynamique de la cocaïne.
Effets et toxicité de la cocaïne
La DL50 de la cocaïne a déjà été déterminée dans quelques études utilisant différents modèles animaux : chez la souris, par administration intrapéritonéale, elle a été évaluée à 95,1 mg/Kg [1] ; chez le rat et le chien, par voie intraveineuse, les valeurs étaient respectivement de 17,5 et 21 mg/Kg.
Comme indiqué précédemment, la cocaïne cible le SNC, induisant une myriade d’effets physiques, psychologiques et comportementaux, qui dépendent intrinsèquement du profil de l’usager, de la voie d’administration et de la dose. Si bon nombre des effets pathologiques graves induits par la cocaïne peuvent être attribués à un mode de consommation chronique (par exemple, neurodégénérescence, vieillissement prématuré du cerveau, dépression, lésions des vaisseaux sanguins), certains effets, tels que la tachycardie, l’hypertension, l’hyperthermie, la diaphorèse, les tremblements, les crises, la mydriase, les maux de tête, les douleurs abdominales, l’hyperactivité musculaire, l’accident vasculaire cérébral hémorragique et la défaillance de plusieurs organes, apparaissent avec des modes d’abus aigus (trop souvent, même après une seule dose). Il est important de garder à l’esprit que certains métabolites de la cocaïne conservent la capacité de traverser la BHE, contribuant ainsi à la fois aux effets désirables et aux réactions indésirables/toxiques rapportés par les usagers.
Effets subjectifs et physiologiques
Des doses modérées de cocaïne induisent une euphorie, améliorent la vigilance et la concentration, augmentent la libido, favorisent une sensation générale de bien-être et réduisent la fatigue et l’appétit. Ces effets s’accompagnent toutefois d’insomnie, d’anxiété, d’irritabilité, de dysphorie et de comportement impulsif – les effets moins désirables peuvent ne pas être remarqués immédiatement et peuvent augmenter en fréquence avec la poursuite de la consommation. Les effets physiologiques caractéristiques de la cocaïne comprennent ceux de nature cardiovasculaire, tels que la vasoconstriction, la tachycardie et l’hypertension. En outre, l’hyperthermie, la diaphorèse, les tremblements et les crises, la mydriase, les maux de tête, les douleurs abdominales et l’hyperactivité musculaire peuvent également survenir, compromettant encore plus la santé de l’usager et pouvant conduire à des convulsions et/ou à une défaillance cardiovasculaire et respiratoire.
Hyperthermie
L’usage de la cocaïne est associé à l’hyperthermie, qui représente l’un des aspects les plus pertinents sur le plan clinique de la toxicité des drogues, car la température corporelle élevée peut provoquer une coagulation intravasculaire disséminée, une rhabdomyolyse et d’autres événements toxiques multi-organes (“infarctus de chaleur”). En fait, l’hyperthermie induite par la cocaïne potentialise le risque de décès de l’usager à des concentrations plasmatiques 10 à 20 fois inférieures au niveau moyen mortel (~6 mg/L). L’hyperactivité induite par la cocaïne entraîne une augmentation supplémentaire de la température corporelle ; en outre, l’effet vasoconstricteur de la drogue contribue également à une augmentation généralisée de la température corporelle de l’usager, en limitant le flux sanguin dermique et en altérant la dissipation de la chaleur. On suppose que l’activation des récepteurs dopaminergiques et sérotoninergiques contribue aux effets hyperthermiques de la cocaïne : Dans un travail récemment publié, l’antipsychotique dopaminergique-sérotoninergique rispéridone, les antagonistes des récepteurs de la sérotonine 2A ritanserine et kétanserine, ainsi que l’antagoniste dopaminergique sélectif halopéridol et l’antagoniste sélectif D1 SCH23390 ont été capables d’inverser l’hyperthermie induite par la cocaïne chez les rats Wistar administrés par voie intrapéritonéale avec une dose de 30 mg/Kg. Ces mêmes travaux ont en outre démontré que le bolus de cocaïne augmentait les niveaux de dopamine, de noradrénaline et de sérotonine dans le centre thermorégulateur hypothalamique de l’organisme, entraînant une altération du point de consigne de la température corporelle et un déséquilibre des mécanismes de production et de dissipation de la chaleur. De plus, la co-consommation fréquente d’alcool et de cocaïne contribue à la déshydratation et à la diminution de la production de sueur, ce qui ajoute à la difficulté de maintenir la température du corps régulée], ce qui est encore aggravé par le contexte de consommation (par exemple, la drogue est souvent consommée dans des lieux bondés et chauds, associés à la danse continue sans repos ni réhydratation suffisants).
Système cardiovasculaire
Le système cardiovasculaire est particulièrement sensible à la toxicité de la cocaïne. Les manifestations cardiovasculaires typiques liées à la consommation de cocaïne sont l’hypertension, la tachycardie et l’ischémie, mais des conséquences plus graves sont également fréquentes. Elles comprennent l’infarctus aigu du myocarde, les dysrythmies, l’anévrisme, l’athérosclérose accélérée, la cardiomyopathie, la diminution de la fonction ventriculaire gauche et l’insuffisance cardiaque.
La littérature fait état de nombreux mécanismes pour expliquer la toxicité de la cocaïne au niveau cardiovasculaire. Tout d’abord, en interférant avec la recapture des catécholamines et en agissant indirectement sur les récepteurs α- et β-adrénergiques, la cocaïne peut induire une vasoconstriction des artères coronaires et augmenter de façon marquée les besoins en oxygène en accélérant la fréquence cardiaque et en stimulant la contractilité du cœur. De plus, l’augmentation induite de l’endothéline-1 (un vasoconstricteur) et la réduction de la production d’oxyde nitrique (un vasodilatateur) créent un déséquilibre qui favorise la vasoconstriction [96]. Par conséquent, l’apport d’oxygène aux tissus diminue, ce qui peut entraîner une ischémie myocardique et un infarctus aigu du myocarde (figure 5).
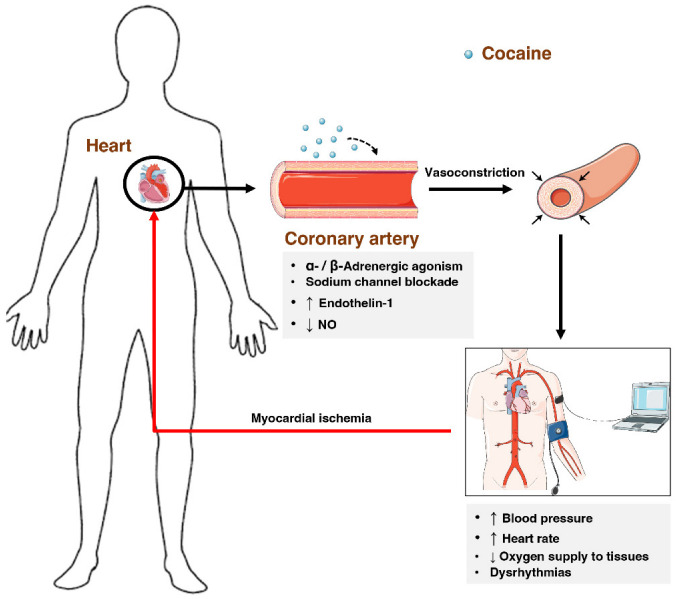
Influence de la cocaïne sur le système cardiovasculaire. La cocaïne favorise la vasoconstriction, par agonisme indirect des récepteurs α-/β-adrénergiques, blocage des canaux sodiques voltage-gated, et augmentation de l’endothéline-1 et diminution de l’oxyde nitrique. Ces facteurs vont augmenter la fréquence cardiaque et la pression artérielle, diminuer l’apport d’oxygène aux tissus, et finalement induire des dysrythmies.
Comme mentionné précédemment, le médicament a la capacité de bloquer les canaux sodiques voltage-dépendants du nerf, empêchant ainsi la conduction de l’influx nerveux. Ce blocage compromet la conduction intracardiaque du signal, ce qui se traduit par un intervalle QRS prolongé, entraînant une dysrythmie. De plus, un retard dans la dépolarisation ventriculaire s’ensuit, entraînant finalement une diminution de la fonction ventriculaire gauche. De plus, l’inhibition des courants sodiques pourrait conduire à une distorsion des échanges extra-intracellulaires sodium-calcium avec une diminution ultérieure de la contractilité des cardiomyocytes, en raison des faibles concentrations cytosoliques de calcium des cardiomyocytes (Figure 3).
La génération d’espèces réactives de l’oxygène (ERO) et de produits d’oxydation tels que les aminochromes et les radicaux libres, due au métabolisme oxydatif des catécholamines, peut également contribuer à la cardiotoxicité, car les augmentations du stress oxydatif ont été liées à l’apoptose et au dysfonctionnement cellulaire dans le coeur.
Le système respiratoire
Le système respiratoire est également vulnérable aux effets de la cocaïne. La littérature existante détaille que l’inhalation de ‘crack’ induit des altérations aiguës des voies respiratoires, ce qui ne se produit pas lorsque la même dose de drogue est administrée par voie intraveineuse. Les complications respiratoires associées à la consommation de cocaïne sont, par exemple, la bronchoconstriction, le pneumothorax, le pneumomédiastin, l’hémorragie pulmonaire, l’œdème pulmonaire non cardiogénique, l’exacerbation de l’asthme, entre autres. Ces effets ne sont pas seulement dus à un effet irritant local qui induit un bronchospasme, mais résultent également de l’exposition des poumons à la vapeur de cocaïne avec des produits toxiques dérivés de la pyrolyse de la cocaïne (par exemple, l’AEME), des impuretés, des adultérants du “crack” (tels que la caféine, la lidocaïne et la prilocaïne) et des produits de combustion.
Les propriétés vasoconstrictrices de la cocaïne affectent également le système respiratoire, notamment au niveau nasal en cas d’administration intranasale. La lésion destructrice de la ligne médiane induite par la cocaïne se produit en raison de la vasoconstriction continue à laquelle sont soumis les vaisseaux de la muqueuse nasale lorsque les consommateurs “sniffent” la cocaïne. La vasoconstriction prolongée des tissus entraîne le développement d’une ischémie qui, associée au processus inflammatoire, aboutit finalement à la perforation des cloisons nasales.
Le “poumon du crack” est un syndrome pulmonaire aigu caractéristique des personnes qui choisissent de fumer comme voie d’administration préférée de la cocaïne. Un cas typique de “crack lung” se manifeste par des douleurs thoraciques, de la fièvre, une hémoptysie et une hypoxémie associées à des infiltrats pulmonaires aigus. De plus, le poumon peut avoir un aspect anthracite dû à l’accumulation de carbone dans les macrophages et les sécrétions expectorées peuvent être noires.
Tous les mécanismes impliqués dans les altérations pulmonaires ne sont pas entièrement connus. Cependant, le système vasculaire pulmonaire présente des récepteurs adrénergiques qui peuvent être activés par une activité excessive des catécholamines. Alors que la stimulation des récepteurs α1-adrénergiques est liée à la contraction des capillaires bronchiques, l’activation des récepteurs β2-adrénergiques induit une dilatation des muscles bronchiques. A noter qu’un œdème pulmonaire non cardiogénique peut survenir en raison d’une atteinte de l’endothélium des vaisseaux pulmonaires, qui va également augmenter leur perméabilité.
Système rénal
La cocaïne peut induire une insuffisance rénale aiguë, en particulier en cas d’abus chronique. De nombreux facteurs peuvent être à l’origine de lésions rénales liées à la cocaïne, notamment le stress oxydatif, l’athérogenèse rénale, les modifications de la synthèse de la matrice glomérulaire et les changements hémodynamiques locaux. En outre, la rhabdomyolyse, l’infarctus rénal, la vasculite, la néphrite interstitielle aiguë, la microangiopathie thrombotique et l’hypertension maligne sont également des causes souvent associées. Chacun de ces événements a des causes sous-jacentes. Le développement de la rhabdomyolyse peut se produire : (1) en réponse à l’hyperthermie avec libération ultérieure de myoglobine qui peut provoquer une cytotoxicité dans les cellules rénales entraînant une nécrose tubulaire aiguë ; (2) en conséquence des effets vasoconstricteurs du médicament provoquant une ischémie et une nécrose musculaires ; (3) par toxicité directe entraînant une dégénérescence myofibrillaire squelettique ; la formation de radicaux libres peut également y contribuer. L’infarctus du rein est lié à une augmentation de la production de thromboxane, de l’agrégation plaquettaire, de la vasoconstriction et de l’accumulation de matrice.
Quelques études ont exploré les mécanismes de néphrotoxicité de la cocaïne au niveau cellulaire. Dans des cultures primaires de cellules épithéliales du tube proximal humain, la cocaïne à 5 mM (une dose extrêmement élevée que l’on ne trouve probablement pas dans l’organisme des consommateurs) a provoqué une diminution de la viabilité cellulaire après 48 heures d’exposition et a eu un impact sur l’adénosine triphosphate (ATP) intracellulaire, tandis que 0,5 mM a suffi à diminuer les niveaux de glutathion réduit (GSH). De plus, cette même étude a démontré que des concentrations de cocaïne comprises entre 0,1 et 2,5 mM induisaient une augmentation des cellules apoptotiques, et que des cellules nécrotiques apparaissaient après une exposition à 5 mM de cocaïne. Une étude in vivo, dans laquelle des souris ont reçu 60 mg/Kg de cocaïne par voie intraveineuse par jour, a rapporté des augmentations du stress oxydatif démontrées par plusieurs résultats tels qu’une peroxydation lipidique et une oxydation des protéines accrues, une diminution du rapport glutathion réduit/oxydé, une activité réduite de la glutathion réductase et de la peroxydase et une augmentation de l’activité de la superoxyde dismutase (SOD), ainsi que des changements dans l’expression des protéines anti- et pro-apoptotiques. Des modifications histopathologiques telles qu’une nécrose tubulaire focale, une hémorragie et une congestion, une vacuolisation de l’épithélium tubulaire, une infiltration de cellules mononucléaires interstitielles et une lésion tubulo-interstitielle plus importante ont été observées. Une étude récente explorant le métabolisme de la cystéine chez des rats s’étant auto-administrés de la cocaïne a révélé que 185 mg/Kg de cocaïne (par voie intraveineuse) entraînait une augmentation des espèces de soufre réactives dans les reins, qui restait significativement élevée après 10 jours d’abstinence, ce qui indique que la cocaïne a déplacé le métabolisme de la cystéine vers une voie anaérobie. Le même groupe de recherche a publié un travail antérieur dans lequel des rats auxquels on avait administré 10 mg/Kg de cocaïne ont également modifié le métabolisme de la cystéine – une dose unique de cocaïne a entraîné une augmentation de l’ensemble des sulfures de sulfane, une diminution des sulfures de sulfane liés et des niveaux de ROS et de glutathion-S-transférase, tandis qu’un régime de doses répétées (5 jours) a provoqué une diminution du sulfure d’hydrogène et une augmentation de l’ensemble des sulfures de sulfane et de la peroxydation lipidique.
Cerveau
La consommation de cocaïne et de crack a également une myriade de répercussions sur le cerveau. La consommation de ces drogues est associée à la survenue d’accidents vasculaires cérébraux ischémiques et hémorragiques, l’augmentation de la pression artérielle étant le principal responsable, bien que les interférences avec les paramètres hématologiques normaux induits par la cocaïne puissent également jouer un rôle. L’apparition d’hémorragies intracrâniennes et sous-arachnoïdiennes est également liée à l’augmentation dérégulée de la pression artérielle. En raison de l’augmentation de la pression artérielle, ainsi que de l’effet de la cocaïne sur les systèmes sérotoninergiques et dopaminergiques, les maux de tête sont également fréquents. Les crises d’épilepsie sont également fréquentes. Elles surviennent non seulement chez les consommateurs chroniques mais aussi après une seule dose, car la cocaïne a la capacité d’abaisser le seuil des crises, par une stimulation chronique de faible intensité du système limbique (kindling). Le blocage de la noradrénaline par la cocaïne est également un facteur contribuant à cette augmentation de la fréquence des crises. Il est à noter qu’un travail récent a déterminé que l’effet d’embrasement de la cocaïne, qui est lié à une augmentation significative de l’expression de p53 dans le cerveau, peut être atténué par une déplétion génétique de p53.
Des études in vivo et in vitro ont également montré que la cocaïne a un potentiel neurotoxique. Cunha-Oliveira et al. ont constaté que 1 mM de cocaïne entraînait une augmentation des concentrations de calcium et de l’activité de la caspase-3, ainsi qu’une diminution du potentiel de la membrane mitochondriale et de l’ATP dans des neurones corticaux de rat exposés pendant 24 h. De plus, l’exposition à la cocaïne dans des modèles de neurones hippocampiques primaires de rat (1 mM) et de neurones corticaux primaires de souris (1, 10, 100 et 200 μM) a augmenté l’expression des marqueurs d’autophagie LC-3 I et II. La nifédipine, un bloqueur sélectif des canaux calciques de type L, a inversé la réduction du débit sanguin cérébral et de l’oxygénation des tissus induite par l’augmentation des courants calciques neuronaux, dans le cortex préfrontal de rats exposés à 1 mg/Kg de cocaïne. L’augmentation du stress oxydatif est un autre mécanisme contribuant aux effets neurotoxiques de la cocaïne ; Par exemple, une étude sur les effets de la cocaïne sur le cervelet de rat a montré qu’après 18 jours d’administration de 15 mg/Kg, la drogue augmente le stress oxydatif, en diminuant l’activité de la glutathion peroxydase (GPx) ainsi qu’en réduisant le rapport glutathion réduit/oxydé, et en augmentant la concentration de glutamate, de facteur nucléaire kappa B et de CD68, indiquant une activation microgliale-macrophage.
Les différences morphologiques entre les consommateurs et les non-utilisateurs de cocaïne ont également été étudiées. Une étude portant sur les anomalies de la matière grise des consommateurs de crack a révélé une diminution de l’épaisseur corticale dans les cortex temporal, orbitofrontal et rostro-frontal gauches et une réduction du volume de la matière grise dans l’hippocampe et le diencéphale ventral droits. Il a également été prouvé que le volume du noyau accumbens gauche et droit, une zone du cerveau cruciale dans les processus de récompense, de plaisir et d’apprentissage par renforcement, était réduit chez les consommateurs de crack par rapport aux témoins sains (sans différence de volume intracrânien).
Foie
La cocaïne est une substance hépatotoxique bien connue. Cela a été démontré pour la première fois chez l’homme en 1987, lorsque la présence d’une inflammation et d’une nécrose périportale avec infiltration modérée de lipides a été vérifiée – avant cela, l’hépatotoxicité n’avait été rapportée que dans des modèles animaux. Ce premier cas était conforme aux études antérieures et ultérieures. La lésion hépatique caractéristique de l’usage de cocaïne est la nécrose hépatocellulaire, qui a également été démontrée dans des études animales. Les autres caractéristiques pathologiques des lésions hépatiques induites par la cocaïne comprennent une infiltration accrue d’acides gras, une augmentation des taux sanguins d’aspartate aminotransférase et des conjugaisons pernicieuses de métabolites réactifs de la cocaïne avec des macromolécules cellulaires.
Des recherches ont montré un lien entre la bioactivation de la cocaïne médiée par le cytochrome P450 et l’inhibition du métabolisme hépatique, avec les propriétés hépatotoxiques de la drogue. Après la formation de la NCOC (également catalysée par des monooxygénases contenant de la flavine adénine dinucléotide), celle-ci est oxydée dans le foie, ce qui entraîne la génération de métabolites oxydatifs (tels que la N-hydroxynorcocaïne (N-OH-NCOC) et le nitroxyde de norcocaïne (NCOC-NO-)). L’oxydation ultérieure du NCOC-NO- forme un cation hautement réactif, le nitrosonium de norcocaïne, qui se lie de manière irréversible aux protéines cellulaires et provoque la mort cellulaire. En outre, le NCOC-NO- peut également être réduit en N-OH-NCOC, contribuant ainsi à la formation de radicaux libres, qui induisent un stress oxydatif et entraînent finalement la mort cellulaire.
La capacité de la cocaïne à interférer avec le système antioxydant des hépatocytes (par exemple, SOD, GPx, catalase) et à déprimer la respiration mitochondriale est bien connue. Un travail récent de Mai et al, étudiant le potentiel protecteur de la GPx, illustre les dommages cellulaires de la cocaïne (à 60 et 90 mg/Kg BW) dans une étude in vivo utilisant des souris. On a constaté une augmentation significative de l’activité de la SOD, des ROS, de la carbonylation des protéines et de la peroxydation des lipides, de l’expression de la caspase-3 clivée et du calcium intramitochondrial, accompagnée d’une diminution significative de la GPx. Les exemples de changements histologiques incluent l’hémorragie, la congestion, la nécrose périventriculaire et la dégénérescence hydropique. Il est à noter que l’expression accrue de la GPx a protégé les animaux d’une issue aussi grave, tout comme la déplétion de p53. Une autre étude portant sur l’influence de la cocaïne et de ses métabolites N-oxydants sur la respiration mitochondriale a déterminé que si la cocaïne n’avait aucune influence sur les états respiratoires 3 et 4 ou sur le rapport de contrôle respiratoire, les métabolites NCOC, N-hydroxycocaïne et NCOC-NO- avaient un impact sur la respiration mitochondriale. Il a donc été suggéré que ces métabolites sont en fait responsables de l’épuisement des réserves intracellulaires d’ATP et de la mort cellulaire qui s’ensuit. De plus, la cocaïne peut stimuler une cascade de réactions, dont l’activation de la caspase-3 et la libération du cytochrome c, conduisant à l’apoptose hépatocellulaire. L’étude de Kowalczyk-Pachel et al, dans laquelle des rats se sont auto-administrés de la cocaïne (jusqu’à un maximum de 185 mg/Kg), a montré que, par rapport aux animaux témoins, la cocaïne diminuait les niveaux d’espèces de soufre réactives, et que les niveaux de sulfate étaient également affectés ; comme pour les effets sur les reins, ces altérations sont restées même pendant la période d’abstinence, et ont reflété l’impact de la cocaïne sur le métabolisme de la cystéine.
Une étude récente a utilisé une approche métabolomique pour étudier les effets de la cocaïne dans la lignée cellulaire d’hépatome HepG2, après exposition à 200 mM de drogue. Des altérations significatives des voies métaboliques des acides aminés (par exemple, glycine, sérine, thréonine, arginine, proline, taurine) ont été observées, qui étaient plus marquées dans le cas du glutamate, de l’aspartate et de l’alanine. Une étude précédente, utilisant un modèle métaboliquement plus compétent (rats Sprague-Dawley), a analysé le plasma d’animaux dépendants à la cocaïne (qui ont reçu une dose de 10 mg/Kg) et a trouvé des changements significatifs dans les niveaux de L-thréonine, spermidine, cystéine et n-Propylamine.
Potentiel d’abus, dépendance et tolérance
L’abus et la dépendance à la cocaïne sont fortement liés à la capacité de la drogue à induire la libération de dopamine dans le circuit mésocorticolimbique (également connu sous le nom de système de récompense). Au fur et à mesure que l’utilisateur consomme de la cocaïne, une désensibilisation se produit et des doses plus importantes sont nécessaires pour induire des stimuli de la même ampleur qu’auparavant, ainsi que pour minimiser les symptômes de sevrage. La dépendance/addiction à la cocaïne n’est pas spécifiquement incluse dans la 5e édition du Manuel des diagnostics et des statistiques des troubles mentaux (DSM-5) ; cependant, les critères du trouble de l’usage des stimulants peuvent être appliqués. Ces critères sont les suivants : consommation dangereuse, négligence des principaux rôles de la vie (par exemple, le travail, l’éducation des enfants) au profit de la consommation, problèmes sociaux/interpersonnels liés à la consommation, état de manque, sevrage, tolérance, activités abandonnées au profit de la consommation, temps passé à consommer, consommation en plus grande quantité/plus longtemps, problèmes physiques/psychologiques liés à la consommation et tentatives répétées pour arrêter/contrôler la consommation.
Il a été démontré que la cocaïne possède un potentiel d’abus élevé, les études expérimentales rapportant qu’elle induit un conditionnement de préférence de place et agit facilement comme un renforçateur pour l’auto-administration de drogues. Di Chiara et Imperato ont testé l’effet de la cocaïne sur la teneur en dopamine extracellulaire dans deux zones dopaminergiques terminales du cerveau des rats (le noyau caudé dorsal et le noyau accumbens septi), et ont constaté que la drogue a la capacité d’augmenter les concentrations de dopamine dans les deux zones, mais surtout dans le noyau accumbens, en postulant que cette capacité pourrait être un élément clé des drogues d’abus. Le striatum dorsal semble également être impliqué dans la dépendance à la cocaïne, étant donné que chez les individus dépendants, l’exposition à des indices de cocaïne (une vidéo de sujets consommant du “crack”) a réduit la liaison d’un radioligand aux récepteurs D2 dans cette région du cerveau, et qu’un déplacement plus important du radioligand correspondait à un état de manque. Les sujets présentant les plus hauts degrés de manque et de dépendance présentaient également le plus grand degré de déplacement. De plus, Volkow et al. ont déterminé que, par rapport aux individus non dépendants, les sujets dépendants de la cocaïne démontrent une altération de l’augmentation de la dopamine dans le striatum dorsal et ventral en réponse au méthylphénidate, qui ne diffère pas de celle provoquée par le placebo. Cette même étude a révélé que les niveaux de base des récepteurs dopaminergiques D2 et D3 du striatum ventral étaient nettement inférieurs chez les cocaïnomanes. Des avancées récentes dans ce domaine ont révélé que l’hétéromérisation des récepteurs D2-NMDA induite par un régime de cocaïne chez la souris était maintenue après une période d’abstinence, et était associée à une sensibilisation comportementale par la drogue. En outre, il a été démontré que les complexes hétéromériques D2-NMDA sont nécessaires au développement et au rétablissement de la préférence de place conditionnée induite par la cocaïne, et que l’inhibition de leur formation n’interfère pas avec les processus naturels de récompense.
Il a été prouvé que la dépendance au ‘crack’ affecte la mémoire de travail : les jeunes femmes dépendantes au ‘crack’ ont des performances similaires à celles des femmes âgées en bonne santé, mais inférieures à celles des jeunes femmes en bonne santé (pour les deux groupes). Il semble clair que, même si une image plus complète des mécanismes qui sous-tendent l’abus de cocaïne et la dépendance à la cocaïne commence à se former, des recherches supplémentaires sont encore nécessaires pour mieux aider les personnes qui luttent contre la dépendance à la cocaïne.
L’utilisation continue de la cocaïne à des doses élevées peut entraîner le développement d’une tolérance aux effets cardiovasculaires et subjectifs signalés par les utilisateurs, les volontaires cocaïnomanes ayant reçu des perfusions continues décrivant un “rush” atténué au fil du temps, mais ressentant toujours le “high”. En fait, une étude portant sur des consommateurs de cocaïne à long terme à Philadelphie et appliquant le “Cocaine History Questionnaire” a révélé une corrélation négative entre la quantité de cocaïne consommée et la sensation d’euphorie obtenue par la consommation, tandis que certains effets négatifs (sautes d’humeur, paranoïa et agitation) associés à la consommation augmentaient. Les études animales ont également permis d’apporter un éclairage sur la tolérance à la cocaïne. Au niveau pharmacodynamique, l’auto-administration de cocaïne à 1,5 mg/Kg (40 injections par jour pendant cinq jours consécutifs) a réduit la quantité de dopamine et la vitesse de libération du neurotransmetteur, comme observé dans des tranches de cerveau de rat ; ce même traitement a conduit à une réduction de l’effet de plusieurs bloqueurs de la capture de la dopamine et de la noradrénaline (bupropion et nomifensine), mais n’a pas affecté la réponse aux libérateurs dopaminergiques (par ex, méthamphétamine et phentermine). De plus, le même régime d’ingestion de cocaïne a conduit des rats Sprague Dawley à augmenter le nombre d’auto-administrations dans la première heure de la session sur cinq sessions consécutives, ainsi qu’une tolérance aux effets d’activation locomotrice de la cocaïne. En outre, l’auto-administration de cocaïne a provoqué une réduction de la quantité de dopamine présynaptique et de son absorption dans le noyau accumbens, et le DAT a montré une sensibilité réduite à la capacité de la cocaïne à inhiber l’absorption de la dopamine. Le développement d’une tolérance – où les effets agréables de la drogue sont diminués – pourrait conduire l’individu à ressentir le besoin d’administrer un nouveau bolus (augmentation de la dose et/ou de la fréquence de prise) alors que les concentrations plasmatiques sont encore élevées, et ainsi augmenter la probabilité d’une toxicité sévère et même éventuellement fatale.
Polytoxicomanie
Les adultérants et les contaminants sont souvent présents dans les échantillons de cocaïne, comme l’indique l’analyse d’un ensemble d’échantillons acquis dans la rue dont la moyenne est de 40%. Beaucoup de ces additifs sont souvent inclus pour augmenter le volume perçu (par exemple, talc, sucre ou amidon de maïs) ou la pureté de la cocaïne (par exemple, lidocaïne, benzocaïne et procaïne ; caféine, éphédrine) et peuvent moduler les effets biologiques de la cocaïne, y compris sa toxicité. En plus de ces substances, la polytoxicomanie avec des drogues licites et illicites est une pratique courante chez les consommateurs de cocaïne. La polytoxicomanie constitue un risque pour les usagers pour une multitude de raisons, notamment la potentialisation des effets nocifs d’une drogue par l’autre ou les autres en raison de la formation de nouveaux métabolites (et peut-être plus toxiques) et/ou de l’inhibition compétitive des systèmes de métabolisation. Le choix de la drogue à combiner avec la cocaïne est souvent basé sur le désir de contrecarrer les effets stimulants (“supérieurs”) de la cocaïne, de sorte qu’une autre drogue pour “s’adoucir” (un “downer”) est fréquemment choisie. Des exemples de ces drogues sont l’alcool, les benzodiazépines (par exemple, le lorazépam et le diazépam), le cannabis et les opioïdes (par exemple, l’héroïne). Deux des combinaisons les plus courantes sont la cocaïne associée à l’alcool et aux opioïdes/héroïne (également connue sous le nom de “speedball”), et feront donc l’objet d’une attention particulière.
Alcool
La grande majorité des consommateurs de cocaïne la consomment en même temps que de l’alcool et déclarent que cette combinaison prolonge la durée de la stimulation et contrebalance la dysphorie consécutive à la consommation de cocaïne. En général, l’éthanol potentialise à la fois la morbidité et la mortalité de la cocaïne. L’utilisation de la cocaïne en combinaison avec l’alcool est cardiotoxique et conduit à la formation de CE, un métabolite pharmacologiquement actif, comme mentionné précédemment. Le CE semble être plus sélectif pour le DAT que la cocaïne elle-même ; le CE est également capable d’induire une augmentation de la pression sanguine et de la fréquence cardiaque, et il semble renforcer les effets de la cocaïne au niveau du SNC ; le CE possède également une demi-vie plus longue que la cocaïne et est capable d’inhiber la conversion de la cocaïne en BE. Tous ces facteurs contribuent à une stimulation plus durable et donc simultanément plus dangereuse. Une étude récente a tenté d’établir une relation entre les concentrations sanguines de cocaïne et d’EC et la gravité des manifestations cliniques chez les personnes hospitalisées pour une intoxication à la cocaïne. Les concentrations sanguines moyennes de cocaïne et d’EC étaient respectivement de 0,34 ± 0,45 μg/mL et de 0,38 ± 0,34 μg/mL et, bien qu’il n’ait pas été possible d’établir un schéma entre le pronostic des patients ou leur parcours thérapeutique et les concentrations sanguines de ces substances, cette évaluation pourrait être utile pour indiquer la gravité de l’intoxication.
Héroïne/Opioïdes
L’utilisation conjointe de cocaïne et d’héroïne est communément appelée “speedball”. Dans cette association, l’héroïne et la cocaïne peuvent être administrées en mélange, ou la cocaïne peut être administrée immédiatement avant ou après l’héroïne. Les deux drogues sont en concurrence pour les mêmes enzymes, comme l’hCE, dans le processus métabolique, ce qui peut prolonger leurs effets biologiques. Les conséquences sociales et sanitaires de la consommation de cocaïne par les personnes dépendantes aux opiacés semblent particulièrement négatives, en raison de la fréquence élevée d’utilisation par voie intraveineuse et de la courte demi-vie de la cocaïne, qui augmente le nombre d’injections. En outre, la pratique du partage des seringues contribue à la propagation des maladies infectieuses. Le rapport 2021 de l’OEDT sur les décès liés à la drogue en Europe révèle que les opioïdes sont la drogue la plus fréquemment retrouvée dans les décès liés à la cocaïne. Malgré sa capacité à augmenter modérément les niveaux d’oxygène cérébral, la cocaïne n’a pas d’impact sur l’hypoxie cérébrale induite par de fortes doses d’héroïne. Les motivations de ce co-usage diffèrent en fonction des objectifs de l’usager : faire l’expérience des effets uniques de la combinaison de l’héroïne et de la cocaïne (cette stimulation est différente de celle de l’une ou l’autre drogue seule), atteindre des effets euphoriques plus importants, ou encore pouvoir réduire la consommation d’héroïne et les symptômes de sevrage.
Traitement de l’intoxication aiguë
Il est difficile de déterminer la “dose létale” de cocaïne, en raison du haut degré de variabilité associé à la manière dont les usagers réagissent à l’ingestion de cocaïne et la métabolisent, en raison des variations du taux métabolique des individus, des interactions médicamenteuses potentielles et des polymorphismes génétiques des enzymes de métabolisation. En outre, il ne semble pas y avoir de relation entre les concentrations sanguines et la toxicité, avec des concentrations plasmatiques de cocaïne de 0,029 mg/l chez un patient qui est décédé, et peu de symptômes chez un individu avec 3,9 mg/l (une concentration considérée auparavant comme presque fatale). Par comparaison, chez les souris Swiss-Webster, la DL50 de la cocaïne a été estimée à 93 mg/Kg.
Une intoxication sévère à la cocaïne peut avoir une issue fatale si elle ne bénéficie pas du traitement médical nécessaire. Étant donné le risque permanent d’arrêt cardio-respiratoire, la surveillance des signes vitaux est extrêmement importante et une réanimation cardio-respiratoire doit être effectuée dès que nécessaire. En cas d’échec, l’administration de vasopressine est recommandée (cette option thérapeutique a démontré une plus grande efficacité que l’épinéphrine, le médicament de première ligne pour la réanimation cardiaque).
Les benzodiazépines sont utiles dans le traitement des sujets qui, en plus de présenter des signes d’ischémie myocardique, sont anxieux, tachycardes ou hypertendus. Non seulement les benzodiazépines exercent une action anxiolytique, mais elles atténuent également les effets toxiques au niveau cardiovasculaire et cérébral, en réduisant à la fois la pression artérielle et le débit cardiaque, ce qui en fait une première approche clé dans le traitement des intoxications aiguës à la cocaïne [96,160]. Il est à noter que lorsque le sujet refuse l’administration orale de benzodiazépines, les voies intramusculaire ou intraveineuse sont recommandées.
Dans certains cas, même après avoir reçu l’administration d’oxygène, d’aspirine, de benzodiazépines et de nitroglycérine, les sujets présentent toujours des douleurs thoraciques. Dans ces cas, l’administration de la phentolamine, un antagoniste non sélectif des α-adrénergiques, est recommandée pour induire une vasodilatation, car les β-bloquants ne sont pas utiles pour traiter cette manifestation clinique. Bien que l’utilité des antagonistes des canaux calciques dans le traitement des douleurs thoraciques liées à la cocaïne ne soit pas totalement connue, le vérapamil est considéré comme efficace pour inverser la vasoconstriction, et doit donc être administré après les benzodiazépines pour assurer une certaine protection du SNC.
L’utilisation d’antipsychotiques pour gérer les intoxications à la cocaïne est discutable et potentiellement dangereuse, car ils peuvent intensifier le risque de dysrythmies cardiaques. De plus, dans le cas de sujets traités par d’autres médicaments, tels que les antidépresseurs tricycliques, il existe un risque élevé de potentialisation des effets de ces médicaments. Pour ces raisons, l’administration d’antipsychotiques doit être considérée avec prudence.
Traitement de l’addiction/dépendance à la cocaïne
Actuellement, aucune thérapie pharmacologique n’est approuvée en Europe ou aux États-Unis pour la gestion du trouble de l’usage de la cocaïne (TUC). Les stratégies pharmacologiques les plus prometteuses pour le traitement du CUD comprennent l’utilisation d’agonistes dopaminergiques, comme l’amphétamine à action prolongée, ou de médicaments capables d’influencer les systèmes glutamatergiques et GABAergiques, comme le topiramate. L’efficacité de ces traitements a été évaluée dans des essais cliniques préliminaires. Aux Pays-Bas, 73 patients présentant une dépendance à l’héroïne et à la cocaïne réfractaire au traitement ont rapporté moins de jours de consommation de cocaïne (45 jours) après 12 semaines d’administration orale de dexamphétamine à libération prolongée (60 mg/jour) par rapport aux patients traités par placebo (61 jours). En ce qui concerne l’utilisation de médicaments glutamatergiques/GABAergiques, 170 personnes dépendantes de la cocaïne et de l’alcool traitées par topiramate (300 mg/jour pendant 13 semaines) étaient significativement plus susceptibles de parvenir à l’abstinence de cocaïne au cours des 3 dernières semaines de traitement [166]. Le modafinil a également montré des résultats prometteurs dans le traitement de la CUD modérée, car il peut affaiblir l’euphorie induite par la cocaïne chez l’homme ; cependant, il n’est pas efficace pour réduire la consommation de cocaïne si les sujets ont une dépendance à l’alcool en plus de la CUD.
Les approches psychosociales restent limitées mais s’attardent néanmoins comme traitement de choix pour la CUD, avec des approches standard comprenant la gestion des contingences et la thérapie cognitivo-comportementale. Bien qu’il n’existe pas de chiffres sur les taux de réussite de ces approches, une méta-analyse récente comparant les options de traitement de la DIU chez les adultes a conclu que les thérapies de gestion des contingences étaient le seul traitement positivement associé à une réduction de la consommation de cocaïne.
Conclusion
La cocaïne reste à ce jour un sujet de préoccupation pour la santé publique, car elle se maintient au deuxième rang des substances illicites les plus utilisées dans la plupart des pays. Qu’elle se présente sous la forme de poudre de cocaïne ou de crack, sa prévalence et son utilisation par des individus de tous horizons doivent être prises au sérieux car elles n’épargnent pas les utilisateurs de la toxicité inhérente à la consommation de cette drogue. Cette revue aidera, nous l’espérons, le lecteur à obtenir une image globale, claire et plus complète de ce que l’on sait de la toxicité de la cocaïne, que ce soit en termes de méthodes analytiques pour la détecter, de matrices (non)biologiques où elle peut être détectée, de sa pharmacocinétique et de sa pharmacodynamique, des répercussions physiopathologiques possibles pour les usagers, et des traitements existants pour l’intoxication à la cocaïne et le CUD.
