Wittenberg, R. E., Wolfman, S. L., De Biasi, M., & Dani, J. A. (2020). Nicotinic acetylcholine receptors and nicotine addiction: A brief introduction. Neuropharmacology, 177, 108256.
Abstract.
La nicotine est une drogue hautement addictive que l’on trouve dans le tabac et qui pousse à continuer à l’utiliser malgré ses conséquences néfastes. L’initiation de l’abus de nicotine implique le système dopaminergique mésolimbique, qui contribue aux stimuli sensoriels gratifiants et aux processus d’apprentissage associatif dans les premiers stades de la dépendance. La nicotine se lie aux récepteurs neuronaux nicotiniques de l’acétylcholine (nAChR), qui se déclinent en une série de sous-types. Les nAChRs qui contiennent les sous-unités α4 et β2, souvent en combinaison avec la sous-unité α6, sont particulièrement importants pour la capacité de la nicotine à augmenter les taux de tir des neurones dopaminergiques du mésencéphale et les tirs en rafale phasiques. L’exposition chronique à la nicotine entraîne de nombreuses neuroadaptations, notamment la régulation à la hausse de sous-types particuliers de nAChR associés à une désensibilisation à long terme des récepteurs. Lorsque la nicotine n’est plus présente, par exemple lors de tentatives d’arrêt du tabac, un syndrome de sevrage se développe. L’expression des symptômes physiques de sevrage dépend principalement des sous-unités nicotiniques α2, α3, α5 et β4 dans le complexe habénulaire épithalamique et ses régions cibles. Ainsi, la nicotine affecte divers systèmes neuronaux et un ensemble de sous-types de nAChR pour médiatiser le processus global de dépendance.
1. Introduction.
La dépendance à la nicotine provoque plus de 7 millions de décès chaque année dans le monde (OMS, 2017). Ce chiffre est en augmentation, ce qui en fait une des principales causes de décès évitables dans le monde. Environ 50 millions de personnes, rien qu’aux États-Unis, sont dépendantes des produits du tabac, ce qui entraîne d’énormes coûts de santé publique, sociétaux et économiques. La nicotine est le principal composant addictif des produits du tabac, mais de multiples constituants contribuent à ses propriétés renforçantes. Alors que le taux de tabagisme a diminué ces dernières années, l’essor des e-cigarettes a entraîné une recrudescence de la consommation de nicotine, en particulier chez les adolescents et les jeunes adultes. Cette résurgence a de nombreuses conséquences néfastes et souligne l’importance de comprendre la pharmacologie de la nicotine et les propriétés des récepteurs neuronaux nicotiniques de l’acétylcholine (nAChRs) pour concevoir des traitements efficaces de la dépendance.
La nicotine est un alcaloïde présent naturellement dans de nombreuses plantes où elle sert d’insecticide. La nicotine est une amine tertiaire qui se présente sous la forme de deux stéréoisomères et se compose d’un cycle pyridine et d’un cycle pyrrolidine. La forme (S)-nicotine se trouve dans le tabac, et c’est la forme active qui se lie à divers sous-types de nAChR dans tout le système nerveux central et périphérique. Lors du fumage ou du chauffage du tabac, une certaine racémisation de la nicotine a lieu et de petites quantités de l’isoforme (R)-nicotine peuvent également être trouvées dans la fumée qui en résulte. En outre, la nicotine étant une amine tertiaire, elle peut exister à la fois sous forme chargée et non chargée. À l’état non chargé, la nicotine est perméable aux membranes et peut pénétrer dans le cerveau, où elle se transforme ensuite en forme chargée et se lie aux récepteurs. La nicotine influence donc indirectement les processus intracellulaires en agissant sur les nAChRs, mais elle peut aussi influencer directement ces processus lorsqu’elle pénètre dans le cytoplasme. Ce chapitre se concentrera exclusivement sur les actions de la nicotine sur les nAChRs à la surface des cellules.
1.1 Structure et sous-types des récepteurs nicotiniques
Les récepteurs nicotiniques de l’acétylcholine sont des canaux cationiques libérés par un ligand qui sont largement distribués dans le système nerveux et l’organisme, mais cette section se concentrera sur les nAChRs neuronaux. Ils sont exprimés dans presque toutes les régions du cerveau, à la fois en pré- et post-synaptique et peuvent être trouvés sur les terminaisons axonales, les axones, les dendrites et les somates. Les récepteurs nicotiniques sont des structures pentamériques composées de cinq sous-unités distinctes qui forment ensemble un pore aqueux central permettant l’influx de cations lorsque le récepteur est activé. Chaque sous-unité est composée d’une extrémité N-terminale extracellulaire qui contribue à la liaison au ligand, de trois domaines transmembranaires hydrophobes (M1-M3), d’une boucle intracellulaire, d’un quatrième domaine transmembranaire hydrophobe (M4) et d’une extrémité C-terminale extracellulaire. L’activation des nAChRs est obtenue par la liaison du neurotransmetteur endogène acétylcholine ou de ligands exogènes comme la nicotine.
On trouve 12 sous-unités homologues de nAChR neuronaux chez les vertébrés, ce qui entraîne une énorme diversité dans la composition des sous-unités de ces récepteurs. Parmi elles, on trouve neuf sous-unités α (α2-10) et trois sous-unités β (β2-4), et diverses combinaisons de ces sous-unités forment des récepteurs fonctionnellement distincts qui peuvent varier considérablement dans leurs propriétés pharmacologiques et biophysiques (Fig. 1). Toutes les sous-unités α partagent un ensemble hautement conservé de six acides aminés, dont deux résidus cystéine adjacents qui partagent un lien disulfure important pour la formation du site de liaison au ligand. Il est important de noter que les sous-unités β sont dépourvues de cette paire de résidus de cystéine. Par conséquent, au moins deux sous-unités alpha sont nécessaires pour former un récepteur fonctionnel.
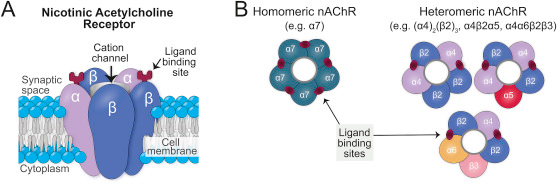
Les sous-types de nAChR qui en résultent peuvent être classés (Fig. 1B) comme étant soit homopentamériques (constitués de 5 sous-unités identiques), soit hétéropentamériques (constitués d’au moins 1 type de sous-unité α et 1 β). On pense que les récepteurs homopentamériques possèdent cinq sites de liaison au ligand identiques, un entre chaque paire de sous-unités voisines, mais il semble qu’un seul site de liaison doive être occupé pour obtenir une certaine activation du récepteur (figure 2). On pense que les récepteurs hétéropentamériques n’ont que deux sites de liaison qui sont situés entre les paires voisines de sous-unités α et β, mais des sites de liaison non orthodoxes ont récemment été signalés. Ces récepteurs contiennent généralement deux paires de sous-unités αβ et une cinquième sous-unité accessoire. Chaque sous-unité n’est pas entièrement symétrique et, par conséquent, le placement de différentes sous-unités dans une variété de positions au sein du complexe pentamérique peut donner lieu à une grande variété de sous-types de nAChR différents, chacun ayant des rôles potentiellement différents. Les sous-unités α5 et β3 ne fonctionnent que comme des sous-unités accessoires, du moins dans les nAChRs natifs. En tant que tels, ils ne contribuent pas au site de liaison aux agonistes, mais modifient plutôt les propriétés fonctionnelles du complexe nAChR et modifient la régulation du récepteur par les agonistes. Par exemple, la sous-unité α5 a un rôle régulateur puisque sa présence émousse la désensibilisation des nAChRs suite à une exposition à la nicotine, et elle serait critique pour contrôler l’expression et la fonction des nAChRs contenant α4 dans la VTA.
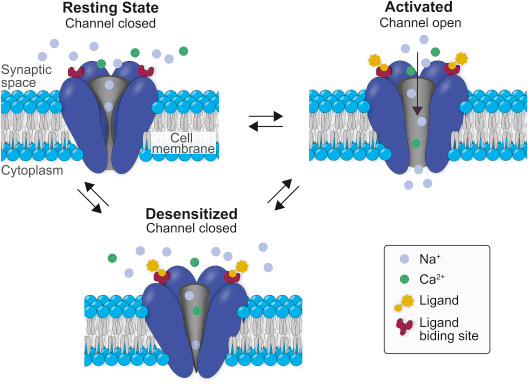
Malgré cette diversité, tous les sous-types de nAChR neuronaux des mammifères partagent la propriété fonctionnelle d’être perméables au Na+, K+ et Ca2+. Les récepteurs nicotiniques, comme la plupart des canaux ioniques dépendant d’un ligand, peuvent exister dans plusieurs états de conformation (Fig. 2) : fermés et capables d’être activés par un ligand, ouverts et conducteurs de petits cations, ou désensibilisés et fermés et incapables d’être activés par un ligand. Lorsque la nicotine se lie au récepteur, le canal ionique est ouvert et brièvement stabilisé dans cette conformation, permettant le flux de cations, ce qui va déplacer le potentiel de la membrane vers 0 mV, dépolarisant généralement la membrane. Le canal retourne ensuite à son état de repos (fermé et capable d’être activé) ou entre dans un état de désensibilisation dans lequel il ne peut pas être activé par la nicotine ou d’autres agonistes. La composition des sous-unités régit la cinétique de ces états conformationnels, la perméabilité cationique sélective du pore du nAChR et les affinités pharmacologiques de divers agonistes. Par conséquent, l’extraordinaire diversité des sous-types de nAChR entraîne de nombreuses réponses fonctionnelles à la nicotine. Parmi le large éventail de combinaisons de sous-types de nAChR dans le cerveau, les récepteurs homomériques les plus couramment exprimés sont de type α7, et les récepteurs hétéromériques les plus couramment exprimés sont ceux contenant les sous-unités α4 et β2.
Étant donné que les nAChRs α7 sont le sous-type homomérique le plus courant, et que les sous-unités α7 forment relativement rarement des récepteurs hétéromériques, un raccourci pour la classification des récepteurs consiste à déterminer si le récepteur est un nAChR α7 ou un nAChR non-α7. Sur le plan pharmacologique, cette détermination peut être effectuée en observant la sensibilité à l’α-bungarotoxine (α-BTX), qui, dans le cerveau, est un antagoniste puissant et sélectif des récepteurs homomères α7 neuronaux. Les récepteurs sensibles à l’α-BTX ont une affinité relativement faible pour la nicotine et une cinétique rapide, tandis que les récepteurs insensibles à l’α-BTX ont généralement une affinité plus élevée pour la nicotine, une cinétique plus lente, sont hétéromériques et se désensibilisent à de faibles concentrations d’agonistes. Ces propriétés distinctes des récepteurs entraînent des réponses temporelles, physiologiques et biochimiques différentes à la nicotine, et l’importance de ces différentes réponses sera discutée dans la section suivante.
1.2 Facteurs génétiques médiateurs des effets de la nicotine
Alors qu’un ensemble complexe de facteurs environnementaux, pharmacologiques et individuels influencent la dépendance à la nicotine et les comportements tabagiques, de nombreuses études ont également examiné la génétique de la dépendance à la nicotine. On pense que les facteurs génétiques jouent un rôle important dans l’initiation au tabagisme, la progression vers une consommation importante et la persistance de la consommation. Une méta-analyse rapporte que des éléments génétiques étaient responsables de 50 % de la variation de l’initiation à la nicotine et de la persistance de l’usage (Li et al., 2003). Bien que les études d’association pangénomique (GWAS) et les études sur les gènes candidats aient permis d’identifier un grand nombre de gènes pouvant influencer le tabagisme, de nombreuses associations entre les variantes génétiques et les phénotypes liés à la nicotine n’ont pas été répliquées de manière fiable. Cependant, les allèles à risque dans le cluster de gènes CHRNA5-A3-B4 des sous-unités des récepteurs nicotiniques sur le chromosome 15q25, qui code pour les sous-unités α5, α3 et β4 des nAChR, ont été systématiquement associés à la dépendance à la nicotine (Bühler et al., 2015). Les polymorphismes dans ce groupe de gènes ont été liés à de multiples phénotypes liés au tabagisme, y compris la dépendance à la nicotine, la quantité de tabac, la quantité de tabac, l’arrêt du tabac et les maladies liées au tabagisme.
Un certain nombre de polymorphismes mononucléotidiques (SNP) dans ce groupe de gènes ont été identifiés, mais les rs16969968 dans CHRNA5 et rs1051730 dans CHRNA3 ont suscité un intérêt particulier en ce qui concerne les phénotypes liés à la nicotine, bien que le SNP rs16969968 ait été étudié plus en détail. Ce SNP est une mutation fonctionnelle faux-sens G/A (D398N) dans l’exon 5 et est le seul SNP qui a été impliqué jusqu’à présent dans les comportements liés à la nicotine et qui entraîne un changement d’acide aminé non synonyme dans la protéine résultante. L’allèle majeur produit des sous-unités α5 avec un aspartate (D) en position 398, qui est échangé contre une asparagine (N) dans l’allèle mineur. Il a été démontré que l’allèle mineur (N398) est fortement associé au tabagisme lourd, à un besoin intense de nicotine et à la dépendance à la nicotine. Ce polymorphisme est également connu pour avoir une signification fonctionnelle car des études in vitro ont montré que les récepteurs α4β2α5 avec l’allèle asparagine présentent une réponse diminuée à un agoniste nicotinique, une perméabilité au calcium réduite et une désensibilisation plus rapide (Bierut et al., 2008).
Le SNP 1051730, situé dans le gène CHRNA3, a également été associé à la dépendance à la nicotine et à la quantité de cigarettes. Ce SNP est en parfait déséquilibre de liaison avec le rs16969968 et les deux SNP sont considérés comme interchangeables, bien que cela nécessite des investigations supplémentaires. Une autre variante non synonyme située dans CHRNB4 (rs12914008) s’est avérée être un médiateur de la transition rapide entre le tabagisme initial et la dépendance à la nicotine, mais il s’agit d’un SNP moins courant et il a été étudié de manière beaucoup moins détaillée. Ce SNP entraîne une mutation faux-sens de CHRNB4 de la thréonine à l’isoleucine. Bien que ces variantes plus rares aient été liées à la dépendance et à la susceptibilité à la nicotine, on ignore actuellement si elles représentent des facteurs de risque indépendants des autres SNP du même groupe de gènes.
De nombreux autres gènes des nAChR ont également été impliqués de diverses manières dans les phénotypes liés à la dépendance à la nicotine, et ces résultats d’études génétiques humaines ont servi de base à une variété de modèles animaux qui ont été utilisés pour étudier le circuit et les effets moléculaires de ces mutations. Les sections suivantes feront référence à ces modèles et à d’autres modèles animaux lors de l’examen des effets de la nicotine sur diverses voies neurales et comportements.
1.3 La nicotine agit sur le circuit mésolimbique de la récompense
Toutes les drogues, y compris la nicotine, activent les neurones dopaminergiques de l’aire tegmentale ventrale (VTA) qui se projettent vers le noyau accumbens (NAc). L’activation de cette voie mésolimbique entraîne un efflux de dopamine dans le NAc, ce qui est important pour l’apprentissage basé sur la récompense par la nicotine et l’initiation du processus de dépendance. Divers sous-types de nAChR sont exprimés dans les populations neuronales de la VTA, ainsi que sur les terminaisons axonales des afférences provenant d’un certain nombre de régions du cerveau. Par conséquent, les effets de la nicotine dans la VTA sont complexes. Cependant, diverses études ont mis en lumière les mécanismes par lesquels la nicotine agit dans la VTA pour provoquer l’activation des neurones dopaminergiques.
La nicotine peut activer directement les neurones dopaminergiques en se liant à leurs récepteurs nicotiniques β2 de haute affinité, provoquant ainsi un afflux net de cations qui dépolarise le neurone. Ces effets augmentent les taux de tir des neurones dopaminergiques et l’activité des rafales phasiques, élevant ainsi les niveaux de dopamine dans le NAc. Par conséquent, la sous-unité β2 pourrait être cruciale dans la médiation des effets gratifiants de la nicotine puisque la nicotine stimule la libération de dopamine chez les souris de type sauvage, mais les souris dépourvues de la sous-unité β2 ne présentent pas d’augmentation de la dopamine extracellulaire après l’administration de nicotine. Cependant, les neurones GABA de la VTA qui inhibent les neurones dopaminergiques expriment également des nAChRs contenant des β2, de sorte que la commande GABAergique vers les neurones dopaminergiques de la VTA est transitoirement augmentée en même temps que les neurones dopaminergiques eux-mêmes sont directement activés par la présence de nicotine. Comme les α4β2 nAChRs se désensibilisent rapidement, la commande GABAergique vers les neurones dopaminergiques est fonctionnellement réduite sur une période plus longue lorsque de faibles niveaux de nicotine sont continuellement présents. Simultanément, la pulsion glutamatergique vers les neurones dopaminergiques est renforcée par l’activation des α7 nAChRs pré-synaptiques, qui sont moins enclins à la désensibilisation aux concentrations de nicotine atteintes par les fumeurs en raison de leur faible affinité pour la nicotine, ce qui entraîne une augmentation durable de la pulsion excitatrice des neurones dopaminergiques en présence de nicotine. Cette augmentation de la pulsion excitatrice combinée à la réduction de la pulsion inhibitrice augmente l’activité des neurones dopaminergiques et facilite la potentialisation à long terme de Hebbian des afférences glutamatergiques sur les neurones dopaminergiques du mésencéphale, ce qui est considéré comme une étape critique dans l’initiation de la dépendance.
La dépendance à la nicotine implique également de manière critique la dopamine striatale. Les neurones dopaminergiques de la VTA expriment des nAChRs sur leurs terminaisons présynaptiques dans le striatum. Par conséquent, en plus d’augmenter l’activité des neurones dopaminergiques eux-mêmes, la nicotine module également la libération de dopamine dans le striatum via l’activation de ces récepteurs. Dans le noyau accumbens, la nicotine agit via des nAChRs présynaptiques hétéromériques qui contiennent les sous-unités α6β2 et/ou α4β2. La sous-unité β2 régule la probabilité de libération de dopamine dans le noyau du NAc ainsi que dans le striatum dorsal. Spécifiquement dans le noyau du NAc, la dopamine est principalement régulée par les α6α4β2β3 nAChRs. De multiples études ont montré que la nicotine désensibilise rapidement ces récepteurs, ce qui entraîne une réduction du tonus dopaminergique tonique. Cependant, cette réduction du ” bruit ” de fond de la dopamine permet d’améliorer le rapport signal/bruit lorsqu’un signal dopaminergique phasique est transmis.
1.4 Effets de la nicotine chronique
L’exposition chronique à la nicotine entraîne un certain nombre de neuroadaptations qui peuvent influencer diverses voies et circuits de signalisation, notamment la voie mésolimbique de la récompense. L’une de ces neuroadaptations est la régulation à la hausse des nAChRs, spécifique au sous-type, qui se produit en réponse à la désensibilisation persistante des récepteurs. Cette désensibilisation se produit parce que, contrairement à l’acétylcholine, la nicotine ne peut être éliminée de la synapse par hydrolyse rapide par l’acétylcholinestérase. La présence durable de la nicotine dans la synapse désensibilise les nAChRs, les rendant insensibles à une nouvelle liaison par la nicotine ou l’acétylcholine et inhibant fonctionnellement les nAChRs. En conséquence, les niveaux de nAChR sont régulés à la hausse pour maintenir l’homéostasie suite à la prise chronique de nicotine.
Le α4β2 nAChR est le récepteur nicotinique de haute affinité prédominant dans le cerveau, et sa régulation ascendante a été la plus étudiée. Comparer d’autres sous-types de nAChR au α4β2 nAChR peut donc être utile pour comprendre comment différents nAChRs sont régulés de manière différentielle par la nicotine. Par exemple, les nAChR α4β2 sont régulés à la hausse par de faibles concentrations de nicotine pertinentes sur le plan physiologique, alors que les nAChR α3β4 ne sont généralement régulés à la hausse que par de fortes concentrations de nicotine qui se situent en dehors de la plage normale obtenue par le tabagisme. Ces changements commencent quelques jours après l’exposition à la nicotine et sont considérés comme des médiateurs importants de la dépendance à la nicotine.
La régulation à la hausse des nAChRs peut être obtenue par de multiples processus, y compris des changements dans l’assemblage, le trafic et la dégradation des récepteurs. Il est important de noter que la régulation ascendante des nAChR et les mécanismes qui sous-tendent ce phénomène peuvent varier, non seulement pour différents sous-types de nAChR, mais aussi pour différentes régions du cerveau et différents paradigmes d’administration de nicotine.
En plus de modifier les niveaux d’expression des nAChR dans des régions cérébrales spécifiques, l’exposition répétée à la nicotine peut également produire une variété de neuroadaptations supplémentaires dans tout le cerveau, notamment en renforçant les synapses glutamatergiques sur les neurones dopaminergiques et sur les neurones de projection du NAc. La nicotine chronique peut également dérégler les mécanismes homéostatiques neuronaux, moduler les circuits GABAergiques du mésencéphale, réguler à la hausse les récepteurs dopaminergiques D2 à haute affinité dans le NAc, moduler les protéines d’échafaudage neuronales et modifier les processus épigénétiques.
1.5 Sevrage de la nicotine chronique
Après une exposition chronique à la nicotine, l’abstinence de cette drogue peut provoquer des symptômes de sevrage désagréables. Le sevrage est défini comme une combinaison de symptômes affectifs et somatiques qui apparaissent peu après l’abstinence de nicotine, reflétant un changement de la neurochimie causé par l’absence de la drogue. Chez l’homme, les symptômes utilisés pour évaluer le sevrage de la nicotine selon le DSM-V sont les suivants : irritabilité/frustration, anxiété, dépression, augmentation de l’appétit, impatience, insomnie et agitation. La demi-vie de la nicotine chez l’homme étant d’environ 20 heures, les symptômes de sevrage atteignent généralement leur maximum dans la semaine qui suit l’arrêt du tabac et s’estompent au cours des 3 à 4 semaines suivantes. Chez les souris, les symptômes peuvent être évalués en observant les signes somatiques du sevrage, qui comprennent une augmentation des tremblements, des secousses des pattes et du grattage, et les symptômes affectifs du sevrage, qui comprennent l’anhédonie, l’aversion et l’anxiété. Ces symptômes affectifs sont étudiés à l’aide d’une variété de tests comportementaux. Par exemple, une augmentation des seuils de récompense de l’autostimulation intracrânienne (ICSS) ou une réduction de la préférence pour le saccharose peuvent indiquer une anhédonie, et une réduction du temps passé dans les bras ouverts d’un labyrinthe en hauteur peut indiquer une augmentation de l’anxiété. La demi-vie de la nicotine chez la souris étant d’environ 6 minutes, les symptômes de sevrage atteignent généralement leur maximum 12 à 36 heures après l’abstinence.
Bien que ce ne soit pas l’objet principal de cette section, il est intéressant de noter que différents sous-types de nAChR semblent médier de manière différentielle les composantes somatiques et affectives du sevrage. Par exemple, la β4 KO est suffisante pour prévenir les signes somatiques du sevrage à la nicotine chez la souris, tandis que la β2 KO n’entraîne aucune modification des signes somatiques du sevrage par rapport aux témoins. Cependant, la β2 KO est suffisante pour réduire les composantes affectives du sevrage, et de manière intéressante, la β4 KO prévient également l’anhédonie induite par le sevrage. Jusqu’à présent, les β2 et α6 nAChRs ont été impliqués dans les composantes affectives du sevrage de la nicotine, tandis que les α7, α3, α5, β4 et α2 nAChRs ont été impliqués dans les aspects somatiques du sevrage nicotinique.
En plus de comprendre les rôles des divers sous-types de nAChR dans les différents aspects du sevrage de la nicotine, il est important de considérer comment les circuits neuronaux médient le sevrage et comment le sevrage sert à maintenir les comportements liés à la dépendance. Le sevrage de la nicotine contribue à la poursuite de la consommation de nicotine par le biais de mécanismes de renforcement négatif, ce qui suggère que les signaux motivationnels et les circuits cérébraux, tant gratifiants qu’aversifs, sont importants pour le maintien de la consommation chronique de nicotine. En fait, les symptômes de sevrage aversifs de la nicotine peuvent être nécessaires pour produire une consommation accrue de nicotine, une caractéristique de la dépendance. Alors que les effets motivationnels positifs de la nicotine sont obtenus par l’activation de la voie mésolimbique de la dopamine, les effets motivationnels négatifs du sevrage de la nicotine sont médiés par la voie habenulo-interpédonculaire. L’habenula est un noyau épithalamique impliqué dans la peur, l’anxiété, la dépression et d’autres formes d’affect négatif. Anatomiquement, l’habenula est divisé en noyaux médial (MHb) et latéral (LHb), mais le MHb a été le plus fortement impliqué dans le sevrage de la nicotine. Le MHb reçoit ses entrées primaires du système limbique et envoie presque toutes ses projections cholinergiques et glutamatergiques au noyau interpédonculaire (IPN).
L’axe MHb-IPN est unique en ce qu’il exprime densément presque tous les sous-types de nAChR neuronaux, et de nombreuses études ont établi son rôle important dans la médiation des symptômes du sevrage de la nicotine. Par exemple, des micro-injections de mécamylamine, un antagoniste des nAChR, dans la MHb ou l’IPN de souris traitées à la nicotine chronique suffisent à précipiter les symptômes de sevrage de la nicotine, et les souris dépourvues des sous-unités α2, α5 et β4 nAChR, qui sont les plus densément exprimées dans la voie MHb-IPN, présentent des réponses de sevrage réduites après la nicotine chronique. Ces résultats indiquent à la fois le rôle du circuit MHb-IPN et le rôle de ces sous-types de récepteurs dans la médiation du sevrage à la nicotine. Des études plus récentes ont également montré que la signalisation cholinergique habénulaire est nécessaire au sevrage de la nicotine, que l’activation optogénétique des neurones GABA de l’IPN est suffisante pour provoquer des symptômes de type sevrage et que l’augmentation de l’activité des nAChR dans la MHb est à l’origine des symptômes du sevrage de la nicotine liés à l’anxiété (Pang et al., 2016). De manière intéressante, des études ont également montré que différentes sous-régions de la MHb et de l’IPN sont impliquées dans différents aspects du syndrome de sevrage de la nicotine.
Bien que l’axe MHb-IPN et son rôle dans le sevrage de la nicotine soient généralement étudiés en parallèle avec le circuit mésolimbique qui régule la récompense de la nicotine, ces voies interagissent probablement les unes avec les autres. Outre l’altération de la voie MHb-IPN, le sevrage de la nicotine chronique entraîne également une réduction des niveaux de dopamine basale dans le NAc. En outre, de nombreux sous-types de nAChR qui sont importants pour les comportements liés au sevrage sont également exprimés dans le circuit mésolimbique, et diverses études ont montré des connexions anatomiques directes et indirectes entre ces voies aversives et gratifiantes.
2. Conclusion
La dépendance à la nicotine résulte d’une série complexe et étendue de neuroadaptations dans de nombreuses régions du cerveau et de systèmes de neurotransmetteurs. Ces adaptations comprennent des modifications de l’expression des récepteurs nicotiniques et la modulation de la libération des neurotransmetteurs. De nombreuses recherches précliniques ont porté sur les circuits qui sous-tendent à la fois les effets gratifiants d’une exposition aiguë à la nicotine et les effets aversifs du sevrage d’une exposition chronique à la nicotine. Ces études ont confirmé le rôle de la voie de récompense mésolimbique dans le développement et le maintien de la dépendance à la nicotine, ainsi que le rôle de l’axe MHb-IPN dans la médiation du syndrome de sevrage de la nicotine.
