De Vos, C. M., Mason, N. L., & Kuypers, K. P. (2021). Psychedelics and neuroplasticity: a systematic review unraveling the biological underpinnings of psychedelics. Frontiers in psychiatry, 12, 724606.
Des études cliniques suggèrent le potentiel thérapeutique des psychédéliques, y compris l’ayahuasca, le DMT, la psilocybine et le LSD, dans les troubles liés au stress. Ces substances induisent des effets cognitifs, antidépresseurs, anxiolytiques et anti-dépendants qui proviendraient de changements biologiques similaires à ceux des antidépresseurs conventionnels ou de la kétamine, une substance à action rapide. La voie proposée consiste à induire une neuroplasticité cérébrale. Cette revue tente de résumer les preuves que les psychédéliques induisent la neuroplasticité en se concentrant sur les effets cellulaires et moléculaires de la neuroplasticité des psychédéliques après une administration unique et répétée. Lorsque des paramètres comportementaux sont observés dans les études sélectionnées, les voies biologiques seront liées aux effets comportementaux. En outre, les lacunes dans les connaissances de la biologie sous-jacente des résultats cliniques des psychédéliques sont mises en évidence. La recherche documentaire a donné 344 résultats. La sélection des titres et des résumés a réduit l’échantillon à 35 ; huit ont été inclus à partir d’autres sources, et la sélection du texte intégral a abouti à la sélection finale de 16 études précliniques et de quatre études cliniques. Les études (n = 20) montrent qu’une seule administration d’un psychédélique produit des changements rapides dans les mécanismes de plasticité au niveau moléculaire, neuronal, synaptique et dendritique. L’expression des gènes et des protéines liés à la plasticité, y compris le facteur neurotrophique dérivé du cerveau (BDNF), est modifiée après une seule administration de psychédéliques, ce qui entraîne une modification de la neuroplasticité. Cette dernière inclut une plus grande complexité dendritique, qui survit aux effets aigus des psychédéliques. L’administration répétée d’un psychédélique a directement stimulé la neurogenèse et augmenté les niveaux d’ARNm du BDNF jusqu’à un mois après le traitement. Les résultats de la présente étude démontrent que les psychédéliques induisent des adaptations moléculaires et cellulaires liées à la neuroplasticité et suggèrent que ces adaptations sont parallèles aux effets cliniques des psychédéliques, et qu’elles les sous-tendent potentiellement. La recherche (pré)clinique future pourrait se concentrer sur le décryptage du mécanisme cellulaire spécifique activé par différents psychédéliques et lié aux effets cliniques et biologiques à long terme afin d’améliorer notre compréhension du potentiel thérapeutique de ces composés.
Présentation des hallucinogènes sérotoninergiques classiques (psychédéliques)
Les hallucinogènes sérotoninergiques classiques (psychédéliques) sont une classe de composés psychoactifs qui produisent des effets psychiques par agonisme des récepteurs sérotoninergiques (5-HT), en particulier le récepteur 5-HT2A. La psilocybine, le diéthylamide de l’acide lysergique (LSD), la N, N-diméthyltryptamine (DMT) et le breuvage contenant de la DMT, l’ayahuasca, sont des exemples prototypiques de psychédéliques utilisés à des fins récréatives. Il a été démontré qu’ils influencent l’état physiologique, cognitif et émotionnel de l’homme, notamment par des changements d’humeur et un traitement conscient accru des émotions. Les psychédéliques sont considérés comme physiologiquement sûrs car ils ne provoquent pas de toxicité physique. Les effets dépendent de la dose, du type de substance, de la voie d’administration, du poids corporel, de la tolérance, de l’âge, de l’espèce et du métabolisme, les doses élevées intensifiant souvent les effets subjectifs par rapport aux doses plus faibles. D’autres prédicteurs importants des effets psychédéliques sont l’état mental (set) et l’environnement (setting), l’humeur et la personnalité.
En y regardant de plus près, ces psychédéliques diffèrent légèrement dans leurs caractéristiques pharmacologiques. La psilocybine, que l’on trouve dans certains champignons comme le Psilocybe Cubensis, est rapidement dégradée en psilocine, son métabolite actif, après ingestion. La psilocine et la psilocybine présentent toutes deux une affinité pour une série de récepteurs de la sérotonine (5-HT1A/B/D/E, 2B, 5, 6, 7) avec une forte affinité pour le récepteur 5-HT2A. Les effets psychologiques commencent environ 10-40 minutes après l’ingestion et durent de 2 à 6 heures. Une pharmacocinétique linéaire a été démontrée pour la gamme de doses orales de 0,3-0,6 mg/kg. Le LSD présente une affinité pour les récepteurs 5-HT1A/D, 2A/B/C et 5-HT6, les récepteurs dopaminergiques D1 et D2 et les récepteurs α-adrénergiques. Il présente un agonisme partagé pour les récepteurs 5-HT2A et les récepteurs dopaminergiques D2. L’effet physiologique aigu d’une dose modérée de LSD, 75-150 μg p.o. pour les humains, montre des effets pharmacocinétiques proportionnels à la dose qui durent 6-12 h, avec la concentration plasmatique maximale après 1,5 h. La DMT et son analogue, la 5-MeO-DMT, sont des agonistes des récepteurs 5-HT1A/D, 2A et 5-HT6, et des récepteurs 5-HT1A et 2A/B/C, respectivement. L’ayahuasca contient, outre la DMT, des β-alcaloïdes non psychédéliques qui agissent comme des inhibiteurs de la monoamine oxydase A. Ces composés permettent à la DMT de traverser le tube digestif et d’atteindre le cerveau sans être métabolisée. Lorsque le DMT est administré sans les autres composants de l’ayahuasca, les effets apparaissent quelques minutes après l’ingestion, par inhalation ou par injection, et durent 15 minutes. Après l’ingestion d’ayahuasca, les effets sont perceptibles 30 minutes après l’ingestion et durent 3 heures, avec un pic à 1,5-2 heures, correspondant au pic de concentration plasmatique de DMT, ce qui indique un rôle significatif de la DMT dans la pharmacologie de l’ayahuasca.
Outre leurs effets aigus, des études ont démontré que les psychédéliques induisent également des changements dans les processus, comme mentionné ci-dessus, au-delà de leur durée de vie prévue dans le plasma sanguin. La recherche naturaliste, par exemple, a montré une amélioration des processus émotionnels et cognitifs après l’auto-administration orale de psilocybine et d’ayahuasca, dans un contexte social, qui dure jusqu’à 4 semaines après l’expérience, par rapport à la ligne de base. Dans des études expérimentales contrôlées par placebo, le LSD, l’ayahuasca et la psilocybine ont amélioré les symptômes dépressifs, anxiolytiques et de dépendance chez les patients après une ou deux doses, mesurables 3 semaines à 6 mois après l’administration. Étant donné la nature persistante des effets psychologiques au-delà de la présence de la substance dans le sang, une adaptation biologique est suggérée.
Les adaptations biologiques qui peuvent sous-tendre les changements comportementaux et cognitifs persistants des psychédéliques incluent des changements dans la neuroplasticité. La neuroplasticité est la capacité du cerveau à changer tout au long de la vie et consiste en des changements dans la structure cellulaire, la plasticité structurelle, et des changements dans l’efficacité de la transmission synaptique, également appelée plasticité fonctionnelle. La plasticité structurelle et la plasticité fonctionnelle sont des processus interconnectés au niveau moléculaire et (sous-)cellulaire (figure 1).
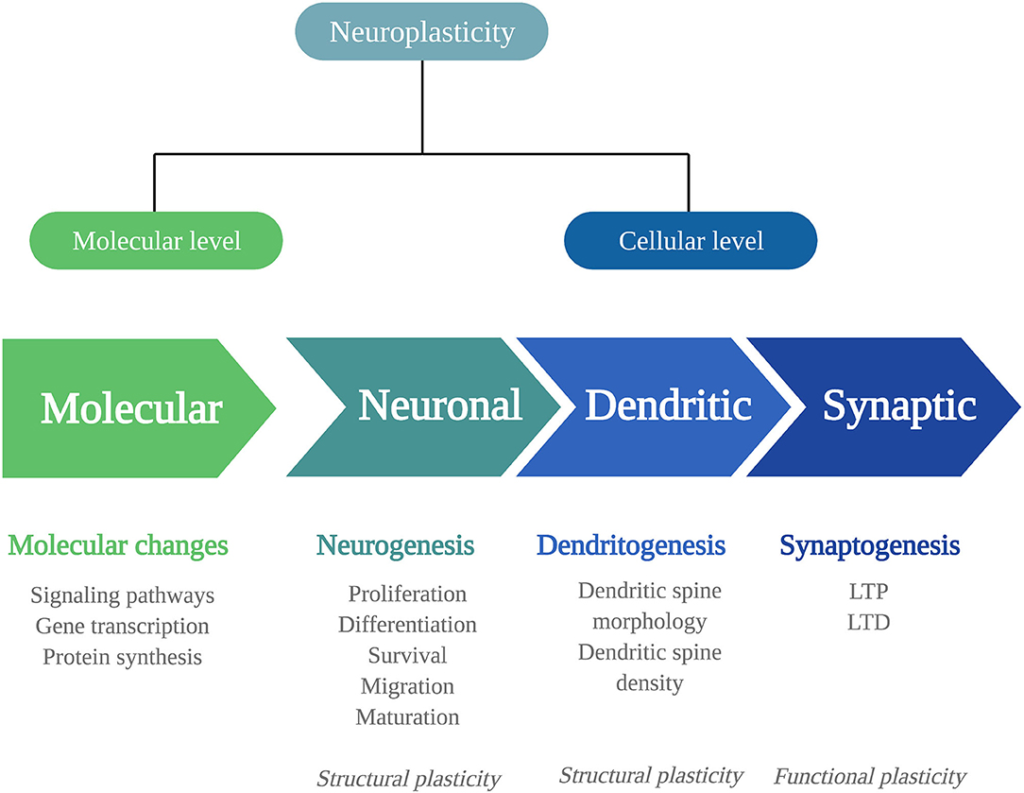
Pour bien comprendre l’étendue des effets des psychédéliques à ces niveaux, il faut d’abord donner plus de détails sur les niveaux auxquels la neuroplasticité peut se produire et sur les substances de signalisation impliquées.
Au niveau moléculaire, les changements neuroplastiques se produisent via des voies de signalisation, c’est-à-dire des cascades de protéines intracellulaires transmettant des signaux des récepteurs à l’ADN. Les voies de signalisation sont activées par un afflux de Ca2+ dû à la dépolarisation ou à l’activation des récepteurs N-méthyl-D-aspartate (NMDAR). Elles comprennent la protéine kinase dépendante du Ca2+/calmoduline (CaMK2), la kinase régulée extracellulaire 1/2 (ERK1/2), la protéine kinase activée par les agents pathogènes (MAP)/ERK et la voie du facteur neurotrophique dérivé du cerveau/récepteur de la propomyosine kinase B (BDNF/TrkB). Dans le noyau, la protéine de liaison de l’élément répondant à l’AMP cyclique (CREB) ou le complexe protéique du facteur nucléaire kappa B (NF-kB) sont activés, ce qui permet de moduler la transcription des gènes et la synthèse des protéines dans les processus de plasticité. Par exemple, les gènes précoces immédiats (IEG), tels que c-Fos, Arc, Egr1/2, C/EBP-β, Fosb, Junb, Sgk1, Nr4a1 et Dusp1, sont rapidement exprimés lors de l’activité neuronale et sont essentiels à la plasticité synaptique. Ces changements dans l’expression des gènes liés à la plasticité peuvent influencer la neuroplasticité au niveau cellulaire.
Au niveau cellulaire, les changements peuvent être structurels ou fonctionnels, et les deux types ont des niveaux différents qui seront énumérés ici. La plasticité structurelle comprend la plasticité neuronale, la plasticité dendritique et la plasticité synaptique. La plasticité neuronale consiste en la neurogenèse, c’est-à-dire la génération de neurones, et se déroule en plusieurs phases distinctes. Tout d’abord, des cellules progénitrices proliférantes sont générées dans la zone subgranulaire de l’hippocampe et se différencient en neurones du granule denté. Les cellules proliférantes qui survivent à l’élimination par mort cellulaire apoptotique migrent et mûrissent en cellules granuleuses nouveau-nées et s’intègrent pleinement dans le réseau hippocampique. La plasticité dendritique comprend des changements dans le nombre ou la complexité des épines dendritiques, où un nombre élevé d’épines et des branches dendritiques complexes reflètent une plus grande force synaptique. Il convient de noter que la libération massive d’acide γ-aminobutyrique (GABA) ou de glutamate entraîne la formation d’épines dendritiques.
Au niveau de la synapse, la force des synapses est liée à l’apprentissage et à la formation de la mémoire. Elle peut changer dans deux directions, soit en augmentant, appelée potentialisation à long terme (LTP), soit en diminuant, appelée dépression à long terme (LTD). Ce type de plasticité synaptique modifie la structure du neurone et ses propriétés fonctionnelles. La plasticité synaptique est régulée par divers facteurs, la protéine BDNF étant le principal régulateur ; le BDNF est fortement exprimé dans tout le système nerveux central, en particulier dans l’hippocampe.
Le BDNF est impliqué à de multiples niveaux de la neuroplasticité, comme la modulation synaptique, la neurogenèse adulte et la croissance dendritique. Il est intéressant de noter que des études ont montré que les niveaux de BDNF sont diminués dans les populations pathologiques souffrant d’anxiété, de dépression et d’addiction. La recherche préclinique et clinique a montré que ces marqueurs sont augmentés et renforcés par les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) utilisés pour gérer les symptômes de ces troubles. La kétamine, agent dissociatif à action rapide, qui a montré son efficacité dans le traitement de la dépression, est connue pour augmenter les niveaux de BDNF. Il a été suggéré que les effets thérapeutiques persistants des psychédéliques sont attribuables à un mécanisme biologique similaire.
L’influence des psychédéliques sur la neuroplasticité est étudiée dans des études précliniques (in vitro/in vivo) et cliniques (Figure 2). Les études in vitro utilisant des lignées cellulaires de rongeurs comprennent des cellules souches neuronales (CSN) dérivées de la zone subgranulaire de l’hippocampe de souris embryonnaires. Les lignées cellulaires humaines comprennent les cellules souches pluripotentes induites (iPSC), les organoïdes cérébraux qui consistent en des cellules cultivées artificiellement de tissus synthétisés ressemblant au cortex, et la lignée cellulaire de neuroblastome SH-SY5Y. Cette dernière peut être utilisée pour modéliser la fonction et la différenciation neuronales, ainsi que la neurodégénérescence en induisant des dommages chimiques (privation d’oxygène) par l’administration in vitro de l’analogue de la dopamine et de la neurotoxine 6-hydroxydopamine (6-OHDA). Les études in vivo chez les rongeurs utilisent l’électrophysiologie, la mesure de la transcription des gènes et des niveaux de protéines, ainsi que des modèles de knock-out des récepteurs pour tester la contribution, par exemple, d’un récepteur spécifique dans les effets du médicament. En outre, une technique in vivo bien établie pour identifier la neurogenèse est l’immunocoloration [“immunohistochimie” (IHC)] avec le marqueur mitotique 5-bromo-2′-désoxyuridine (BrdU) ou Ki-67 pour déterminer la croissance et la division des cellules progénitrices (prolifération). Ces techniques peuvent être utilisées chez des animaux sains et intacts ou après une lésion chirurgicale du cerveau par suture d’une artère carotide interne pour tester les changements de neuroplasticité après administration de médicaments et lésion cérébrale.
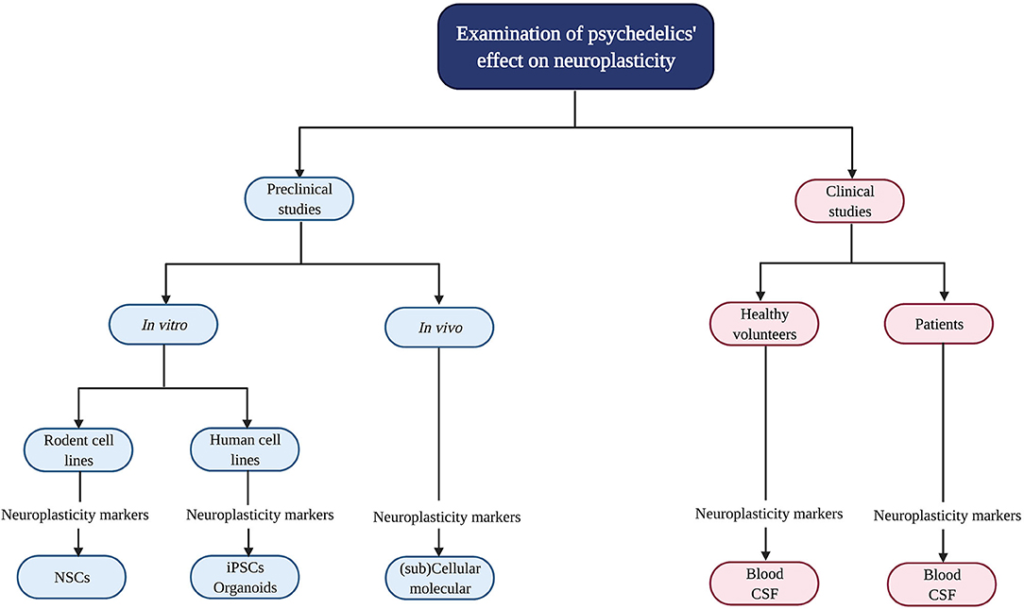
Dans les études cliniques, des échantillons biologiques sont prélevés sur des volontaires sains et des patients souffrant d’une psychopathologie telle que la dépression résistante au traitement (TRD) afin de déterminer les niveaux de BDNF. Les symptômes cliniques sont évalués à l’aide, par exemple, de l’échelle d’évaluation de la dépression de Montgomery-Åsberg (MADRS) pour tester la gravité de la dépression.
En résumé, on suppose que les changements neurobiologiques, en particulier l’amélioration de la neuroplasticité, sont à la base des effets thérapeutiques des psychédéliques. Les techniques mentionnées ci-dessus peuvent être utilisées pour évaluer les changements de plasticité après l’administration de psychédéliques par rapport à la ligne de base, à un placebo ou à un groupe de contrôle. Il est essentiel de comprendre les voies biologiques des effets aigus et persistants des psychédéliques pour saisir tout le potentiel thérapeutique de ces composés. Bien que les psychédéliques n’aient pas encore d’utilisation thérapeutique établie en psychiatrie, les résultats préliminaires prometteurs de leur potentiel thérapeutique justifient des recherches plus approfondies et donnent un aperçu des fondements biologiques des troubles psychiatriques. Pour combler cette lacune et répondre à la question des effets des psychédéliques (sérotoninergiques) sur la neuroplasticité moléculaire et cellulaire, une étude systématique a été réalisée en se concentrant exclusivement sur les psychédéliques sérotoninergiques classiques (y compris la psilocybine, le LSD, l’ayahuasca, le DMT et son analogue étroitement apparenté, la 5-méthoxy-N,N-diméthyltryptamine, 5-MeO-DMT). Ces substances ont été choisies en raison de leur agonisme commun sur les récepteurs 5-HT2A. À l’instar des ISRS et de la kétamine, on a émis l’hypothèse que les psychédéliques favorisent la neuroplasticité moléculaire et cellulaire.
[……]
Études précliniques
Les effets des psychédéliques sur la neuroplasticité moléculaire et cellulaire dans les études précliniques sont présentés du niveau moléculaire au niveau subcellulaire. Elles sont séparées par des études in vitro et in vivo. Les résultats des études précliniques (n = 15 sur 16) suggèrent que les psychédéliques induisent des modulations synaptiques structurelles et fonctionnelles au niveau moléculaire et cellulaire (Tableau 1).
In vitro
Des études in vitro (n = 5) suggèrent que les psychédéliques stimulent la neuroplasticité moléculaire et cellulaire. L’effet aigu d’une dose unique de (5-MeO-)DMT sur la neuroplasticité a été étudié par trois études in vitro. L’administration de DMT (10 μM) et de LSD (90 μM) à des neurones corticaux de rat (n = 39-41) pendant 24 h a entraîné une augmentation de la complexité dendritique, exprimée par une augmentation du nombre et de la longueur totale des dendrites par rapport aux témoins traités avec le véhicule. Les propriétés de promotion des épines dendritiques se sont avérées être médiées par le 5-HT2AR, car elles ont été bloquées par la kétansérine. Le LSD était le psychédélique le plus puissant en ce qui concerne la neuritogenèse par rapport aux psychédéliques testés. Dans des organoïdes cérébraux humains (n = 4-5), la 5-MeO-DMT (13 μM) administrée pendant 24 h a directement entraîné la synthèse stimulée de protéines impliquées dans les voies de signalisation intracellulaires liées à la plasticité, telles que le NMDAR, le récepteur alpha-amino-3-hydroxy-méthyl-5-4-isoxazolpropionique (AMPAR) et l’Eprhin B2. Ces résultats montrent des changements aigus dans les processus moléculaires liés à la neuroplasticité structurelle et fonctionnelle induite par le 5-MeO-DMT.
Outre la stimulation de la neuroplasticité dans des conditions “optimales” (saines), des données montrent qu’une dose unique de DMT (1, 10, 50, 200 μM) présente des propriétés neuroprotectrices aiguës dans des cellules iPSCs humaines cultivées qui ont été différenciées en neurones corticaux (n = 3) et exposées à un stress neuronal sévère. Le DMT a stimulé la neurogenèse en augmentant le taux de survie neuronale de 19% (cellules non traitées) à 31% (10 μM) et 64% (50 μM), 6 h après l’exposition à un stress hypoxique sévère. En outre, le silençage sélectif du récepteur intracellulaire sigma-1 (S1R) (64), qui favorise la plasticité, a diminué la survie des iPSC de 93 %, ce qui indique que le S1R a joué un rôle de médiateur dans la survie induite par le DMT. L’ensemble de ces résultats montre qu’une dose unique de 5-MeO-DMT, de DMT et de LSD in vitro stimule directement la plasticité dendritique et neuronale résultant de changements intracellulaires. Les effets subaigus et à long terme d’une dose unique de psychédélique sur la plasticité moléculaire et cellulaire n’ont pas été étudiés in vitro.
Les effets aigus de l’administration répétée de DMT et d’ayahuasca ont été étudiés in vitro et suggèrent une stimulation de la neuroplasticité à un niveau (sub)cellulaire. L’administration quotidienne répétée de DMT (1 μM, 7 jours) à des cellules souches neurales (n = 6) de la zone subgranulaire du gyrus denté de souris adultes a montré une stimulation de la prolifération, et de la différenciation en neurones, astrocytes et oligodendrocytes (41). Dans des cellules humaines cultivées de neuroblastome (SH-SY5Y) (n = 3) exposées à un stress neurotoxique par 6-OHDA, la viabilité cellulaire a été modifiée de manière différentielle après traitement par l’ayahuasca (1, 1,5, 2,5, ou 10 μg/mL) toutes les 24 h, et incubation pendant 48 et 72 h. De faibles doses d’ayahuasca (1,5 et 2,5 μg/mL) ont augmenté la viabilité cellulaire (±70 %) par rapport aux témoins non stressés après 48 h, tandis que la viabilité cellulaire a diminué après une forte dose (10,5μg/mL) à 72 h après l’administration. Ces résultats suggèrent des effets stimulants aigus de la plasticité neuronale par le DMT, des propriétés neuroprotectrices dépendantes de la dose, et peut-être des effets prolifératifs de l’ayahuasca dans des cultures cellulaires stressées à faibles doses. L’ensemble des résultats des études in vitro confirme les caractéristiques de promotion de la plasticité du DMT, de l’ayahuasca et du LSD lorsqu’ils sont administrés une ou plusieurs fois. Les effets subaigus et à long terme de l’administration répétée de psychédéliques sur la plasticité moléculaire et cellulaire n’ont pas été étudiés in vitro.
In vivo
Les études in vivo (n = 13 sur 16) indiquent également des effets neuroplastiques des psychédéliques. Les résultats des études in vivo portant sur les effets aigus d’une dose unique de 5-MeO-DMT, DMT, psilocybine et LSD (37%) suggèrent une altération de la plasticité cellulaire de nature structurelle et fonctionnelle. Une dose unique de 5-MeO-DMT (100 μg, i.c.v.) a stimulé la neurogenèse et la spinogenèse chez des souris (n = 5), 12 h après le traitement. La prolifération des cellules neuronales progénitrices et la survie des cellules granuleuses nouveau-nées ont augmenté dans l’hippocampe ventral, une zone du cerveau impliquée dans la régulation des émotions et du stress, par rapport aux témoins traités avec le véhicule. Dans cette étude, la 5-MeO-DMT a également stimulé la spinogenèse des cellules granuleuses dans l’hippocampe. Les épines dendritiques se sont développées plus rapidement pour atteindre la morphologie complexe d’un neurone mature. L’analyse électrophysiologique a montré un seuil de potentiel d’action plus bas des synapses dans l’hippocampe, ce qui indique que les synapses sont plus enclines à recevoir une entrée synaptique et suggère une plasticité fonctionnelle stimulée. Une dose unique de psilocybine (0,5, 1, 2, 4, 8, 14, 20 mg/kg, i.p.) administrée à des rats (n = 10) a modifié l’expression des gènes favorisant la plasticité dans le cortex préfrontal (PFC) et l’hippocampe, 90 minutes après le traitement. La psilocybine a stimulé l’expression des IEG dans le PFC et a induit des effets stimulants et inhibiteurs dans l’hippocampe. Étant donné que davantage de gènes cibles ont été régulés dans le PFC, les auteurs ont suggéré une stimulation plus forte dans le PFC que dans l’hippocampe par la psilocybine. En outre, dans les deux zones, la plupart des IEG ont été affectés de manière dose-dépendante, des doses plus élevées entraînant une plus grande stimulation de l’expression génique. Une dose unique de LSD (0,20, 0,24, 0,5, 1,0 mg/kg i.p.) a stimulé l’expression de l’ARNm des gènes favorisant la plasticité dans le cortex des rats et des souris, dans les 1 à 2 heures suivant l’administration et de manière dépendante du temps et de la dose. Inversement, dans une autre étude portant sur des rats (n = 5) ayant reçu du LSD (0,5 mg/kg, i.p.), aucun changement n’a été constaté dans la prolifération hippocampique 2,5 h après l’administration par rapport aux témoins traités avec le véhicule, comme l’indiquent les cellules BrdU+ (60). Dans l’ensemble, il est démontré qu’un traitement unique avec des psychédéliques régule de manière aiguë les processus moléculaires de l’expression des gènes favorisant la plasticité, la neuroplasticité au niveau cellulaire de la neurogenèse, et la plasticité dendritique. Les effets subaigus des psychédéliques d’une dose unique de DMT (10 mg/kg, i.p.) ont été étudiés dans les neurones pyramidaux corticaux de rat (n = 11-37 neurones de trois animaux). Les courants post-synaptiques excitateurs spontanés (EPSC) et la densité des épines dendritiques ont été stimulés 24 heures après l’administration, ce qui indique une stimulation de la plasticité structurelle et fonctionnelle. Les effets à long terme d’une dose unique de psychédéliques n’ont pas été évalués sur la plasticité moléculaire et cellulaire in vivo.
Des études in vivo portant sur les effets subaigus et à long terme, mais pas aigus, de l’administration répétée de psychédéliques (n = 3) montrent que le DMT et le LSD stimulent la neurogenèse. Les effets subaigus d’un traitement répété (4 jours consécutifs) ou prolongé (21 jours, tous les deux jours) de DMT (2 mg/kg, i.p.) ont été évalués sur la neurogenèse chez la souris, 24 h après l’arrêt de l’administration (41). Le traitement à court terme (n = 5) a entraîné l’apparition de cellules BrdU+ dans l’hippocampe, ce qui indique une prolifération et une migration accrues des précurseurs neuronaux, et le traitement à long terme (n = 12) a augmenté la survie neuronale dans la zone subgranulaire. L’administration répétée de LSD (0,5 mg/kg, i.p.), quotidiennement pendant sept jours consécutifs à des rats (n = 3-5) n’a pas entraîné de changements dans les cellules BrdU+ par rapport aux témoins traités avec le véhicule, 26 h après l’administration, ce qui indique que l’administration répétée de LSD n’a pas affecté la neurogenèse (60). L’ensemble de ces résultats montre que l’administration répétée de DMT, mais pas de LSD, a stimulé la neurogenèse hippocampique de manière subaiguë. Les effets à long terme de doses répétées de psychédéliques ont été examinés pour le LSD, au niveau moléculaire. Un traitement chronique au LSD (0,16 mg/kg i.p., tous les deux jours pendant 90 jours) a augmenté l’expression des gènes liés à la plasticité dans le mPFC des rats (n = 10), 4 semaines après l’arrêt du traitement. Parmi les gènes régulés à la hausse, on trouve Bdnf, Egr2, Nor-1, Nr2a et Npy. Nr2a code pour les sous-unités des récepteurs NMDA, et la protéine NPY stimule la neurogenèse et a des effets anxiolytiques. Ces résultats montrent que l’administration répétée de LSD stimule l’expression des gènes liés à la plasticité 4 semaines après le traitement. Dans l’ensemble, les résultats des études in vivo confirment les propriétés de promotion de la plasticité des psychédéliques au niveau moléculaire et cellulaire après l’administration d’une dose unique ou de doses multiples.
Comportement
Quatre études (sur 16) ont examiné la relation entre les effets biologiques des psychédéliques (5-MeO-DMT, DMT, ayahuasca, LSD et psilocybine) et les changements comportementaux. Alors que les effets aigus d’une dose unique de psychédélique sur les marqueurs biologiques et le comportement n’ont pas été évalués, les effets à long terme d’une dose unique de psilocybine ont été étudiés. Des souris (n = 6) ayant reçu une seule dose faible de psilocybine (0,1 mg/kg, i.p.) ont montré une augmentation non significative de la prolifération des cellules progénitrices de l’hippocampe 14 jours plus tard. En revanche, des doses plus élevées (1,0 mg/kg, i.p.) ont entraîné une diminution significative de la prolifération, 14 jours après le traitement. Afin d’étudier si l’hippocampe est le médiateur des changements comportementaux 48 h après le traitement à la psilocybine, des souris (n = 9-10) ont été soumises à un conditionnement de peur. Les souris traitées à la psilocybine ont présenté une extinction accrue par rapport aux témoins traités à la solution saline pour toutes les doses, ce qui indique une réponse d’apprentissage plus rapide à la peur. Au niveau biologique, la psilocybine a induit un effet dose-dépendant sur la neurogenèse, une faible dose augmentant la neurogenèse et une forte dose la diminuant. Les effets comportementaux de la psilocybine ont montré une stimulation indépendante de la dose de l’extinction de la peur, ce qui suggère que les altérations de la neurogenèse hippocampique ne sont pas liées à l’extinction de la peur après l’administration de psilocybine.
La relation entre les effets des psychédéliques sur les marqueurs biologiques et le comportement a également été étudiée après une administration répétée de psychédéliques. Trois études ont examiné les effets immédiats et à long terme de l’administration répétée d’ayahuasca, de LSD et de DMT. L’ayahuasca a été administrée quotidiennement à des rats (n = 7-10) pendant 28 jours, à une dose de 0,5, 1 ou 2 fois la dose orale rituelle humaine, soit 0,26 mg/kg de DMT p.o., 2,58 mg/kg d’harmine, 0,171 mg/kg d’harmaline et 0,33 mg/kg de tétrahydroharmine. Ces modes d’administration n’ont pas modifié les taux de protéines BDNF dans l’hippocampe et ont entraîné une augmentation du comportement anxieux chez les rats mâles traités avec la dose moyenne, 1 heure après le dernier traitement. Après 3 heures, les rats femelles traités avec la dose élevée présentaient une augmentation des niveaux de protéines BDNF hippocampiques, mais n’ont pas modifié leur comportement anxieux. Ces résultats indiquent des effets directs de l’ayahuasca sur la neuroplasticité moléculaire et le comportement anxieux, en fonction du sexe et de la dose.
Alors que les effets subaigus de doses répétées de psychédéliques n’ont pas été étudiés, les effets à long terme de l’administration chronique de DMT (2 mg/kg, i.p.) (21 jours, tous les deux jours) à des souris (n = 10-12) ont été testés. Les résultats ont montré une neurogenèse accrue qui correspondait à une amélioration de l’apprentissage spatial et des tâches de mémoire pendant 10 jours après le traitement. Dans une étude menée sur des rats (n = 10) ayant subi une lésion cérébrale chirurgicale et traités par DMT (1 mg/kg, i.p., suivi d’une dose d’entretien de 2 mg/kg/h pendant 24 h), le DMT a entraîné une stimulation des taux corticaux (ARNm) et plasmatiques de BDNF (protéine) 1 h après l’arrêt du traitement par DMT. Sur le plan comportemental, les rats (n = 8) ont montré une fonction motrice accrue qui a duré jusqu’à 30 jours après le traitement. De plus, les animaux (n = 10) traités par DMT combiné à un antagoniste du S1R (BD-1,063) présentaient un volume de lésion plus important que les animaux traités par DMT 24 h après l’apparition des lésions cérébrales, ce qui suggère que les effets du DMT sont médiés par le S1R. Ces résultats montrent que le DMT a un impact stimulant immédiat sur les processus de plasticité moléculaire et favorise la récupération du comportement jusqu’à un mois après une lésion cérébrale induite. Dans l’ensemble, les résultats des études comportementales confirment les caractéristiques de promotion de la plasticité de l’ayahuasca et du DMT au niveau moléculaire et cellulaire, accompagnées de changements comportementaux liés à la plasticité.
Études cliniques
Les résultats de quatre études randomisées, contrôlées par placebo, examinant les effets aigus et subaigus, mais pas à long terme, d’une dose unique de psychédéliques au niveau moléculaire, montrent qu’un traitement unique à l’ayahuasca ou au LSD peut, mais pas toujours, augmenter le BDNF circulant chez les volontaires sains et les patients atteints de TRD (Tableau 2). La recherche clinique sur les effets des psychédéliques sur la neuroplasticité cellulaire fait défaut.
Une dose unique et faible de LSD (5, 10 et 20 μg) administrée à des volontaires sains (n = 24) a entraîné une augmentation des taux sériques de BDNF par rapport au placebo, 6 h après le traitement. Les échantillons de sang prélevés toutes les 2 h, jusqu’à 6 h après l’administration, ont montré des niveaux élevés de BDNF plasmatique à 4 h après l’administration pour la dose de 5 μg, et à 6 h pour la dose de 20 μg. Les taux de BDNF étaient les plus élevés 4 h après le traitement pour la dose de 5 μg et 6 h après le traitement pour les doses de 10 μg et 20 μg, ce qui suggère une stimulation du BDNF spécifique à la dose (50). Dans une étude croisée menée auprès de participants sains (n = 18) traités avec des doses uniques de LSD (25, 50, 100 et 200 μg) au cours de six séances, avec 10 jours d’intervalle entre les administrations, les résultats ont montré que les niveaux de BDNF dans le plasma sanguin étaient élevés en fonction de la dose par rapport au placebo. Six heures après l’administration de 200 μg, les participants ont signalé une dissolution de l’ego et de l’anxiété, parallèlement à une augmentation du BDNF plasmatique. La réponse subjective a été partiellement prévenue par l’administration d’un antagoniste des récepteurs 5-HT2A/C (kétansérine) 1 h avant le traitement au LSD, comme l’a montré une “réponse à la dose de 25 μg” après l’administration de 200 μg de LSD plus kétansérine.
Les propriétés neuroplastiques subaiguës d’une dose orale unique d’ayahuasca (1 ml/kg, p.o., composition de l’ayahuasca non indiquée) ont été évaluées chez des patients souffrant de TRD (n = 28), et chez des témoins sains (n = 45) naïfs d’ayahuasca, dans un environnement contrôlé. Les niveaux de BDNF dans le sérum sanguin ont augmenté 48 heures après l’administration par rapport à la ligne de base dans les deux groupes, et ils ont été corrélés négativement avec les scores MADRS chez les patients souffrant de TRD traités avec l’ayahuasca. Ces résultats suggèrent qu’une symptomatologie dépressive plus faible est associée à des niveaux de BDNF plus élevés. Il a été suggéré que les patients souffrant de la dépression la plus persistante étaient ceux qui bénéficiaient le plus du traitement par l’ayahuasca. La composition spécifique de l’infusion d’ayahuasca et donc la dose de DMT n’étant pas indiquée dans l’étude, il est difficile de comparer les résultats de cette expérience avec ceux d’études similaires. Inversement, dans une étude de suivi, une dose orale unique d’ayahuasca (1 ml/kg, p.o., 0,36 mg/ml de DMT, 1,86 mg/ml d’harmine, 0,24 mg/ml d’harmaline) administrée à des patients atteints de TRD (n = 28) et à des témoins sains (n = 45) dans un environnement contrôlé n’a pas affecté les taux sériques de BDNF 48 heures après l’administration.
Le nombre limité d’études portant sur les corrélats biologiques moléculaires et comportementaux des effets des psychédéliques montre que les psychédéliques stimulent de manière aiguë et subaiguë la plasticité moléculaire et diminuent les symptômes dépressifs chez les patients sains et les patients souffrant de TRD, avec des effets qui durent jusqu’à 48 heures après l’administration. Les effets biologiques et comportementaux aigus d’une administration répétée sur la plasticité moléculaire et cellulaire n’ont pas été étudiés dans un contexte clinique.
Discussion
Pour comprendre les effets aigus, subaigus (24 h-1 semaine après le traitement) et à long terme des psychédéliques (sérotoninergiques) sur la neuroplasticité moléculaire et cellulaire, des études précliniques et cliniques ont été évaluées. Les études précliniques montrent que les psychédéliques stimulent de manière aiguë les processus de neuroplasticité structurelle au niveau moléculaire et (sous-)cellulaire après une dose unique. Les effets subaigus d’une dose unique de psychédéliques sur la neuroplasticité moléculaire et cellulaire n’ont pas encore été étudiés, et une étude portant sur les effets à long terme de la psilocybine a montré une diminution de la neurogenèse plusieurs semaines après l’administration d’une dose unique. L’administration répétée de psychédéliques stimule la neurogenèse de manière aiguë et la plasticité moléculaire de manière subaiguë. De plus, un nombre limité d’études (pré)cliniques qui ont examiné la relation entre les adaptations biologiques et comportementales ont montré que la stimulation de la plasticité moléculaire et neuronale s’accompagnait d’une augmentation du comportement d’apprentissage. Dans des conditions de stress, la plasticité neuronale et les processus de plasticité moléculaire ont été stimulés chez les rongeurs, et l’augmentation des niveaux de BDNF dans le plasma induite par l’ayahuasca a été corrélée avec une diminution des symptômes dépressifs dans les populations cliniques, de manière subaiguë. De même, les résultats d’études cliniques ont montré que les taux sanguins de BDNF étaient directement élevés chez des participants en bonne santé traités avec une dose unique de LSD. Les effets de l’administration répétée et à long terme sur la plasticité moléculaire et cellulaire n’ont pas été étudiés. Dans l’ensemble, les preuves limitées qui sont présentées sont cohérentes avec notre hypothèse selon laquelle les psychédéliques stimulent la neuroplasticité structurelle moléculaire et cellulaire.
Il est à noter que les effets antidépresseurs de l’ayahuasca peuvent également être produits par ses β-alcaloïdes non psychédéliques, l’harmine, la tétrahydroharmine et l’harmaline, présents dans l’infusion d’ayahuasca. Des études in vitro et in vivo montrent que ces composés stimulent la neurogenèse, le BDNF et ont des effets antidépresseurs. Les changements neuroplastiques induits par l’ayahuasca peuvent résulter de la DMT, des β-alcaloïdes ou d’une interaction entre ces composés, ce qui doit être pris en compte lors de l’interprétation des résultats des études biologiques utilisant l’ayahuasca.
Quatre résultats principaux ressortent de notre étude. La première concerne les différences de doses entre les études précliniques et cliniques et leur transposition de l’animal à l’homme. En clinique, les doses de LSD varient entre 5 et 200 μg. Pour comparer les doses précliniques et cliniques, la formule de conversion dose animale = dose humaine × (37/3) a été utilisée. Par exemple, une dose élevée de 200 μg p.o. de LSD pour un humain d’un poids moyen de 70 kg équivaut à 0,00285 mg/kg et se convertit en une dose de 0,021 mg/kg de LSD pour les rats et de 0,041 mg/kg de LSD pour les souris. En utilisant la formule de molarité (M = m/MW * 1/V où m = masse en grammes, MW = poids moléculaire du LSD et V = volume du diluant en litres), en supposant un poids de souris de 25 g et en préparant une solution de 0,025 L, une approximation de la dose de LSD in vitro serait de 0,126 μM sur la base d’une dose humaine de 200 μg par 70 kg. Ce chiffre est remarquablement plus bas que les 10 μM de LSD utilisés par Ly et al., et probablement encore plus bas pour les autres doses cliniques plus faibles. La conversion des doses in vitro en doses in vivo et vice versa est plus compliquée que ces calculs. Les doses animales de LSD varient entre 0,16 et 1,0 mg/kg i.p. chez les rats et les souris, ce qui indique que les doses de LSD étaient plus élevées dans les études animales que dans les études cliniques. Cette différence est encore plus importante en raison du métabolisme de premier passage qui réduit l’exposition systémique au LSD après l’administration orale utilisée dans les études cliniques. L’administration intrapéritonéale chez les rongeurs permet d’éviter cette dégradation. Ces résultats suggèrent que les doses les plus élevées administrées dans les études cliniques ressemblent aux doses les plus faibles de LSD dans les études précliniques, soulignant un facteur important qui devrait être pris en compte dans la transposition des résultats précliniques à l’homme. Des recherches plus approfondies sur la neuropharmacocinétique des psychédéliques pourraient combler ce fossé entre les doses précliniques et cliniques optimales.
La deuxième découverte significative concerne les différences de sexe dans la réponse aux psychédéliques, qui ont été démontrées dans une étude préclinique où les rats mâles, mais pas les rats femelles, ont montré un comportement d’anxiété accru directement après une administration prolongée d’ayahuasca. Cela pourrait être lié à des changements spécifiques au sexe dans la neuroplasticité. L’œstrogène, hormone sexuelle féminine, exerce des effets antidépresseurs en stimulant le BDNF et la plasticité synaptique, d’une manière distincte pour les mâles et les femelles. Dans cette lignée, les rats femelles ont montré une plus grande sensibilité aux effets antidépresseurs de la kétamine que les rats mâles, et les effets ont été abolis chez les rats dont les ovaires avaient été enlevés et restaurés lorsque des œstrogènes et de la progestérone ont été ajoutés. Les effets antidépresseurs de la kétamine et des psychédéliques résulteraient tous deux de changements dans la neuroplasticité, et ces résultats indiquent un rôle potentiel des hormones gonadiques dans la réponse sexospécifique à ces substances. La recherche neurobiologique sur les modèles animaux privilégie les mâles. Ces faits soulignent l’importance d’étudier les deux sexes dans la recherche préclinique afin de mieux élucider les différences entre les sexes dans les psychopathologies et d’améliorer la transposition aux populations cliniques.
La troisième constatation concerne la mesure du BDNF dans les études cliniques. Toutes les études cliniques ont rapporté les niveaux de BDNF périphérique, une mesure indirecte des niveaux de BDNF dans le cerveau. Il serait plus précis d’examiner les taux de BDNF dans le liquide céphalo-rachidien (LCR), qui reflète directement l’activité cérébrale. Bien que le prélèvement du LCR soit invasif, seul un nombre limité d’études a examiné les niveaux de BDNF dans le LCR ; deux études ont trouvé une corrélation positive entre les niveaux de BDNF dans le LCR et le plasma chez des patients psychotiques et dépressifs au premier épisode. En outre, alors qu’il n’était pas clair auparavant si la réponse clinique était liée aux niveaux de BDNF plasmatique, des preuves suggèrent qu’il existe une relation positive avec l’amélioration clinique liée à une neuroplasticité améliorée. Néanmoins, des recherches supplémentaires sont recommandées pour étudier l’effet des psychédéliques sur les niveaux de BDNF dans le liquide céphalorachidien dans les populations cliniques et leur relation avec les niveaux plasmatiques de BDNF.
La quatrième conclusion de cette étude concerne la taille de l’échantillon de certaines études in vivo, qui était faible. De nombreux chercheurs considèrent qu’un échantillon de six animaux par groupe est une taille d’échantillon adéquate dans la recherche animale, mais il réduit la puissance statistique. Il s’agit d’un problème bien connu dans la recherche (neuro)biologique. Les chercheurs doivent justifier le nombre d’animaux utilisés dans leurs expériences, qui doivent être conçues pour minimiser le nombre d’animaux utilisés. Cela pourrait expliquer la faible taille de l’échantillon dans les études in vivo examinées ici, et il est essentiel d’en tenir compte car cela réduit la puissance statistique et limite la fiabilité des conclusions.
Les changements observés dans la neuroplasticité induits par les psychédéliques sont supposés résulter des voies neurobiologiques activées par le 5-HT2AR lors de l’activation par les psychédéliques, affectant le système sérotonergique et glutamatergique (Figure 4). Les psychédéliques agissent principalement sur les 5-HT2AR exprimés sur les cellules pyramidales glutamatergiques dans les couches corticales et corticales profondes (V et VI). Via l’activation des 5-HT2AR, les psychédéliques activent des voies de signalisation intracellulaires telles que PLC, PLA et Src. L’activation de Src serait essentielle pour les effets hallucinogènes des psychédéliques, car son inhibition empêche les effets hallucinogènes du LSD. L’activation de la signalisation intracellulaire de ces voies conduit à la libération de Ca2+ et de glutamate qui stimule la plasticité synaptique. L’augmentation du glutamate dans le cortex peut stimuler davantage la plasticité synaptique via l’AMPAR sur les neurones pyramidaux de la couche corticale V et le transport ultérieur (trafic) de l’AMPAR vers la membrane de la cellule postsynaptique. Cela augmente la densité des AMPAR, ce qui entraîne une plus grande libération de glutamate extracellulaire et de BDNF dans le cortex. Le potentiel des psychédéliques classiques à modifier le glutamate dans le cortex humain, bien que de manière dépendante de la région, a été démontré. Indirectement, les psychédéliques influencent la plasticité via l’expression du BDNF et d’autres gènes et protéines liés à la plasticité, y compris les IEG. L’ARNm du BDNF cortical a été régulé à la hausse par le LSD et l’ayahuasca. Les GEI sont impliquées dans la plasticité synaptique et la synaptogenèse et de nombreuses GEI codent pour des protéines impliquées dans des cascades de signalisation spécifiques. Par exemple, Arc est localisé dans les dendrites et participe aux réarrangements du cytosquelette, Egr2 a une activité couplée avec le NMDAR, Sgk favorise la survie cellulaire et le récepteur orphelin dérivé des neurones 1 (Nor1 ; NR4A3) est important pour la LTP.
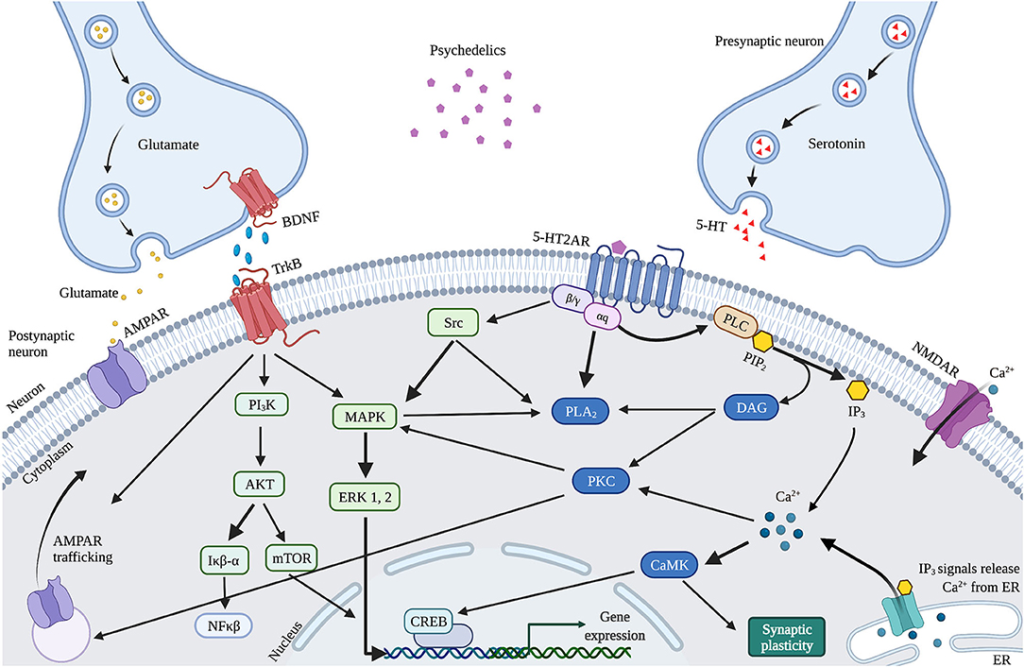
L’amélioration de la neuroplasticité peut également être attribuée aux différences d’affinité des récepteurs, étant donné que les psychédéliques ne sont pas des agonistes 5-HT2AR purs, ce qui pourrait expliquer les différents effets sur la neuroplasticité entre les psychédéliques. Outre le 5-HT2AR, le DMT présente également une forte affinité pour le S1R, qui est fortement exprimé dans l’hippocampe et qui stimule la plasticité synaptique. L’activation du S1R par le DMT a été suggérée pour stimuler la plasticité synaptique en plus de la modulation induite par le 5-HT2AR et est probablement responsable des effets antidépresseurs de l’ayahuasca. En outre, il a été démontré que le LSD stimule indirectement le S1R via l’activation du neurostéroïde déhydroépiandrostérone (DHEA), qui stimule la plasticité synaptique et la neurogenèse. De la même manière, l’activation du S1R par les ISRS renforce l’expression du BDNF. Ces résultats soutiennent l’hypothèse selon laquelle la stimulation de la neuroplasticité induite par les psychédéliques repose sur un mécanisme similaire à celui des ISRS.
La kétamine, un dissociatif, est une autre substance dont les effets antidépresseurs résulteraient d’une augmentation du BDNF et de la plasticité synaptique. En tant qu’antagoniste des NMDAR, la kétamine bloque les NMDAR postsynaptiques situés sur les neurones glutamatergiques du cortex. Elle désactive la kinase du facteur d’élongation eucaryote 2 (eEF2), ce qui atténue le blocage de la traduction du BDNF, entraînant une augmentation des niveaux de BDNF. En outre, on suppose que la kétamine bloque les NMDAR sur les interneurones GABA, ce qui libère l’inhibition de la libération de glutamate. Cela active l’AMPAR sur les cellules glutamatergiques et augmente ensuite le BDNF et le glutamate dans le cortex. La kétamine et les psychédéliques activent les AMPAR corticaux et stimulent ensuite le BDNF et l’efficacité synaptique. Cela pourrait expliquer l’effet antidépresseur et anxiolytique (rapide) des psychédéliques et de la kétamine, et donne un aperçu des fondements biologiques de ces substances et de leur potentiel thérapeutique.
Cette étude systématique est la première à expliquer les effets antidépresseurs et cognitifs rapides des psychédéliques, en étudiant les changements moléculaires et cellulaires liés à la neuroplasticité. Les données examinées ici contribuent à une meilleure compréhension des mécanismes biologiques sous-jacents des psychédéliques sérotoninergiques et soulignent la nécessité d’une recherche scientifique dans ce domaine, car les psychédéliques ne sont pas seulement bénéfiques pour les populations souffrant de psychopathologies, mais aussi pour celles qui n’en souffrent pas, en améliorant les compétences sociales et cognitives telles que l’empathie et la créativité, mais aussi le bien-être général. Des recherches supplémentaires sont essentielles pour établir le mécanisme (intra)cellulaire spécifique activé par les différents psychédéliques, leurs effets à long terme et leur relation avec l’altération du comportement. Les résultats actuels soutiennent la recherche explorant le potentiel des psychédéliques dans le traitement des psychopathologies.
