Ly, C., Greb, A. C., Cameron, L. P., Wong, J. M., Barragan, E. V., Wilson, P. C., … & Olson, D. E. (2018). Psychedelics promote structural and functional neural plasticity. Cell reports, 23(11), 3170-3182.
Abstract
L’atrophie des neurones du cortex préfrontal (PFC) joue un rôle clé dans la physiopathologie de la dépression et des troubles apparentés. La capacité à promouvoir la plasticité structurelle et fonctionnelle dans le PFC a été supposée sous-tendre les propriétés antidépressives à action rapide de l’anesthésique dissociatif qu’est la kétamine. Nous rapportons ici que, comme la kétamine, les psychédéliques sérotoninergiques sont capables d’augmenter fortement la neuritogenèse et/ou la spinogenèse à la fois in vitro et in vivo. Ces changements dans la structure neuronale s’accompagnent d’une augmentation du nombre et de la fonction des synapses, mesurée par microscopie à fluorescence et électrophysiologie. Les changements structurels induits par les psychédéliques semblent résulter de la stimulation des voies de signalisation TrkB, mTOR et 5-HT2A et pourraient expliquer l’efficacité clinique de ces composés. Nos résultats soulignent le potentiel thérapeutique des psychédéliques et, surtout, identifient plusieurs échafaudages principaux pour les efforts de chimie médicinale axés sur le développement de composés favorisant la plasticité en tant que traitements sûrs, efficaces et à action rapide pour la dépression et les troubles connexes.
Introduction
Les maladies neuropsychiatriques, y compris les troubles de l’humeur et de l’anxiété, comptent parmi les principales causes d’invalidité dans le monde et représentent un énorme fardeau économique pour la société. Environ un tiers des patients ne répondront pas aux médicaments antidépresseurs actuels, et ceux qui y répondent ont généralement besoin d’au moins 2 à 4 semaines de traitement avant d’en ressentir les effets bénéfiques. La dépression, le syndrome de stress post-traumatique (PTSD) et l’addiction partagent des circuits neuronaux communs et présentent une comorbidité élevée (Kelly et Daley, 2013). Une prépondérance de preuves provenant d’une combinaison d’imagerie humaine, d’études post-mortem et de modèles animaux suggère que l’atrophie des neurones du cortex préfrontal (PFC) joue un rôle clé dans la physiopathologie de la dépression et des troubles connexes et est précipitée et/ou exacerbée par le stress. Ces changements structurels, tels que la rétraction des neurites, la perte des épines dendritiques et l’élimination des synapses, peuvent potentiellement être contrés par des composés capables de promouvoir la plasticité neuronale structurelle et fonctionnelle dans le PFC, offrant ainsi une solution générale pour traiter l’ensemble de ces maladies apparentées. Cependant, seul un nombre relativement restreint de composés capables de favoriser la plasticité dans le PFC a été identifié jusqu’à présent, chacun présentant des inconvénients significatifs. Parmi eux, l’anesthésique dissociatif kétamine s’est révélé le plus prometteur, revitalisant le domaine de la psychiatrie moléculaire au cours des dernières années.
La kétamine a démontré un potentiel clinique remarquable en tant qu’antidépresseur à action rapide, montrant même une efficacité chez les populations résistantes au traitement. En outre, elle s’est révélée prometteuse pour traiter le PTSD et la dépendance à l’héroïne. Les modèles animaux suggèrent que ses effets thérapeutiques découlent de sa capacité à favoriser la croissance des épines dendritiques, à augmenter la synthèse des protéines synaptiques et à renforcer les réponses synaptiques.
Comme la kétamine, les psychédéliques sérotoninergiques et les entactogènes ont démontré des effets antidépresseurs et anxiolytiques rapides et durables en clinique après une dose unique, y compris dans des populations résistantes au traitement. En fait, de nombreux essais cliniques ont été menés au cours des 30 dernières années pour examiner les effets thérapeutiques de ces drogues, la 3,4-méthylènedioxyméthamphétamine (MDMA) ayant récemment reçu la désignation de “thérapie révolutionnaire” par la Food and Drug Administration pour le traitement du PTSD. En outre, les psychédéliques classiques et les entactogènes produisent des réponses antidépressives et anxiolytiques dans les tests comportementaux sur les rongeurs, tels que le test de natation forcée et l’apprentissage par extinction de la peur, paradigmes pour lesquels la kétamine s’est également révélée efficace. Malgré les propriétés antidépressives, anxiolytiques et anti-addictives prometteuses des psychédéliques sérotoninergiques, leur mécanisme d’action thérapeutique reste mal compris, et les préoccupations relatives à la sécurité ont fortement limité leur utilité clinique.
En raison des similitudes entre les psychédéliques sérotoninergiques classiques et la kétamine dans les modèles précliniques et les études cliniques, nous avons pensé que leurs effets thérapeutiques pourraient résulter d’une capacité commune à promouvoir la plasticité neuronale structurelle et fonctionnelle dans les neurones corticaux. Nous rapportons ici que les psychédéliques sérotoninergiques et les entactogènes de diverses classes chimiques (par exemple, l’amphétamine, la tryptamine et l’ergoline) présentent des propriétés de promotion de la plasticité comparables ou supérieures à celles de la kétamine. Comme la kétamine, ces composés stimulent la plasticité structurelle en activant la cible mammalienne de la rapamycine (mTOR). Pour classer le nombre croissant de composés capables de promouvoir rapidement la plasticité induite, nous introduisons le terme “psychoplastogène”, issu des racines grecques psych- (esprit), -plast (moulé) et -gen (produisant). Notre travail renforce le corpus croissant de littérature indiquant que les psychoplastogènes capables de promouvoir la plasticité dans le PFC pourraient avoir une valeur en tant qu’antidépresseurs et anxiolytiques à action rapide avec une efficacité dans les populations résistantes au traitement et suggère qu’il pourrait être possible d’utiliser les psychédéliques classiques comme structures de plomb pour identifier des alternatives plus sûres.
Résultats
Les psychédéliques favorisent la neuritogenèse
Parce que l’atrophie des neurones corticaux est considérée comme un facteur contribuant au développement des troubles de l’humeur et de l’anxiété, nous avons d’abord traité des neurones corticaux cultivés avec des psychédéliques de diverses classes structurelles (Figures 1A et S1A) et mesuré les changements qui en résultent dans diverses caractéristiques morphologiques. En utilisant l’analyse de Sholl, nous avons observé que plusieurs psychédéliques augmentaient la complexité des arborescences dendritiques de manière comparable à la kétamine, comme mesuré par l’aire sous la courbe des tracés de Sholl ainsi que le nombre maximum de croisements (Figures 1B-1E et S1B-S1E). Cette augmentation de la complexité des arborescences semble résulter de changements importants dans le nombre de branches dendritiques et dans la longueur totale des arborescences (figures 1F, 1H, S1F et S1H). Les psychédéliques ont eu un effet limité sur le nombre de dendrites primaires et n’ont pas modifié la longueur de la dendrite la plus longue (Figures 1G, 1I, S1G, et S1I).
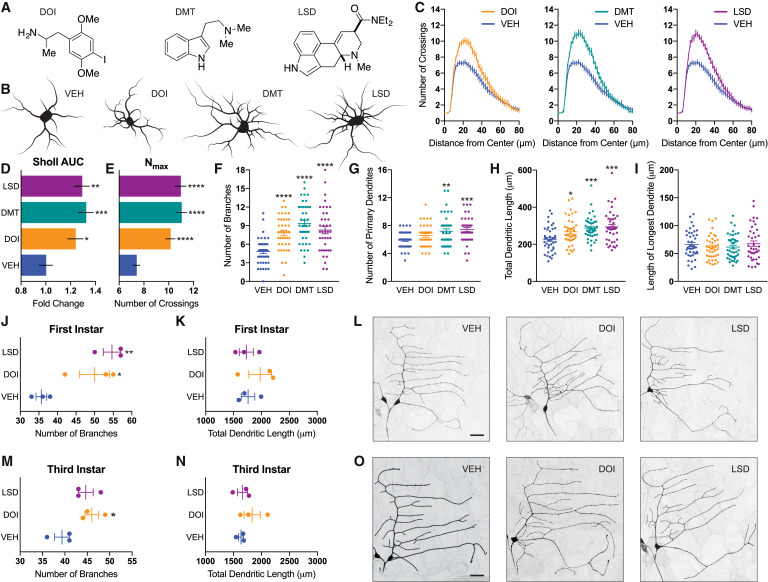
Presque tous les composés psychédéliques testés étaient capables de promouvoir de manière robuste la neuritogenèse, avec des effets comparables produits par les tryptamines (N,N-diméthyltryptamine [DMT] et psilocine), les amphétamines (2,5-diméthoxy-4-iodoamphétamine [DOI] et MDMA), et les ergolines (diéthylamide de l’acide lysergique [LSD]). Comme contrôle positif, nous avons traité les cellules avec du 7,8-dihydroxyflavone (DHF), un psychoplastogène structurellement différent des psychédéliques classiques, et nous avons constaté qu’il augmentait également la complexité des arborescences dendritiques (Figure S2). Ce phénotype structurel de croissance neuritique ne semble être induit que par des composés sélectionnés, car la sérotonine et la D-amphétamine, des molécules chimiquement apparentées aux psychédéliques classiques et aux entactogènes, n’ont exercé que des effets minimes, voire nuls, sur la neuritogenèse (Figure S2).
Pour établir les puissances et efficacités relatives des hallucinogènes et des entactogènes dans la promotion de la croissance des neurites, nous avons mené des études dose-réponse en 8 points (Figure S3). Nous avons défini 100% et 0% d’efficacité comme le nombre maximal de croisements induits par la kétamine (10 μM) et le véhicule (0,1% DMSO), respectivement. Nous avons choisi la concentration de 10 μM de kétamine comme limite supérieure car cette concentration de kétamine est atteinte dans le cerveau après l’administration intrapéritonéale d’une dose d’antidépresseur chez le rat (Yang et al., 2018). Par souci de cohérence, nous avons utilisé cette même concentration pour tester les effets des psychédéliques et des entactogènes, le DMT étant la seule exception. Nous avons utilisé une concentration maximale de 90 μM de DMT dans nos études afin de reproduire plus fidèlement la concentration cérébrale de DMT chez les rats traités avec une dose d’antidépresseur. Dans cet essai de neuritogenèse, la valeur de la concentration efficace semi-maximale (EC50) de la kétamine était de 132 nM. De manière surprenante, la majorité des psychédéliques et des entactogènes que nous avons testés ont montré une puissance significativement supérieure à celle de la kétamine, le LSD étant particulièrement puissant (EC50 = 0,409 nM). En fait, le LSD a montré une activité sur 8 ordres de grandeur jusqu’à la gamme des faibles picomolaires (Figure S3).
Notamment, l’ibogaïne, alcaloïde anti-addictif, est le seul psychédélique testé qui n’a eu aucun effet (Figure S4). Ce résultat est surprenant car nous avons émis l’hypothèse que les propriétés anti-addictives durables de l’ibogaïne pourraient résulter de ses propriétés psychoplastogènes. Des travaux antérieurs de He et al. (2005) ont clairement démontré que l’ibogaïne augmente l’expression du facteur neurotrophique dérivé de la lignée des cellules gliales (GDNF) et que cette protéine favorisant la plasticité est essentielle au mécanisme d’action anti-dépendance de l’ibogaïne. Comme plusieurs rapports ont suggéré que la noribogaïne, un métabolite de l’ibogaïne, pourrait en fait être le composé actif in vivo, nous avons décidé de tester sa capacité à promouvoir la neuritogenèse dans des neurones corticaux en culture. De manière gratifiante, la noribogaïne a fortement augmenté la complexité des arborescences dendritiques avec une valeur EC50 comparable à celle de la kétamine (Figure S3), fournissant des preuves supplémentaires suggérant qu’il pourrait s’agir du composé actif in vivo.
Pour évaluer les effets in vivo des psychédéliques classiques sur la neuritogenèse, nous avons commencé à traiter des larves de drosophile au cours du premier stade avec du LSD et du DOI. Comme observé dans les cultures corticales de rongeurs, le LSD et le DOI ont tous deux augmenté de manière significative la ramification dendritique des neurones sensoriels de classe I ; cependant, ils n’ont pas augmenté la longueur totale des tonnelles dendritiques (Figures 1J-1L). En raison des effets frappants des psychédéliques sur les structures des neurones immatures, nous avons émis l’hypothèse qu’ils pourraient influencer le développement neurologique. Pour vérifier cela, nous avons traité chroniquement des embryons de poisson zèbre avec des composés pendant 6 jours immédiatement après la déchorion et nous avons évalué les changements morphologiques bruts et le comportement. Nous n’avons pas observé de différences dans la taille des têtes entre les groupes de traitement, ni de différences statistiquement significatives dans les niveaux d’activité (Figure S5). Ensuite, nous avons évalué la capacité des psychédéliques à promouvoir la neuritogenèse dans les neurones plus matures en commençant à traiter les larves de drosophile à la fin du deuxième stade. A nouveau, les psychédéliques ont augmenté la ramification des neurones de classe I, bien que l’effet soit moins spectaculaire que celui observé lorsque le traitement a commencé au cours du premier stade (Figure 1M-1O). Bien que les différents stades de développement puissent être plus ou moins sensibles aux effets des psychédéliques, il est également possible que l’effet moins important observé après l’administration de composés à partir du dernier stade soit simplement dû au fait que les larves ont été traitées pendant une période plus courte. Quoi qu’il en soit, il est assez surprenant d’observer des changements dans la structure neuronale induits par les composés après avoir commencé le traitement à la fin du deuxième stade, car les neurones de classe I sont stéréotypés et possèdent généralement relativement peu de branches d’ordre supérieur. De plus, nos résultats démontrent que les psychédéliques peuvent promouvoir des changements dans la structure neuronale chez les vertébrés (rats) et les invertébrés (drosophile), ce qui suggère qu’ils agissent par un mécanisme conservé au cours de l’évolution.
Les psychédéliques favorisent la spinogenèse et la synaptogenèse
En plus de l’atrophie dendritique, la perte des épines dendritiques est une caractéristique de la dépression et d’autres troubles neuropsychiatriques, nous avons donc évalué les effets des psychédéliques sur la spinogénèse. Nous avons traité des cultures corticales de rats matures pendant 24 heures avec du DOI, du DMT et du LSD, des composés représentatifs des classes d’amphétamine, de tryptamine et d’ergoline des psychédéliques, respectivement. Les trois composés ont augmenté le nombre d’épines dendritiques par unité de longueur, mesuré par microscopie à illumination structurée super-résolution (SIM) (figures 2A, 2B et S6), le LSD doublant presque le nombre d’épines par 10 μm. En outre, le traitement a provoqué un changement dans la morphologie des épines, favorisant les types d’épines immatures (minces et filopodium) par rapport aux types d’épines plus matures (champignon) (figure 2C). La colocalisation des marqueurs pré- et postsynaptiques après le traitement a démontré que les psychédéliques ont favorisé la synaptogenèse en augmentant la densité, mais pas la taille des synapses (Figure 2D-2F). Cette augmentation de la densité des synapses s’est accompagnée d’une augmentation de la densité des puncta VGLUT1, mais pas des puncta PSD-95, après l’administration du composé (Figures 2G et 2H).
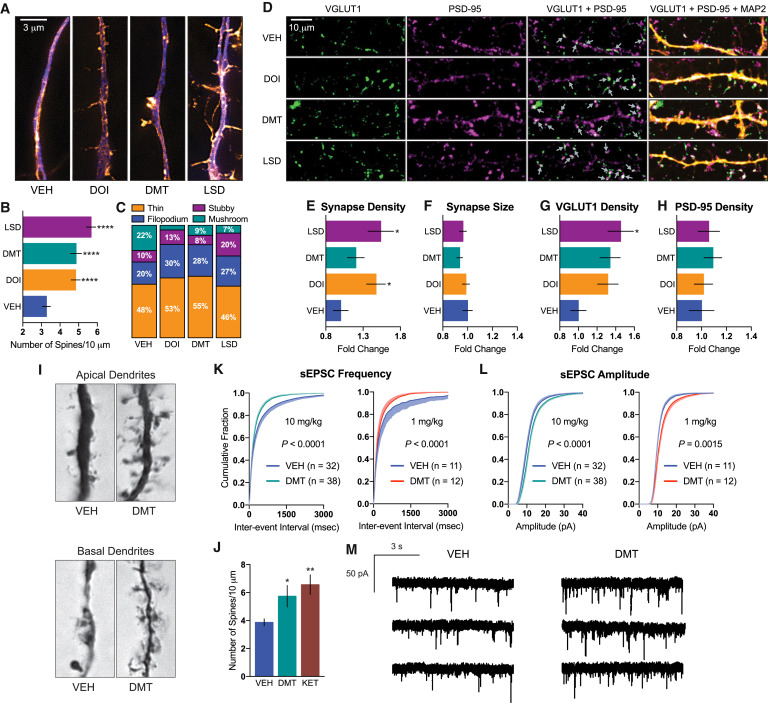
Encouragés par nos résultats in vitro, nous avons ensuite évalué les effets d’une dose intrapéritonéale unique de DMT sur la spinogenèse dans le PFC de rats adultes en utilisant la coloration de Golgi-Cox. Nous avons choisi d’administrer une dose de 10 mg/kg de DMT pour trois raisons. Premièrement, toutes les données disponibles suggèrent que cette dose produirait des effets hallucinogènes chez les rats avec des risques de sécurité minimes. Deuxièmement, nous avons précédemment montré qu’une dose de 10 mg/kg de DMT produit des effets positifs dans les tests comportementaux chez le rat pertinents pour la dépression et le PTSD. Enfin, nous voulions comparer directement les effets du DMT avec ceux de la kétamine, et des études séminales menées par Li et al. (2010) avaient précédemment démontré qu’une dose de 10 mg/kg de kétamine produisait une augmentation robuste de la densité des épines dendritiques dans le PFC des rats. Nous avons observé une augmentation significative de la densité des épines dendritiques sur les neurones pyramidaux corticaux 24 heures après l’administration de DMT (Figures 2I et 2J). Cet effet était comparable à celui produit par la kétamine à la même dose (figure 2J). Il est important de noter que cette augmentation de la densité des épines dendritiques induite par la DMT s’est accompagnée d’effets fonctionnels. Les enregistrements de tranches ex vivo ont révélé que la fréquence et l’amplitude des courants post-synaptiques excitateurs spontanés (EPSC) étaient augmentées après le traitement au DMT (figures 2K-2M). Il est intéressant de noter que les doses de 10 mg/kg et de 1 mg/kg ont produit des réponses similaires malgré le fait qu’elles sont prédites comme étant hallucinogènes et subhallucinogènes, respectivement.
La demi-vie de la DMT étant extrêmement courte (∼15 min), ces résultats confirment que les changements structurels et fonctionnels induits par la DMT persistent pendant des heures après que le composé a été éliminé de l’organisme. De plus, ils démontrent que la DMT produit des effets fonctionnels sur les neurones pyramidaux du PFC qui reflètent ceux produits par la kétamine. Étant donné que le PFC est une région cérébrale clé impliquée dans l’apprentissage de l’extinction, et qu’il a été démontré que la kétamine et le DMT facilitent l’extinction de la peur, nos résultats suggèrent un lien entre les effets favorisant la plasticité et les effets comportementaux de ces médicaments. Étant donné que l’extinction de la peur peut être améliorée par l’augmentation des niveaux de facteur neurotrophique dérivé du cerveau (BDNF) dans le PFC, et qu’il a été démontré que les effets comportementaux de la kétamine dépendent du BDNF, nous avons ensuite cherché à déterminer le rôle de la signalisation du BDNF dans les effets de promotion de la plasticité des psychédéliques classiques.
Les psychédéliques favorisent la plasticité par un mécanisme dépendant de TrkB et mTOR
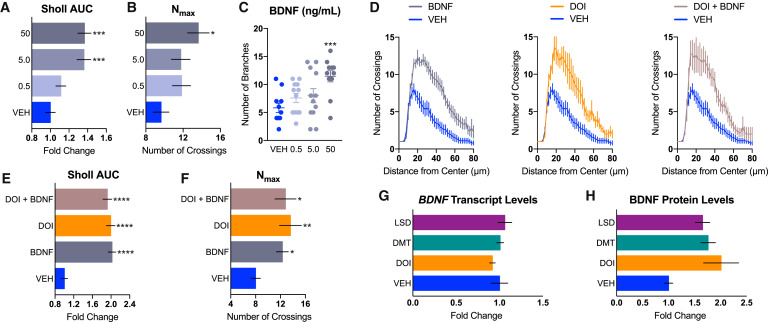
Le rôle du BDNF dans la neuritogenèse et la spinogenèse est bien connu, et plusieurs rapports suggèrent que les psychédéliques sont capables d’augmenter les niveaux de facteurs neurotrophiques. Nous avons donc traité les neurones corticaux avec du BDNF, du DOI et une combinaison des deux pour voir s’ils avaient des effets additifs ou synergiques. Des études dose-réponse utilisant du BDNF recombinant (figures 3A-3C) ont révélé qu’un traitement de 50 ng/mL augmentait la neuritogenèse dans une mesure comparable à celle du DOI (10 μM). En outre, une combinaison des deux n’a pas conféré de bénéfice supplémentaire, ce qui suggère qu’ils fonctionnent par un mécanisme apparenté (figures 3D-3F). Ensuite, nous avons traité les neurones corticaux avec du DOI, du DMT et du LSD pendant 24 heures avant de mesurer l’expression du gène et de la protéine BDNF à l’aide de la PCR numérique en gouttelettes (ddPCR) et de l’ELISA, respectivement. Bien que les psychédéliques n’aient pas augmenté l’expression de la transcription du BDNF (Figure 3G), ils ont multiplié par 2 les niveaux de protéines BDNF, bien que cet effet ne soit pas statistiquement significatif (Figure 3H). Lorsque les cultures corticales ont été traitées conjointement avec l’ANA-12, un antagoniste sélectif du récepteur de haute affinité TrkB du BDNF, la capacité des psychédéliques ou du BDNF à stimuler la neuritogenèse et la spinogenèse a été complètement bloquée (Figure 4).
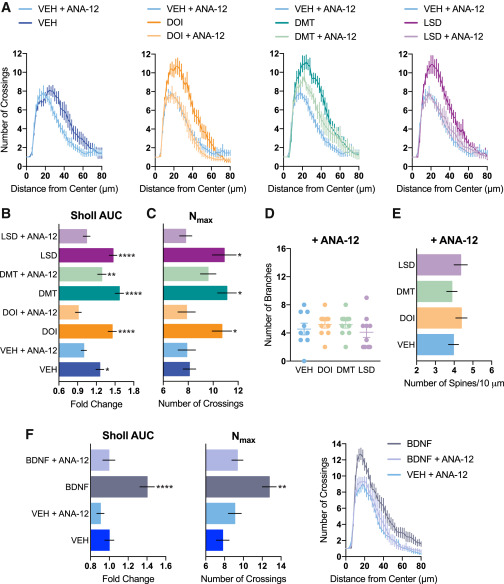
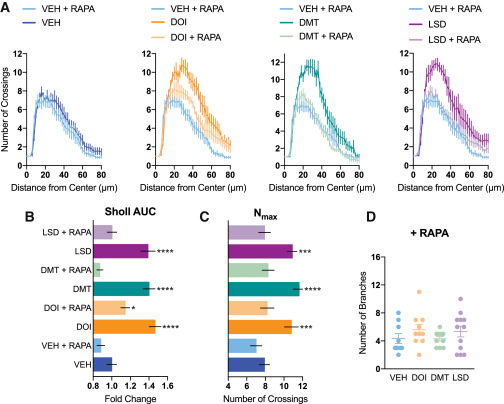
L’activation de TrkB est connue pour promouvoir la signalisation par mTOR, qui joue un rôle clé dans la plasticité structurelle, la production de protéines nécessaires à la synaptogenèse, et les effets de la kétamine. Le traitement avec la rapamycine, un inhibiteur de mTOR, a complètement bloqué la neuritogenèse induite par les psychédéliques (Figure 5), confirmant ainsi que l’activation de mTOR joue un rôle dans les effets de promotion de la plasticité des psychédéliques sérotoninergiques classiques.
Le récepteur 5-HT2A médiateur des effets des psychédéliques sur la plasticité structurelle
Enfin, nous avons cherché à déterminer si le récepteur 5-HT2A jouait un rôle dans les effets de promotion de la plasticité du DOI, du DMT et du LSD, car ce récepteur est connu pour être principalement responsable des effets hallucinogènes des psychédéliques classiques. En outre, les pouvoirs psychoplastogènes de ces composés et des composés apparentés sont bien corrélés avec leurs affinités pour le récepteur 5-HT2A (figure S3) (c’est-à-dire qu’une affinité de liaison 5-HT2A plus élevée prédit généralement des effets psychoplastogènes plus puissants). Des expériences de contrôle ont montré que les récepteurs 5-HT2A étaient exprimés sur les neurones corticaux de rat en culture à la fois à 6 jours in vitro (DIV6) et à DIV19 (Figure 6A). Nous avons ensuite constaté que le co-traitement avec la kétansérine, un antagoniste sélectif des récepteurs 5-HT2A, annulait complètement la capacité du DMT, du LSD et du DOI à promouvoir à la fois la neuritogenèse et la spinogenèse (figures 6B-6F). La kétansérine a également été en mesure de bloquer les effets de la psilocine ainsi que ceux de la noribogaïne, psychédélique non classique, et de la MDMA, agent enactogène (figure 6G).
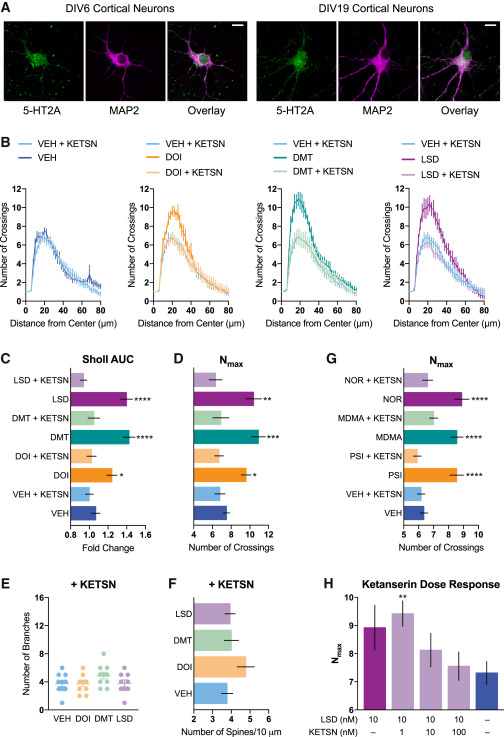
Ces premières expériences ont été réalisées en utilisant des doses de psychoplastogènes produisant des effets maximaux sur la plasticité structurelle (environ 10 μM) en combinaison avec un excès de 10 fois de kétansérine (100 μM). À ces concentrations, nous ne pouvions pas exclure la possibilité que d’autres récepteurs contribuent aux effets antagonistes de la kétansérine. Par conséquent, nous avons traité des neurones corticaux cultivés avec une dose nettement plus faible de LSD (10 nM) et tenté de bloquer sa capacité à promouvoir la croissance des neurites en utilisant des doses croissantes de kétansérine (figure 6H). Nous avons constaté que la kétansérine bloque les effets psychoplastogènes du LSD de ∼50% lorsqu’elle est traitée à 10 nM. Ceci est cohérent avec le fait que les affinités de liaison de la kétansérine et du LSD pour le récepteur 5-HT2A sont à peu près équivalentes (faible nanomolaire). L’augmentation de la concentration de kétansérine à 100 nM, 10 fois plus élevée que la concentration de LSD utilisée dans cette expérience, a complètement empêché la neuritogenèse induite par le LSD. À 100 nM, la kétansérine est relativement sélective pour le récepteur 5-HT2A, bien qu’à cette concentration, nous ne puissions pas exclure l’implication possible des récepteurs 5-HT2C, adrénergiques ou histaminiques.
Enfin, les réponses à la concentration de la plupart des psychoplastogènes ont des pentes de colline qui s’écartent de 1,0 (Figure S3), ce qui implique une polypharmacologie. Comme les psychédéliques ont une affinité relativement élevée pour les récepteurs 5-HT2A, il est probable que les effets des psychédéliques soient médiés principalement par les récepteurs 5-HT2A à de faibles concentrations et modulés par d’autres cibles à des concentrations élevées. Il est intéressant de noter que la réponse à la concentration de DMT est la seule à présenter une pente de Hill supérieure à 1,0, ce qui indique une certaine forme de coopérativité.
Discussion
Les psychédéliques sérotoninergiques classiques sont connus pour provoquer des changements d’humeur et de fonction cérébrale qui persistent longtemps après que les effets aigus des drogues se soient dissipés. En outre, plusieurs psychédéliques élèvent les niveaux de glutamate dans le cortex et augmentent l’expression génétique in vivo de la neurotrophine BDNF ainsi que des gènes à action immédiate associés à la plasticité. Ces preuves indirectes ont conduit à l’hypothèse raisonnable que les psychédéliques favorisent la plasticité neuronale structurelle et fonctionnelle, bien que cette hypothèse n’ait jamais été rigoureusement testée. Les données présentées ici fournissent des preuves directes de cette hypothèse, démontrant que les psychédéliques provoquent des changements à la fois structurels et fonctionnels dans les neurones corticaux.
Avant cette étude, deux rapports suggéraient que les psychédéliques pouvaient être capables de produire des changements dans la structure neuronale. Jones et al. (2009) ont démontré que le DOI était capable d’augmenter transitoirement la taille des épines dendritiques sur les neurones corticaux, mais aucun changement dans la densité des épines n’a été observé. La seconde étude a montré que le DOI favorisait l’extension des neurites dans une lignée cellulaire de la lignée neuronale (Marinova et al., 2017). Ces deux rapports ont utilisé le DOI, un psychédélique de la classe des amphétamines. Nous démontrons ici que la capacité à modifier la structure neuronale n’est pas une propriété unique des amphétamines comme le DOI, car les psychédéliques des classes de l’ergoline, de la tryptamine et de l’iboga favorisent également la plasticité structurelle. En outre, la D-amphétamine n’augmente pas la complexité des tiges dendritiques corticales en culture, et ces changements morphologiques ne peuvent donc pas être simplement attribués à une augmentation de la neurotransmission monoaminergique.
L’identification de psychoplastogènes appartenant à des familles chimiques distinctes est un aspect important de ce travail car il suggère que la kétamine n’est pas unique dans sa capacité à promouvoir la plasticité structurelle et fonctionnelle. Outre la kétamine, le psychoplastogène prototypique, seul un nombre relativement restreint de petites molécules favorisant la plasticité ont été identifiées précédemment. Ces composés comprennent le ligand du récepteur N-méthyl-D-aspartate (NMDA) GLYX-13 (c’est-à-dire le rapastinel), l’antagoniste mGlu2/3 LY341495, l’agoniste TrkB 7,8-DHF et l’antagoniste des récepteurs muscariniques scopolamine. Nous observons que les hallucinogènes de quatre classes structurelles distinctes (c’est-à-dire la tryptamine, l’amphétamine, l’ergoline et l’iboga) sont également de puissants psychoplastogènes, ce qui fournit des échafaudages supplémentaires pour les efforts de chimie médicinale visant à identifier des neurothérapeutiques. En outre, nos essais cellulaires ont révélé que plusieurs de ces composés étaient plus efficaces (par exemple, la MDMA) ou plus puissants (par exemple, le LSD) que la kétamine. En fait, les propriétés de promotion de la plasticité des psychédéliques et des entactogènes rivalisent avec celles du BDNF (figures 3A-3C et S3). L’extrême puissance du LSD en particulier pourrait être due à une cinétique d’extinction lente, comme cela a été récemment proposé après la divulgation de la structure cristalline de la 5-HT2B liée au LSD.
Fait important, les effets psychoplastogènes des psychédéliques dans les cultures corticales ont également été observés in vivo en utilisant des modèles vertébrés et invertébrés, ce qui démontre qu’ils agissent par le biais d’un mécanisme conservé au cours de l’évolution. En outre, les concentrations de psychédéliques utilisées dans nos essais de culture cellulaire in vitro correspondaient à celles atteintes dans le cerveau après l’administration systémique de doses thérapeutiques chez les rongeurs. Cela suggère que les essais de neuritogenèse, de spinogenèse et/ou de synaptogenèse réalisés à l’aide de cultures corticales pourraient être utiles pour identifier les psychoplastogènes et les antidépresseurs à action rapide. Il convient de noter que nos études de plasticité structurelle réalisées in vitro ont utilisé des neurones exposés à des psychédéliques pendant de longues périodes. L’exposition du cerveau à ces composés étant souvent de courte durée en raison de leur métabolisme rapide, il sera intéressant d’évaluer la cinétique de la plasticité induite par les psychédéliques.
Une question clé dans le domaine de la médecine psychédélique a été de savoir si les psychédéliques favorisent ou non les changements dans la densité des épines dendritiques. En utilisant la SIM super-résolution, nous démontrons clairement que les psychédéliques augmentent effectivement la densité des épines dendritiques sur les neurones corticaux, un effet qui n’est pas limité à une classe structurelle particulière de composés. En utilisant la DMT, nous avons vérifié que la densité des épines des neurones corticaux augmente in vivo et que ces changements dans la plasticité structurelle s’accompagnent d’effets fonctionnels tels que l’augmentation de l’amplitude et de la fréquence des EPSC spontanés. Nous avons spécifiquement conçu ces expériences pour imiter les études précédentes sur la kétamine afin de pouvoir comparer directement ces deux composés et, en première approximation, ils semblent être remarquablement similaires. Non seulement ils augmentent tous deux la densité des épines et l’excitabilité neuronale dans le cortex, mais ils semblent également avoir des effets comportementaux similaires. Nous avons montré précédemment que, comme la kétamine, le DMT favorise l’apprentissage de l’extinction de la peur et a des effets antidépresseurs dans le test de la nage forcée (Cameron et al., 2018). Ces résultats, associés au fait que l’ayahuasca, une concoction contenant du DMT, a de puissants effets antidépresseurs chez l’homme, suggèrent que les psychédéliques classiques et la kétamine pourraient partager un mécanisme thérapeutique apparenté.
Bien que les cibles moléculaires de la kétamine et des psychédéliques soient différentes (récepteurs NMDA et 5-HT2A, respectivement), elles semblent provoquer des effets en aval similaires sur la plasticité structurelle en activant mTOR. Cette découverte est importante car la kétamine est connue pour être addictive alors que de nombreux psychédéliques classiques ne le sont pas. Les mécanismes exacts par lesquels ces composés stimulent mTOR ne sont pas encore entièrement compris, mais nos données suggèrent que, au moins pour les psychédéliques classiques, les récepteurs TrkB et 5-HT2A sont impliqués. Bien que la plupart des psychédéliques classiques ne soient pas considérés comme créant une dépendance, leur utilisation en médecine soulève encore des problèmes de sécurité importants, car ils provoquent de profondes perturbations perceptives et peuvent encore faire l’objet d’abus. Par conséquent, l’identification d’analogues non hallucinogènes capables de promouvoir la plasticité dans le PFC pourrait faciliter un changement de paradigme dans notre approche du traitement des maladies neuropsychiatriques. En outre, de tels composés pourraient être essentiels pour résoudre le débat de longue date dans le domaine concernant la question de savoir si les effets subjectifs des psychédéliques sont nécessaires pour leurs effets thérapeutiques. Bien que notre groupe étudie activement les propriétés psychoplastogènes des analogues non hallucinogènes des psychédéliques, d’autres ont rapporté le potentiel thérapeutique d’analogues structurels et fonctionnels plus sûrs de la kétamine.
Nos données démontrent que les psychédéliques classiques de plusieurs classes chimiques distinctes sont capables de promouvoir de manière robuste la croissance des neurites et des épines dendritiques in vitro, in vivo et à travers les espèces. Fait important, nos études mettent en évidence les similitudes entre les effets de la kétamine et ceux des psychédéliques sérotoninergiques classiques, soutenant l’hypothèse selon laquelle les effets antidépresseurs et anxiolytiques cliniques de ces molécules pourraient résulter de leur capacité à promouvoir la plasticité structurelle et fonctionnelle dans les neurones corticaux préfrontaux. Nous avons démontré que les propriétés de promotion de la plasticité des psychédéliques requièrent les signaux TrkB, mTOR et 5-HT2A, ce qui suggère que ces nœuds de signalisation clés peuvent servir de cibles potentielles pour le développement de psychoplastogènes, d’antidépresseurs à action rapide et d’anxiolytiques. Dans l’ensemble, nos résultats suggèrent que les psychédéliques peuvent être utilisés comme structures principales pour identifier les neurothérapies de la prochaine génération avec des profils d’efficacité et de sécurité améliorés.