Le Foll, B., Piper, M. E., Fowler, C. D., Tonstad, S., Bierut, L., Lu, L., … & Hall, W. D. (2022). Tobacco and nicotine use. Nature Reviews Disease Primers, 8(1), 19.
Abstract.
Le tabagisme est un déterminant majeur de la morbidité et de la mortalité évitables dans le monde. Plus d’un milliard de personnes fument, et si l’on n’augmente pas considérablement le nombre d’abandons, au moins la moitié d’entre elles mourront prématurément de complications liées au tabac. En outre, les personnes qui fument voient leur qualité de vie considérablement réduite. Les découvertes neurobiologiques ont permis d’identifier les mécanismes par lesquels la nicotine contenue dans le tabac affecte le système de récompense du cerveau et provoque la dépendance. Ces modifications cérébrales contribuent au maintien de la consommation de nicotine ou de tabac malgré la connaissance de ses conséquences négatives, ce qui est une caractéristique de la dépendance. Des approches efficaces de dépistage, de prévention et de traitement du tabagisme peuvent être largement mises en œuvre pour limiter l’effet du tabac sur les individus et la société. L’efficacité des interventions psychosociales et pharmacologiques pour aider les gens à arrêter de fumer a été démontrée. Comme la majorité des fumeurs finissent par rechuter, il est important d’améliorer la portée des interventions disponibles et de continuer à développer de nouvelles interventions. Ces efforts associés à des réglementations politiques innovantes (visant à réduire la teneur en nicotine ou à éliminer les produits du tabac) ont le potentiel de réduire la prévalence du tabagisme et de la nicotine et leur énorme impact négatif sur la santé de la population.
Introduction.
Le tabac est la deuxième substance psychoactive la plus utilisée dans le monde, avec plus d’un milliard de fumeurs dans le monde. Bien que la prévalence du tabagisme ait diminué dans de nombreux pays à revenu élevé (PFR), le tabagisme reste très répandu dans les pays à revenu faible ou intermédiaire (PRFM). La majorité des fumeurs sont dépendants de la nicotine fournie par la cigarette (définie comme une dépendance au tabac dans la Classification internationale des maladies, dixième révision (CIM-10) ou comme un trouble lié au tabagisme dans le Manuel diagnostique et statistique des troubles mentaux, cinquième édition (DSM-5)). En raison des neuro-adaptations et des mécanismes psychologiques provoqués par l’exposition répétée à la nicotine délivrée rapidement par les cigarettes, l’arrêt du tabac peut également entraîner un syndrome de sevrage bien caractérisé, se manifestant généralement par de l’irritabilité, de l’anxiété, une baisse d’humeur, des difficultés de concentration, une augmentation de l’appétit, de l’insomnie et de l’agitation, qui contribue à la difficulté d’arrêter de fumer.
Historiquement, le tabac était utilisé dans certaines cultures dans le cadre de cérémonies traditionnelles, mais son usage était peu fréquent et peu répandu dans la population. Cependant, depuis le début du vingtième siècle, l’utilisation de cigarettes commerciales a augmenté de façon spectaculaire en raison des pratiques de fabrication automatisées qui permettent la production à grande échelle de produits peu coûteux et fortement promus par les médias et la publicité. Le tabagisme est devenu très répandu au cours du siècle dernier et a été suivi par des augmentations substantielles de la prévalence des maladies induites par le tabac des décennies plus tard. Il a fallu des décennies pour établir la relation entre le tabagisme et les effets associés sur la santé et pour découvrir le rôle addictif de la nicotine dans le maintien du tabagisme, ainsi que pour éduquer les gens sur ces effets. Il convient de noter que l’industrie du tabac a contesté ces preuves pour permettre la poursuite des ventes de tabac. L’expansion des campagnes de santé publique visant à réduire le tabagisme a progressivement diminué la consommation de tabac dans les PFRH, avec des augmentations marquées de l’arrêt du tabac chez les adultes, mais les progrès ont été moins importants dans les PFRH.
La nicotine est le composé du tabac qui crée la dépendance et qui est à l’origine de la poursuite de la consommation de tabac malgré les méfaits et le désir d’arrêter, mais la nicotine n’est pas directement responsable des effets nocifs de la consommation de produits du tabac (encadré 1). D’autres composants du tabac peuvent moduler le potentiel addictif du tabac (par exemple, les arômes et les composés non nicotiniques). Les principaux méfaits liés au tabagisme, qui sont bien couverts ailleurs, sont liés à une multitude de composés présents dans la fumée du tabac (tels que les substances cancérigènes, les substances toxiques, les particules et le monoxyde de carbone). Chez les adultes, les effets néfastes du tabagisme sur la santé comprennent le cancer dans pratiquement tous les organes périphériques exposés à la fumée du tabac et des maladies chroniques telles que les maladies oculaires, les maladies parodontales, les maladies cardiovasculaires, les maladies pulmonaires obstructives chroniques, les accidents vasculaires cérébraux, le diabète sucré, la polyarthrite rhumatoïde et les troubles de la fonction immunitaire. En outre, le tabagisme pendant la grossesse peut augmenter le risque d’effets indésirables sur la reproduction, tels qu’une grossesse extra-utérine, un faible poids de naissance et une naissance prématurée. L’exposition à la fumée de cigarette secondaire chez les enfants a été liée au syndrome de mort subite du nourrisson, à l’altération de la fonction pulmonaire et aux maladies respiratoires, en plus des déficiences cognitives et comportementales. Les effets à long terme de la nicotine sur le développement sont probablement dus à des modifications structurelles et fonctionnelles du cerveau au cours de cette période précoce du développement.
La nicotine administrée seule dans diverses formulations de substituts nicotiniques (tels que les patchs, les gommes et les pastilles) est sûre et efficace en tant qu’aide au sevrage tabagique fondée sur des preuves. De nouvelles formes de systèmes d’administration de nicotine sont également apparues (appelées systèmes électroniques d’administration de nicotine (ENDS) ou e-cigarettes), qui peuvent potentiellement réduire les effets nocifs du tabagisme pour ceux qui passent complètement des combustibles aux e-cigarettes.
Cet abécédaire met l’accent sur les déterminants de la consommation de nicotine et de tabac, et passe en revue la neurobiologie des effets de la nicotine sur les circuits cérébraux de récompense et le fonctionnement des réseaux cérébraux de manière à contribuer à la difficulté d’arrêter de fumer. Cet abécédaire traite également de la manière de prévenir le tabagisme, de dépister le tabagisme et de proposer aux fumeurs des interventions psychosociales et pharmacologiques pour les aider à arrêter de fumer. En outre, cet abécédaire présente les interventions pharmacologiques émergentes et les nouvelles interventions sur le cerveau qui pourraient améliorer les taux de réussite du sevrage tabagique, ainsi que les approches de santé publique qui pourraient être bénéfiques.
Les produits du tabac conventionnels comprennent les produits combustibles qui produisent de la fumée inhalée (le plus souvent des cigarettes, des bidis (petites cigarettes de fabrication locale utilisées en Asie du Sud) ou des cigares) et ceux qui délivrent de la nicotine sans utiliser la combustion (tabac à mâcher ou à tremper et tabac à priser). Les produits alternatifs plus récents qui n’impliquent pas de combustion comprennent les e-cigarettes contenant de la nicotine et les appareils à tabac sans combustion. Bien que les produits sans combustion et les produits alternatifs puissent présenter un risque moindre que les produits avec combustion, aucune forme de tabac n’est totalement sans risque.
| Box 1. Produits tabagiques. Les produits du tabac conventionnels comprennent les produits combustibles qui produisent de la fumée inhalée (le plus souvent des cigarettes, des bidis (petites cigarettes de fabrication locale utilisées en Asie du Sud) ou des cigares) et ceux qui délivrent de la nicotine sans utiliser la combustion (tabac à mâcher ou à tremper et tabac à priser). Les produits alternatifs plus récents qui n’impliquent pas de combustion comprennent les e-cigarettes contenant de la nicotine et les appareils à tabac sans combustion. Bien que les produits sans combustion et les produits alternatifs puissent présenter un risque moindre que les produits avec combustion, aucune forme de tabac n’est totalement sans risque. |
Épidémiologie.
Prévalence et poids des maladies.
Le Global Burden of Disease Project (GBDP) a estimé qu’environ 1,14 milliard de personnes fumaient en 2019, dans le monde entier, contre un peu moins d’un milliard en 1990 (réf.1). Il convient de noter que la prévalence du tabagisme a considérablement diminué entre 1990 et 2019, mais que l’augmentation de la population adulte a entraîné une hausse du nombre total de fumeurs dans le monde. Un décès lié au tabagisme survient pour environ 0,8 à 1,1 million de cigarettes fumées, ce qui suggère que la consommation mondiale estimée à environ 7,4 billions de cigarettes en 2019 a entraîné environ 7 millions de décès.
Dans la plupart des populations, la prévalence du tabagisme est beaucoup plus élevée parmi les groupes dont le niveau d’éducation ou de revenu est faible et parmi ceux qui souffrent de troubles mentaux et d’autres codépendances. Le tabagisme est également plus fréquent chez les hommes que chez les femmes (figures 1-3). Les personnes appartenant à des minorités sexuelles et/ou de genre présentent des taux disproportionnés de tabagisme et d’autres dépendances. En outre, la prévalence du tabagisme varie considérablement selon les régions et les ethnies ; les taux de tabagisme sont élevés dans certaines régions d’Asie, comme la Chine et l’Inde, mais sont plus faibles en Amérique du Nord et en Australie. Il convient de noter que la prévalence des troubles de santé mentale et d’autres codépendances est plus élevée chez les fumeurs que chez les non-fumeurs. Par exemple, la probabilité de fumer chez les personnes souffrant d’un quelconque trouble lié à la consommation de substances est plus de cinq fois supérieure à celle des personnes sans trouble lié à la consommation de substances. De même, la probabilité de fumer chez les personnes souffrant de troubles psychiatriques est plus de trois fois supérieure à celle des personnes sans diagnostic psychiatrique. Dans une étude menée aux États-Unis, par rapport à une population de fumeurs sans diagnostic psychiatrique, les sujets souffrant d’anxiété, de dépression et de phobie présentaient une prévalence de tabagisme environ deux fois plus élevée, et les sujets souffrant d’agoraphobie, de manie ou d’hypomanie, de psychose et de troubles de la personnalité antisociale ou du comportement présentaient une prévalence de tabagisme au moins trois fois plus élevée. Les troubles comorbides sont également associés à des taux plus élevés de tabagisme.
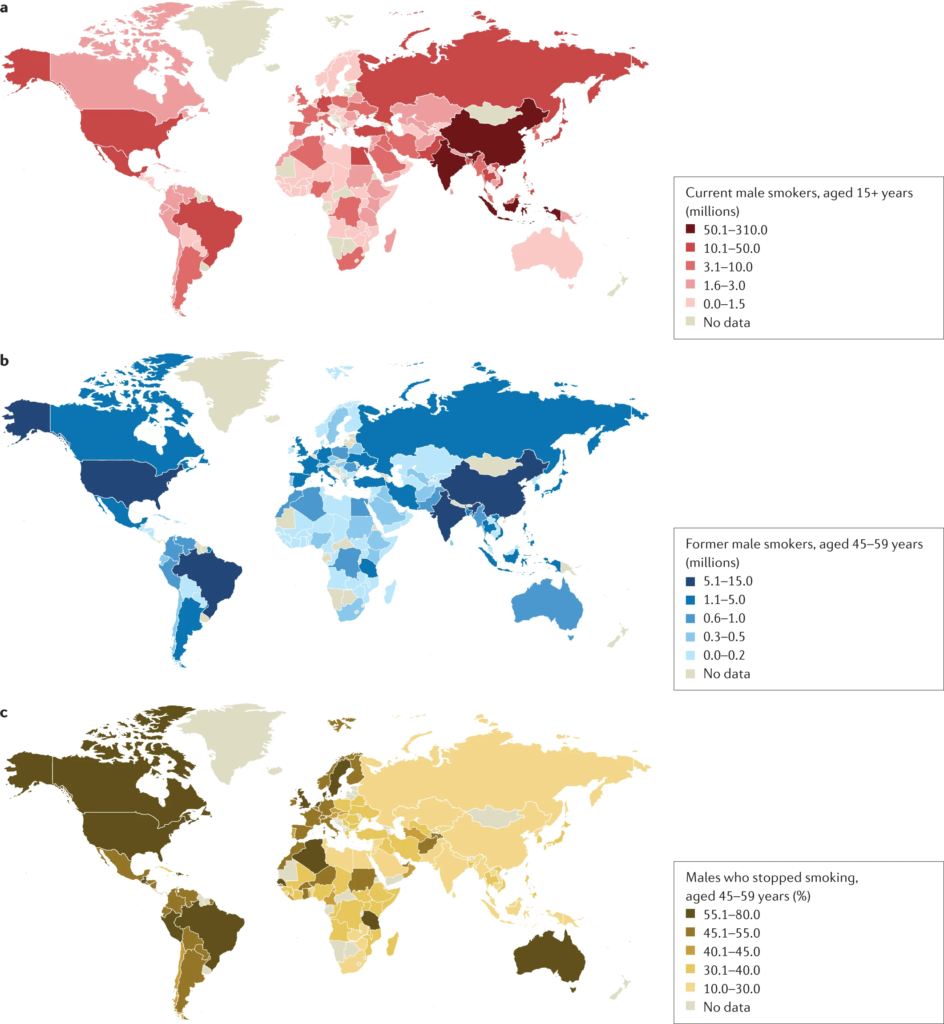
a | Nombre de fumeurs masculins actuels âgés de 15 ans ou plus par pays exprimé en millions. b | Anciens fumeurs masculins âgés de 45 à 59 ans par pays exprimé en millions. c | Anciens fumeurs masculins âgés de 45 à 59 ans par pays exprimé en pourcentage de fumeurs ayant arrêté. Les données présentées concernent les fumeurs masculins pour la période 2015-2019 et proviennent de pays ayant mené des enquêtes directes sur le tabagisme. La prévalence du tabagisme chez les hommes est moins variable que chez les femmes. Données tirées de la réf. 1.
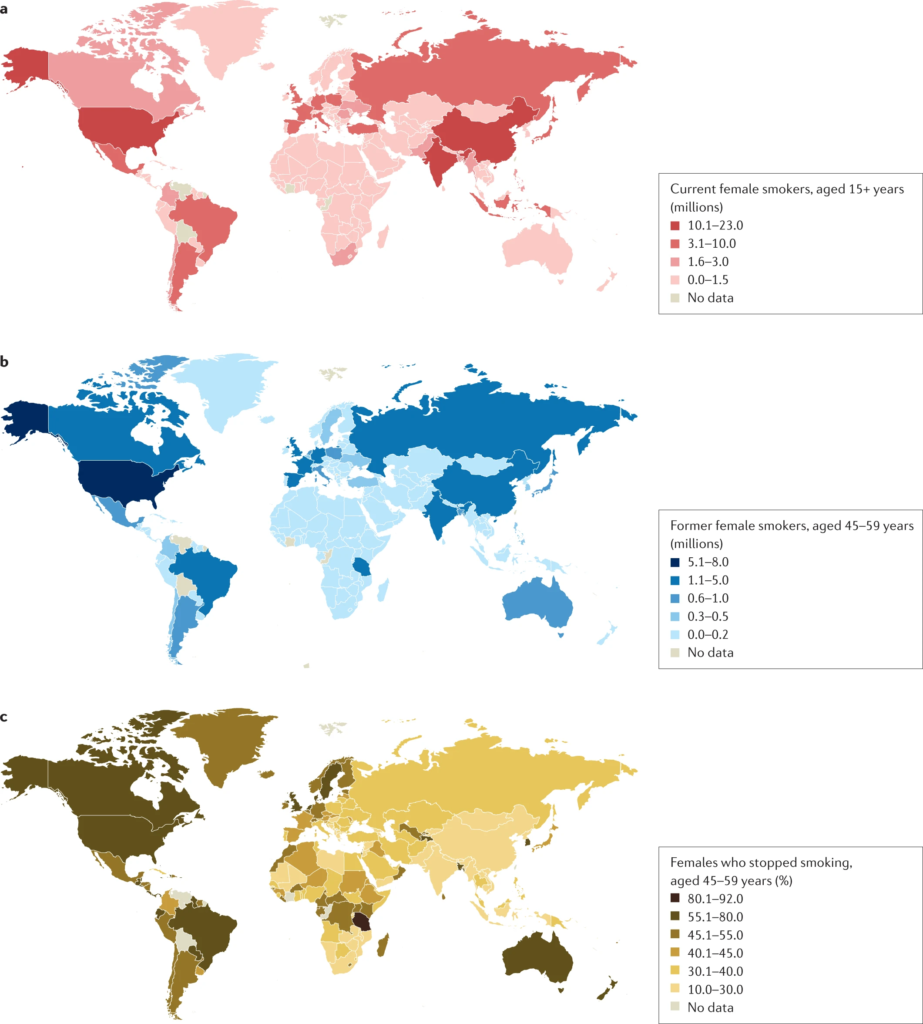
a | Nombre de fumeuses actuelles âgées de 15 ans ou plus par pays, exprimé en millions. b | Anciennes fumeuses âgées de 45 à 59 ans par pays, exprimé en millions. c | Anciennes fumeuses âgées de 45 à 59 ans par pays, exprimé en pourcentage de fumeuses ayant arrêté. Les données présentées concernent les fumeuses pour la période 2015-2019 et proviennent de pays ayant mené des enquêtes directes sur le tabagisme. La prévalence du tabagisme chez les femmes est beaucoup plus faible en Asie de l’Est et du Sud qu’en Amérique latine ou en Europe de l’Est. Données tirées de la réf. 1.
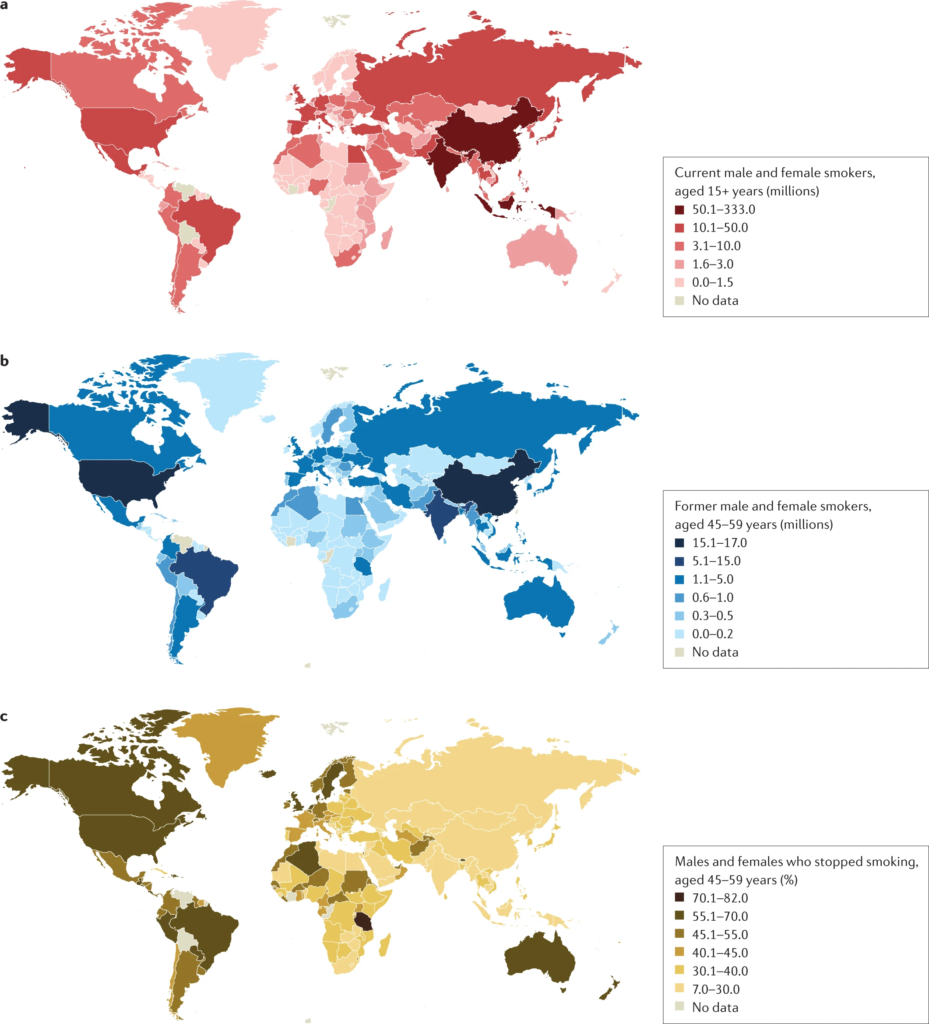
a | Nombre de fumeurs actuels, hommes et femmes, âgés de 15 ans ou plus par pays, exprimé en millions. b | Anciens fumeurs, hommes et femmes, âgés de 45 à 59 ans par pays, exprimé en millions. c | Anciens fumeurs, hommes et femmes, âgés de 45 à 59 ans par pays, exprimé en pourcentage de fumeurs ayant arrêté. Les données présentées concernent la période 2015-2019 et proviennent de pays disposant d’enquêtes directes sur le tabagisme. Les taux d’arrêt sont plus élevés dans les pays à revenu élevé, mais aussi notablement élevés au Brésil. L’arrêt du tabac est beaucoup moins fréquent en Asie du Sud et de l’Est, en Russie et dans d’autres pays d’Europe de l’Est, et également faible en Afrique du Sud. Données tirées de la réf.1.
Âge de début.
La plupart des fumeurs commencent à fumer pendant l’adolescence, près de 90 % des fumeurs commençant entre 15 et 25 ans. La prévalence du tabagisme chez les jeunes a considérablement diminué dans de nombreux HIC entre 1990 et 2019 (réf.25). Plus récemment, l’adoption généralisée des ENDS dans certaines régions comme le Canada et les États-Unis a suscité des inquiétudes quant aux effets à long terme de la consommation prolongée de nicotine chez les adolescents, y compris la notion possible que les ENDS augmenteront l’utilisation des produits de tabagisme combustibles (bien que certaines études n’aient pas trouvé beaucoup d’effet global au niveau de la population).
Mortalité.
Le tabagisme qui commence au début de l’adolescence ou au début de l’âge adulte et qui persiste tout au long de la vie a un effet plus grave sur la santé que le tabagisme qui commence plus tard dans la vie et/ou qui n’est pas persistant. Plus de 640 millions d’adultes de moins de 30 ans fument dans 22 juridictions seulement (dont 27 pays de l’Union européenne où des efforts centraux pour réduire la dépendance au tabac pourraient être possibles). Chez les moins de 30 ans, au moins 320 millions de décès liés au tabagisme se produiront s’ils n’arrêtent pas de fumer. Le nombre réel de décès liés au tabagisme pourrait être supérieur à un sur deux, et peut-être même à deux sur trois, chez les fumeurs de longue durée. Au moins la moitié de ces décès sont susceptibles de survenir à un âge moyen (30-69 ans), entraînant une perte de deux décennies de vie ou plus. Les personnes qui fument peuvent s’attendre à perdre en moyenne au moins une décennie de vie par rapport à des non-fumeurs similaires.
Des études épidémiologiques directes menées dans plusieurs pays, associées à des estimations basées sur des modèles, ont estimé que le tabagisme était responsable de 7,7 millions de décès dans le monde en 2020, dont 80 % chez les hommes et 87 % chez les fumeurs actuels. Dans les PFR, les principales causes de décès dus au tabac sont le cancer du poumon, l’emphysème, les crises cardiaques, les accidents vasculaires cérébraux, le cancer des voies aérodigestives supérieures et le cancer de la vessie. Dans certains pays à faible revenu, la tuberculose est une cause supplémentaire importante de décès liés au tabac, ce qui pourrait être lié, par exemple, à une prévalence accrue de l’infection, à une tuberculose/mortalité plus grave et à une prévalence plus élevée de tuberculose résistante au traitement chez les fumeurs que chez les non-fumeurs dans les pays à faible revenu.
Malgré des réductions substantielles de la prévalence du tabagisme, il y avait 34 millions de fumeurs aux États-Unis, 7 millions au Royaume-Uni et 5 millions au Canada en 2017, et le tabagisme reste la principale cause de décès prématuré avant 70 ans dans une grande partie de l’Europe et de l’Amérique du Nord. Les maladies associées au tabagisme sont responsables d’environ 41 millions de décès aux États-Unis, au Royaume-Uni et au Canada entre 1960 et 2020. De plus, comme les maladies associées au tabagisme sont plus répandues parmi les groupes ayant des niveaux d’éducation et de revenu plus faibles, le tabagisme explique au moins la moitié de la différence de mortalité globale entre ces groupes sociaux. Toute réduction de la prévalence du tabagisme réduit l’écart absolu de mortalité entre ces groupes.
Le sevrage tabagique est devenu courant dans les PFR qui bénéficient de bonnes interventions de lutte antitabac. Par exemple, en France, le nombre d’ex-fumeurs est quatre fois supérieur au nombre de fumeurs actuels parmi les personnes âgées de 50 ans ou plus. En revanche, l’arrêt du tabac dans les PRFM reste peu fréquent avant que les fumeurs ne développent des maladies liées au tabac. L’arrêt du tabac réduit considérablement les risques de maladies liées au tabac. En effet, les fumeurs qui arrêtent de fumer avant 40 ans évitent presque tous les risques accrus de mortalité. De plus, les personnes qui arrêtent de fumer avant l’âge de 50 ans réduisent d’environ deux tiers le risque de décès par cancer du poumon. Des risques plus modestes persistent pour les décès dus au cancer du poumon et à l’emphysème ; cependant, les risques chez les anciens fumeurs sont d’un ordre de grandeur inférieur à ceux des personnes qui continuent à fumer.
Mécanismes/pathophysiologie.
La nicotine est le principal agent psychoactif du tabac et des e-cigarettes. La nicotine agit comme un agoniste sur les récepteurs nicotiniques de l’acétylcholine (nAChR), qui sont localisés dans tout le cerveau et le système nerveux périphérique. Les nAChR sont des canaux ioniques pentamériques constitués de combinaisons variables de sous-unités α2-α7 et β2-β4, et pour lesquels l’acétylcholine (ACh) est le ligand endogène. Lorsqu’il est activé par la liaison de la nicotine, le nAChR subit un changement de conformation qui ouvre le pore interne, permettant un afflux d’ions sodium et calcium. Au niveau des membranes postsynaptiques, l’activation des nAChR peut conduire à l’activation du potentiel d’action et à la modulation en aval de l’expression des gènes par des systèmes de second messager médiés par le calcium. Les nAChR sont également localisés sur les membranes présynaptiques, où ils modulent la libération des neurotransmetteurs. Les nAChR se désensibilisent après l’activation, pendant laquelle la liaison du ligand n’ouvre pas le canal.
Les nAChRs avec des combinaisons variables de sous-unités α et β présentent des différences en termes d’affinité de liaison à la nicotine, d’efficacité et de taux de désensibilisation, et ont une expression différentielle selon la région du cerveau et le type de cellule. Par exemple, aux concentrations de nicotine trouvées chez les fumeurs humains, les nAChRs contenant des β2 se désensibilisent relativement rapidement après activation, alors que les nAChRs contenant des α7 ont un profil de désensibilisation plus lent. L’exposition chronique à la nicotine dans des modèles animaux expérimentaux ou chez l’homme induit une augmentation de l’expression corticale des nAChRs contenant α4β2, mais augmente également l’expression des sous-unités β3 et β4 des nAChRs dans la voie habenula médiale (MHb)-noyau interpédonculaire (IPN). Il est clair que la localisation cérébrale et le type de nAChR sont des éléments critiques dans la médiation des divers effets de la nicotine, mais d’autres facteurs tels que le taux d’administration de la nicotine peuvent également moduler les effets addictifs de la nicotine.
Circuit neuronal de l’addiction à la nicotine.
La nicotine a à la fois des effets gratifiants (comme le “buzz” ou le “high”) et des effets aversifs (comme les nausées et les vertiges), le résultat net dépendant de la dose et d’autres facteurs tels que la sensibilité interindividuelle et la présence d’une tolérance. Ainsi, les propriétés addictives de la nicotine impliquent l’intégration de signaux contrastés provenant de plusieurs régions du cerveau qui traitent la récompense et l’aversion (Fig. 4).
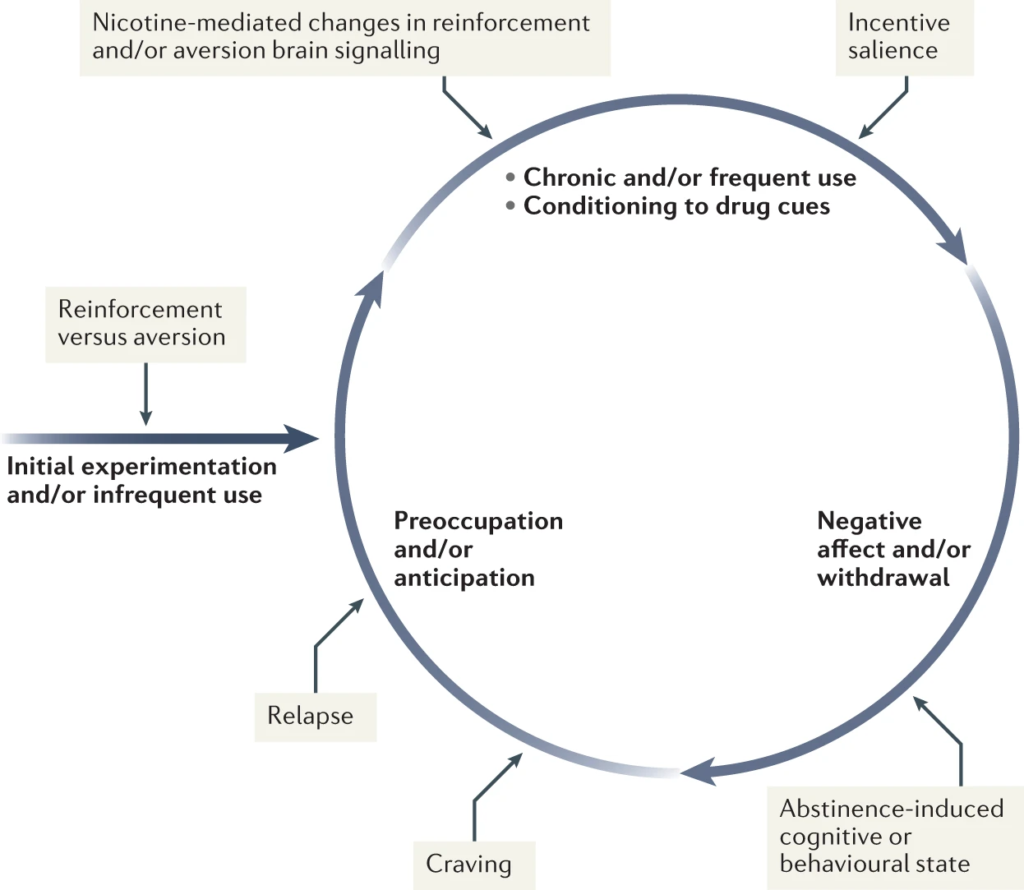
Lors de l’usage initial, la nicotine exerce à la fois des effets de renforcement et des effets aversifs, qui déterminent ensemble la probabilité d’un usage continu. Lorsque l’individu passe à un usage chronique plus fréquent, la nicotine induit des changements pharmacodynamiques dans les circuits cérébraux, ce qui entraînerait une réduction de la sensibilité aux propriétés aversives de la drogue. La nicotine est également un puissant renforçateur qui entraîne le conditionnement d’indices secondaires associés à l’expérience de la prise de drogue (tels que le paquet de cigarettes, les propriétés sensorielles de la fumée de cigarette et la sensation de la cigarette dans la main ou la bouche), ce qui permet d’augmenter la saillance incitative de ces facteurs environnementaux et d’encourager la prise de drogue. Lorsque l’individu entre dans des états d’abstinence (comme tous les jours pendant le sommeil de la nuit ou lors de tentatives d’abandon), il ressent une symptomatologie de sevrage, qui peut inclure l’irritabilité, l’agitation, des déficits d’apprentissage ou de mémoire, des difficultés de concentration, l’anxiété et la faim. Ces symptômes affectifs et cognitifs négatifs conduisent à une intensification de la préoccupation de la personne à obtenir et à utiliser le produit du tabac ou de la nicotine, et par la suite, ce besoin intense peut conduire à une rechute.
Les actions gratifiantes de la nicotine ont été largement attribuées à la voie mésolimbique, qui consiste en des neurones dopaminergiques dans l’aire tegmentale ventrale (ATV) qui se projettent vers le noyau accumbens et le cortex préfrontal (Fig. 5). Les circuits intégrateurs et les régions de projection de l’ATV expriment plusieurs sous-types de nAChR sur les neurones dopaminergiques, GABAergiques et glutamatergiques. En fin de compte, l’administration de nicotine augmente les niveaux de dopamine par le biais d’une augmentation du tir des neurones dopaminergiques dans les zones striatales et extrastriatales (comme le pallidum ventral) (Fig. 6). Cet effet est impliqué dans la récompense et serait principalement médié par l’action de la nicotine sur les nAChRs contenant α4 et β2 dans l’ATV.
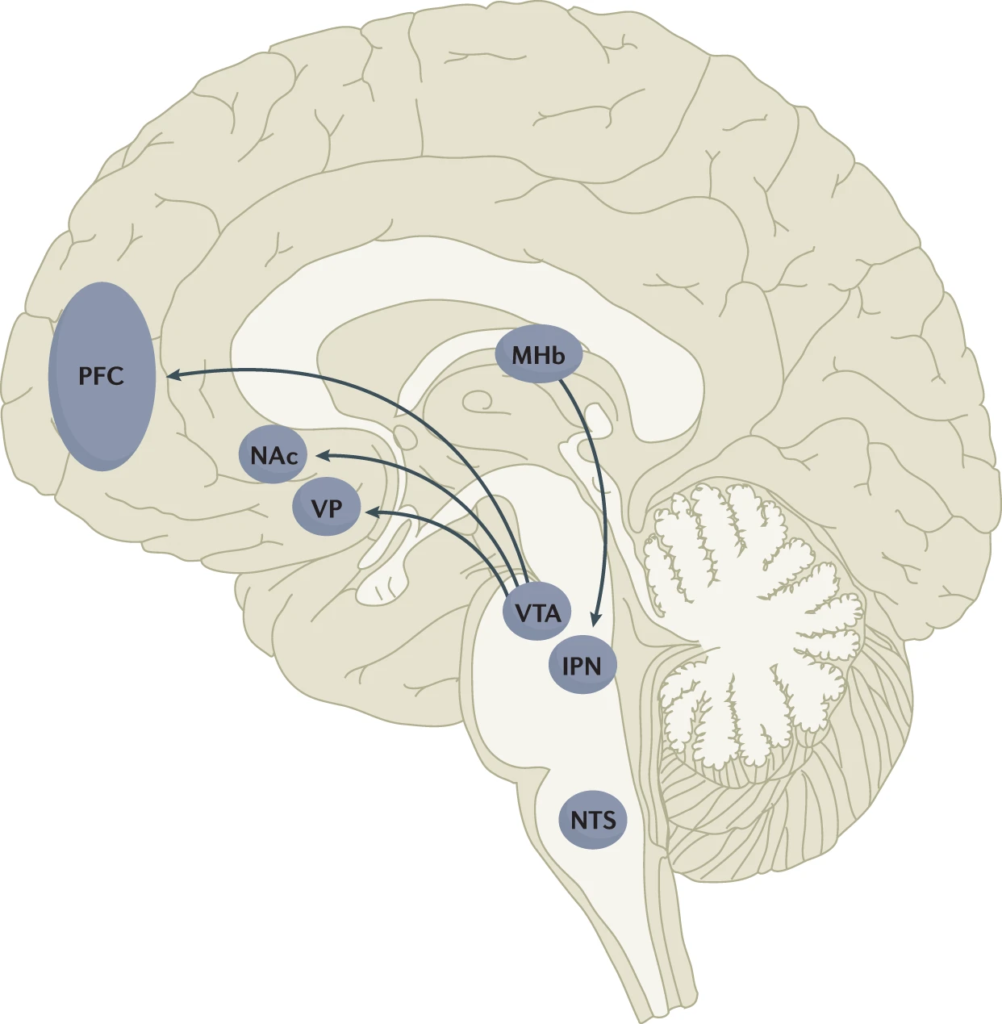
De multiples recherches ont démontré que le renforcement de la nicotine est principalement contrôlé par deux voies cérébrales, qui relaient principalement des signaux liés à la récompense ou à l’aversion. Les propriétés gratifiantes de la nicotine qui favorisent la prise de drogue impliquent la projection mésolimbique de dopamine de l’aire tegmentale ventrale (ATV) vers le noyau accumbens (NAc). En revanche, les propriétés aversives de la nicotine qui limitent la prise de drogue et atténuent les symptômes de sevrage impliquent la projection du fasciculus retroflexus de l’habenula médian (MHb) vers le noyau interpédonculaire (IPN). D’autres régions du cerveau ont également été impliquées dans divers aspects de la dépendance à la nicotine, comme le cortex préfrontal (CPF), le pallidum ventral (VP), le noyau tractus solitarius (NTS) et l’insula (non représentés ici pour plus de clarté). Toutes ces régions cérébrales sont directement ou indirectement interconnectées en tant que circuits intégratifs afin de stimuler les comportements de recherche et de consommation de drogues.
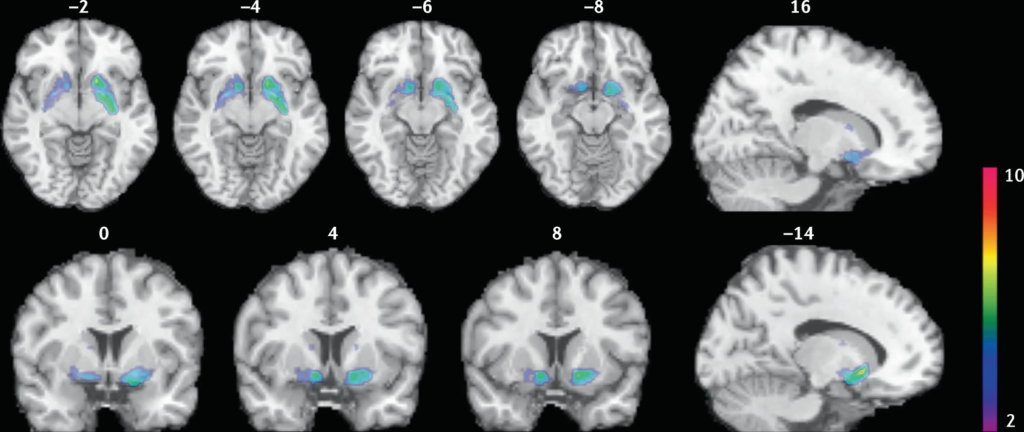
Les fumeurs ont subi des examens TEP du cerveau avec du [11C]PHNO, un traceur TEP de la dopamine D2/3 qui a une grande sensibilité pour détecter les fluctuations de la dopamine. Les TEP scans ont été réalisés pendant l’abstinence ou après avoir fumé une cigarette. Une réduction du potentiel de liaison (BPND) a été observée après avoir fumé, indiquant une augmentation des niveaux de dopamine dans le striatum ventral et dans la zone qui correspond au pallidum ventral. Les images montrent des grappes avec des diminutions statistiquement significatives du BPND du [11C]PHNO après avoir fumé une cigarette par rapport à la condition d’abstinence. Ces clusters ont été superposés sur des images IRM T1 structurelles du cerveau.
Les propriétés aversives de la nicotine sont médiées par les neurones de la MHb, qui se projettent vers l’IPN. Des études menées chez les rongeurs à l’aide de stratégies génétiques de knockdown et de knockout ont démontré que les nAChRs contenant α5, α3 et β4 dans la voie MHb-IPN médient les propriétés aversives de la nicotine qui limitent la prise de drogue, en particulier lorsque les animaux ont la possibilité de consommer des doses de nicotine plus élevées. En plus des nAChRs, d’autres facteurs de signalisation agissant sur les terminaisons MHb dans l’IPN régulent également les actions de la nicotine. Par exemple, dans des conditions d’exposition chronique à la nicotine ou lors de l’activation optogénétique des neurones de l’IPN, un sous-type de neurones de l’IPN co-exprimant Chrna5 (codant pour la sous-unité α5 du nAChR) et Amigo1 (codant pour la molécule d’adhésion avec le domaine 1 semblable à l’immunoglobuline) libère de l’oxyde nitrique du corps cellulaire qui inhibe de manière rétrograde les terminaisons axonales MHb. En outre, la nicotine active les neurones exprimant des nAChR contenant α5 qui se projettent du noyau tractus solitarius vers le NPI, ce qui entraîne la libération de glucagon-like peptide-1 qui se lie aux récepteurs GLP sur les terminaisons axonales habénulaires, ce qui augmente ensuite l’activation des neurones du NPI et diminue l’auto-administration de nicotine. L’ensemble de ces résultats suggère un processus de signalisation dynamique au niveau des terminaisons axonales MHb dans l’IPN, qui régule les propriétés addictives de la nicotine et détermine la quantité de nicotine qui est auto-administrée.
Le sevrage de la nicotine dans les modèles animaux peut être évalué en examinant les signes somatiques (tels que le tremblement, le grattage, les hochements de tête et la mastication) et les signes affectifs (tels que l’augmentation des comportements liés à l’anxiété et l’aversion de place conditionnée). Il est intéressant de noter que peu de signes somatiques de sevrage à la nicotine sont observés chez les souris présentant un knockout génétique des sous-unités α2, α5 ou β4 nAChR. En revanche, les souris avec un knockout β2 nAChR ont moins de comportements liés à l’anxiété pendant le sevrage de la nicotine, sans différence dans les symptômes somatiques par rapport aux souris de type sauvage.
Outre l’ATV (médiateur de la récompense) et la voie MHb-IPN (médiateur de l’aversion), d’autres zones du cerveau sont impliquées dans la dépendance à la nicotine (Fig. 5). Chez les animaux, le cortex insulaire contrôle la prise de nicotine et la recherche de nicotine. De plus, les humains présentant des lésions du cortex insulaire peuvent arrêter de fumer facilement sans rechute78. Cette constatation a conduit à la mise au point d’une nouvelle intervention thérapeutique modulant la fonction de l’insula (voir la gestion, ci-dessous). Diverses zones du cerveau (enveloppe du noyau accumbens, amygdale basolatérale et cortex prélimbique) exprimant des récepteurs cannabinoïdes CB1 sont également essentielles au contrôle des effets gratifiants et des rechutes. Les récepteurs α1-adrénergiques exprimés dans le cortex contrôlent également ces effets, probablement par le biais d’afférences glutamatergiques vers le noyau accumbens.
Différences individuelles dans le risque de dépendance à la nicotine.
La vulnérabilité à la dépendance à la nicotine varie selon les individus, et les raisons de ces différences sont multidimensionnelles. De nombreux facteurs sociaux (tels que le niveau d’éducation et le revenu) jouent un rôle. De vastes facteurs psychologiques et sociaux modulent également ce risque. Par exemple, le statut de fumeur parmi les pairs, les connaissances sur les effets du tabac, les attentes en matière d’acceptation sociale, l’exposition au tabagisme passif modulent le risque d’initiation au tabac.
Les facteurs génétiques jouent un rôle dans l’initiation au tabagisme, le développement de la dépendance à la nicotine et la probabilité d’arrêter de fumer. En effet, on estime que l’héritabilité contribue à environ la moitié de la variabilité de la dépendance à la nicotine87,88,89,90. Des progrès importants dans notre compréhension de ces contributions génétiques ont été réalisés grâce à des études d’association à grande échelle sur le génome entier de fumeurs et de non-fumeurs. L’un des résultats les plus frappants a été que la variation allélique dans le groupe de gènes CHRNA5-CHRNA3-CHRNB4, qui code pour les sous-unités α5, α3 et β4 des nAChR, est corrélée à une vulnérabilité accrue à la dépendance à la nicotine, indiquée par une probabilité plus élevée de devenir dépendant de la nicotine et de fumer un plus grand nombre de cigarettes par jour. L’effet le plus significatif a été trouvé pour un polymorphisme mononucléotidique dans CHRNA5 (rs16969968), qui entraîne un changement d’acide aminé et une fonction réduite des nAChRs contenant α592.
La variation allélique du CYP2A6 (codant pour l’enzyme CYP2A6, qui métabolise la nicotine) a également été associée à une vulnérabilité différentielle à la dépendance à la nicotine. Le CYP2A6 est hautement polymorphe, ce qui entraîne une activité enzymatique variable. Les personnes dont la variation allélique entraîne un métabolisme lent de la nicotine consomment moins de nicotine par jour, présentent des symptômes de sevrage moins sévères et réussissent mieux à arrêter de fumer que les personnes dont le métabolisme est normal ou rapide. En outre, les personnes présentant un métabolisme lent de la nicotine ont une expression plus faible des récepteurs dopaminergiques dans les régions dopaminergiques D2 du striatum associatif et du striatum sensorimoteur dans les études TEP105 et prennent moins de bouffées de cigarettes contenant de la nicotine (par rapport aux cigarettes dé-nicotinisées) dans une tâche de choix forcé. On pense que le ralentissement du métabolisme de la nicotine augmente la durée d’action de la nicotine, ce qui permet aux niveaux de nicotine de s’accumuler au fil du temps, et donc à des niveaux d’absorption plus faibles de soutenir l’activation des nAChRs.
Des études génétiques à grande échelle ont identifié des centaines d’autres loci génétiques qui influencent l’initiation au tabagisme, l’âge auquel on commence à fumer, les cigarettes fumées par jour et la réussite du sevrage tabagique. Les plus fortes contributions génétiques au tabagisme par le biais des récepteurs nicotiniques et du métabolisme de la nicotine sont parmi les plus fortes contributions génétiques au cancer du poumon. D’autres variations génétiques (telles que celles liées aux récepteurs des cannabinoïdes, de la dopamine ou d’autres neurotransmetteurs) peuvent affecter certains phénotypes liés au tabagisme (tels que la préférence pour la nicotine et la réactivité aux indices).
Diagnostic, dépistage et prévention.
Dépistage du tabagisme.
Le dépistage du tabagisme devrait avoir lieu lors de chaque visite chez le médecin. À cet égard, une question simple et directe sur le tabagisme d’une personne peut être l’occasion d’offrir des informations sur les risques potentiels et les traitements d’aide à l’arrêt. Tous les fumeurs devraient se voir proposer une aide au sevrage, car même un faible niveau de tabagisme présente un risque important pour la santé. Le statut tabagique peut être évalué par une auto-catégorisation ou une évaluation autodéclarée du comportement tabagique (tableau 1). Chez les personnes qui fument, la fréquence du tabagisme peut être évaluée et une mesure combinée de la fréquence des quantités, telle que l’historique des paquets-années (c’est-à-dire le nombre moyen de cigarettes fumées par jour multiplié par le nombre d’années, divisé par 20), peut être utilisée pour estimer le risque cumulatif d’effets indésirables sur la santé. L’Association pour le traitement du tabagisme et de la dépendance au tabac recommande que tous les dossiers médicaux électroniques documentent le statut tabagique à l’aide des catégories d’auto-déclaration énumérées dans le tableau 1.
| Type d’évaluation | Question | Réponses possibles |
| Auto-catégorisation | Laquelle de ces réponses décrit le mieux votre histoire de fumeur ? | Fumeur actuel quotidien/quotidien Fumeur actuel non quotidien/quelques jours Ancien fumeur Jamais fumeur Statut tabagique inconnu |
| Catégorisation via évaluation du comportement | Avez-vous déjà fumé une cigarette ? Avez-vous fumé plus de 100 cigarettes au cours de votre vie ? Avez-vous fumé au cours des 30 derniers jours ? Fumez-vous tous les jours ou presque tous les jours de la semaine ? | N = Jamais fumeur O = Déjà fumé N = Jamais fumeur O = Déjà fumé N (mais jamais fumeur) = Ancien fumeur O = Fumeur actuel N (mais fumeur actuel) = Fumeur non quotidien O = Fumeur quotidien |
Questions d’auto-évaluation sur le tabagisme.
En raison de l’arrivée des e-cigarettes et des produits sans combustion, ainsi que de la popularité des petits cigares aux États-Unis qui imitent les cigarettes combustibles, les personnes qui consomment du tabac peuvent utiliser plusieurs produits en même temps. Le dépistage de l’utilisation d’autres produits à base de nicotine et de tabac est donc important dans la pratique clinique. L’approche d’auto-catégorisation peut également être utilisée pour décrire l’utilisation de ces autres produits.
Diagnostic.
Traditionnellement, le tabagisme est classé selon que le fumeur répond ou non aux critères de dépendance à la nicotine dans l’une des deux principales classifications diagnostiques : le DSM (trouble du tabagisme) et la CIM (dépendance au tabac). Le diagnostic du trouble du tabagisme selon les critères du DSM-5 requiert la présence d’au moins 2 des 11 symptômes qui ont produit une altération clinique ou une détresse marquée au cours d’une période de 12 mois (encadré 2). Il convient de noter que ces symptômes sont similaires pour tous les diagnostics de troubles liés à la consommation de substances et peuvent ne pas être tous pertinents pour le trouble lié au tabagisme (comme l’incapacité à remplir les rôles de la vie). Dans la CIM-10, les codes permettent d’identifier les produits du tabac spécifiques utilisés (cigarettes, tabac à chiquer et autres produits du tabac).
La dépendance peut également être évaluée comme un concept continu associé à des niveaux d’utilisation plus élevés, à un sevrage plus important et à une probabilité réduite d’arrêter de fumer. Le niveau de dépendance peut être évalué avec le test de Fagerström pour la dépendance à la nicotine, un court questionnaire comprenant six questions (box 2). Un score de ≥4 indique une dépendance modérée à élevée. Comme le temps disponible lors des consultations cliniques peut être très limité, l’indice de lourdeur du tabagisme (HSI) a été développé, qui comprend deux questions sur le nombre de cigarettes fumées par jour et sur le moment où la première cigarette est fumée après le réveil. Le HSI peut guider le dosage des thérapies de remplacement de la nicotine (NRT).
D’autres mesures de la dépendance à la cigarette ont été développées mais ne sont pas utilisées dans le cadre clinique, telles que l’échelle de dépendance à la cigarette, la liste de contrôle Hooked on Nicotine, l’échelle du syndrome de dépendance à la nicotine, le Wisconsin Inventory of Smoking Dependence Motives (Brief) et le Penn State Cigarette Dependence Index. Cependant, dans la pratique, ils ne sont pas souvent utilisés, car l’aspect le plus important est de dépister le tabagisme et d’encourager tous les fumeurs à arrêter de fumer, quel que soit leur statut de dépendance.
| Box 2. Critères du DSM-5 pour le trouble du tabagisme et items du test de Fagerström pour la dépendance à la nicotine. Outil taxonomique et diagnostique du trouble du tabagisme publié par l’American Psychiatric Association. Un mode de consommation problématique de tabac entraînant une déficience ou une détresse cliniquement significative, se manifestant par au moins deux des éléments suivants, survenus au cours d’une période de 12 mois. – Le tabac est souvent utilisé en plus grande quantité ou sur une période plus longue que prévu – Un désir persistant ou des efforts infructueux pour réduire ou contrôler le tabagisme – Beaucoup de temps passé à des activités nécessaires pour obtenir ou utiliser du tabac – Un état de manque, c’est-à-dire une forte envie ou un besoin impérieux de consommer du tabac. – Un usage récurrent du tabac entraînant l’incapacité de remplir des obligations majeures au travail, à l’école ou à la maison. – La poursuite du tabagisme malgré des problèmes sociaux ou interpersonnels persistants ou récurrents causés ou exacerbés par les effets du tabac (par exemple, des disputes avec d’autres personnes au sujet du tabagisme). – Abandon ou réduction d’activités sociales, professionnelles ou récréatives importantes en raison du tabagisme. – Consommation récurrente de tabac dans des situations dangereuses (par exemple, fumer au lit). – Poursuite du tabagisme malgré la connaissance d’un problème physique ou psychologique persistant ou récurrent susceptible d’avoir été causé ou exacerbé par le tabagisme. – Tolérance, définie par l’un ou l’autre des éléments suivants : *Un besoin de quantités nettement plus importantes de tabac pour obtenir l’effet désiré. *Un effet nettement diminué par l’utilisation continue de la même quantité de tabac. – Le sevrage, qui se manifeste par l’une ou l’autre des manifestations suivantes : *Syndrome de sevrage du tabac *Prise de tabac (ou d’une substance étroitement liée, comme la nicotine) pour soulager ou éviter les symptômes de sevrage. Test de Fagerström pour la dépendance à la nicotine. Instrument standard pour évaluer l’intensité de la dépendance physique à la nicotine. – Combien de temps après votre réveil fumez-vous votre première cigarette ? Dans les 5 minutes (score de 3 points) De 5 à 30 minutes (score de 2 points) De 31 à 60 min (score de 1 point) Après 60 min (score de 0 point) – Trouvez-vous difficile de ne pas fumer dans des endroits où vous ne devriez pas, comme à l’église ou à l’école, au cinéma, à la bibliothèque, dans un bus, au tribunal ou à l’hôpital ? Oui (1 point) Non (0 point) – Quelle est la cigarette que vous détesteriez le plus abandonner ; quelle est celle que vous chérissez le plus ? La première du matin (1 point) N’importe quelle autre (0 point) – Combien de cigarettes fumez-vous par jour ? 10 ou moins (0 point) De 11 à 20 (1 point) 21 à 30 (score de 2 points) 31 ou plus (score de 3 points) – Fumez-vous plus pendant les premières heures après le réveil que pendant le reste de la journée ? Oui (score de 1 point) Non (0 point) – Fumez-vous encore si vous êtes tellement malade que vous restez au lit presque toute la journée ou si vous avez un rhume ou une grippe et que vous avez du mal à respirer ? Oui (1 point) Non (0 point) Un score de 7-10 points est classé comme hautement dépendant ; 4-6 points est classé comme modérément dépendant ; <4 points est classé comme minimalement dépendant. DSM-5, Manuel diagnostique et statistique des troubles mentaux, cinquième édition. |
Prévention.
Les jeunes qui ne commencent pas à fumer des cigarettes entre 15 et 25 ans ont un risque très faible de fumer un jour. Ce groupe d’âge offre une occasion cruciale de prévenir le tabagisme à l’aide de stratégies efficaces, fondées sur des données probantes, visant à empêcher l’initiation au tabac et à réduire l’escalade de l’expérimentation à la consommation régulière.
Une prévention efficace du tabagisme nécessite un ensemble complet de politiques rentables visant à réduire de manière synergique la prévalence du tabagisme dans la population. Ces politiques comprennent des taux élevés de taxation du tabac, des politiques antitabac généralisées et rigoureusement appliquées, l’interdiction de la publicité et de la promotion du tabac, l’utilisation d’emballages neutres et d’avertissements graphiques sur les risques du tabagisme pour la santé, des programmes d’éducation par les médias et par les pairs pour décourager le tabagisme, et l’application de lois interdisant la vente de cigarettes aux jeunes n’ayant pas atteint l’âge minimum légal d’achat. Ces politiques rendent les cigarettes moins disponibles et moins abordables pour les jeunes. De plus, ces politiques rendent l’achat de cigarettes plus difficile pour les jeunes et font du tabagisme une pratique beaucoup moins acceptable socialement. Il convient de noter que ces politiques sont généralement adoptées dans les PFRH, ce qui peut être lié à la baisse de la prévalence du tabagisme dans ces pays, par rapport à la prévalence dans les PFRH.
Prise en charge.
Pharmacothérapie.
Trois classes de pharmacothérapie fondées sur des preuves sont disponibles pour le sevrage tabagique : Les NRT (patchs, gommes, pastilles, mini-pastilles, sprays nasaux et inhalateurs à base de nicotine), la varénicline (un agoniste partiel des nAChR) et le bupropion (un inhibiteur du recaptage de la noradrénaline et de la dopamine qui inhibe également la fonction des nAChR et est également utilisé comme antidépresseur). Ces pharmacothérapies approuvées par la FDA et l’EMA sont des traitements de sevrage tabagique rentables qui doublent ou triplent les taux d’abstinence réussie par rapport à l’absence de traitement ou aux contrôles par placebo.
Les combinaisons de pharmacothérapies sont également efficaces pour le sevrage tabagique. Par exemple, l’association de NRT (tels que le patch à la nicotine à l’état stable et les NRT au besoin tels que la gomme ou la mini-gélule) est plus efficace qu’une seule forme de NRT. L’association d’un NRT et de varénicline est la pharmacothérapie de sevrage tabagique la plus efficace. L’association d’une pharmacothérapie approuvée par la FDA et d’un conseil comportemental augmente encore les chances de réussite du sevrage. Les pharmacothérapies de deuxième intention (par exemple, la nortriptyline) ont un certain potentiel pour l’arrêt du tabac, mais leur utilisation est limitée en raison de leur profil de tolérance.
Tous les fumeurs devraient recevoir une pharmacothérapie pour les aider à cesser de fumer, à l’exception de ceux chez qui l’efficacité de la pharmacothérapie n’est pas suffisamment prouvée (chez les adolescents, les utilisateurs de tabac sans fumée, les femmes enceintes ou les fumeurs légers) ou ceux chez qui la pharmacothérapie est médicalement contre-indiquée. Le tableau 2 fournit des informations spécifiques concernant la posologie et la durée de chaque pharmacothérapie approuvée par la FDA. L’utilisation prolongée de la pharmacothérapie au-delà du régime standard de 12 semaines après l’arrêt du tabac est efficace et devrait être envisagée. De plus, la pharmacothérapie de précharge (c’est-à-dire l’initiation de la médication de désaccoutumance avant une tentative d’abandon), particulièrement avec le timbre de nicotine, est un traitement prometteur, bien que d’autres études soient nécessaires pour confirmer son efficacité.
| Médicament | Vigilance | Effets secondaires | Usage | Disponibilité |
| Traitement combiné de substitution de la nicotine : patch plus pastille ou patch plus gomme. | Suivre les instructions pour chaque médicament | Voir les médicaments individuels ci-dessous | Voir les médicaments individuels ci-dessous | Voir les médicaments individuels ci-dessous |
| Varenicline | Utiliser avec précaution chez les patients souffrant d’une insuffisance rénale importante, d’une maladie psychiatrique grave ou sous dialyse. | Nausées, insomnie et rêves anormaux | Commencez une semaine avant la date d’arrêt et utilisez-le pendant 3 à 6 mois ; arrêtez généralement le 8e jour ; vous pouvez aussi arrêter entre le 8e et le 35e jour. | Sur ordonnance seulement |
| Patch de nicotine | Ne pas utiliser si vous souffrez d’eczéma ou de psoriasis sévères. | Réaction cutanée locale et insomnie | Après l’arrêt du tabac : 12 semaines ; facultatif avant l’arrêt du tabac jusqu’à 6 mois avant la date d’arrêt avec réduction du tabagisme. | En vente libre ou sur ordonnance |
| Pastille à la nicotine | Ne pas manger ou boire 15 min avant ou pendant l’utilisation ; consommer une pastille à la fois avec une limite de 20 pastilles par 24 h. | Hoquet, toux et brûlures d’estomac | 3-6 mois ; facultatif avant l’arrêt du tabac jusqu’à 6 mois avant la date d’arrêt en cas de réduction du tabagisme ; recommander la mini-gélule en raison du taux sanguin de nicotine plus rapide et de la facilité d’utilisation. | En vente libre uniquement |
| Chewing-gum à la nicotine | Attention aux prothèses dentaires ; ne pas manger ou boire 15 min avant ou pendant l’utilisation. | Douleur dans la bouche et mal de ventre | Après l’arrêt du tabac : jusqu’à 12 semaines ; facultatif avant l’arrêt du tabac jusqu’à 6 mois avant la date d’arrêt avec réduction du tabagisme | En vente libre uniquement |
| Inhalateur à la nicotine | Peut irriter la bouche ou la gorge au début (s’améliore avec l’usage). | Irritation locale de la bouche et de la gorge | Après l’arrêt du tabac : jusqu’à 6 mois, diminution progressive à la fin ; facultatif avant l’arrêt du tabac : jusqu’à 6 mois avant l’arrêt du tabac avec réduction du tabagisme. | Sur ordonnance seulement |
| Spray nasal à la nicotine | Ne pas administrer aux patients asthmatiques ; peut irriter le nez (s’améliore avec le temps) et peut entraîner une dépendance. | Irritation nasale | 3-6 mois, diminution progressive à la fin | Prescription uniquement |
| Bupropion SR 150 | Ne pas administrer aux patients qui prennent un inhibiteur de la monoamine oxydase, qui utilisent le bupropion sous une autre forme, ou qui ont des antécédents de crises d’épilepsie ou de troubles alimentaires. | Insomnie et bouche sèche | Commencez 1-2 semaines avant la date d’arrêt ; utilisez pendant 2-6 mois | Sur ordonnance seulement |
Pharmacothérapies de sevrage tabagique approuvées par la FDA
La cytisine est utilisée depuis longtemps pour le sevrage tabagique en Europe de l’Est et est disponible dans certains pays (comme le Canada) sans ordonnance. La cytisine est un agoniste partiel des nAChRs et sa structure a été le précurseur du développement de la varénicline. La cytisine est au moins aussi efficace que certaines pharmacothérapies approuvées pour le sevrage tabagique, comme le NRT, et le rôle de la cytisine dans le sevrage tabagique est susceptible de s’étendre à l’avenir, notamment en raison de son coût beaucoup plus faible que les pharmacothérapies traditionnelles. Les e-cigarettes pourraient également être utiles comme dispositifs de sevrage tabagique. Le rapport 2020 du Surgeon General américain a conclu qu’il n’y avait pas suffisamment de preuves pour promouvoir la cytisine ou les e-cigarettes en tant que traitements efficaces du sevrage tabagique, mais au Royaume-Uni, son utilisation est recommandée pour le sevrage tabagique (voir réf.15 pour une revue régulièrement mise à jour).
Conseils et traitements comportementaux.
Le conseil psychosocial augmente considérablement la probabilité de réussite de l’arrêt du tabac, en particulier lorsqu’il est associé à une pharmacothérapie. Même une séance de conseil de seulement 3 minutes peut aider les fumeurs à arrêter, bien que les lignes directrices 2008 du US Public Health Service et le Preventive Services Task Force aient chacun conclu qu’un conseil plus intensif (≥20 min par séance) est plus efficace qu’un conseil moins intensif (<20 min par séance). Des taux d’arrêt du tabac plus élevés sont obtenus en utilisant des techniques de changement de comportement qui ciblent les processus associatifs et autorégulateurs. En outre, les techniques de changement de comportement qui favoriseront l’engagement, la récompense sociale et l’identité associés au changement de comportement semblent associées à des taux de réussite plus élevés. Le counseling fondé sur des données probantes est axé sur l’apport d’un soutien social pendant le traitement, sur l’acquisition de compétences pour faire face au sevrage et à l’abandon du tabac, et sur la résolution de problèmes dans des situations difficiles. Un conseil efficace peut être dispensé par divers prestataires (tels que des médecins, des infirmières, des pharmaciens, des travailleurs sociaux, des psychologues et des spécialistes certifiés du traitement du tabagisme).
Le conseil peut être dispensé selon diverses modalités. Le conseil individuel et de groupe en personne est efficace, tout comme le conseil téléphonique (lignes d’aide à l’arrêt du tabac). Les interventions par Internet et par texte semblent être efficaces pour le sevrage tabagique, surtout lorsqu’elles sont interactives et adaptées à la situation spécifique du fumeur. Au cours des dernières années, le nombre d’applications smartphone pour le sevrage tabagique a augmenté, mais les preuves que l’utilisation de ces applications augmente significativement les taux de sevrage tabagique ne sont pas suffisantes.
La gestion des contingences (fournir des incitations financières pour l’abstinence ou l’engagement dans un traitement) a montré des résultats prometteurs mais ses effets ne sont pas durables une fois que les contingences sont supprimées. D’autres traitements tels que l’hypnose, l’acupuncture et le traitement au laser n’ont pas montré qu’ils amélioraient les taux d’arrêt du tabac par rapport aux traitements placebo. De plus, aucune preuve solide ne soutient l’utilisation de la stimulation magnétique transcrânienne (TMS) conventionnelle pour le sevrage tabagique à long terme.
Bien qu’il existe une variété d’interventions de sevrage tabagique soutenues par des données empiriques, plus des deux tiers des fumeurs adultes qui ont tenté d’arrêter de fumer aux États-Unis au cours de l’année écoulée n’ont pas utilisé de traitement fondé sur des données probantes et ce taux est probablement inférieur dans de nombreux autres pays. Cela montre la nécessité d’accroître la sensibilisation et l’accès à des aides efficaces au sevrage tabagique chez tous les fumeurs.
Stimulation du cerveau.
L’insula (qui fait partie du cortex frontal) est une structure cérébrale critique impliquée dans l’envie de fumer et la rechute. L’activité de l’insula peut être modulée à l’aide d’une approche innovante appelée TMS profonde de l’insula et du cortex préfrontal (TMS profonde), qui est efficace pour aider les gens à arrêter de fumer. Cette approche a été approuvée par la FDA en tant qu’intervention efficace pour le sevrage tabagique. Cependant, bien que cette intervention ait été développée et soit efficace pour le sevrage tabagique, le nombre de personnes y ayant accès est limité en raison du nombre restreint de sites équipés et disposant de personnel formé, et du coût de cette intervention.
Qualité de vie.
Des instruments génériques (tels que l’enquête de santé Short-Form (SF-36)) peuvent être utilisés pour évaluer la qualité de vie (QDV) des fumeurs. Les personnes qui fument évaluent leur QDV plus bas que les personnes qui ne fument pas, avant et après qu’elles soient devenues fumeuses. La QDV s’améliore lorsque les fumeurs arrêtent de fumer. La santé mentale peut également s’améliorer lors de l’arrêt du tabac. En outre, la QDV est bien moins bonne chez les fumeurs atteints de maladies liées au tabac, telles que les maladies respiratoires chroniques et les cancers, que chez les personnes qui n’ont pas de maladies liées au tabac. Les dimensions de la QDV qui présentent les plus fortes diminutions chez les personnes qui fument sont celles liées à la santé physique, aux activités quotidiennes et à la santé mentale, comme la dépression. Le tabagisme augmente également le risque de diabète sucré, qui est un déterminant majeur de la mauvaise qualité de vie pour un large éventail de pathologies.
Le lourd tribut payé aux décès prématurés dus au tabagisme peut masquer le fait que nombre des maladies à l’origine de ces décès entraînent également une incapacité substantielle dans les années précédant le décès. En effet, chez les fumeurs, le décès est généralement précédé de plusieurs années de vie avec une incapacité grave et un handicap dans les activités quotidiennes causés par les maladies respiratoires chroniques, les maladies cardiaques et le cancer. La qualité de vie des fumeurs au cours de ces années peut également être affectée par les effets négatifs des traitements médicaux qu’ils reçoivent pour ces maladies liées au tabagisme (tels qu’une chirurgie et une radiothérapie importantes).
Perspectives.
Développer l’arrêt du tabac dans le monde.
Le principal défi à relever au niveau mondial est d’envisager des stratégies individuelles et populationnelles susceptibles d’augmenter les taux d’arrêt du tabac chez les adultes, qui sont considérablement bas dans la plupart des PFR-PRI, ainsi que des stratégies visant à garantir que même dans les PFR-PRI, l’arrêt du tabac continue d’augmenter. En général, les outils les plus efficaces recommandés par l’OMS pour développer l’arrêt du tabac sont les mêmes que ceux qui peuvent prévenir l’initiation au tabagisme, notamment des taxes plus élevées sur le tabac, l’interdiction de la publicité et de la promotion, des étiquettes d’avertissement bien visibles ou des emballages neutres, l’interdiction de fumer en public, et des efforts médiatiques et éducatifs. L’utilisation effective de ces politiques, en particulier la taxation, est à la traîne dans la plupart des PRFM par rapport à la plupart des PITS, avec des exceptions importantes comme le Brésil. L’accès à des pharmacothérapies et à des conseils efficaces ainsi qu’à un soutien pour les conditions de santé mentale coexistantes serait également nécessaire pour accélérer l’arrêt du tabac dans les PRFM. Ceci est particulièrement important car les fumeurs vivant dans les PRFM n’ont souvent pas accès à la gamme complète des options de traitement efficaces.
Réglementer l’accès aux e-cigarettes.
La manière dont les e-cigarettes devraient être utilisées fait l’objet d’un débat dans le domaine de la lutte antitabac. Dans certains pays (par exemple, le Royaume-Uni), l’utilisation des e-cigarettes comme aide au sevrage tabagique et comme stratégie de réduction des risques est soutenue, sur la base de l’idée que l’utilisation des e-cigarettes entraînera une exposition aux composés toxiques bien moindre que l’utilisation du tabac, réduisant ainsi les dommages globaux. Dans d’autres pays (par exemple, les États-Unis), on se préoccupe davantage de prévenir l’utilisation accrue des e-cigarettes par les jeunes, qui pourrait ensuite conduire au tabagisme. Il est essentiel de réglementer les e-cigarettes de manière nuancée afin de permettre aux fumeurs d’accéder à ces produits tout en empêchant leur adoption par les jeunes.
Réglementation de la teneur en nicotine des produits du tabac.
La réduction de la teneur en nicotine des cigarettes pourrait potentiellement produire des produits moins addictifs qui permettraient une réduction progressive de la prévalence du tabagisme dans la population. Certaines études cliniques ont montré qu’il n’y avait pas d’augmentation compensatoire du tabagisme lorsqu’on donne accès à du tabac à faible teneur en nicotine. Une réglementation future pourrait être mise en œuvre pour diminuer progressivement la teneur en nicotine du tabac combustible et d’autres produits à base de nicotine.
Les jeux de la fin du tabac.
Certaines personnes ont proposé de se débarrasser des produits du tabac commerciaux au cours de ce siècle ou d’utiliser la perturbation économique majeure découlant de la pandémie de COVID-19 pour accélérer la disparition de l’industrie du tabac. Certains producteurs de tabac ont même proposé cette stratégie comme objectif interne, avec l’idée de passer à des systèmes d’administration de nicotine moins nocifs (Philip Morris International). Certains pays s’orientent vers un tel objectif ; par exemple, en Nouvelle-Zélande, l’objectif que moins de 5 % des Néo-Zélandais soient des fumeurs en 2025 a été fixé. L’approche de la fin du tabagisme serait globalement la meilleure approche pour réduire la charge du tabagisme sur la société, mais elle nécessiterait la coordination de plusieurs pays et un fort consensus public et privé sur la stratégie pour éviter une expansion majeure du marché illicite existant des produits du tabac dans certains pays.
Interventions novatrices.
La pandémie de COVID-19 a montré que les investissements à grande échelle dans la recherche peuvent conduire au développement rapide d’interventions thérapeutiques efficaces. En revanche, le sevrage tabagique a été sous-financé par rapport à la contribution qu’il apporte à la charge mondiale de morbidité. En outre, la coordination entre les équipes de recherche est limitée et la plupart des études sont à petite échelle et souvent peu puissantes. Il est temps de financer un programme de recherche ambitieux et coordonné pour tester les thérapies les plus prometteuses basées sur une meilleure compréhension de la base neurobiologique du tabagisme et de la dépendance à la nicotine (tableau 3). Beaucoup de ces idées n’ont pas encore été testées correctement et cela pourrait être réalisé par un programme de recherche coordonné au niveau international.
