Kolaczynska, K. E., Thomann, J., Hoener, M. C., & Liechti, M. E. (2021). The pharmacological profile of second generation pyrovalerone cathinones and related cathinone derivative. International journal of molecular sciences, 22(15), 8277.
Abstract
Les cathinones pyrovalérones sont des substances psychoactives puissantes qui possèdent une partie pyrrolidine. Les nouvelles substances psychoactives (NPS) de type pyrovalérone sont continuellement détectées, mais leur pharmacologie et leur toxicologie sont largement inconnues. Nous avons évalué plusieurs dérivés de la pyrovalérone et des cathinones apparentées au niveau des transporteurs humains de la noradrénaline (NET), de la dopamine (DAT) et de la sérotonine (SERT) en utilisant des cellules HEK293 surexprimant chaque transporteur respectif. Nous avons examiné l’efflux de monoamines médié par les transporteurs dans des cellules préchargées. Le pouvoir de liaison et d’activation des récepteurs 5-HT1A, 5-HT2A, 5-HT2B et 5-HT2C a également été évalué. Toutes les pyrovalérones cathinones étaient de puissants inhibiteurs de DAT (IC50 = 0,02-8,7 μM) et de NET (IC50 = 0,03-4,6 μM), et ne présentaient aucune activité SERT à des concentrations < 10 μM. Aucun des composés n’a induit d’efflux de monoamines. La NEH était un puissant inhibiteur de la DAT/NET (IC50 = 0,17-0,18 μM). Le 4F-PBP et la NEH présentaient une sélectivité élevée pour la DAT (rapport DAT/SERT = 264-356). L’allongement de la chaîne alkyle a renforcé le pouvoir d’inhibition de la NET et de la DAT, tandis que la présence d’un groupement 3,4-méthylènedioxy a augmenté le pouvoir d’inhibition de la SERT. La plupart des composés ne présentaient pas d’activité pertinente sur d’autres récepteurs monoaminergiques. En conclusion, le 4F-PBP et la NEH sont des inhibiteurs sélectifs de la DAT et de la NET, ce qui indique que ces substances produisent probablement de forts effets psychostimulants et présentent un risque élevé d’abus.
1. Introduction
Les cathinones synthétiques constituent un vaste sous-groupe de drogues de synthèse, communément appelées “legal highs” ou “sels de bain”, qui imitent les effets psychostimulants des drogues classiques, notamment la 3,4-méthylènedioxyméthamphétamine [MDMA], l’amphétamine ou la cocaïne. Vendues souvent à bas prix sur Internet, avec des étiquettes telles que “non destiné à la consommation humaine”, ces nouvelles substances psychoactives sont synthétisées comme des alternatives légales aux drogues classiques, contournant ainsi la législation sur le contrôle des drogues, et sont souvent commercialisées comme des alternatives plus sûres. Cependant, ces substances ont rarement des profils pharmacologiques et toxicologiques bien définis et représentent souvent un énorme fardeau pour la santé publique en raison des effets indésirables et des toxicités potentielles qui leur sont associés. Les effets indésirables les plus courants sont la tachycardie, les hallucinations, l’agitation et les accès de violence, qui peuvent tous mettre la vie en danger.
Structurellement analogue à la cathinone, l’agent psychoactif naturel se trouve dans la plante de khat (Catha edulis) ; ce sous-groupe de drogues de synthèse se compose de plusieurs membres possédant différentes entités structurelles au niveau de l’anneau phényle, du carbone central ou de l’atome d’azote. Un sous-ensemble comprend les cathinones pyrovalérones, qui présentent un anneau pyrrolidine au niveau de l’atome d’azote, par exemple l’α-pyrrolidinopropiophénone (α-PPP). Il est intéressant de noter que les cathinones pyrovalérones se distinguent des autres cathinones par leurs effets pharmacologiques, car elles imitent les effets psychostimulants des amphétamines et se comportent comme de purs bloqueurs des transporteurs de la captation des monoamines.
La 3,4-méthylènedioxypyrovalérone (MDPV), membre clé du sous-groupe des cathinones pyrovalérones, est la cathinone la plus fréquemment détectée et consommée dans les préparations de “legal highs” en Europe et aux États-Unis. En tant qu’inhibiteur très puissant des transporteurs de la dopamine (DAT) et de la norépinéphrine (NET), mais pas du transporteur de la sérotonine (SERT), le MDPV produit des effets sympathomimétiques et psychostimulants chez les utilisateurs et est associé à un risque élevé d’abus, similaire à celui de l’amphétamine ou de la cocaïne. Des dérivés structurellement similaires du MDPV sont continuellement synthétisés afin de contourner la réglementation imposée au MDPV et à ses cathinones apparentées. La production de cathinones pyrovalérones de deuxième génération comme l’α-pyrrolidinopentiophénone (α-PVP), l’α-pyrrolidinobutiophénone (α-PBP), la 3,4-méthylènedioxy-α-pyrrolidinopropiophénone (MDPPP) et la 3,4-méthylènedioxy-α-pyrrolidinopropiophénone (MDPPP) est en cours, et la 3,4-méthylènedioxy-α-pyrrolidinobutiophénone (MDPBP) pose un problème aux régulateurs, car ces nouvelles substances se trouvent dans des préparations de “legal high” et doivent être réglementées. En outre, elles posent également des problèmes aux utilisateurs, car leurs propriétés pharmacologiques et toxicologiques n’ont pas fait l’objet d’études appropriées. Il est donc essentiel de générer des données pharmacologiques pour les nouvelles substances afin de prédire leurs effets in vivo et leurs effets secondaires indésirables potentiels, car certains d’entre eux peuvent être liés à des événements toxicologiques graves.
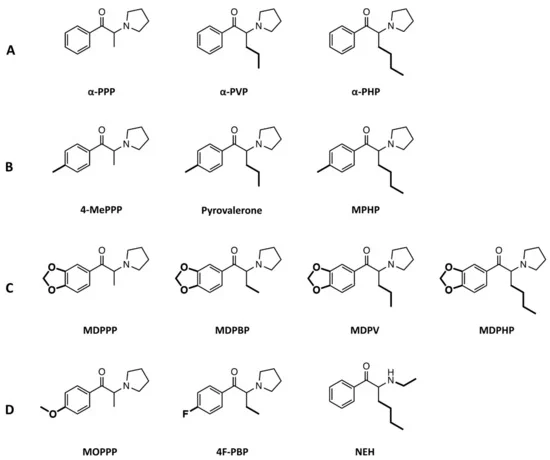
Notre groupe a précédemment étudié la pharmacologie in vitro de certaines cathinones pyrovalérones, notamment le MDPV, le MDPPP, le MDPBP, la naphyrone, la pyrovalérone et l’α-PVP. Tous ces composés ont puissamment inhibé le NET et le DAT, mais pas le SERT, à l’exception de la naphyrone, qui a également inhibé le SERT. En outre, aucune des pyrovalérones ne produit d’efflux de monoamines, contrairement aux cathinones substituées par des anneaux comme la méphédrone. En raison de l’afflux de cathinones pyrovalérones de deuxième génération apparaissant dans les préparations de “sel de bain”, nous avons voulu étudier les profils pharmacologiques in vitro des nouveaux dérivés afin de les comparer aux membres des cathinones pyrovalérones précédemment décrites (figure 1). Bien que des données pharmacologiques existent pour certains de ces dérivés étudiés (Marusich et al. 2014, Eshleman et al. 2017), nous visons à confirmer ces résultats en utilisant notre configuration d’essai et à fournir en outre des données pour les substances qui ont été inexplorées jusqu’à présent en utilisant le même essai utilisé pour caractériser les pyrovalérones de première génération et de nombreux autres NPS. Dans l’ensemble, nous avons examiné si chaque composé inhibait le recaptage des trois monoamines au niveau du NET, du DAT et du SERT, en explorant en outre le potentiel de chaque substance à induire une libération des monoamines par le biais du transporteur. En outre, nous avons étudié les propriétés de liaison et d’activation des récepteurs de ces cathinones pyrovalérones au niveau des récepteurs sérotoninergiques humains (5-HT1A, 5-HT2A, 5-HT2B et 5-HT2C).
Afin de fournir une caractérisation pharmacologique complète de chaque composé au niveau des transporteurs et des récepteurs des monoamines, y compris les récepteurs dopaminergiques, adrénergiques et le récepteur 1 associé aux traces d’amines (TAAR1), nous avons également compilé des données provenant de publications antérieures de notre groupe.
2. Résultats
2.1 Inhibition de l’absorption des monoamines par les transporteurs
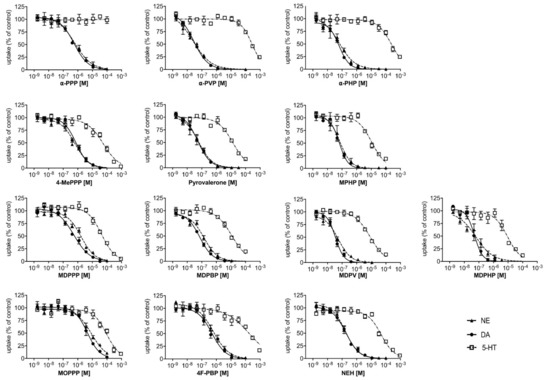
Les courbes d’inhibition de l’absorption des monoamines au niveau des transporteurs humains NET, DAT et SERT sont illustrées à la figure 2. Les puissances d’inhibition correspondantes (IC50) des cathinones à base de pyrovalérone au niveau de chaque transporteur respectif sont indiquées dans le tableau 1.
[TABLEAU 1]
Les pyrovalérones cathinones avec une chaîne de carbone progressivement plus longue au niveau du groupe α-carbone (Figure 1A ; α-PPP, α-PVP, et α-PHP, respectivement) étaient de puissants inhibiteurs du NET et du DAT (IC50 = 0,02 – 0,64 μM), mais présentaient peu d’activité au niveau du SERT (Figure 2, Tableau 1). Les rapports d’inhibition DAT/SERT élevés (> 1000) signifient que ces composés étaient les inhibiteurs les plus sélectifs du transporteur dopaminergique de toute la série. L’extension progressive du groupe α-carbone (α-PPP, méthyl → α-PVP, propyl → α-PHP, butyl) a augmenté la puissance d’inhibition au niveau du NET et du DAT.
De même, les pyrovalérones avec un fragment 4-méthyle et des extensions du groupe α-carbone (figure 1B ; 4-MePPP, pyrovalérone et MPHP, respectivement) étaient des inhibiteurs très sélectifs de la DAT (rapports d’inhibition DAT/SERT > 72) et de la NET (IC50 = 0,06 – 0,64 μM), et présentaient une puissance accrue au niveau du SERT (IC50 = 11 – 55 μM). De même, l’extension progressive du groupe méthyle α-carbone a augmenté la CI50 au niveau du DAT et du NET, ainsi qu’au niveau du SERT.
La pyrovalérone contenant la fraction 3,4-méthylènedioxy et différentes extensions du groupe α-carbone (figure 1C ; MDPPP, MDPBP, MDPV et MDPHP, respectivement) a interagi avec le NET et le DAT à des concentrations submicromolaires (IC50 < 1 μM ; tableau 1), à l’exception du MDPPP qui a inhibé le NET à une concentration micromolaire (IC50 = 1,7 μM). Les rapports d’inhibition DAT/SERT présentés par ces substances reflétaient la forte sélectivité pour le transporteur de la dopamine (rapport DAT/SERT = 80-241). Dans l’ensemble, le groupement 3,4-méthylènedioxy a renforcé le pouvoir d’inhibition de ces composés sur le SERT par rapport à leurs homologues (principalement l’α-PPP, l’α-PVP et l’α-PHP dépourvus du groupement), bien que le pouvoir d’inhibition du SERT soit encore relativement faible par rapport à la CI50 observée au niveau de la DAT ou de la NET.
Enfin, le MOPPP contenant du 4-méthoxy a interagi avec le NET et le DAT à des concentrations micromolaires (IC50 = 8,7 μM et 4,6 μM, respectivement ; figure 1D), présentant les interactions les moins puissantes au niveau des transporteurs parmi toutes les substances examinées dans l’ensemble de la série. Avec une faible puissance d’inhibition au niveau du SERT (IC50 > 10 μM), le MOPPP reflète une plus grande sélectivité pour le DAT par rapport au SERT. L’analogue 4-fluoré de l’α-PBP, le 4F-PBP, a puissamment inhibé le NET et le DAT (IC50 < 0,61 μM ; tableau 1), mais a montré une puissance plus faible au niveau du SERT (IC50 > 100 μM), similaire aux profils observés pour les cathinones pyrovalérones avec une chaîne progressivement plus longue au niveau du groupe méthyle de l’α-carbone. De même, la NEH était un puissant inhibiteur du NET et du DAT (IC50 < 0,18 μM ; tableau 1) avec une sélectivité pour le ratio d’inhibition DAT vs SERT de 264, similaire à celui du MDPV.
2.2 Interactions avec les récepteurs sérotoninergiques : Affinité de liaison et pouvoir d’activation
Les affinités de liaison et les pouvoirs d’activation des récepteurs sérotoninergiques pour les récepteurs humains 5-HT1A, 5-HT2A, 5-HT2B et 5-HT2C sont présentés dans le tableau 2. Toutes les cathinones à base de pyrovalérone, sauf deux, se lient au récepteur h5-HT1A dans la plage micromolaire (Ki ≤ 13 μM), ce qui est similaire à l’affinité de liaison observée pour la MDMA et l’amphétamine (Ki = 6,7-11 μM). La MOPPP et la NEH sont les seules cathinones qui ne se sont pas liées au récepteur dans la plage de concentrations examinée (Ki ≥ 17 μM). En revanche, la plupart des composés ne se sont pas liés au récepteur h5-HT2A (Ki ≥ 13 μM), tandis que l’α-PPP, le 4-MePPP, le MPHP et le MDPPP ont présenté une faible liaison micromolaire au récepteur (Ki = 1,1-8,0 μM) similaire à la MDMA (Ki = 6,3 μM). Aucune des cathinones pyrovalérones n’a interagi avec les récepteurs h5-HT2C dans la plage de concentrations examinée (Ki ≥ 5,1 μM). Dans l’ensemble, tous les composés de la série n’ont pas présenté de pouvoir d’activation pertinent au niveau des récepteurs 5-HT2A ou 5-HT2B (CE50 ≥ 10 μM).
[TABLEAU 2]
2.3 Interactions de liaison entre les transporteurs de monoamines et les récepteurs non sérotoninergiques
L’affinité de liaison aux transporteurs de monoamines et aux récepteurs monoaminergiques est présentée dans le tableau 3. Les pyrovalérones cathinones examinées se sont liées au NET (Ki = 0,06-3,5 μM) et au DAT (Ki = 0,007-0,18 μM) avec une grande affinité, ce qui correspond à leur puissance d’inhibition élevée au niveau de ces deux transporteurs. En outre, certains composés, principalement la pyrovalérone, le MDPPP, le MDPBP, le MDPHP et le MDPV ont présenté une affinité pertinente pour le SERT, bien que dans la plage micromolaire inférieure (Ki = 2,9-12 μM).
[TABLEAU 3]
Dans l’ensemble, les cathinones pyrovalérones n’ont pas interagi à des concentrations pertinentes avec le récepteur dopaminergique D2, les récepteurs adrénergiques α1A et α2A ou le récepteur 1 associé aux traces d’amines (TAAR1 ; humain, rat et souris), à l’exception du 4-MePPP, qui s’est lié au récepteur adrénergique α1A dans la plage micromolaire inférieure (Ki = 2,2 μM).
2.4 Efflux de monoamines médié par le transporteur
L’efflux de monoamines médié par les transporteurs à 100 μM de chaque drogue testée est illustré à la figure 3. La MDMA a été utilisée comme contrôle positif car elle provoque un efflux significatif au niveau des transporteurs par rapport à chaque inhibiteur respectif. Dans l’ensemble, aucune des cathinones pyrovalérones examinées n’a induit de libération significative des monoamines à la concentration examinée, ce qui indique que tous les composés agissent comme des bloqueurs purs de l’absorption au niveau des transporteurs.
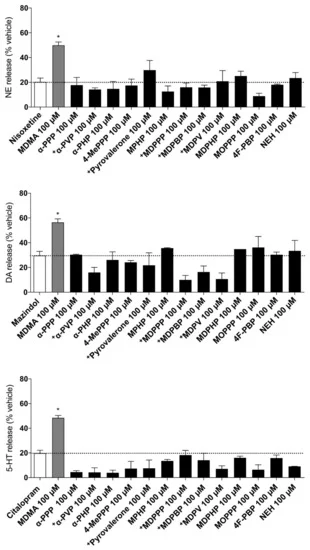
Figure 3. Efflux de monoamine induit par 100 μM de drogue dans des cellules HEK293 exprimant des NET, DAT ou SERT humains préchargés en monoamine radiomarquée. L’efflux de monoamine induit par chaque composé a été mesuré en pourcentage de la diminution d’un neurotransmetteur radiomarqué respectif ([3H]-NE/DA/5-HT) dans les cellules préchargées en monoamine par rapport au contrôle. Le “pseudo-efflux” non spécifique résultant de la diffusion des monoamines et de l’inhibition de la recapture qui s’ensuit est indiqué par une ligne en pointillé sur les graphiques. Une substance était un substrat du transporteur de monoamines si elle produisait un efflux de monoamines significativement plus important (* p < 0,05) que chaque inhibiteur de recapture pur respectif (nisoxétine, mazindol ou citalopram). Les données présentées sont la moyenne ± SEM. Les données sur l’efflux de monoamine pour certaines cathinones pyrovalérones (indiquées par +) ont été adaptées d’une publication précédente.
3. Discussion
3.1 Inhibition du transporteur des monoamines et efflux médié par le transporteur
Les pyrovalérones les plus simples de la série, principalement l’α-PPP, l’α-PVP et l’α-PHP (figure 1A), ont toutes interagi avec les transporteurs de monoamines d’une manière similaire, en inhibant principalement et puissamment le NET et le DAT, avec une faible activité sur le SERT (figure 2, tableau 1). L’α-PVP et l’α-PHP ont présenté une puissance d’inhibition 32 fois et 11 fois plus élevée au niveau de la NET, respectivement, par rapport à l’α-PPP. De même, au niveau du DAT, l’α-PVP et l’α-PHP ont présenté un pouvoir d’inhibition 17 fois et 9 fois plus élevé, ce qui indique que l’extension de la longueur de la chaîne alkyle entraîne une inhibition progressivement plus puissante au niveau de la NET et du DAT. Ce résultat est cohérent avec les études précédentes de, qui confirment nos résultats dans les synaptosomes de cerveau de rat et dans les cellules HEK293 transfectées. En outre, les trois pyrovalérones étaient très sélectives pour le DAT par rapport au SERT, qui est associé à un potentiel d’abus plus élevé. Des études in vivo prolongent ces résultats dans le paradigme de l’effet de stimulus discriminant chez le rat, où ces pyrovalérones sont substituées à des drogues classiques d’abus, telles que la cocaïne et la méthamphétamine. En outre, les trois pyrovalérones n’ont pas induit d’efflux de monoamine dans les cellules préchargées (figure 3), ce qui confirme leur statut de purs bloqueurs de l’absorption des transporteurs.
Les pyrovalérones avec une fraction 4-méthyle (4-MePPP) et/ou des extensions du groupe α-carbone (pyrovalérone et MPHP) étaient également des inhibiteurs puissants des transporteurs, le 4-MePPP présentant une puissance 11 fois et 15 fois plus faible au niveau de la NET et de la DAT, respectivement, par rapport à la pyrovalérone et au MPHP (Figure 1B et Figure 2, Tableau 1). Il est intéressant de noter que les trois pyrovalérones ont montré une plus grande puissance sur le SERT que les pyrovalérones les plus simples de la série (α-PPP, α-PVP et α-PHP). Ils étaient cependant de puissants inhibiteurs de la DAT (rapport DAT/SERT = 72-169), ce qui correspond aux rapports DAT/SERT précédemment rapportés par. La présence de la fraction 4-méthyle a eu peu d’effet sur la puissance d’inhibition observée au niveau de la NET et de la DAT. Comme les pyrovalérones les plus simples de la série, le MPHP et le 4-MePPP sont des inhibiteurs purs de la captation des transporteurs, car aucun efflux de monoamine n’a été observé (figure 3). Des études in vivo portant sur les effets neurochimiques et comportementaux du 4-MePPP suggèrent que la substance est susceptible d’être auto-administrée, car elle provoque une augmentation dose-dépendante des niveaux de dopamine dans le noyau accumbens et déclenche une locomotion vers l’avant et des mouvements stéréotypés chez les rongeurs. Cependant, par rapport aux pyrovalérones hautement dopaminergiques comme l’α-PPP, le 4-MePPP a probablement un potentiel d’abus plus faible car il est moins dopaminergique (rapport DAT/SERT plus faible) et des études in vivo récentes ont montré qu’il n’induit pas de préférence de place conditionnée chez les rats, et qu’il peut seulement être entièrement substitué à la méthamphétamine, mais pas à la cocaïne.
Les pyrovalérones contenant du 3,4-méthylènedioxy (figure 1C) avec diverses extensions du groupe α-carbone étaient des inhibiteurs purs et puissants du NET et du DAT (figure 3) et présentaient une puissance d’inhibition du SERT similaire à celle observée avec les pyrovalérones décrites ci-dessus (figure 1B). Il est intéressant de noter que le MDPPP a présenté le pouvoir d’inhibition le plus faible au niveau du NET et du DAT par rapport aux autres pyrovalérones contenant du 3,4-méthylènedioxy, qui ont à leur tour inhibé les deux transporteurs, mais avec un pouvoir d’inhibition plus élevé (de 8 à 34 fois plus élevé). En outre, l’extension du groupe α-carbone a également renforcé le pouvoir d’inhibition au niveau du SERT, ce qui s’est traduit par une valeur IC50 progressivement plus faible lorsque l’on compare le MDPPP, le MDPBP, le MDPV et le MDPHP (dans cet ordre), ce qui est conforme aux études antérieures de. Dans l’ensemble, la présence du groupe 3,4-méthylènedioxy a simplement renforcé le pouvoir d’inhibition de SERT, comme l’indiquent les valeurs IC50 plus élevées observées pour le MDPPP/MDPV/MDPHP par rapport à leurs homologues dépourvus de 3,4-méthylènedioxy, l’α-PPP, l’α-PVP et l’α-PHP (tableau 1).
Le MOPPP, qui possède un groupement 4-méthoxy sur l’anneau phényle (Figure 1D), a présenté la puissance d’inhibition la plus faible au niveau de la NET parmi tous les composés étudiés, avec une valeur IC50 environ 14 fois plus élevée que celle observée pour l’α-PPP (Tableau 1). Une observation similaire a pu être faite au niveau de la DAT, où le MOPPP a montré un pouvoir d’inhibition 8 fois plus faible avec une valeur IC50 de 4,6 μM, par rapport à l’α-PPP qui n’a pas subi de modification en position 4′. De plus, le MOPPP a inhibé le SERT mais dans une bien moindre mesure et a affiché le ratio DAT vs. SERT le plus faible de tous les composés étudiés. À notre connaissance, le MOPPP n’a pas été examiné auparavant au niveau des transporteurs de la captation des monoamines. Nos résultats suggèrent qu’il n’inhibe pas les transporteurs d’absorption des monoamines aussi puissamment que d’autres substances étudiées ici, par exemple l’α-PPP. Avec une sélectivité pour le DAT par rapport au SERT, elle est susceptible d’induire des effets de type psychostimulant et d’être associée à un risque élevé d’abus. La MOPPP a déjà été détectée dans des mélanges de cathinones synthétiques contaminés et, jusqu’à présent, elle a été principalement étudiée pour son métabolisme et son dépistage toxicologique.
D’autre part, la 4F-PBP, qui contient un groupement 4-fluor sur l’anneau phényle (figure 1D), a puissamment inhibé la NET et la DAT, avec un profil similaire à celui de l’α-PPP. Comme toutes les pyrovalérones étudiées ici, le 4F-PBP n’a pas induit d’efflux de monoamines (figure 3) et s’est avéré un puissant bloqueur DAT vs. SERT pur, avec un rapport DAT/SERT similaire à celui de la pyrovalérone et du MDPV. En outre, cela suggère que l’ajout de la fraction fluor sur la position 4 de l’anneau phényle n’augmente pas le profil d’inhibition de l’α -PBP, l’homologue sans fluor du 4F-PBP, car il semble être également très puissant au niveau du DAT et du NET, mais pas au niveau du SERT, comme l’a rapporté. Comme le MOPPP, le 4F-PBP a été trouvé dans des produits cathinoniques saisis mais n’a pas été étudié auparavant au niveau des transporteurs de monoamines. Nos résultats suggèrent que le profil d’inhibition puissant du 4F-PBP, avec une forte sélectivité au niveau du DAT par rapport au SERT, est susceptible de présenter des effets psychostimulants puissants chez les utilisateurs (similaires à ceux de l’α-PPP) et d’être associé à un risque élevé d’abus, comme les substances ayant des effets plus prononcés au niveau du DAT par rapport au SERT.
La NEH, une cathinone synthétique dépourvue d’anneau de pyrrolidine, a également inhibé puissamment le NET et le DAT, tout en présentant une puissance beaucoup plus faible au niveau du SERT (tableau 1). En outre, la NEH n’a pas produit d’efflux de monoamine (figure 3), ce qui confirme son rôle de bloqueur pur et puissant des monoamines au niveau du NET et du DAT. La forte sélectivité de l’inhibition de la NEH pour le DAT par rapport au SERT indique que la substance produira principalement des effets psychostimulants et sera associée à un risque élevé d’abus, similaire à celui de la pyrovalérone ou du MDPV. Ces résultats sont conformes aux rapports précédents sur l’effet de la NEH sur les transporteurs d’absorption des monoamines. Comme d’autres cathinones, la NEH a été détectée dans des produits cathinoniques synthétiques dès 2017. Des rapports récents sur la toxicité mortelle associée à la NEH et sa classification recommandée par l’Organisation mondiale de la santé en 2020 indiquent que cette substance est susceptible de faire l’objet d’un abus.
3.2 Interactions de liaison et d’activation des récepteurs sérotoninergiques
Dans l’ensemble, les cathinones à base de pyrovalérone ont surtout interagi avec les récepteurs 5-HT1A et 5-HT2A. L’α-PVP, le MDPV, le MDPBP et le 4F-PBP se sont liés au récepteur 5-HT1A dans une plage similaire à celle de l’amphétamine (Ki ≤ 10 μM). En revanche, tous les autres composés, à l’exception de la NEH et du MOPPP, se sont liés au récepteur avec une affinité moindre, similaire à celle de la MDMA (Ki ≥ 10 μM). Il est intéressant de noter que la plupart des composés n’ont pas interagi avec le récepteur 5-HT2A, qui est le site cible responsable des effets psychédéliques associés induits par les substances psychédéliques classiques comme le LSD ou la psilocybine. Seuls l’α-PPP, le 4-MePPP, le MPHP et le MDPPP se lient au récepteur 5-HT2A dans la plage micromolaire inférieure (Ki ≤ 10 μM), comme l’entactogène prototypique MDMA, qui produit également des effets psychédéliques chez les utilisateurs. Auparavant, l’affinité de liaison au récepteur a été un prédicteur utile de la dose clinique nécessaire pour produire des effets psychédéliques par divers stimulants. Cependant, aucune des quatre pyrovalérones n’a activé le récepteur 5-HT2A, il est donc peu probable que ces substances produisent des effets psychédéliques pertinents in vivo, mais cela doit être confirmé par d’autres études. En outre, aucune liaison pertinente n’a été observée pour aucune des cathinones examinées au niveau du récepteur 5-HT2C correspondant, qui est également impliqué, mais dans une bien moindre mesure, dans le profil psychologique global produit par les psychédéliques. L’activation du récepteur 5-HT2B a été évaluée afin d’apprécier le potentiel de fibrose endocardique induit par les drogues et associé à ce récepteur. Aucune des substances n’a activé le récepteur 5-HT2B dans la gamme de concentrations examinée, ce qui indique qu’il est peu probable qu’elles soient associées à ce type de cardiotoxicité.
3.3 Interactions de liaison avec les transporteurs de monoamines et les récepteurs non sérotoninergiques
Les pyrovalérones ont principalement interagi avec le NET et le DAT, se liant aux transporteurs avec une affinité élevée allant de 0,06 à 3,5 μM. Au niveau du SERT, la plupart des pyrovalérones présentaient une affinité de liaison beaucoup plus faible, ce qui, dans l’ensemble, confirmait les profils d’inhibition du captage des monoamines des substances et leur action en tant qu’inhibiteurs et non substrats au niveau des transporteurs. Aucune interaction pertinente n’a été observée au niveau du récepteur dopaminergique D2, du TAAR1 humain ou du TAAR1 de la souris. De même, aucune pyrovalérone ne s’est liée au récepteur adrénergique α1A, à l’exception du 4-MePPP. Le récepteur adrénergique α1A a déjà été associé à des processus physiologiques tels que la vasoconstriction et l’hyperthermie, qui se produisent couramment chez les consommateurs de stimulants. En revanche, le 4-MePPP et d’autres pyrovalérones n’ont pas interagi avec le récepteur adrénergique α2A dans la gamme de concentration examinée, à l’exception du MDPPP et du MDPBP, qui ont lié le récepteur dans la gamme micromolaire inférieure. Auparavant, le récepteur adrénergique α2A a été signalé dans son contrôle de la libération de norépinéphrine et de la toxicité des sympathomimétiques. Seuls l’α-PVP, le MDPPP et le MDPV se lient au TAAR1 du rat, un récepteur important impliqué dans l’auto-inhibition des effets stimulants induits par les amphétamines chez les rongeurs.
4. Matériel et méthode
4.1 Composés
Les drogues étudiées, dont la 3,4-méthylènedioxyméthamphétamine (MDMA), la 3,4-méthylènedioxpyrovalérone (MDPV), la 3,4-méthylendioxy-α-pyrrolidinobutiophénone (MDPBP), la pyrovalérone, α-pyrrolidinopropiophénone (α-PPP) et α-pyrrolidinopentiophénone (α-PVP) ont été achetés à Lipomed (Arlesheim, Suisse), tandis que l’α-pyrrolidinohexanophénone (α-PHP), 4-fluoro-α-pyrrolidinobutiophénone (4-fluoro-α-PBP), N-éthylamine-hexanophénone (NEH), 3,4-méthylènedioxy-α-pyrrolidinopropiophénone (MDPPP), 4-méthoxy-α-pyrrolidinopropiophénone (MOPPP), La 3,4-méthylènedioxy-α-pyrrolidinohexanophénone (MDPHP) et la 4-méthyl-α-pyrrolidinohexanophénone (MPHP) ont été achetées à Adipogen AG (Liestal, Suisse). Enfin, le 4-méthyl-α-pyrrolidinopropiophénone (4-MePPP) a été synthétisé par ReseaChem GmbH (Burgdorf, Suisse). Toutes les substances susmentionnées étaient sous forme de chlorhydrate avec une pureté > 98,5 %.
Les neurotransmetteurs monoaminergiques radiomarqués [3H]-norépinéphrine (NE ; 10,0 Ci/mmol) et [3H]-dopamine (DA ; 45,4 Ci/mmol) ont été achetés chez Perkin-Elmer (Schwerzenbach, Suisse), tandis que la [3H]-sérotonine (5-HT ; 80,0 Ci/mmol) a été obtenue auprès d’Anawa (Zurich, Suisse). Les inhibiteurs sélectifs des transporteurs de la dopamine et de la sérotonine, le mazindol et la fluoxétine, respectivement, ont été achetés à Lipomed (Arlesheim, Suisse), tandis que l’inhibiteur sélectif de la norépinéphrine, la nisoxétine, a été obtenu auprès de Sigma-Aldrich (Buchs, Suisse).
4.2 Inhibition du transporteur d’absorption des monoamines
L’inhibition du transporteur d’absorption des monoamines a été examinée conformément aux méthodes décrites précédemment par [56,57] pour chaque substance d’intérêt.
Les cellules de rein embryonnaire humain 293 (HEK293) (Invitrogen, Zug, Suisse) transfectées de manière stable avec les transporteurs humains de la noradrénaline (hNET), de la dopamine (hDAT) ou de la sérotonine (hSERT) ont été brièvement cultivées dans du milieu d’Eagle modifié de Dulbecco (DMEM ; Gibco, Life Technologies, Zug, Suisse) contenant 10 % de sérum bovin fœtal et 250 μg/mL de généticine (Gibco, Life Technologies, Zug, Suisse). Ensuite, les cellules ont été détachées à un taux de confluence de 70-90 % et remises en suspension dans le tampon de bicarbonate de Krebs-Ringer (Sigma-Aldrich, Buchs, Suisse) à une concentration de 3 × 106 cellules par ml. Le tampon d’absorption a été complété par 0,2 mg/ml d’acide ascorbique (Sigma-Aldrich, Buchs, Suisse) pour les expériences d’absorption de [3H]-DA.
En résumé, à l’aide de plaques à 96 puits à fond rond, 100 μL de suspension cellulaire ont été incubés dans 25 μL de tampon contenant les substances d’essai, le véhicule témoin (0,7 % de diméthylsulfoxyde, DMSO) ou 10 μM de l’inhibiteur respectif du captage des monoamines, principalement la fluoxétine (SERT), la nisoxétine (NET) ou le mazindol (DAT) pendant 10 minutes à température ambiante sur un agitateur rotatif à 450 tr/min (Thermomixer Comfort, Eppendorf, Hambourg, Allemagne). Ensuite, le transporteur d’absorption des monoamines a été initié par l’ajout de 50 μL de chaque neurotransmetteur radiomarqué respectif ([3H]-5-HT, [3H]-DA ou [3H]-NE) dissous dans le tampon d’absorption à une concentration finale de 5 nM pendant 10 min supplémentaires. Ensuite, 100 μL du mélange de suspension cellulaire ont été transférés dans des tubes de microcentrifugation contenant 50 μL d’hydroxyde de potassium 3 M (KOH, Sigma-Aldrich, Buchs, Suisse) et 200 μL d’huile de silicium (mélange 1:1 d’huile de silicium de type AR20 et AR200 ; Sigma-Aldrich, Buchs, Suisse). Immédiatement après, les tubes ont été centrifugés (3 min, 13200 rpm) pour mettre fin à la réaction d’absorption en permettant aux cellules de se déplacer à travers l’huile de silicium dans le KOH, qui a ensuite lysé les cellules. Peu après, les tubes ont été immédiatement congelés avec de l’azote liquide. Ensuite, le culot cellulaire congelé a été découpé dans des flacons à scintillation de 6 mL (Perkin-Elmer, Schwerzenbach, Suisse) remplis de 500 μL de tampon de lyse (EDTA 5 mM, TRIS-HCl 0,05 M, NaCl 50 mM et NP-40 1 % dans l’eau). Directement après, les flacons ont été agités pendant 1 h à 700 rpm, puis chaque flacon a été rempli avec 3 mL de liquide de scintillation (Ultimagold, Perkin-Elmer, Schwerzenbach, Suisse). L’absorption des monoamines a été mesurée à l’aide d’un compteur à scintillation liquide (Packard Tri-Carb Liquid Scintillation Counter 1900 TR). L’absorption spécifique des monoamines a été examinée en soustrayant l’absorption non spécifique en présence d’un inhibiteur sélectif du nombre total mesuré.
Les données ont été analysées à l’aide du logiciel Prism (version 8, GraphPad, San Diego, CA, USA) et ont été ajustées par une régression non linéaire à une courbe dose-réponse sigmoïdale à pente variable. Les valeurs IC50 ont été extraites afin de déterminer le pouvoir d’inhibition de chaque drogue au niveau des différents transporteurs de monoamines. En outre, le rapport DAT/SERT exprimé par 1/DAT IC50 : 1/SERT IC50 a été calculé pour évaluer si une substance présentait des effets sérotoninergiques plus importants (rapport < 1, plus entactogène et similaire à la MDMA) ou des effets dopaminergiques plus importants (rapport > 1, plus psychostimulant et similaire à la cocaïne).
4.3 Efflux de monoamines médié par les transporteurs
L’efflux de monoamines a été évalué à l’aide de cellules de rein embryonnaire humain 293 (HEK293) (Invitrogen, Zug, Suisse) transfectées de manière stable avec les transporteurs humains de noradrénaline (hNET), de dopamine (hDAT) ou de sérotonine (hSERT). En résumé, les cellules ont été ensemencées dans des microplaques de culture cellulaire XF24 enduites de poly-D-lysine (Seahorse Biosciences, North Billerica, MA, USA) et cultivées pendant une nuit à une concentration de 100 000 cellules par puits.
Les cellules ont ensuite été exposées au tampon de libération Krebs-HEPES (85 μL/puits) composé de 130 mM NaCl, 1,3 mM KCl, 2,2 mM CaCl2, 1,2 mM MgSO4, 1,2 mM KH2PO4, 10 mM HEPES et 10 mM D-glucose à un pH de 7. 5, qui contenait également 10 nM de neurotransmetteur radiomarqué ([3H]-5-HT pour SERT, [3H]-DA pour DAT ou [3H]-NE pour NET), 1 μM de neurotransmetteur non marqué (DA ou NE, uniquement), 10 μM de pargyline et 0,2 mg/mL d’acide ascorbique. Cela a permis de charger les cellules avec leurs neurotransmetteurs respectifs via les transporteurs d’absorption. Ensuite, le tampon de libération a été remplacé par un tampon frais pour laver les cellules deux fois et les cellules ont ensuite été incubées pendant 15 min (DAT et SERT) ou 45 min (NET) à 100 μM de drogues à tester dissoutes dans 1 mL de tampon Krebs-HEPES tout en agitant à 300 rpm et 37 °C. La réaction de libération a été interrompue en retirant le tampon des cellules et en les lavant avec un tampon glacé. Ensuite, 50 μL de tampon de lyse ont été ajoutés aux cellules pendant 1 h afin de lyser les cellules. Ensuite, 40 μL du mélange de cellules lysées ont été transférés dans des flacons à scintillation (Perkin-Elmer, Schwerzenbach, Suisse) contenant 3 mL de liquide de scintillation (Ultimagold, Perkin-Elmer, Schwerzenbach, Suisse) et mesurés à l’aide de la scintillation liquide (comme décrit précédemment à la section 2.2).
Pour quantifier le “pseudo-efflux” causé par la libération de monoamines sans transporteur et l’inhibition successive de la recapture, chaque expérience d’efflux de monoamines comprenait un contrôle dans lequel les cellules étaient exposées à chaque bloqueur de transporteur respectif (nisoxétine pour le NET, mazindol pour le DAT et citalopram pour le SERT). La radioactivité à l’intérieur des cellules sans aucune drogue a été fixée à 100 %. La libération non spécifique a été soustraite de la libération totale observée à 100 μM de chaque drogue examinée pour calculer la libération spécifique médiée par le transporteur. Une seule concentration des drogues testées a été utilisée (100 μM) et les durées d’exposition à la libération ont été fixées en fonction de la cinétique des courbes de libération en fonction du temps évaluée précédemment.
Une substance qui produisait un efflux de monoamine significativement plus élevé (valeur p < 0,05) par rapport à l’efflux observé en présence d’un inhibiteur du transporteur de monoamine, a été identifiée comme un libérateur de monoamine. Une ANOVA suivie d’un test de Holm-Sidak a été réalisée pour comparer l’efflux de chaque drogue médié par le transporteur, sur la base d’au moins trois expériences indépendantes, à la condition de contrôle.
4.4 Liaison du radioligand, puissance d’activation et efficacité sur les récepteurs 5-HT
Les essais de liaison du radioligand pour les récepteurs 5-HT1A, 5-HT2A et 5-HT2C humains ont été examinés comme décrit précédemment par. En résumé, les préparations cellulaires du rein embryonnaire humain 293 (HEK293) ont été transfectées de manière stable avec les récepteurs humains 5-HT1A, 5-HT2A ou 5-HT2C, puis incubées avec leurs ligands radiomarqués respectifs à une concentration égale à la constante de dissociation Kd. Les radioligands suivants ont été utilisés pour les récepteurs 5-HT1A, 5-HT2A et 5-HT2C, respectivement : 0,90 nM [3H]8-hydroxy-2-(dipropylamino) tétraline (8-OH-DPAT), 0,40 nM [3H]kétansérine et 1,4 nM [3H]mésulgérine. Le déplacement du radioligand pour chaque drogue examinée a été déterminé. La liaison spécifique du radioligand à la cible a été calculée en soustrayant la liaison non spécifique (en présence du concurrent du récepteur en excès) de la liaison totale observée. Les radioligands concurrents suivants ont été utilisés pour les récepteurs 5-HT1A, 5-HT2A et 5-HT2C, respectivement : 10 μM de pindolol (récepteur 5-HT1A), 10 μM de spipérone (récepteur 5-HT2A) et 10 μM de miansérine (récepteur 5-HT2C).
Le pouvoir d’activation et l’efficacité des récepteurs 5-HT2A et 5-HT2B ont été évalués comme décrit précédemment par. Des fibroblastes embryonnaires de souris (NIH-3T3) ont été transfectés avec les récepteurs 5-HT2A humains, ensemencés dans des plaques à 96 puits recouvertes de poly-D-lysine à une concentration de 70 000 cellules par 0,1 ml, puis incubés pendant 1 heure à 37 °C dans un tampon HEPES-Hank’s Balanced Salt Solution (HBSS) (Gibco). Ensuite, les plaques ont été exposées à 100 μL/puits de solution de colorant pendant 1 h à 37 °C à l’intérieur du FLIPR (fluorescence imagining plate reader [FLIPR] calcium 5 assay kit ; Molecular Devices, Sunnyvale, CA, USA). Ensuite, les plaques ont été exposées aux 25 μL/puits de drogues d’essai dissoutes dans un tampon HEPES-HBSS et 250 mM de probencid pendant le mode en ligne. Les courbes correspondantes de concentration en fonction de la réponse ont été ajustées à l’aide d’une régression non linéaire et les valeurs EC50 ont été calculées. L’efficacité (activité maximale) a été calculée par rapport à l’activité 5-HT, qui a été définie comme étant de 100%.
Des cellules de rein embryonnaire humain 293 (HEK293) ont été transfectées avec les récepteurs 5-HT2B humains, ensemencées dans des plaques à 96 puits enduites de poly-D-lysine à une concentration de 50 000 cellules par 0. 1 mL, puis incubées pendant une nuit à 37 °C dans du milieu Dulbecco’s modified Eagle’s medium (DMEM ; Invitrogen, Zug, Suisse) à haute teneur en glucose contenant 10 % de sérum de veau fœtal (non dialysé, inactivé par la chaleur), 250 mg/L de généticine et 10 mL/L de PenStrep (Gibco). Le milieu a ensuite été retiré par inversion rapide et les cellules ont été incubées avec la solution de 100 μL/puits d’indicateur de calcium Fluo-3 pendant 45 minutes à 31 °C (Molecular Probes, Eugene, OR, USA). Ensuite, la solution a été retirée par inversion rapide et remplacée par une solution fraîche d’indicateur de calcium Fluo-3 pendant 45 min supplémentaires à 31 °C. Les cellules ont ensuite été lavées avec du HBSS et 20 mM HEPES à l’aide du laveur de cellules EMBLA et immédiatement après incubées avec 100 μL de tampon de dosage. La plaque a ensuite été placée dans le FLIPR, mise en ligne et les drogues à tester, diluées dans le tampon de dosage, ont été ajoutées dans les puits correspondants (25 μL/puits). Les courbes de concentration et de réponse correspondantes ont été ajustées à l’aide d’une régression non linéaire et les valeurs EC50 ont été calculées. L’efficacité (activité maximale) a été calculée par rapport à l’activité 5-HT, qui a été définie comme étant de 100 %.
5. Conclusions de l’étude
Dans la présente étude, nous avons examiné les profils pharmacologiques in vitro de plusieurs pyrovalérones cathinones de première et de deuxième génération présentant diverses modifications structurelles. Dans l’ensemble, nous avons observé que tous les composés étaient de puissants inhibiteurs des transporteurs d’absorption de la norépinéphrine et de la dopamine et, dans une bien moindre mesure, du transporteur d’absorption de la sérotonine. Le 4F-PBP et la NEH ont fortement inhibé le DAT par rapport au SERT et n’ont pas induit d’efflux de monoamine. Les deux substances présentaient des profils de ratio DAT/SERT comparables à ceux du MDPV ou de la pyrovalérone, ce qui indique que ces deux substances sont susceptibles de produire de forts effets psychostimulants chez les utilisateurs et qu’elles présentent un potentiel d’abus élevé.
Enfin, la plupart des composés ont interagi avec une affinité modérée ou faible avec le récepteur 5-HT1A, tandis que pour tous les autres récepteurs (récepteurs 5-HT2A, 5-HT2B, 5-HT2C, récepteur dopaminergique D2, récepteurs adrénergiques et TAAR1 humain, de rat ou de souris), aucune activité pertinente n’a été observée pour la plupart des composés.