Connor, J. P., Stjepanović, D., Le Foll, B., Hoch, E., Budney, A. J., & Hall, W. D. (2021). Cannabis use and cannabis use disorder. Nature Reviews Disease Primers, 7(1), 16.
Abstract.
Le trouble de l’usage du cannabis (CUD) est un risque sous-estimé de la consommation de cannabis qui touche environ 10 % des 193 millions de consommateurs de cannabis dans le monde. Les conséquences sur la santé individuelle et publique sont moindres que celles d’autres formes de consommation de drogues, mais le CUD représente une proportion substantielle des personnes demandant un traitement pour des troubles liés à la consommation de drogues, en raison de la forte prévalence mondiale de la consommation de cannabis. La thérapie cognitivo-comportementale, la thérapie d’amélioration de la motivation et la gestion des contingences peuvent réduire considérablement la consommation de cannabis et les problèmes liés au cannabis, mais l’abstinence durable n’est pas un résultat courant. Aucune pharmacothérapie n’a été approuvée pour la consommation de cannabis ou la CUD, bien qu’un certain nombre de classes de médicaments (comme les agonistes cannabinoïdes) se soient révélées prometteuses et nécessitent une évaluation plus rigoureuse. Le traitement de la consommation de cannabis et de la CUD est souvent compliqué par la présence de troubles mentaux et d’autres troubles liés à la consommation de substances. La légalisation de l’usage non médical du cannabis dans certains pays à revenu élevé peut augmenter la prévalence de la CUD en rendant les produits du cannabis plus puissants plus facilement disponibles à un prix plus bas. Les États qui légalisent l’usage médical et non médical du cannabis doivent informer les usagers des risques de CUD et leur fournir des informations sur la manière d’obtenir de l’aide s’ils développent des problèmes de santé mentale et/ou physique liés au cannabis.
Le cannabis est la troisième substance contrôlée la plus utilisée dans le monde après l’alcool et le tabac (respectivement premier et deuxième). En 2018, les Nations unies ont estimé que 192 millions de personnes, soit 3,9 % de la population adulte mondiale, avaient consommé du cannabis au cours de l’année précédente1. Les pays à revenu élevé présentent la prévalence la plus élevée de la consommation de cannabis, avec une consommation plus faible mais en augmentation dans les pays à revenu faible et intermédiaire. Environ 9,9 % des personnes ayant déclaré avoir consommé du cannabis au cours de l’année écoulée étaient des consommateurs quotidiens ou quasi quotidiens. Le trouble de l’usage du cannabis (CUD) est défini de manière générale comme l’incapacité d’arrêter de consommer du cannabis même lorsque celui-ci cause des dommages physiques ou psychologiques. Les données mondiales sur le CUD sont incomplètes, mais selon l’estimation mondiale la plus récente, 22,1 millions de personnes répondaient aux critères de diagnostic du CUD en 2016 (289,7 cas pour 100 000 personnes).
Dans ce guide, nous utilisons le terme ” cannabis ” pour désigner la plante de cannabis ou ses extraits qui contiennent des quantités importantes de Δ9-tétrahydrocannabinol (THC), le composé qui interagit avec le récepteur cannabinoïde CB1 dans le cerveau pour produire les effets euphoriques (le ” high “) recherchés par les personnes qui consomment du cannabis. L’euphorie peut susciter un désir de consommation répétée, qui se transforme chez certains usagers en CUD9. Les personnes qui consomment du cannabis peuvent croire à tort que le cannabis ne produit pas de syndrome de dépendance ou de symptômes de sevrage ; cependant, les effets de la consommation régulière de cannabis sur le système endocannabinoïde et un nombre considérable de recherches comportementales et cliniques indiquent le contraire. En outre, la CUD se produit chez environ 1 utilisateur régulier sur 10 et jusqu’à un tiers de ceux qui consomment quotidiennement. Les personnes atteintes de CUD présentent également des risques plus élevés de mauvaise santé mentale, de psychoses et de bronchite.
Les traitements optimaux de la plupart des troubles liés à l’utilisation de substances (SUD) combinent des interventions psychosociales et pharmacologiques. Il n’existe aucune approche pharmacologique efficace pour la CUD. Les interventions psychosociales, notamment la thérapie cognitivo-comportementale (TCC), la thérapie d’amélioration de la motivation (MET) et la gestion des contingences basée sur l’abstinence combinée à la TCC et à la MET, constituent donc le traitement de première intention pour les adolescents et les adultes. Les approches de prévention telles que les campagnes médiatiques et les programmes scolaires, familiaux et communautaires bénéficient d’un soutien mitigé.
L’usage non médical du cannabis est illégal dans la plupart des régions du monde mais, à ce jour, 12 États américains, l’Uruguay et le Canada ont légalisé l’usage récréatif du cannabis par les adultes. L’usage médical du cannabis a été légalisé dans de nombreuses autres juridictions dans le monde. Il est trop tôt pour évaluer tous les effets de la légalisation de l’offre commerciale, mais l’expérience avec l’alcool suggère fortement que l’accès accru à des produits de cannabis moins chers et plus puissants augmentera la prévalence de la consommation régulière de cannabis, la mauvaise santé et par conséquent la CUD.
Ce guide passe en revue l’épidémiologie de la consommation de cannabis et de la CUD, ainsi que les preuves de l’efficacité des approches de prévention et de traitement. Il aborde également les mécanismes biologiques et sociaux qui sous-tendent le développement de la CUD et examine les impacts potentiels des tendances mondiales à autoriser l’accès légal à la consommation de cannabis. L’abécédaire se termine par les principales questions de recherche en suspens dans le domaine et examine comment les chercheurs peuvent faire progresser ces domaines. Les produits à base de cannabidiol (CBD) qui ne contiennent pas ou très peu de THC ne sont pas examinés. Le CBD a suscité un grand intérêt pour son utilisation thérapeutique potentielle car il ne produit pas d’euphorie24 et son potentiel d’abus ou de dépendance est faible.
Epidémiologie.
Prévalence.
En 2018, les Nations unies ont estimé que 192 millions de personnes avaient consommé du cannabis cette année-là. La prévalence de la consommation de cannabis au cours de l’année écoulée varie considérablement d’un pays et d’une région à l’autre, la consommation estimée étant plus élevée en Amérique du Nord (12,4 %), en Afrique de l’Ouest et centrale (12,4 %) et en Océanie (10,3 %) qu’en Asie (1,8 %), en Afrique du Nord (4,3 %) et en Europe de l’Est et du Sud (2,4 %)2. Au sein de l’Europe, les régions occidentales et centrales présentent des taux de consommation plus élevés que les régions orientales et du sud-est, et la consommation de cannabis est restée stable en Europe occidentale et centrale au cours de la dernière décennie. La prévalence de l’usage de cannabis est faible en Asie par rapport aux autres régions, mais l’usage a augmenté dans les régions à faible et moyen revenu, comme l’Uruguay, depuis 2011. Aux États-Unis, le nombre d’individus ayant consommé du cannabis a diminué entre la fin des années 1970 et le début des années 1990. Cependant, la consommation a augmenté chez les adultes au cours de la dernière décennie, tout comme la proportion de personnes qui consomment du cannabis de façon quotidienne ou quasi quotidienne.
En 1992, le risque de dépendance au cours de la vie chez les personnes ayant déjà essayé le cannabis était estimé à 9 %, ce qui était inférieur aux risques pour le tabac (32 %), l’héroïne (23 %), la cocaïne (17 %) et l’alcool (15 %). Ce risque augmente à 30-40% chez les personnes ayant des antécédents de consommation quotidienne de cannabis. Plus récemment, des données représentatives au niveau national aux Etats-Unis suggèrent que ~30% des personnes qui consomment du cannabis peuvent développer une CUD. Cette constatation peut refléter l’augmentation de la puissance du cannabis, les modifications du statut juridique et l’acceptation sociétale de la consommation de cannabis au fil du temps.
Le peu de temps écoulé depuis la légalisation du cannabis sur le continent américain (BOX 1) rend difficile l’évaluation de tous ses effets sur la prévalence de la dépendance au cannabis. Dans les enquêtes auprès des ménages américains de 1992 à 2015, les adultes qui consommaient du cannabis ont déclaré en consommer plus souvent qu’au cours de la décennie précédente28, mais la prévalence de la CUD chez les adultes est restée relativement stable entre 2002 et 2014. La consommation de cannabis chez les adolescents et les jeunes adultes n’a pas augmenté entre 2010 et 2016. Chez les jeunes d’âge scolaire, les données d’une enquête nationale américaine couvrant la période 2017-2019 suggèrent une augmentation de la consommation quotidienne et du vapotage de cannabis, mais pas une augmentation globale de la prévalence de la consommation de cannabis. La légalisation du cannabis a fortement réduit les prix du cannabis et augmenté la vente de cannabis à forte puissance, comme les edibles, les huiles, les extraits et les cires de cannabis contenant >70 % de THC.
| Box 1 | Évolution du statut juridique du cannabis Jusqu’à la fin des années 1990, la production, la vente et la possession de cannabis étaient illégales dans la plupart des pays. En 1996, l’usage médical du cannabis pour traiter les nausées, la perte de poids, la douleur et les spasmes musculaires, ainsi que les “conditions médicales graves” a été légalisé en Californie ; depuis lors, 34 juridictions aux États-Unis ont légalisé le cannabis médical sous une forme ou une autre. Dans de nombreux États, les conditions requises pour l’utilisation du cannabis médical ont été progressivement élargies depuis 1996, et les adultes souffrant de ces conditions sont autorisés à acheter du cannabis dans des dispensaires de détail. Des assouplissements similaires ont eu lieu au Canada en réponse à des décisions de justice, ouvrant la porte aux praticiens médicaux pour recommander du cannabis et aux patients pour acheter du cannabis auprès de producteurs autorisés. Il faut noter que les preuves des effets thérapeutiques positifs du cannabis manquent pour la plupart des conditions pour lesquelles l’usage médical a été approuvé. Les programmes libéraux de cannabis médical ont facilité la légalisation ultérieure de l’usage non médical du cannabis en brouillant la distinction entre usage médical et non médical. Les ventes de cannabis commercialisées ont eu lieu avec une surveillance médicale minimale, augmentant la perception du public que l’utilisation du cannabis est sûre et augmentant le soutien à la légalisation de l’utilisation récréative. Depuis 2012, 12 États américains ont légalisé l’usage récréatif du cannabis, et la plupart de ces États ont approuvé la production commerciale et la vente de cannabis. La plupart de ces 12 États ont également imposé une taxe de détail sur les ventes de cannabis. Le Canada a légalisé la vente commerciale de cannabis à des fins récréatives dans toutes les provinces en 2018, et le gouvernement fédéral canadien accorde des licences et réglemente les producteurs de cannabis ainsi que la taxation. |
Âge d’apparition
Le début de la consommation de cannabis se produit le plus souvent à la fin de l’adolescence, l’âge médian du début de la consommation dans les Amériques, en Europe, en Asie, en Nouvelle-Zélande, au Moyen-Orient et en Afrique étant de 18-19 ans (moyenne de 15-16 ans). L’initiation à la consommation de cannabis avant l’âge de 16 ans augmente le risque de développer une CUD, le taux d’évolution vers une CUD, d’autres SUD et des troubles anxieux. La consommation de cannabis avant 18 ans est associée à un risque accru d’accidents de voiture, de comportement antisocial, de polytoxicomanie et de décrochage scolaire précoce par rapport aux non-consommateurs de cannabis ou à ceux qui commencent à consommer du cannabis à un âge plus avancé. Des études de jumeaux ont observé que l’âge précoce de début de la consommation est influencé par des facteurs génétiques, même après avoir pris en compte la consommation d’autres substances, les troubles du comportement, la dépression et l’anxiété. Comme pour d’autres types de consommation de drogues illicites, des facteurs génétiques communs ou des facteurs environnementaux partagés, y compris la vulnérabilité sociale et développementale, contribuent à un âge précoce de début de la consommation de cannabis.
Schémas de consommation
Le risque d’évolution de la consommation de cannabis vers la CUD augmente avec la fréquence de la consommation. Aux États-Unis, les adultes atteints de CUD consomment en moyenne du cannabis 6,2 jours sur 10 sur une année. Environ 17,0 % des fumeurs hebdomadaires et 19,0 % des fumeurs quotidiens de cannabis répondent aux critères de dépendance au cannabis. En outre, dans une étude longitudinale, près d’un consommateur hebdomadaire de cannabis non dépendant sur 19 (9,7 %) a évolué vers la dépendance en un an. La consommation conjointe de tabac et de cannabis est associée à un risque plus élevé de CUD, à un plus grand nombre de symptômes de sevrage et à des taux d’arrêt plus faibles que chez les personnes qui consomment du cannabis sans tabac.
Troubles mentaux concomitants
Dans un échantillon national stratifié australien de personnes âgées de 18 ans et plus, 7 personnes sur 10 souffrant de CUD présentaient un autre trouble psychiatrique, contre 4 sur 10 chez les consommateurs de cannabis sans CUD et 1,5 sur 10 chez les personnes ne consommant pas de cannabis47. De même, dans des enquêtes américaines représentatives au niveau national, la présence de CUD au cours des 12 derniers mois était significativement associée à un risque élevé de tout trouble de l’humeur (odds ratio (OR) 3,8), de trouble anxieux (OR 2,8), de trouble de stress post-traumatique (PTSD) (OR 4,3) et de trouble de la personnalité (OR 4,8). Parmi les personnes ayant reçu un diagnostic de CUD au cours des 12 derniers mois, 40,5 % répondaient aux critères d’un trouble anxieux lors d’une enquête australienne représentative des ménages à l’échelle nationale. Des troubles anxieux ont été signalés chez 20,8% des consommateurs de cannabis sans CUD et chez 11,2% des personnes qui ne consommaient pas de cannabis48. Des enquêtes sur la population américaine ont révélé une prévalence de 8,9 % pour le trouble d’anxiété généralisée, 8,4 % pour l’anxiété sociale, 7,7 % pour le trouble panique et 16,4 % pour la phobie spécifique chez les personnes souffrant de CUD.
Une méta-analyse d’études épidémiologiques et cliniques réalisées principalement aux États-Unis et en Europe a révélé que 12 % des personnes ayant été traitées pour un trouble dépressif majeur ou ayant reçu un diagnostic de ce trouble souffraient de DIU. Dans des études cliniques et de population portant sur des personnes atteintes de troubles bipolaires, 24 % consomment du cannabis et 20 % ont une DIU. Environ un patient sur quatre (26,6 %) atteint de schizophrénie a une CUD actuelle ou répond aux critères d’une CUD à vie. La prévalence varie considérablement d’une région à l’autre, la prévalence la plus élevée de la comorbidité de la CUD et de la schizophrénie se situant au Royaume-Uni (36,7 %), suivi de l’Australie (35,2 %), de l’Europe (27,8 %), de l’Amérique du Nord (23,5 %) et de toutes les autres régions (4,5 %). Les données sur la comorbidité de la CUD avec d’autres troubles psychiatriques sont moins cohérentes. Par exemple, parmi les personnes atteintes de PTSD, une enquête nationale américaine a révélé une prévalence de 9,4 % pour la CUD sur 12 mois et une prévalence de 17,6 % pour la CUD à vie ; toutefois, une prévalence plus faible (3 %) a été signalée dans des études danoises de registres psychiatriques basés sur la population.
Cannabis et consommation d’autres substances
Dans un échantillon américain représentatif au niveau national, les personnes ayant eu une CUD au cours de l’année écoulée étaient plus susceptibles d’avoir un trouble de la consommation d’alcool (OR 6,0) et un trouble de la consommation de toute autre drogue (OR 9,0), après ajustement pour le sexe, la race et les variables sociodémographiques et autres. Parmi les personnes ayant eu une CUD au cours de l’année écoulée, 83,5 % des hommes et 82,9 % des femmes avaient un autre SUD, et 59,4 % des hommes et 59,5 % des femmes avaient un trouble lié à l’alcool. Les taux d’autres SUD étaient plus faibles chez les personnes présentant une CUD légère ou modérée selon les critères du Manuel diagnostique et statistique des troubles mentaux (DSM)-5 que chez les personnes présentant une CUD sévère.
Chez les consommateurs de cannabis qui cherchent à se faire soigner, la prévalence des autres problèmes de drogue varie en fonction de la disponibilité de la drogue, des pratiques culturelles, de la politique en matière de drogue, du coût, de la pureté et des profils de risque sanitaire et psychiatrique. En général, trois personnes sur quatre qui entreprennent un traitement de CUD ont également un autre SUD. Certaines personnes consomment d’autres substances pour renforcer les effets du cannabis, réduire les symptômes de sevrage (comme l’anxiété et l’agitation), ou utilisent le cannabis pour inverser ou réduire les états d’hyperactivité induits par les psychostimulants, soulager la douleur (généralement en conjonction avec des médicaments prescrits) et réduire les effets indésirables des médicaments prescrits. Les consommateurs de cannabis qui utilisent plus de types de drogues présentent un plus grand nombre et une plus grande gravité de symptômes psychotiques et une dépression, une anxiété et une manie plus graves que les consommateurs de cannabis qui utilisent moins de types de drogues.
Les raisons des taux élevés de comorbidité entre la consommation de cannabis et la consommation d’autres drogues sont débattues. L’une des possibilités est l’hypothèse de la porte d’entrée (BOX 2) selon laquelle la consommation de cannabis augmente le risque de consommer d’autres drogues illicites et de développer d’autres SUD. Les études épidémiologiques et animales ne permettent pas de savoir si le cannabis a un effet causal sur le risque de consommation d’autres drogues ou si l’association s’explique par une responsabilité partagée de s’engager dans différents types de consommation de drogues, ou par un accès accru à d’autres drogues illicites via les marchés de la drogue ou l’affiliation à d’autres consommateurs de drogues illicites.
| Box 2 | L’hypothèse de la porte d’entrée Aux États-Unis et dans d’autres régions à revenu élevé, les personnes qui consomment régulièrement du cannabis sont beaucoup plus susceptibles de consommer de l’héroïne et de la cocaïne que les personnes qui ne consomment pas de cannabis ; la probabilité que des personnes consomment d’autres drogues illicites est plus élevée chez les personnes dont l’âge de la première consommation de cannabis est plus précoce et chez les consommateurs plus fréquents. La meilleure façon d’expliquer ces schémas de consommation de drogues est débattue. Une explication est que le cannabis est une drogue d’introduction (c’est-à-dire que ses effets pharmacologiques augmentent la propension d’un jeune à consommer d’autres drogues illicites). À l’appui de ce modèle, les animaux adolescents auxquels on a administré de fortes doses de Δ9-tétrahydrocannabinol (THC) sont plus susceptibles de s’auto-administrer de l’héroïne et de la cocaïne que les animaux auxquels on n’a pas administré de THC, mais ces conclusions sont moins claires chez les animaux adultes. Il existe deux explications alternatives populaires au modèle de la porte d’entrée. La première est que les personnes qui consomment du cannabis ont plus d’occasions de consommer d’autres drogues illicites qui sont fournies par le même marché illicite ou par des pairs consommateurs de drogues. La seconde est que les premiers consommateurs de cannabis ont une plus grande propension (génétique, environnementale ou les deux) à adopter toutes les formes de comportement à risque, y compris la consommation d’autres drogues illicites. À l’appui de chacune de ces explications, les jeunes qui consomment du cannabis déclarent avoir plus d’occasions de consommer des drogues illicites à un âge plus précoce et les jeunes qui adoptent de multiples comportements à risque commencent à consommer du cannabis à un âge plus précoce que leurs pairs. En outre, la modélisation statistique indique que des facteurs de risque partagés peuvent expliquer ces relations entre la consommation de cannabis et d’autres drogues illicites. L’hypothèse des facteurs de risque partagés a été testée en évaluant si les associations entre la consommation de cannabis et d’autres drogues illicites persistent après avoir contrôlé ces facteurs. Dans ces études, la prise en compte des facteurs de risque réduit mais n’élimine pas la relation entre la consommation régulière de cannabis et la consommation d’autres drogues illicites. En outre, dans les études de jumeaux comprenant des jumeaux discordants pour la consommation de cannabis, le jumeau qui a consommé du cannabis est marginalement plus susceptible de consommer d’autres drogues illicites que le jumeau qui n’a pas consommé de cannabis. |
On sait peu de choses sur les interactions entre les effets du cannabis et d’autres drogues. Des interactions pharmacodynamiques (entre des médicaments ayant des effets similaires) et pharmacocinétiques (entre des médicaments qui modifient les enzymes métaboliques) néfastes peuvent compliquer la présentation clinique. Les évaluations cliniques doivent donner la priorité à la réduction de l’utilisation simultanée de substances qui augmentent les risques de symptômes de sevrage graves (comme les dépresseurs du système nerveux central ( CNS)) ou de surdose (comme les opioïdes, en particulier lorsqu’ils sont utilisés en même temps que des dépresseurs du CNS).
Mécanismes/pathophysiology
Notre compréhension actuelle des mécanismes neurobiologiques impliqués dans la CUD provient d’études précliniques et cliniques. Bien que l’utilité des modèles animaux de la dépendance ait été remise en question par certains chercheurs, les études précliniques ont révélé comment l’exposition au THC peut affecter le cerveau et le comportement. Bien qu’aucun modèle préclinique unique ne permette de saisir tous les aspects des SUD, divers modèles se sont avérés inestimables pour comprendre les processus de dépendance. Ces modèles suggèrent que, plus la gravité des SUD augmente, plus les systèmes neurobiologiques sont impliqués et dysfonctionnels. Diverses études humaines (génétique, imagerie, études pharmacologiques et essais cliniques randomisés) ont également fourni des preuves du rôle de l’altération de l’activité cérébrale et des réseaux fonctionnels dans l’apparition et le maintien de la CUD. Cette section décrit les principaux systèmes neurobiologiques que les études animales ont mis en cause dans la consommation de cannabis et la CUD.
Systèmes endocannabinoïdes
Les propriétés du cannabis liées à l’abus sont médiées par le THC. La cible principale du THC est le récepteur cannabinoïde CB1, le récepteur couplé à la protéine G le plus abondant dans le cerveau. Le THC agit également sur le récepteur cannabinoïde CB2, qui se trouve principalement dans les cellules immunitaires et est beaucoup moins densément exprimé dans le cerveau que le récepteur CB162 (FIG. 1). Le THC est un agoniste partiel des récepteurs CB1 et CB263. Les cannabinoïdes endogènes (endocannabinoïdes), dont les plus abondants sont l’anandamide et le 2-arachidonoylglycérol (2-AG), sont des neurotransmetteurs qui sont synthétisés par la N-acylphosphatidyléthanolamine phospholipase D et la diacylglycérol lipase, respectivement. Les enzymes qui dégradent les endocannabinoïdes comprennent l’amide hydrolase des acides gras (FAAH) pour l’anandamide et la monoacylglycérolipase pour le 2-AG. Le THC est métabolisé dans le foie par diverses enzymes du cytochrome P450.
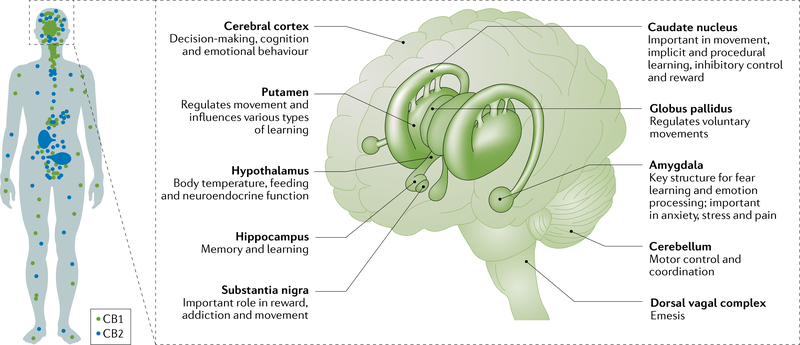
a | La concentration de récepteurs CB1 est plus élevée dans le cerveau que dans le reste de l’organisme, tandis que les récepteurs CB2 sont principalement présents dans les cellules immunitaires et sont moins répandus dans le cerveau. b | Certaines régions du cerveau présentent des concentrations élevées de récepteurs CB1 ; ces régions ont des fonctions diverses.
Le THC et les cannabinoïdes endogènes modulent la fonction cérébrale principalement par le biais du récepteur CB1. Le premier processus intracellulaire est l’inhibition de l’activité de l’adénylyl cyclase par l’activation de la protéine Gi/o. CB1 peut également activer d’autres cibles cellulaires (comme les β-arrestines, les MAPK, divers canaux ioniques et les kinases régulées extracellulaires), ce qui entraîne une réponse complexe qui semble dépendre du type de neurone.
La localisation cellulaire de CB1 contrôle sa fonction. La plupart des fonctions des récepteurs CB1 dans le cerveau sont médiées par des récepteurs situés sur les terminaisons présynaptiques. Cependant, CB1 peut également être exprimé dans les astrocytes, les mitochondries et les compartiments somatodentriques des neurones. Ces récepteurs CB1 pourraient également jouer un rôle dans la médiation de certains effets centraux de CB1 (comme la fonction de mémoire). Les récepteurs CB1 les plus importants dans le cerveau sont les récepteurs CB1 présynaptiques qui assurent la médiation du rôle des cannabinoïdes endogènes en tant que messagers de signalisation rétrograde (FIG. 2). Après l’activation des neurones post-synaptiques, les cannabinoïdes endogènes sont libérés par les neurones post-synaptiques dans la fente synaptique et agissent sur les récepteurs CB1 présynaptiques. Ces récepteurs CB1 réduisent ensuite la libération de neurotransmetteurs par des canaux Ca2+ ou des mécanismes de libération vésiculaire. L’effet de cette signalisation rétrograde dépend du type de neurones concernés. L’expression la plus élevée de CB1 se trouve dans les neurones glutamate et GABAergiques, mais d’autres types de neurones expriment également CB1 (comme les neurones sérotoninergiques et noradrénergiques).
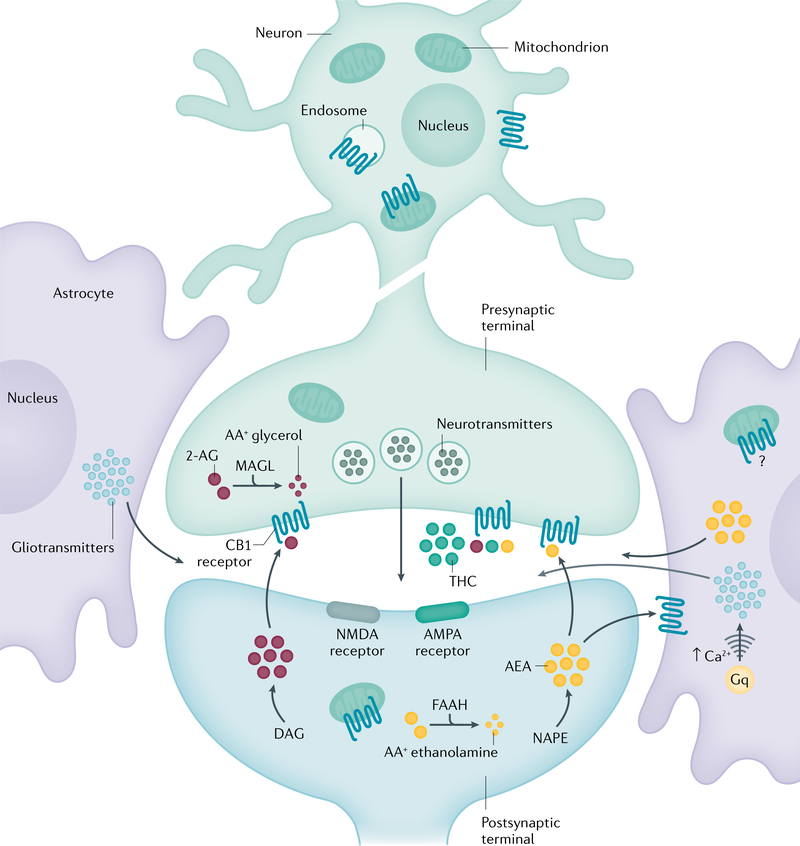
Les neurotransmetteurs endocannabinoïdes anandamide (AEA) et 2-arachidonoylglycérol (2-AG) activent les récepteurs cannabinoïdes CB1 et CB2. Le 2-AG et l’AEA sont synthétisés à partir du diacylglycérol (DAG) et de la N-arachidonoyl phosphatidyléthanolamine (NAPE), respectivement. Les cannabinoïdes exogènes dérivés des plantes, comme le Δ9-tétrahydrocannabinol (THC) et leurs équivalents synthétiques, stimulent le système endocannabinoïde en se liant aux récepteurs CB1 et CB2. Les endocannabinoïdes libérés dans la zone synaptique agissent comme un frein sur la mise à feu des neurones présynaptiques, inhibant ainsi la libération de neurotransmetteurs tels que le glutamate et l’acide γ-aminobutyrique (GABA). La signalisation des cannabinoïdes est interrompue par une famille d’enzymes de dégradation intracellulaire, notamment l’amide hydrolase d’acide gras (FAAH) et la monoacylglycérol lipase (MAGL). AMPA, acide α-amino-3-hydroxy-5-méthyl-4-isoxazolepropionique ; Gq, protéine de liaison au nucléotide de guanine ; NMDA, N-méthyl-D-aspartate.
Dans ce processus de signalisation rétrograde, la stimulation excessive d’un neurone post-synaptique libère des cannabinoïdes endogènes qui agissent sur les récepteurs présynaptiques situés sur les neurones excitateurs glutamatergiques pour réduire l’hyper-excitabilité et éventuellement prévenir les crises. Cependant, in vivo, le circuit est souvent plus complexe, avec des récepteurs CB1 présynaptiques situés sur les terminaux GABAergiques et glutamatergiques. Les cannabinoïdes endogènes modulent l’excitabilité neuronale des circuits cérébraux en régulant la libération de GABA et de glutamate. L’effet global net dépend de multiples facteurs tels que le degré d’expression de CB1 dans les neurones GABAergiques par rapport aux neurones glutamatergiques, l’anatomie du circuit local et l’efficacité de la signalisation dans chaque neurone, qui peut différer selon les zones du cerveau.
Les endocannabinoïdes et le système de récompense
La stimulation des récepteurs CB1 peut activer indirectement le système dopaminergique qui médiatise les effets gratifiants de nombreuses drogues (FIG. 3). Bien que les récepteurs CB1 soient largement exprimés dans tout le cerveau, les neurones dopaminergiques du mésencéphale n’expriment pas de récepteurs CB1. Il est très probable que le THC augmente indirectement l’activité dopaminergique en influençant l’allumage des neurones dopaminergiques dans le mésencéphale. Dans l’aire tegmentale ventrale (VTA), les récepteurs CB1 sont principalement situés sur les neurones GABAergiques (par opposition aux neurones glutamatergiques). Une proposition est que l’activation par le THC des récepteurs CB1 présynaptiques sur les neurones GABAergiques de la VTA inhibe la libération présynaptique de GABA, permettant aux neurones dopaminergiques de la VTA de s’activer. Dans deux petites études humaines d’imagerie TEP, le THC a augmenté de manière significative la libération de dopamine dans le striatum limbique. L’augmentation des niveaux de dopamine était beaucoup plus faible que celle provoquée par les drogues psychostimulantes et ressemblait davantage aux changements produits par l’alcool.
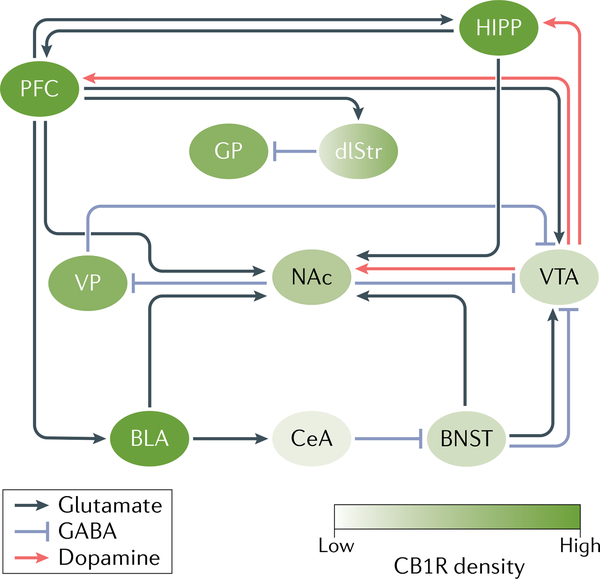
Une exposition aiguë aux cannabinoïdes entraîne une cascade dans le circuit de la récompense qui ressemble à celle d’autres drogues. Le composant le mieux caractérisé du circuit est constitué par les projections dopaminergiques de l’aire tegmentale ventrale (VTA) vers le noyau accumbens (NAc), qui sont cruciales pour la reconnaissance de la récompense dans l’environnement et l’initiation du comportement de consommation. De plus, les neurones dopaminergiques de la VTA innervent l’hippocampe (HIPP) et le cortex préfrontal (PFC), entre autres régions, permettant ainsi la régulation de ces régions. Au-delà de ces projections dopaminergiques, la NAc reçoit des innervations glutamatergiques denses du PFC, de l’amygdale basolatérale (BLA), du HIPP et du noyau de la stria terminalis (BNST). Il existe de riches interconnexions glutamatergiques entre l’amygdale, le PFC et le HIPP, permettant l’exécution de comportements affectifs et cognitifs complexes tels que la formation et la récupération de souvenirs associatifs et contextuels liés à la peur et à la récompense. En outre, des neurones GABAergiques sont présents dans la VTA et se projettent du NAc vers la VTA par une voie directe et une voie indirecte via le pallidum ventral (VP). Ces neurones GABAergiques constituent un puissant régulateur de l’activité dopaminergique de la VTA, agissant ainsi pour réguler la récompense et le comportement aversif. CB1R, récepteur CB1 ; CeA, noyau central de l’amygdale ; dlStr, striatum dorsolatéral ; GP : globus pallidus.
Les antagonistes cannabinoïdes CB1 bloquent les effets du THC dans les procédures de discrimination des drogues chez les rats et les singes. Chez l’homme, un antagoniste CB1 (rimonabant) réduit les effets subjectifs du cannabis, validant ainsi le rôle de CB1 dans la médiation du “high” produit par le cannabis.
Des études animales ont exploré les circuits neurobiologiques qui médient les effets gratifiants du THC. Le conditionnement de lieu est un paradigme qui teste les effets gratifiants des substances en mesurant si un animal passe ou non du temps dans un environnement précédemment associé aux effets de la drogue. La plupart des drogues d’abus produisent une préférence de place conditionnée chez les animaux, mais cela a été difficile à démontrer avec le THC. En effet, la plupart des études sur les rongeurs n’ont pas trouvé de préférence de place significative, bien que certaines aient trouvé une préférence de place avec des doses plus faibles de THC (allant de 0,075 à 4 mg/kg) et aucun effet ou une aversion conditionnée avec des doses élevées de THC. Les doses les plus faibles étaient celles auxquelles le THC augmentait la libération de dopamine ou avait des effets anxiolytiques ; les doses de THC qui produisaient des effets aversifs augmentaient également l’anxiété, les niveaux de corticostérone, les aversions gustatives conditionnées et les troubles de la fonction motrice (catalepsie).
Le paradigme de l’auto-administration (au cours duquel les animaux appuient sur un levier pour obtenir une perfusion intraveineuse de drogue) a été l’étalon-or des études animales démontrant les effets renforçants des drogues. Dans ces paradigmes, les rongeurs s’auto-administrent la plupart des drogues que les humains s’auto-administrent, mais les rats ne s’auto-administrent pas le THC de manière fiable. Cela peut être dû au fait que le THC a des effets agonistes partiels, alors que les rongeurs s’auto-administrent un agoniste CB1 complet. Le singe écureuil est jusqu’à présent la seule espèce animale testée qui s’auto-administre de manière fiable le THC. L’auto-administration du THC est diminuée par le blocage des récepteurs CB1 et des récepteurs μ-opioïdes prolongés chez le singe écureuil et chez l’homme. D’autres récepteurs cibles ont été étudiés dans des modèles animaux, mais ces résultats doivent être validés chez les sujets humains.
Chez l’homme, l’aspect le plus difficile du traitement de la dépendance est le maintien de l’abstinence (c’est-à-dire la prévention de la rechute). La rechute a été modélisée dans des études animales à l’aide du paradigme de l’auto-administration et de la recherche de drogues après l’abstinence. Chez l’homme, la rechute est souvent observée après une exposition aux drogues, à des stimuli liés aux drogues ou à des événements stressants. Ces mêmes stimuli peuvent réactiver la recherche de drogue chez les animaux de laboratoire, de sorte que ces études peuvent aider à comprendre pourquoi les personnes qui consomment du cannabis rechutent. Les récepteurs CB1 sont impliqués dans la rechute chez les singes écureuils et les rats. La rechute est un phénomène complexe qui implique probablement plusieurs zones cérébrales telles que le noyau accumbens, l’amygdale, le cortex préfrontal et l’insula (FIG. 3). Ces divers stimuli (exposition à la drogue, exposition aux indices et stress) modulent l’activité neuronale dans certaines zones corticales qui contrôlent la capacité à résister à la prise de drogue et déclenchent finalement la décision de consommer la substance. Des études humaines en laboratoire ont également testé des médicaments susceptibles de réduire la consommation de cannabis. Par exemple, l’agoniste des récepteurs CB1, la nabilone, réduit la prise de cannabis, ce qui suggère un rôle thérapeutique possible des agonistes dans le traitement de la dépendance au cannabis. La quantité et la fréquence du dosage nécessitent une étude plus approfondie, et ce médicament n’a pas été approuvé pour le traitement de la CUD.
L’administration d’un antagoniste CB1 à des animaux qui ont été exposés de façon répétée au THC produira des symptômes de sevrage comportementaux (tels que le grattage, le frottement du visage, le léchage et les tremblements de chien mouillé). Les humains qui cessent de consommer régulièrement du cannabis peuvent également présenter un syndrome de sevrage (voir Diagnostic, dépistage et prévention, ci-dessous). Dans certaines études d’imagerie TEP, la disponibilité des récepteurs CB1 était négativement associée à la gravité des symptômes de sevrage, ce qui suggère un rôle direct des récepteurs CB1 dans le sevrage du cannabis. L’intensité du sevrage du cannabis a été réduite par des agonistes CB1 tels que le dronabinol ou le nabilone93,95 ou les nabiximols (qui sont une combinaison ~1:1 de THC et de CBD)96. Le blocage de la FAAH pour augmenter les niveaux d’anandamide est un autre moyen potentiel de réduire les symptômes de sevrage.
Altérations cérébrales
L’administration chronique de THC ou d’agonistes des récepteurs CB1 diminue la disponibilité des récepteurs CB1 dans le système limbique et le néocortex dans des études post-mortem animales et humaines (FIG. 2). Les récepteurs CB1 sont régulés à la baisse chez les personnes atteintes de CUD et, dans certaines études, une association inverse a été trouvée entre la densité des récepteurs CB1 dans les zones corticales et la durée du tabagisme au cannabis. D’autres études ont rapporté que la densité des récepteurs CB1 se normalise quelques jours à 4 semaines après le sevrage du cannabis, ce qui suggère que les effets de la consommation chronique de cannabis sur les récepteurs CB1 peuvent être réversibles. Outre la régulation à la baisse de la densité des récepteurs CB1, le cannabinoïde endogène anandamide est régulé à la baisse dans les zones striatales après l’administration répétée de THC chez les rongeurs. Des niveaux plus faibles d’anandamide ont également été trouvés dans le liquide céphalo-rachidien des personnes qui consomment du cannabis, bien que l’activité de la FAAH soit plus faible dans le cerveau des personnes qui consomment du cannabis (FIG. 4). Tous les effets de l’exposition chronique au cannabis sur le système cannabinoïde n’ont pas encore été élucidés.
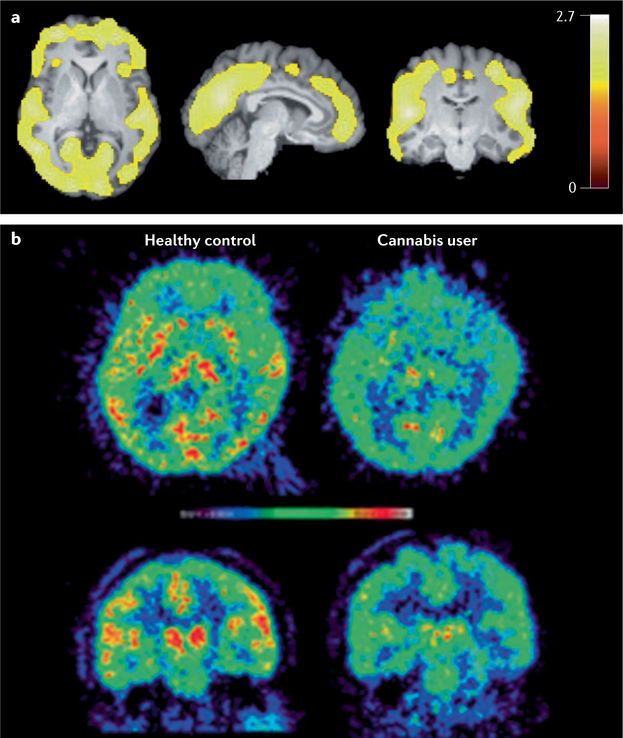
a | Imagerie TEP des récepteurs CB1 utilisant le [18F]FMPEP-d2. L’analyse de cartographie statistique paramétrique (SPM) a montré un volume de distribution VT (une mesure de la densité des récepteurs) plus faible chez les fumeurs quotidiens chroniques de cannabis (n = 30) que chez les sujets témoins (n = 28) au début de l’étude sous la forme d’un grand groupe unique qui comprend des régions corticales. La barre représente les valeurs t dans chaque voxel au sein du groupe significatif. b | Imagerie TEP de l’amide hydrolase d’acide gras (FAAH) utilisant le [11C]CURB dans des vues transaxiales (en haut) et coronales (en bas) d’un individu utilisé comme témoin (à gauche) et d’un sujet souffrant de trouble de la consommation de cannabis (CUD) (à droite) après une nuit d’abstinence. Le sujet atteint de CUD présentait une plus faible absorption du traceur TEP dans le striatum, le thalamus et les régions corticales.
La plupart des études d’imagerie TEP du système dopaminergique dans le cerveau des consommateurs de cannabis n’ont pas identifié l’un des changements les plus constants dans d’autres types de dépendance aux drogues, à savoir une moindre disponibilité des récepteurs D2 et D3 striataux. En outre, l’administration chronique de THC n’affecte pas la disponibilité des récepteurs D2 et D3 chez les primates non humains. Les consommateurs chroniques de cannabis peuvent avoir une plus faible capacité à synthétiser la dopamine, car certaines études ont révélé une plus faible libération de dopamine, notamment dans les zones striatales et le globus pallidus, en réponse à un défi amphétaminique chez les consommateurs chroniques de cannabis. Ce n’est peut-être pas le cas chez les personnes présentant une dépendance légère ou modérée au cannabis. En outre, les consommateurs de cannabis ont une disponibilité des transporteurs de dopamine inférieure à celle des témoins dans le striatum dorsal, le striatum ventral, le mésencéphale, le cingulaire moyen et le thalamus. Il n’est pas clair si ces changements reflètent des facteurs de vulnérabilité ou des neuro-adaptations à l’exposition au cannabis. Très peu d’autres systèmes neurobiologiques ont été étudiés, de sorte que ce domaine nécessite une exploration plus approfondie80.
De multiples études ont examiné les effets de la consommation chronique et aiguë de cannabis sur l’activation et la connectivité fonctionnelles du cerveau. La synthèse de ces résultats est difficile car la plupart des études fonctionnelles ont utilisé différents paradigmes cognitifs et avaient des échantillons de petite taille. Cependant, une méta-analyse des activations fonctionnelles a révélé que les consommateurs de cannabis présentaient une activation cérébrale accrue dans le striatum, ainsi que dans les zones frontales et autres zones limbiques. En revanche, une diminution de l’activation a été observée dans le cortex cingulaire antérieur et le cortex préfrontal dorsolatéral, des zones associées au contrôle cognitif et aux processus liés à l’attention. Il est intéressant de noter que la réponse du striatum ventral peut être associée à une forte consommation de cannabis, tandis que la réactivité du striatum dorsal peut servir de médiateur à la formation d’une habitude et à la CUD.
D’autres études ont exploré les effets du cannabis sur l’anatomie du cerveau. Les effets anatomiques de la consommation régulière de cannabis sont plus subtils et difficiles à détecter que les effets neurochimiques ou fonctionnels. Une méta-analyse a indiqué que les consommateurs chroniques ont des volumes significativement plus petits dans l’hippocampe, le cortex orbitofrontal et le cortex latéral que les non-utilisateurs, mais il y avait un grand chevauchement entre les consommateurs de cannabis et les témoins. Un examen des études réalisées chez les adolescents a révélé certains changements anatomiques dans les zones fronto-pariétales, mais on ne sait pas si ces effets anatomiques sont directement liés à la consommation de cannabis ou à d’autres facteurs comme la dépression. Dans l’ensemble, il semble que les effets anatomiques du cannabis soient plus modestes et bien moindres que ceux créés par l’exposition régulière à l’alcool, qui produit des modifications anatomiques du cerveau plus importantes.
La consommation aiguë et chronique de cannabis a été associée à une réduction des performances cognitives dans un certain nombre de domaines chez les adultes, les jeunes adultes et les adolescents. La fonction psychomotrice est le domaine cognitif le plus touché par l’intoxication aiguë au cannabis. Les autres domaines clés touchés sont la mémoire à court terme, l’attention et l’inhibition. Une méta-analyse a mis en évidence une corrélation faible mais significative entre la consommation chronique de cannabis et les troubles de l’impulsivité cognitive (mais pas motrice), de la flexibilité cognitive, de l’attention, de la mémoire à court terme et de la mémoire à long terme. Certaines données indiquent que les troubles cognitifs liés à l’usage chronique de cannabis peuvent s’améliorer après une abstinence prolongée, en particulier dans les domaines des troubles de l’apprentissage et de la mémoire, mais ces études ont rarement prolongé le suivi au-delà de 4 semaines, de sorte que des études de suivi plus longues et bien contrôlées sont nécessaires.
Étiologie
Génétique. Les études d’héritabilité et de liens familiaux ont indiqué que la consommation de cannabis est héréditaire, mais les différences entre les populations et les classifications diagnostiques ne permettent pas d’estimer de manière cohérente les contributions génétiques d’une étude à l’autre. Les études de jumeaux qui ont estimé les effets des facteurs environnementaux partagés et non partagés sur la consommation de cannabis fournissent des preuves plus cohérentes d’une responsabilité génétique unique. Une méta-analyse de ces études a révélé que les facteurs génétiques contribuent pour 40 % chez les femmes et 48 % chez les hommes à la vulnérabilité au début de la consommation de cannabis et pour 59 % chez les femmes et 51 % chez les hommes à la consommation de cannabis accompagnée de symptômes d’abus et de dépendance43. En outre, les données d’une étude transversale australienne portant sur 3 303 jumeaux suggèrent que l’héritabilité génétique de l’abus et de la dépendance au cannabis est substantielle, mais qu’elle recoupe largement les influences qui affectent l’opportunité et la fréquence de la consommatio.
Les gènes qui semblent être impliqués dans la consommation de cannabis et la CUD ont été mis en cause dans la régulation de la dopamine (comme DRD2, également impliqué dans la susceptibilité à d’autres SUD), ceux codant pour le récepteur cannabinoïde (CNR1), les gènes FAAH ou transporteurs et les gènes de l’horloge. Les études d’association génomique (GWAS) sur la dépendance au cannabis n’ont pas permis de détecter de manière fiable les allèles à risque. Dans une méta-analyse de huit études d’association pangénomique, plusieurs variantes génétiques communes associées à la consommation de cannabis au cours de la vie représentaient 11 % de la variance observée. Les variants présentant les associations les plus fortes étaient ceux associés à la “prise de risque” et à l'”abus de substances”. Les variantes génétiques identifiées dans ces GWAS peuvent avoir un effet fonctionnel limité ou nul sur le comportement. Des recherches récentes suggèrent que l’expression des gènes peut être influencée par l’exposition au cannabis pendant des périodes clés du développement du cerveau, comme les périodes prégestationnelle et prénatale. Ces effets pourraient sous-tendre la transmission intergénérationnelle du risque de consommation de cannabis, de CUD et d’autres troubles psychiatriques.
Processus d’apprentissage psychologique. Les processus d’apprentissage social et cognitif peuvent expliquer l’apparition, le déroulement et le maintien d’un comportement de dépendance. Les études sur les placebos équilibrés peuvent isoler les effets pharmacologiques d’une substance des changements cognitifs attendus (appris). Ces modèles amènent généralement les participants à s’attendre à ce qu’ils consomment de l’alcool ou des drogues lorsque certains participants reçoivent un placebo (substance non active). La théorie de l’apprentissage social, qui met l’accent sur le rôle de la modélisation sociale, stipule que les attentes en matière de résultats (par exemple, la consommation de cannabis présente des avantages) peuvent être apprises en observant le comportement des autres. Au cœur de cette théorie se trouve l’auto-efficacité, c’est-à-dire l’évaluation par une personne de sa capacité à accomplir une tâche (par exemple, la croyance en sa capacité à résister à la consommation de cannabis). Les différences individuelles, comme la constitution biologique, les compétences sociales et la gestion des émotions, interagissent avec les influences environnementales, comme les pairs, les normes culturelles et les représentations positives du cannabis dans les médias, et contribuent au risque de consommation de cannabis et de CUD.
Les expériences positives de récompense ou de renforcement peuvent maintenir la consommation de cannabis après l’expérimentation car, selon l’apprentissage instrumental (également connu sous le nom de conditionnement opérant), le comportement est contrôlé par ses conséquences. Sur la base de ce modèle, si une personne trouve la consommation de cannabis gratifiante, elle est plus susceptible de continuer ou d’augmenter sa consommation que si la consommation de cannabis n’avait pas de conséquences positives. Le renforcement peut être positif (comme la satisfaction physique) ou négatif (comme le soulagement de la gêne). La punition diminue la probabilité du comportement (par exemple, par des conséquences aversives comme la douleur ou la perte de conséquences positives). La fréquence et la régularité des conséquences affectent l’apprentissage ; par exemple, un consommateur de cannabis qui fume 5 joints et tire 10 bouffées par cigarette reçoit 50 renforcements par jour.
Les humains et les animaux apprennent rapidement les indices qui prédisent la disponibilité des drogues. Dans le conditionnement classique, l’association répétée d’un stimulus neutre (comme une cloche) à un stimulus qui évoque un réflexe physiologique (comme la nourriture et la salivation) amène le stimulus neutre à susciter une réponse similaire à celle du stimulus qui évoque un réflexe (par exemple, le fait de sonner une cloche produit une salivation). L’apprentissage associé à la récompense joue un rôle crucial dans le développement de la dépendance. En effet, le développement de la recherche fréquente de drogues fait intervenir de multiples systèmes parallèles d’apprentissage et de mémoire. L’association répétée d’indices environnementaux (tels que l’odeur, l’attirail de cannabis, les lieux de consommation et les amis consommateurs de cannabis) et d’une récompense positive (avantages perçus de la consommation de cannabis) améliore les réponses subjectives et physiologiques. Une fois appris, les indices et les contextes associés à la consommation de cannabis permettent de prédire la récompense, d’initier la recherche de drogue, l’état de manque et la rechute dans les modèles animaux et les études cliniques humaines. Le risque de rechute peut rester élevé même après de longues périodes d’abstinence.
La VTA, le noyau accumbens, le cortex préfrontal, l’hippocampe et l’amygdale basolatérale sont tous des zones cérébrales critiques pour l’apprentissage, l’attention, la mémoire, la prise de décision, les fonctions exécutives, la motivation et le mouvement. Dans toutes ces régions du cerveau, des études précliniques et d’imagerie ont mis en évidence des modifications neuroplastiques et fonctionnelles qui sous-tendent le développement et le maintien des comportements addictifs. L’une des hypothèses est que la base neuronale du conditionnement des associations entre la drogue et les indices sensibilise le système dopaminergique mésolimbique, entraînant une diminution de la valeur des récompenses naturelles et un déplacement de l’attention vers les indices associés à la drogue. Il existe de nombreuses variantes de la théorie dopaminergique du renforcement positif, mais toutes soulignent l’importance des récepteurs de la dopamine dans le noyau accumbens. Un renforcement de la pulsion glutamatergique en réponse à des stimuli associés à la drogue contribue également de manière substantielle au maintien des troubles de la dépendance. Les processus d’apprentissage médiés par le système de récompense du cerveau peuvent être modifiés par des thérapies comportementales (voir Traitements psychosociaux).
Facteurs de risque et de protection. La consommation de cannabis et la CUD présentent des facteurs de risque similaires à ceux d’autres substances et SUD. Par exemple, la famille d’un individu peut être un facteur de protection (par exemple, avec des règles et des rôles clairs, une communication ouverte et un soutien individuel) ou un facteur de risque (par exemple, la séparation des parents, le décès d’un parent, le fait de grandir sans parents, des événements traumatiques et des circonstances de vie familiale conflictuelles). D’autres facteurs qui augmentent le risque de SUD sont la consommation de drogues par les parents, les attitudes permissives à l’égard de la consommation de drogues, les troubles mentaux, les mauvaises relations et une éducation défavorable des enfants. La consommation de substances, les attitudes et les comportements des pairs jouent un rôle important chez les adolescents. Les facteurs de risque psychosociaux comprennent le désavantage social, les difficultés comportementales précoces et les affiliations défavorables avec les pairs, le déménagement, l’abandon des études, la déviance comportementale et les actes de violence. Le nombre et le type d’événements négatifs de la vie sont également des prédicteurs indépendants de l’incidence de la CUD.
Plus un adolescent présente de facteurs de risque, plus il risque de recevoir un diagnostic de CUD au début de l’âge adulte. Le risque individuel de CUD peut en outre être influencé par les normes, valeurs et règles culturelles, le prix, la disponibilité et l’offre de drogues, ainsi que par la politique, la législation, les poursuites, la prévention et l’accès au traitement en matière de drogues. Les traits de personnalité et le tempérament peuvent également jouer un rôle dans la vulnérabilité à la consommation de cannabis et à la CUD, par exemple le comportement antisocial, la recherche de nouveauté et l’impulsivité.
Modèle multifactoriel de la CUD
Des théories globales des SUD ont été proposées, mais il n’existe aucun cadre spécifique pour la CUD. Un modèle multifactoriel de la maladie (FIG. 5) est proposé, qui intègre les preuves des études épidémiologiques, les facteurs neurobiologiques, psychologiques et sociaux, ainsi que la vulnérabilité individuelle et les influences environnementales, et qui décrit les trajectoires et transitions communes de l’usage du cannabis à la CUD au cours de la vie.
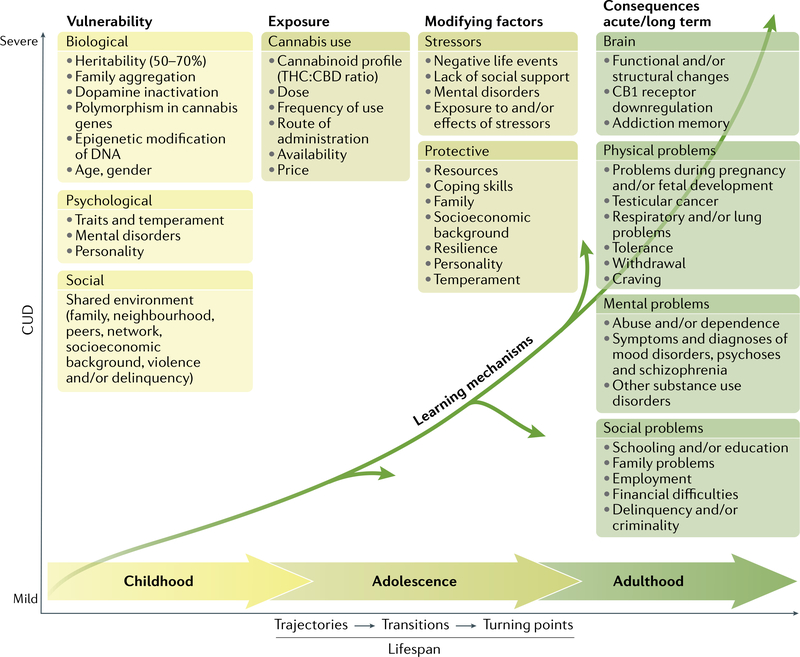
Une série de facteurs biologiques, de facteurs psychologiques et de facteurs sociaux façonnent la vulnérabilité d’un individu. L’exposition répétée à des doses suffisamment élevées de Δ9-tétrahydrocannabinol (THC) pendant une période prolongée (des mois à des années) peut entraîner des conséquences négatives aiguës et à long terme sur le plan mental, physique et social. Des altérations chimiques du fonctionnement du système nerveux peuvent se produire dans le cerveau. Les mécanismes d’apprentissage (tels que la réactivité aux indices et l’apprentissage opérant) expliquent également les changements comportementaux durables. Le modèle de la maladie implique des changements dynamiques tout au long de la vie. Les facteurs de stress et les facteurs de protection peuvent modifier la gravité de la dépendance. De nombreux changements dans la direction d’une voie sont possibles au cours de la vie. La vulnérabilité et les facteurs de risque varient selon les populations. CBD, cannabidiol ; CUD, trouble de l’usage du cannabis.
Diagnostic, dépistage et prévention
Systèmes de diagnostic
L’usage problématique de cannabis est marqué par une consommation persistante malgré des effets négatifs sur le fonctionnement social et la santé physique ou mentale de l’utilisateur ou sur la santé d’autres personnes. Deux systèmes de diagnostic permettent de classer et de définir la gravité de la CUD : le DSM4 et la Classification internationale des maladies (CIM)5. Il est important de comprendre les classifications diagnostiques les plus récentes et les plus anciennes de la CUD car la plupart des essais cliniques et des études épidémiologiques ont utilisé ces classifications (FIG. 6).
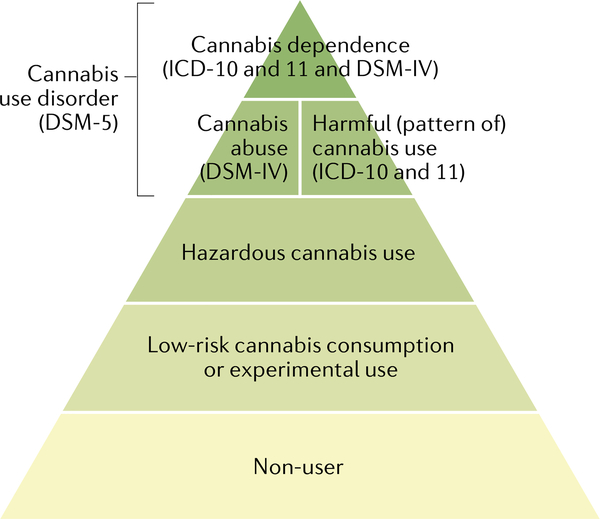
L’usage et le mésusage du cannabis forment un spectre de gravité. La plupart des individus ne consomment pas de cannabis. Ceux qui en consomment ne le font généralement pas souvent. Cependant, chez un pourcentage plus faible de consommateurs de cannabis, l’usage fréquent augmente le risque de préjudice (c’est-à-dire d’usage dangereux de cannabis selon la Classification internationale des maladies (CIM)) ou de préjudice réel (usage nocif de cannabis selon la CIM). Ce sont les seuils à partir desquels les professionnels de la santé doivent intervenir. À l’extrémité la plus grave du spectre se trouve la dépendance au cannabis (CIM-11), qui est définie comme un trouble de la régulation des substances. L’édition la plus récente du Manuel diagnostique et statistique des troubles mentaux (DSM-5) a remplacé les catégories précédentes de “dépendance au cannabis” et d'”abus de cannabis” par une catégorie unique de “trouble de l’usage du cannabis”.
Jusqu’au DSM-5, les systèmes de classification DSM et CIM incluaient tous deux la “dépendance au cannabis”. Cependant, dans l’édition la plus récente du DSM (DSM-5), il n’existe qu’une seule catégorie de CUD, le “trouble de l’usage du cannabis”, basée sur des preuves statistiques que les symptômes de l’abus et de la dépendance au cannabis se situent dans une seule dimension de gravité (TABLEAU 1). Un diagnostic de CUD selon le DSM-5 requiert la présence de 2 des 11 symptômes qui ont produit une déficience ou une détresse clinique marquée au cours des 12 derniers mois, et la gravité du CUD est évaluée par le nombre de symptômes (TABLEAU 1). Il convient de noter que les spécificateurs de rémission peuvent être utilisés pour les patients qui répondaient auparavant aux critères de la CUD. En revanche, la CIM-11 classe l’usage du cannabis en Usage dangereux du cannabis (susceptible de causer des dommages), Usage nocif du cannabis (causant des dommages, similaire à l’abus de cannabis du DSM-IV-TR) et Dépendance au cannabis (similaire à la dépendance au cannabis du DSM-IV-TR). La CIM-11 utilise des directives de diagnostic qui peuvent laisser plus de place au jugement clinique et aux variations culturelles.
Le DSM-5 a inclus des critères diagnostiques pour le sevrage du cannabis au fur et à mesure que les preuves de ce syndrome se sont accumulées. Les symptômes de sevrage du cannabis commencent généralement 24 à 48 heures après l’arrêt, atteignent leur maximum au cours de la première semaine et durent une à deux semaines. Trois ou plus des signes suivants doivent apparaître dans la semaine suivant l’arrêt du cannabis pour un diagnostic de sevrage du cannabis basé sur les critères du DSM-5 : irritabilité, colère ou agressivité ; nervosité ou anxiété ; difficultés de sommeil (comme l’insomnie ou des rêves troublants) ; diminution de l’appétit ou perte de poids ; agitation ; humeur dépressive ; et au moins un symptôme physique causant un malaise grave, comme des douleurs abdominales, des tremblements ou des secousses, des sueurs, de la fièvre, des frissons ou des maux de tête. En outre, ces signes doivent provoquer une détresse ou une altération cliniquement grave dans un contexte social ou professionnel, ou dans d’autres domaines importants du fonctionnement. Dans un échantillon américain représentatif au niveau national, 12 % des personnes qui consommaient fréquemment du cannabis présentaient des symptômes cliniques de sevrage du cannabis selon le DSM-5 au cours des 12 derniers mois. Nombre de ces symptômes peuvent se produire dans d’autres types de sevrage de substances et/ou comme symptômes d’autres troubles mentaux.
Dépistage et évaluation
Il n’existe pas de consensus sur la question de savoir si la consommation de cannabis doit faire l’objet d’un dépistage systématique dans les populations générales. Le US Preventive ServicesTask Force a recommandé le dépistage de l’usage de drogues illicites chez les adultes ≥18 ans, chez les femmes enceintes et post-partum et chez les adolescents âgés de 12 à 17 ans dans les établissements de soins primaires, si des soins de suivi peuvent être proposés179. Les bonnes pratiques cliniques comprendraient, au minimum, une évaluation de la quantité, de la fréquence et du mode d’administration du cannabis, et si possible, une estimation des composés actifs (THC et CBD) dans les produits utilisés. L’utilisation de produits contenant une forte proportion de THC est plus préoccupante que celle de produits contenant une forte proportion de CBD et peu ou pas de THC. Pour évaluer les composés actifs, on peut interroger le patient sur ses préférences en matière de produits à base de cannabis : une préférence pour les produits “forts” (tels que les souches Sativa, ou les parties de la plante, y compris la résine cristalline qui recouvre la plante, ou les parties fleuries de la plante) fournit un indicateur indirect d’une teneur élevée en THC et faible en CBD.
Le dépistage des populations à haut risque (comme les patients ayant des antécédents psychiatriques ou médico-légaux) est considéré comme une bonne pratique clinique. Un examen systématique des mesures de dépistage dans les services d’urgence a révélé qu’une seule question de dépistage (“Au cours de la dernière année, combien de fois avez-vous consommé du cannabis ?”) était aussi efficace que les mesures à plusieurs items. Dans les populations en quête de traitement, la consommation de cannabis doit être abordée dès le début de la consultation. Dans la population générale, la consommation de cannabis peut être incluse dans l’anamnèse de routine sur le mode de vie (y compris, par exemple, la consommation d’autres substances, le régime alimentaire et l’exercice physique).
Si une personne déclare avoir récemment consommé du cannabis, un entretien clinique plus complet doit permettre d’évaluer si la consommation se situe dans le spectre de l’usage dangereux, de l’usage nocif et du CUD (FIG. 6). Cet entretien clinique peut également comprendre des échelles psychométriques du cannabis et de la santé mentale, un examen physique et un dépistage toxicologique urinaire de la consommation récente de substances. L’évaluation clinique doit également déterminer la présence de problèmes de santé mentale et physique comorbides et d’autres SUD.
Un diagnostic de CUD nécessite une altération cliniquement significative pendant une période minimale, généralement 12 mois (DSM-5, CIM-11) ou 1 mois si la consommation a été quotidienne ou quasi quotidienne (CIM-11). Les échelles psychométriques peuvent compléter un entretien structuré et les critères de diagnostic de la CUD. L’utilisation systématique de ces échelles est limitée, en partie, par le temps, l’absence de mesures de dose normalisées, les délais restreints, la validité et la fiabilité incohérentes, le développement médiocre des échelles et le manque d’étalonnage en fonction du sexe, de l’âge et de la culture.
Le suivi chronologique (TLFB) et l’échelle de gravité de la dépendance (SDS) en cinq points peuvent être utilisés pour compléter les critères de diagnostic de la CUD (BOX 3). Le TLFB est une interview guidée par un clinicien qui utilise un calendrier pour aider les patients à identifier avec précision le moment où ils ont consommé du cannabis. Dans le cas du cannabis, le taux de concordance entre le TLFB et les marqueurs biologiques de la consommation de cannabis, comme les tests urinaires, est de ~90 %. Le SDS est une échelle d’auto-évaluation en 5 points qui permet de distinguer les consommateurs réguliers de cannabis qui répondent ou non aux critères de dépendance (selon les critères du DSM-III-R) avec une sensibilité de 64 % et une spécificité de 82 %. Il convient de noter que le SDS et le TLFB peuvent ne pas être fiables si le patient a des raisons de sous-estimer sa consommation, par exemple pour évaluer son aptitude au travail, pour des questions médico-légales, pour l’aide aux handicapés ou pour l’aide sociale. Dans ces cas, on peut accorder plus de poids aux données corroborantes provenant de la famille, du travail, des dossiers médicaux et aux marqueurs biologiques de la consommation de cannabis.
| Encadré 3 | Évaluation du trouble de l’usage du cannabis Intoxication au cannabis Prise d’antécédents cliniques – Consommation récente de cannabis – Changements comportementaux ou psychologiques spécifiques au cannabis (altération de la coordination motrice et du jugement, rapports de ralentissement du temps, euphorie, anxiété et retrait social) – Injection conjonctivale (dilatation des vaisseaux conjonctivaux), augmentation de l’appétit, sécheresse de la bouche ou tachycardie dans les 2 heures suivant la consommation de cannabis – Outils adjuvants (spécifiques au cannabis)a – Aucun Prise de cannabis Prise d’antécédents cliniques – Date et heure de la dernière consommation – Fréquence de la consommation – Quantité consomméeb et si possible rapport entre le Δ9-tétrahydrocannabinol (THC) et le cannabidiol (CBD) – Mode d’utilisation habituel (presque quotidien, quotidien, ponctuel ou peu fréquent) – Mode d’administration : fumer (joint ou cône), inhaler (vaping), ingérer (huile ou edibles) ou dabbing. – Durée de la consommation, y compris les périodes prolongées d’abstinence ou de consommation minimale. Outils auxiliaires (spécifiques au cannabis) – Les plus applicables : Suivi de la chronologie181 – Autre : dépistage urinaire pour la vérification biologique de la consommation de cannabis Méfaits et conséquences du cannabis Antécédents cliniques – Sociale (comme les relations interpersonnelles, les circonstances financières, professionnelles, médico-légales et de logement) – Mental (par exemple anxiété, dépression, idées et tentatives de suicide, pensées homicides ou troubles psychotiques induits par le cannabis), y compris examen de l’état mental (EEM) – Physique (par exemple, cognition, mémoire, blessures auto-infligées ou accidentelles, et systèmes respiratoire et cardiovasculaire) Outils auxiliaires (spécifiques au cannabis) – Les plus applicables : aucun. – Autre : Marijuana Problem Scale (MPS)314, Risk and Consequences Questionnaire-Marijuana (RCQ-M) Trouble de la consommation de cannabis/dépendance Prise d’antécédents cliniques – Critères du DSM-5 pour le trouble de l’usage du cannabis – CIM-11 Usage dangereux de cannabis, usage nocif de cannabis ou dépendance au cannabis Outils auxiliaires (spécifiques au cannabis) – Les plus applicables : Échelle de gravité de la dépendance (SDS)- ≥3/15 seuil de dépendance probable et entretien diagnostique international composite (CIDI). – Autres : Cannabis Abuse Screening Test (CAST) ; Cannabis Use Disorder Identification Test (CUDIT) ; Cannabis Problems Questionnaire (CPQ) ; Marijuana Screening Inventory (MSI-X) ; et Alcohol, Smoking, and Substance Involvement Screening Test (ASSIST). Sevrage du cannabis Prise d’antécédents cliniques – Critères de sevrage du cannabis du DSM-5 Outils auxiliaires (spécifiques au cannabis) – Les plus applicables : Échelle de sevrage du cannabis (CWS) et liste de contrôle du sevrage de la marijuana (MWC ; disponible en ligne). – D’après une étude, ces outils sont principalement utilisés à des fins de recherche ou pour des populations nécessitant un bilan complet, une planification du traitement et une évaluation. bIl n’existe pas d’approche standard pour mesurer la quantité de cannabis. La teneur en THC varie considérablement, tout comme le volume, en fonction du type de cannabis utilisé (par exemple feuille de cannabis, “bourgeons”/fleurs, résine, huile) et de la méthode d’administration. Certains chercheurs ont utilisé un joint (5 mg de THC), cinq coups de bong ou de pipe, ou dix bouffées pour faciliter la normalisation. Dans certaines régions, il est courant de mélanger le cannabis avec du tabac. |
Diagnostic différentiel
Les troubles psychiatriques et physiques qui coexistent avec la CUD peuvent se présenter de la même manière que l’intoxication, la dépendance ou le sevrage au cannabis. L’intoxication au cannabis peut altérer la coordination, la mémoire et le temps de réaction, et produire de la confusion, des nausées, des vomissements, une perception déformée, des hallucinations, de l’agitation et de l’anxiété. Ces symptômes peuvent également se manifester, par exemple, dans le delirium tremens lié au sevrage de l’alcool, qui constitue une urgence médicale. Chez les personnes présentant ces symptômes, la priorité est de déterminer quelle(s) substance(s) a (ont) été consommée(s), quand, par quelle voie d’administration et en quelle quantité. Pour les patients fortement intoxiqués ou inconscients, ou soupçonnés de consommer d’autres drogues illicites, il faut obtenir la confirmation des amis et de la famille ou des marqueurs biologiques de la consommation de substances.
Les symptômes courants de la CUD comprennent des changements d’humeur épisodiques ou chroniques (que l’on retrouve également dans les troubles dépressifs), l’anxiété (que l’on retrouve également dans les troubles anxieux) et des troubles de la pensée (que l’on retrouve également dans le spectre de la schizophrénie et d’autres troubles psychotiques ou dans d’autres intoxications induites par des substances). Un diagnostic différentiel nécessite des informations sur la séquence temporelle de la consommation régulière de cannabis4, et l’exclusion des troubles mentaux induits par le cannabis (psychose, trouble bipolaire, dépression, anxiété, trouble obsessionnel-compulsif, troubles du sommeil, dysfonctionnement sexuel, délire ou troubles neurocognitifs). Il existe une relation dose-réponse entre la consommation de cannabis et le risque de psychose, et il est prouvé que la consommation de cannabis exacerbe les symptômes de la schizophrénie. L’effet causal du cannabis sur la psychose est contesté car il pourrait être la conséquence d’un risque environnemental et génétique partagé pour le développement de la CUD et de la schizophrénie186. La psychose induite par le cannabis est l’un des diagnostics différentiels les plus difficiles à établir car les patients souffrant de troubles psychotiques primaires consomment souvent du cannabis. La séquence temporelle de la consommation de cannabis suivie de nouveaux symptômes psychotiques est la caractéristique centrale. Il convient de noter que les patients souffrant d’un trouble psychotique induit par une substance ont généralement une meilleure compréhension de leur maladie, ont moins souvent des antécédents familiaux de trouble psychotique, moins de symptômes positifs et négatifs et une dépression et une anxiété plus sévères que les consommateurs de cannabis souffrant d’un trouble psychotique primaire.
Les vomissements récurrents sont un symptôme du syndrome d’hyperémèse cannabique (SHC), qui a été signalé chez des patients des services d’urgence présentant des vomissements cycliques et des antécédents actuels ou récents de consommation de cannabis. Le diagnostic différentiel du SHC et d’autres troubles de vomissements cycliques est sous-développé en raison de symptômes mal spécifiés et qui se chevauchent, mais presque tous les patients atteints du SHC sont de gros consommateurs hebdomadaires de cannabis et 90 % d’entre eux déclarent que les bains chauds et l’abstinence de cannabis soulagent leurs symptômes. La consommation de cannabis peut affecter les systèmes cardiovasculaire, gastro-intestinal, immunitaire, neuro-musculaire, oculaire, reproductif et cognitif, mais le principal effet néfaste du cannabis sur la santé physique concerne le système respiratoire.
Prévention
Les approches de prévention les plus efficaces pour l’alcool et le tabac consistent à réduire l’offre (par exemple, par la tarification, la taxation et l’introduction de restrictions légales sur l’âge minimum d’achat) et à restreindre la publicité. Les mêmes stratégies sont susceptibles d’être efficaces dans les juridictions qui ont légalisé la vente au détail du cannabis médicinal et récréatif (BOX 1). Dans les régions où le cannabis est illégal, les approches de prévention comprennent des campagnes médiatiques et des programmes primaires (universellement appliqués) et secondaires (appliqués de manière sélective aux populations à haut risque, y compris les consommateurs de cannabis) individuels, scolaires, familiaux et communautaires. Les approches médiatiques de la prévention prennent généralement la forme de courtes campagnes de “publicité” présentant des modèles positifs qui rejettent la consommation de substances. Les preuves sont contradictoires quant à la fiabilité de ces campagnes pour réduire la consommation de drogues.
Peu de programmes de prévention de la toxicomanie portent uniquement sur le cannabis. La plupart visent à réduire la consommation de toutes les substances et sont mis en œuvre dans les écoles, qui offrent un accès facile aux jeunes. Une méta-analyse des programmes de prévention primaire incluant un contenu spécifique au cannabis a révélé que la moitié des programmes rapportaient des effets significatifs mais modestes sur la consommation de cannabis (médiane du d de Cohen = 0,12). L’ampleur de l’effet médian comparatif sur la consommation de cannabis dans les programmes généraux de prévention de la toxicomanie était de 0,30. Les programmes de prévention de la toxicomanie semblent avoir réduit la consommation de cannabis dans la plupart mais pas dans toutes des études, mais ces études ont généralement une méthodologie faible, une faible fidélité de la mise en œuvre du programme, une faible validité des mesures des résultats et des procédures statistiques. Les interventions communautaires qui visent à mobiliser les “champions”, les dirigeants et les organisations de la communauté ont un effet limité ou nul sur la consommation de cannabis à 12 mois, bien que très peu d’études contrôlées aient été réalisées.
Consommation de cannabis à faible risque. Des lignes directrices sur l’usage à moindre risque du cannabis ont été approuvées par les organisations de santé canadiennes en 2017 comme source d’information pour le public et les prestataires de soins de santé après la légalisation du cannabis. Ces lignes directrices comprennent dix recommandations (BOX 4) qui sont similaires aux lignes directrices à faible risque élaborées pour l’alcool, la nutrition ou le comportement sexuel. Les lignes directrices partent du principe que les personnes qui continuent de consommer du cannabis, malgré les conseils d’abstinence, peuvent être prêtes à modifier leur consommation pour minimiser les méfaits, y compris la CUD.
| Encadré 4 | Lignes directrices pour l’usage du cannabis à risque réduit Abstinence – Le moyen le plus efficace d’éviter les risques liés à la consommation de cannabis est l’abstinence. Âge de la première consommation – Retarder la consommation de cannabis, au moins jusqu’après l’adolescence, réduira la probabilité ou la gravité des effets néfastes sur la santé. Choix des produits à base de cannabis – Utilisez des produits à faible teneur en Δ9-tétrahydrocannabinol (THC) et à fort rapport cannabidiol (CBD) / THC. – Les produits à base de cannabis synthétique, comme le K2 et le Spice, sont à éviter. Méthodes et pratiques de consommation du cannabis – Évitez de fumer du cannabis brûlé et choisissez des méthodes d’inhalation plus sûres, notamment les vaporisateurs, les e-cigarettes et les edibles. – Si le cannabis est fumé, il faut éviter les pratiques nocives telles que l’inhalation profonde ou la rétention de la respiration. Fréquence et intensité de la consommation – Évitez l’usage fréquent ou intensif, et limitez la consommation à un usage occasionnel, par exemple un jour par semaine ou le week-end, voire moins. Consommation de cannabis et conduite – Ne conduisez pas ou n’utilisez pas d’autres machines pendant au moins 6 heures après avoir consommé du cannabis. La combinaison de l’alcool et du cannabis augmente l’affaiblissement des facultés et doit être évitée. Populations à risque particulier – Les personnes ayant des antécédents personnels ou familiaux de psychose ou de troubles liés à la consommation de substances, ainsi que les femmes enceintes, ne doivent absolument pas consommer de cannabis. Combinaison de risques ou de comportements à risque – Évitez de combiner tous les facteurs de risque liés à la consommation de cannabis. Les comportements à haut risque multiples amplifient la probabilité ou la gravité des effets indésirables. |
Prise en charge
Sevrage de cannabis
Un syndrome de sevrage du cannabis augmente la difficulté d’arrêter de fumer et peut précipiter une rechute. Des données provenant principalement d’Amérique du Nord estiment que la prévalence du syndrome de sevrage du cannabis dans la population générale des consommateurs de cannabis est de 12 à 17 %. En revanche, chez les patients souffrant de CUD qui cherchent à se faire soigner, 54 % des patients ambulatoires et 87 % des patients hospitalisés signalent un sevrage cliniquement grave. La majorité des patients cherchant un traitement pour la CUD, y compris les adolescents, rapportent des antécédents de symptômes de sevrage du cannabis.
En l’absence de comorbidités médicales ou psychiatriques, le sevrage du cannabis ne présente pas de risques sérieux pour les individus, et la plupart des personnes atteintes de CUD ne nécessitent que des soins de soutien. Les approches comportementales de la gestion du sevrage comprennent la psychoéducation et la formation aux techniques d’adaptation, qui normalisent l’expérience en informant le patient des signes, des symptômes et de l’évolution dans le temps, et suggèrent des moyens de gérer des symptômes spécifiques (comme faire de l’exercice ou prendre un bain chaud pour gérer l’irritabilité, éviter l’excès de caféine pour lutter contre l’agitation, consommer des aliments nutritifs pour contrer la diminution de l’appétit, et rappeler aux patients que les symptômes sont temporaires).
Les essais de pharmacothérapie pour la CUD ont étudié des médicaments de type agoniste qui ciblent les récepteurs CB1 (thérapies de substitution) tels que le dronabinol ou les nabiximols. Ils semblent réduire la sévérité des symptômes de sevrage du cannabis. Bien qu’aucune directive n’ait été élaborée pour préciser quels patients sont de bons candidats pour ces médicaments agonistes CB1, ceux qui pourraient en bénéficier sont les patients qui ont déjà signalé des symptômes de sevrage sévères ou qui ont échoué dans leurs tentatives d’arrêt du tabac en raison de symptômes de sevrage. En outre, le zolpidem et d’autres benzodiazépines (nitrazépam) ont été utilisés pour traiter les troubles du sommeil liés au sevrage. Il est à noter que certains médicaments pour l’humeur, le sommeil ou l’envie de fumer qui réduisent les symptômes de sevrage n’ont pas produit de réduction proportionnelle de la quantité de cannabis consommée ou augmenté la durée de l’abstinence de cannabis, mais seules quelques études ont été menées.
Traitements psychosociaux
Les approches psychosociales pour les adultes atteints de CUD comprennent la TCC, la MET, y compris la MET brève (bMET), la gestion des contingences, le conseil en soutien social, le conseil en éducation sur les drogues, la prévention des rechutes, la méditation de pleine conscience et les groupes d’entraide, basés sur les approches en 12 étapes (comme Marijuana Anonyme) (TABLEAU 2).
Une méta-analyse groupée de la TCC, de la MET, de la prévention des rechutes et de la gestion des contingences a révélé une taille d’effet globale modérée (g de Hedges = 0,44) après 2 à 14 semaines de suivi par rapport aux contrôles (qui comprenaient la liste d’attente, le placebo psychologique et le traitement habituel). Il est à noter que ces tailles d’effet ne différaient pas entre les personnes souffrant d’abus de cannabis et celles souffrant de dépendance au cannabis. Une méta-analyse antérieure des interventions psychosociales sur le cannabis a trouvé un effet plus important (d de Cohen = 0,81). L’efficacité des interventions psychosociales de la CUD est similaire à celle des interventions psychosociales dans les troubles de la consommation d’alcool (Hedges’ g = 0,15 à Cohen’s d = 0,77) et la dépression majeure (Hedges’ g = 0,38-1,10).
La TCC et la MET ont une efficacité similaire dans la réduction de la consommation de cannabis et de la DIU. Certaines études ont révélé que la combinaison de la TCC et de la MET est plus efficace que l’un ou l’autre des traitements seuls. L’augmentation de la TCC ou de la MET, ou la combinaison de la TCC et de la MET avec une gestion des contingences axée sur l’abstinence réduit davantage la fréquence de la consommation et la gravité du problème lié au cannabis que les deux interventions seules. La plupart des études qui ont appliqué une gestion des contingences en complément ont également signalé une amélioration des taux d’abstinence, mais d’autres études sont nécessaires. Malgré ses avantages potentiels pour le traitement de la CUD, la gestion des contingences a été largement utilisée dans les études de recherche en raison des préoccupations perçues quant au coût, au fardeau du fournisseur et au manque de familiarité avec l’approche. Trop peu d’études sur le traitement de la CUD par le counseling de soutien social, le counseling d’éducation sur les drogues, la prévention des rechutes, la méditation de pleine conscience et les groupes d’entraide ont été réalisées pour évaluer de façon fiable leur efficacité (TABLEAU 2).
À court terme (médiane de 4 mois), la combinaison de MET et de TCC produit une réduction de 25 % de la fréquence de la consommation de cannabis et double les taux d’abstinence par rapport au traitement non actif. Ni la MET ni la TCC n’étaient supérieures l’une à l’autre lors du suivi de 6 mois. Peu d’interventions psychosociales maintiennent les gains du traitement après un suivi de 9 mois. Certaines preuves indiquent que plus de quatre séances de TCC, de TME ou de TCC et de TME sur une période de plus d’un mois sont plus efficaces que moins de séances sur une période plus courte. Une étude a révélé que les interventions très brèves (deux séances ou moins ou ≤60 minutes de temps d’intervention) appliquant les principes de la MET ne réduisaient pas de manière significative la fréquence de la consommation de cannabis ou la gravité de la dépendance. Comme la TCC implique généralement plus de séances sur une période plus longue, cela peut expliquer pourquoi la TCC montre une amélioration par rapport à la MET dans certaines études, mais il n’est pas clair si cela reflète un traitement plus important ou une efficacité différentielle. Chez les adultes, il n’existe pas suffisamment de données pour recommander un traitement psychosocial en groupe plutôt qu’individuel, ou des interventions délivrées par téléphone ou par Internet. Le traitement le plus efficace pour les adultes atteints de CUD semble être une combinaison de TCC en face à face et de MET (avec plus de quatre séances sur plus d’un mois), de préférence avec une gestion des contingences.
Les approches psychosociales pour les adolescents (10-18 ans) atteints de CUD comprennent des interventions individuelles, en groupe et en famille. La thérapie familiale multidimensionnelle, la thérapie familiale fonctionnelle, la MET et la TCC, et la gestion des imprévus intégrée à la MET et à la TCC sont bien étayées. La combinaison d’approches fondées sur des données probantes semble améliorer les résultats. Des interventions brèves et des interventions numériques innovantes en matière de santé sont actuellement testées afin d’étendre la portée et d’améliorer l’efficacité des interventions destinées aux adolescents souffrant de CUD.
Pharmacothérapie
Aucun traitement pharmacologique n’a été approuvé pour la CUD. Diverses classes de médicaments ont été testées pour traiter le sevrage et/ou la consommation de cannabis et favoriser l’abstinence. Parmi ces médicaments évalués, Cochrane et d’autres revues ont trouvé un soutien limité pour les inhibiteurs sélectifs de la recapture de la sérotonine, l’antidépresseur bupropion, l’anxiolytique buspirone et l’inhibiteur sélectif de la recapture de la noradrénaline atomoxetine. Les traitements de substitution (agonistes) et antagonistes du THC ont donné quelques résultats positifs à court terme dans la réduction de la consommation de cannabis, tout comme un certain nombre d’agents utilisés pour la gestion de la dépendance et de la non-dépendance, mais le nombre d’études est faible et leur qualité est médiocre.
Qualité de vie
Les évaluations de la qualité de vie (QV) permettent de surveiller le fonctionnement et le bien-être subjectifs et objectifs dans le traitement de la CUD. La qualité de vie et la qualité de vie liée à la santé (QVLS) fournissent de vastes évaluations multidimensionnelles du bien-être qui peuvent compléter des évaluations plus spécifiques du fonctionnement (BOX 3). La QV chez les personnes atteintes de CUD n’a pas fait l’objet d’un examen aussi approfondi que la QV chez les personnes atteintes d’autres troubles de santé mentale. Pour évaluer la QV, les études appliquent généralement des échelles d’auto-évaluation de la QV ou de la QVHR ou, par procuration, évaluent les comportements qui sont associés à la QV ou à la QVHR pour mesurer le bien-être des personnes qui consomment du cannabis. Les domaines les plus étudiés comprennent la relation entre la QDV et la consommation récréative de cannabis, les effets résiduels du cannabis, les troubles psychiatriques liés au cannabis et la détresse.
Il existe une relation dose-réponse entre une plus grande consommation de cannabis et une moins bonne QDV. Les personnes qui répondent aux critères de la CUD ou qui ont des problèmes liés au cannabis évalués selon des critères psychométriques ont une moins bonne QV que les personnes sans CUD. Il n’est pas certain que la QDV s’améliore après le traitement ou l’arrêt de la CUD. Certaines études n’ont constaté aucune amélioration de la QV associée à une rémission ou à une réduction de la consommation de cannabis chez les personnes atteintes de CUD, tandis que d’autres études ont signalé des améliorations significatives de la QV après l’abstinence et la réduction de la consommation de cannabis. Les utilisateurs abstinents ont signalé une amélioration du sommeil, de l’anxiété et de la fonction cognitive autodéclarée par rapport aux gros consommateurs de cannabis.
Une comparaison de jumeaux monozygotes dont l’un n’avait pas d’antécédents de consommation de cannabis et l’autre était un ancien gros consommateur de cannabis n’a révélé aucune différence entre les deux en termes de niveau d’éducation, d’emploi, de santé physique ou mentale ou de QVLS, ce qui suggère que les effets cognitifs négatifs du cannabis peuvent être inversés par une abstinence durable.
Les autres effets néfastes aigus de la consommation de cannabis sont l’anxiété, la dépression et les symptômes psychotiques, cardiovasculaires et gastro-intestinaux. La conduite sous l’influence du cannabis est un problème de santé publique. Il existe une relation dose-réponse entre l’intoxication au cannabis et les troubles cognitifs et psychomoteurs, et les données épidémiologiques indiquent que la consommation de cannabis contribue faiblement aux accidents de la route. La bronchite chronique est associée de manière fiable à la consommation régulière de cannabis après contrôle du tabagisme. Des séries de cas suggèrent que le fait de fumer beaucoup de cannabis peut entraîner un syndrome d’hyperémèse et augmenter le risque d’infarctus du myocarde et d’accident vasculaire cérébral chez les personnes prédisposées. Certaines preuves épidémiologiques soutiennent que la croissance et le développement du fœtus peuvent être affectés négativement si le cannabis est consommé pendant la grossesse.
Perspectives
Effets futurs du cannabis légal
Il faudra peut-être attendre plus d’une décennie avant que les marchés commerciaux légaux du cannabis récréatif aux États-Unis et au Canada n’arrivent à maturité, et leurs effets sur la CUD ne seront peut-être pas pleinement évalués avant les années 2030. Si la réglementation de l’alcool sert de guide, la commercialisation des ventes de cannabis est susceptible d’augmenter la fréquence d’utilisation parmi les utilisateurs actuels en raison d’une plus grande accessibilité et acceptabilité du cannabis et des prix plus bas pour les produits plus puissants. Certains éléments indiquent que c’est peut-être le cas. Une préoccupation sérieuse est que les nouveaux produits de cannabis plus puissants seront commercialisés auprès des jeunes d’une manière qui augmente le risque de CUD et de problèmes sociaux et de santé liés au cannabis. Par exemple, la vente légale de boissons alcoolisées infusées au THC et de produits comestibles à base de cannabis (par exemple les ” gummies “, les sodas, les barres chocolatées et les biscuits) peut attirer les jeunes non-fumeurs qui veulent essayer le cannabis.
L’industrie légale du cannabis est en train de devenir une entreprise de plusieurs milliards de dollars en Amérique du Nord, dans laquelle les industries de l’alcool et du tabac ont commencé à investir. Comme l’industrie de l’alcool, l’industrie du cannabis cherchera à maximiser ses profits en augmentant le nombre de gros consommateurs réguliers qui constituent ses meilleurs clients. L’industrie du cannabis légal fait aujourd’hui pression sur les gouvernements pour qu’ils réduisent les taxes sur le cannabis, s’oppose aux plafonds sur la puissance du cannabis, fait campagne pour les salons de vapotage et les services de livraison à domicile, et fait des déclarations non fondées sur les avantages médicaux de la consommation de cannabis. Les pays qui envisagent de légaliser le cannabis devraient l’aborder principalement sous l’angle de la santé publique, en utilisant des approches dont l’efficacité a été démontrée pour réduire les dommages liés au tabac et à l’alcool. Un référendum en Nouvelle-Zélande et un vote au parlement fédéral allemand ont récemment rejeté des projets de loi visant à légaliser l’usage récréatif du cannabis.
Risques potentiels des produits à forte puissance
Les effets sur la santé de l’utilisation de produits de cannabis plus puissants dans les États et les provinces disposant de dispensaires de cannabis médical et récréatif nécessitent une surveillance attentive au cours de la prochaine décennie. Dans les enquêtes, les personnes qui déclarent utiliser des extraits de cannabis plus puissants signalent davantage de symptômes de dépendance et de détresse mentale que les utilisateurs de cannabis à base de plantes. Aux Pays-Bas, le nombre de personnes cherchant de l’aide pour arrêter de consommer du cannabis a augmenté lorsque la puissance du cannabis a augmenté et a ensuite diminué lorsqu’elle a baissé. Une préoccupation majeure est que l’utilisation de cannabis à forte puissance peut augmenter le risque de troubles psychotiques. Certaines approches telles que des restrictions sur les produits à forte puissance, des taxes basées sur la teneur en THC du produit, un étiquetage clair sur le dosage et les risques, et un suivi solide des ventes et des impacts pourraient réduire les effets négatifs de la commercialisation de ces produits.
Mesures de la consommation de cannabis
L’une des principales limites de la recherche épidémiologique sur la consommation de cannabis est l’absence de mesures adéquates de la quantité de THC consommée. Contrairement à l’alcool, où l’on peut distinguer la consommation à haut risque de la consommation à faible risque, seule la fréquence de consommation du cannabis est généralement évaluée. Il est donc difficile d’étudier les risques et les avantages de la consommation de cannabis et d’évaluer les effets des changements de politique et les résultats des traitements dans les essais cliniques de la CUD. Il existe des recommandations pour quantifier une unité de THC standard comme 5 mg. Un défi majeur dans le développement de meilleures mesures de la consommation de THC est la variété croissante des produits du cannabis, les changements dans les méthodes d’utilisation et le manque de technologies permettant de quantifier de manière fiable et rentable la consommation dans les recherches cliniques et non-laboratoires.
Les épidémiologistes et les économistes bénéficieraient de meilleures mesures pour étudier l’effet des lois sur le cannabis sur les attitudes, les marchés, la consommation et les méfaits. Les chercheurs cliniques ont besoin de meilleures mesures de la consommation de cannabis pour orienter les traitements, évaluer les résultats et conseiller les patients sur des modes de consommation plus sûrs. En outre, les éducateurs sanitaires et les décideurs politiques ont besoin de meilleures informations pour planifier les programmes d’intervention et de prévention, concevoir la réglementation du cannabis et fournir au public des informations précises sur les risques liés au cannabis.
Pharmacothérapie
La recherche sur les pharmacothérapies pour la CUD est moins développée que pour d’autres drogues d’abus. Les principales classes de médicaments qui ont été étudiées sont résumées dans le TABLEAU 3. Les plus prometteurs sont les agonistes cannabinoïdes qui peuvent être utilisés de la même manière que le patch de nicotine pour le tabagisme (sevrage), ou comme des agonistes opioïdes à action prolongée tels que la méthadone et la buprénorphine dans la dépendance à l’héroïne (entretien). Les agonistes pharmacologiques compensent les symptômes de sevrage du cannabis et réduisent la motivation à consommer du cannabis en occupant les récepteurs CB1. L’administration d’antagonistes CB1 peut également bloquer les effets du cannabis et favoriser l’abstinence. Des études précliniques montrent de fortes interactions entre les systèmes opioïde et cannabinoïde, ce qui suggère que les antagonistes opiacés tels que la naltrexone peuvent réduire la récompense et la consommation de cannabis. Parmi les autres agents prometteurs examinés dans le TABLEAU 3 figurent le topiramate, la N-acétylcystéine, la gabapentine, l’ocytocine et la varénicline. Des recherches plus poussées sur la pharmacothérapie de remplacement ou de substitution/agoniste devraient personnaliser le traitement en fonction des caractéristiques du patient (comme le sexe et l’âge) et de la symptomatologie (par exemple, la gravité de la consommation de cannabis). Les études portant sur des agents nouveaux ou repurposés nécessiteront des avancées similaires en matière d’interventions psychosociales d’accompagnement.
Interventions psychosociales
Des outils de dépistage et d’évaluation sont nécessaires pour personnaliser la prévention et le traitement. Le développement nécessite l’identification des mécanismes qui répondent aux interventions psychosociales. La recherche devrait explorer les avantages supplémentaires de la combinaison de différents éléments de traitement et identifier la meilleure façon de traiter les troubles psychiatriques comorbides courants.
La stigmatisation de la consommation de cannabis et de la CUD doit être réduite pour augmenter le nombre de demandes de traitement. Cela peut inclure le perfectionnement des approches en ligne et d’auto-assistance qui peuvent être fournies dans l’intimité de son propre domicile et une meilleure communication sur la prévention et les traitements de meilleure qualité afin d’accroître la confiance du public dans leur efficacité. Les programmes en ligne efficaces doivent être plus accessibles, car moins d’un programme sur six ayant montré des avantages dans des ECR en ligne est disponible pour un usage général.
Réduction de l’offre, publicité et éducation
Dans les juridictions où la consommation de cannabis par des adultes est légale, les gouvernements peuvent minimiser la consommation excessive et l’adoption par les adolescents en utilisant la taxation, les restrictions légales sur l’âge minimum d’achat et le contrôle de la publicité. L’une des priorités de la recherche sur le cannabis devrait être de fournir des informations exactes pour aider la communauté et les décideurs à éviter les décisions influencées par l’idéologie. L’amélioration de l’éducation doit s’attaquer à la désinformation et à l’exagération des avantages médicaux du cannabis. Une communication plus efficace d’informations exactes par le biais des médias sociaux et d’autres formes de médias est nécessaire pour atteindre les jeunes et les jeunes adultes afin de contrer les activités promotionnelles de l’industrie légale du cannabis.
Mécanismes de la CUD
La recherche sur le système endocannabinoïde devrait permettre de mieux comprendre l’étiopathogénie de la CUD, la vulnérabilité à la dépendance et la comorbidité avec d’autres troubles mentaux. La compréhension des rôles des cannabinoïdes endogènes et exogènes pourrait accroître nos connaissances des trajectoires de développement de différentes substances addictives si le THC modifie le système de récompense dopaminergique pour rendre d’autres substances plus gratifiantes.
La recherche génétique peut aider à comprendre la contribution du système endocannabinoïde à la vulnérabilité à la CUD. Certaines études d’association pangénomique sur la dépendance au cannabis ont identifié des allèles de risque individuels significatifs, mais ces résultats n’ont pas été reproduits dans toutes les études. Les études d’association pangénomique les plus importantes n’ont pas permis d’identifier des loci génétiques spécifiques significativement associés à la consommation de cannabis ou à la dépendance au cannabis au cours de la vie, et les SNP individuels expliquent généralement moins de 1 % de la variance des risques de CUD. Ces résultats limitent les approches pharmacogénomiques du traitement. Il est nécessaire de mieux comprendre le rôle fonctionnel des gènes, par exemple les gènes de l’horloge, qui peuvent réguler la transmission de la dopamine par le biais d’une modification des rythmes circadiens. Les scores de risque polygénique qui combinent les SNP associés à la consommation de cannabis et à la réponse au traitement peuvent être utiles pour cibler les approches comportementales et pharmacologiques. Il pourrait y avoir des gains supplémentaires en combinant les scores de risque polygénique et les facteurs de risque sociaux et individuels pour le développement de la CUD. L’exposition au cannabis pendant les périodes critiques du développement peut influer sur l’expression des gènes, affectant la nature et la gravité de la CUD. En outre, l’exposition au cannabis peut produire des altérations épigénétiques dans les gènes fonctionnels au cours des périodes prégestationnelles et adolescentes qui augmentent les risques de troubles du développement chez les enfants, et de troubles psychiatriques et de SUD chez les adolescents et les adultes.